Heat shock proteins (HSPs)는 세포 내 chaperones 또는 스트레스 단백질로 잘 알려져 있으며, 세포내에서 수송과정과 단백질 접힘, 단백질 기능 저하에 대항하여 중요한 역할에 관여한다(Lindquist and Craig, 1988; Hartl and Hayer-Hartl, 2002; Mayer and Bukau, 2005; Wang et al., 2009). 분자량에 따라 HSP100, HSP90, HSP70, HSP60, HSP40, HSP10 등으로 분류되며 모든 생물에서 공통적으로 보존되어 있다(Padmini and Geetha, 2009). 대부분의 HSPs는 생리학적 환경에서 낮은 농도로 존재하나, heat shock와 oxidative stress, hydroperoxidase stress, radioadaptive response, glucose deprivation 등에 의해 발현이 증가된다(Hadari et al., 1997; Lee, 2001; Mitsumoto et al., 2002; Jönsson and Schill, 2007).
미토콘드리아에 존재하는 HSP75 (mtHSP75)는 TNF receptor-associated protein 1 (TRAP1)로서 HSP90 계열에 속하는 단백질이며 다른 HSP90계열 단백질과는 달리 N-말단에 미토콘드리아를 target하는 signal peptide을 가지고 있다(Matassa et al., 2012). mtHSP75는 미토콘드리아에 필요한 단백질의 수송과 단백질 가수분해를 통해 단백질 재조립하는 역할을 한다(Haynes and Ron, 2010). Heat shock이나 다른 형태의 스트레스에 노출되었을 경우, 미토콘드리아에서는 reactive oxygen species (ROS)가 과도하게 생성되는데 이렇게 생성된 ROS는 단백질 변성을 촉진시키고(Sakurai and Cederbaum, 1998; Gutterman, 2005) 세포자살(apoptosis)를 유발시킨다(Hua et al., 2007). 이때 mtHSP75는 ROS와 같은 산화적 스트레스로 인해 변성된 단백질을 회복시켜 세포자살을 방지한다(Im et al., 2007).
HSPs는 오랫동안 지속적으로 연구를 해왔으나, 어류에서의 미토콘드리아 단백질에 속하는 HSPs에 관한 많은 연구가 되지 않았다. 최근 경골어류인 나일틸라피아(
해마는 세계적으로 천식, 심장병, 골절 등에 치료하는 약제로 쓰이며, 특히 빅벨리해마(
이에 본 연구에서는 빅벨리해마으로부터 mitochondrial heat shock protein 75 (BsmtHSP75)유전자의 분자유전학적 특징과 조직별 발현 양상을 분석하고 동정하였으며 해마에 병원체 및 면역자극제를 사용하여 유전자의 변화를 관찰하였다.
제주에 위치한 한국해수관상어종묘센터(CCORA, http://www.ccora.com/)에서 약 20 cm 크기의 빅벨리해마를 구입하여 수온 18±0.2℃, 염분 32±1 psu의 순환수조에서 일주일동안 순치시켰으며, 각 수조당 35마리씩 사육하였다. 대조군을 제외한 각 실험군에 lipopolysaccharide (1.25 μg/μL), Poly I:C(1.5 μg/μL),
>
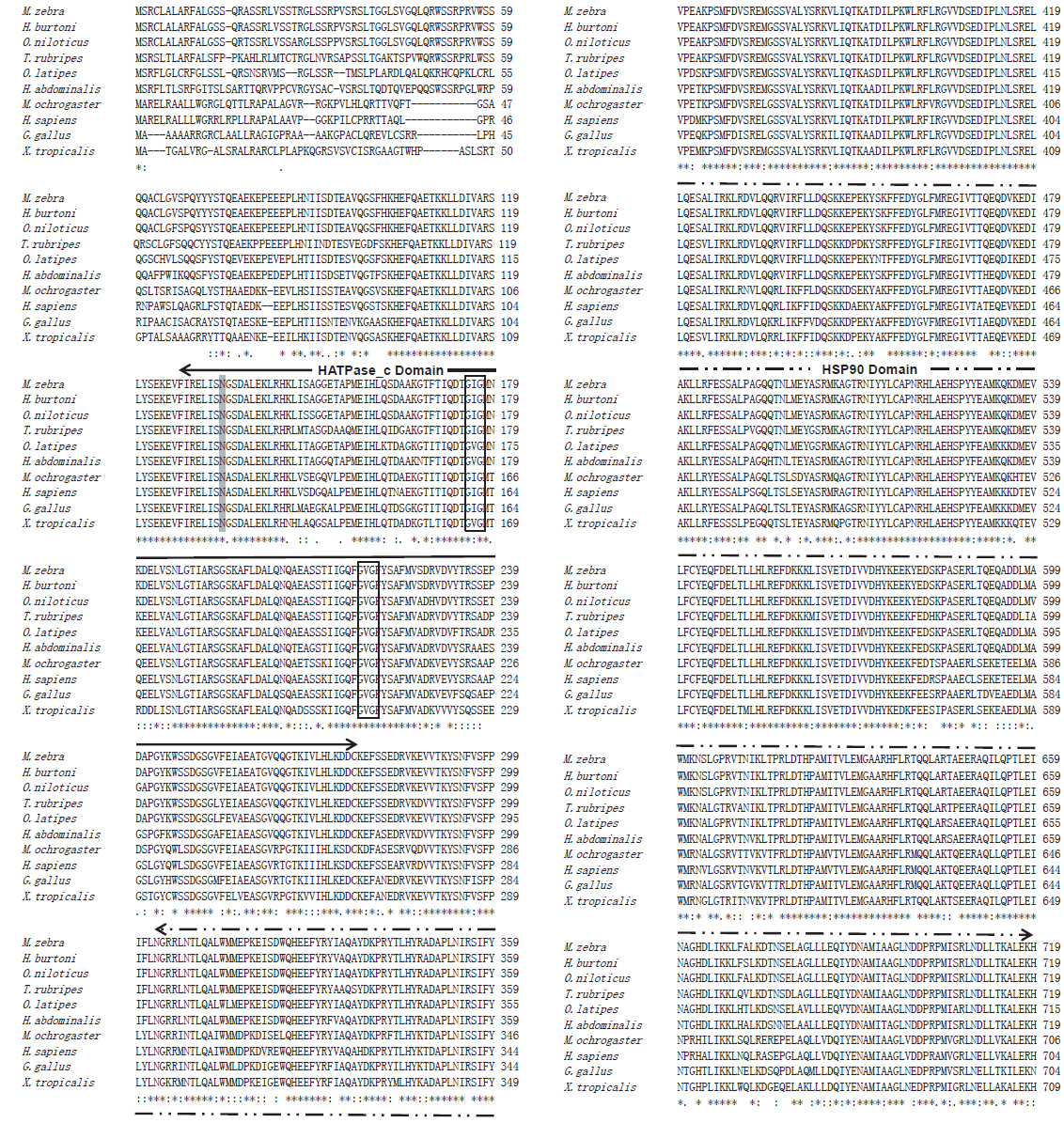
BsmtHSP75 유전자 클로닝과 분자적 특징 분석
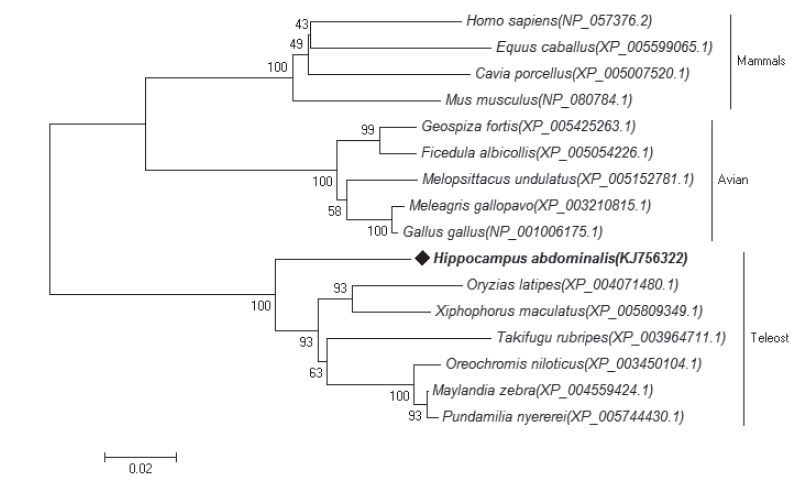
건강한 해마의 blood와 liver, kidney, gill, spleen에서 추출한 RNA를 이용하여 합성된 cDNA 염기서열은 454 GS-FLXTM system (Roche 454 Life Sciences, USA)로 분석하여 cDNA library database를 구축하였다. BLAST (http://www.ncbi. nlm.nih.gov/BLAST)를 이용하여 빅벨리해마 mtHSP75 유전자의 cDNA 전체 서열을 확인하였으며, BLAST Search program을 사용하여 BsmtHSP75의 상동유전자를 비교하였다. ClustalW2 program을 이용하여 Multiple sequence alignment를 수행하였으며, 비교 분석한 다른 종은
Total RNA 추출을 위해 건강한 빅벨리해마의 14개 조직 (Blood, brain, gill, heart, intestine, liver, kidney, muscle, ovary, pouch, skin, spleen, stomach, testis)과 공격실험한 빅벨리해마의 조직(blood와 kidney)을 분리하여 액체질소로 냉동시킨 후 −80℃에 보관하였다. 각 조직의 total RNA는 RNAiso plus (TaKaRa, Japan)을 사용하여 추출하였으며, PrimeScriptTM II 1st strand cDNA Synthesis kit (TaKaRa)를 사용하여 제조사의 방법에 따라 first-strand cDNA를 합성하였다.
>
Quantitative real-time PCR을 이용한 BsmtHSP75의 발현분석
BsmtHSP75의 cDNA 단편을 증폭하기 위해 사용된 oligonucleotide primer는 각각 mtHSP75-F (5'-TCTGGACATTGTTGCCAGGTCTCT-3')와 mtHSP75-R (5'-CGTGTCCTGTATGGTGAAGGTGTTCT-3')이다. 각 조직별 cDNA는 real-time PCR을 수행하기 위한 주형으로 사용되었다. Quantitative real-time PCR 분석은 2X SYBR Premix Ex Taq (TaKaRa)을 이용하여 95℃에서 30초간 1 cycle, 그리고 95℃에서 5초, 58℃에서 10초, 72℃에서 20초를 45 cycles, 그리고 95℃에서 15초, 60℃에서 30초, 95℃에서 15초간 1 cycle로 반응하였고, Thermal cycler DICE Real Time System (TP800; TaKaRa, Tokyo, Japan)을 사용하여 분석하였다. BsmtHSP75의 발현 결과는 Livak (2−ΔΔCT) 방법(Livak and Schmittgen, 2001)을 통해 나타내었으며 빅벨리해마의 40S ribosomal protein S7 (F: 5'-GCGGGAAGCATGTGGTCTTCATT-3', R: 5'-ACTCCTGGGTCGCTTCTGCTTATT-3')을 reference gene으로 사용하였고, 모든 데이터는 40S ribosomal protein S7 (Accession No. KP780177)에 대해 상대적으로 나타내었다.
실험결과는 mean±표준편차(S.D.)로 나타냈으며 PASW Statistics 18 (SPSS Inc.) program을 이용하여 일원배치 분산분석을 실시하였다. 유의수준은 Duncan’s Multiple Range test를 통해
본 연구에서는 빅벨리해마의 mitochondrial heat shock protein 75 (BsmtHSP75)를 추출하여 cDNA를 확인하고 분자유전학적 특징과 발현 양상을 분석하였다. BsmtHSP75 cDNA(KJ756322)의 open reading frame (ORF)는 2,157 bp로 719개의 아미노산을 암호화하며 분자량은 82 kDa으로 추정되었다(Fig. 1).
mtHSP75은 다른 HSP90 계열의 단백질과는 달리 N-말단에는 미토콘드리아를 인식하는 mitochondrial signal peptide와 ATPase domain을 가지며, C-말단에는 HSP90 dimer 형성도메인을 포함하는 HSP90 domain으로 구성되어 있다(Buchner, 1999; Sreedhar et al., 2004; Wegele et al., 2004). 이와 마찬가지로
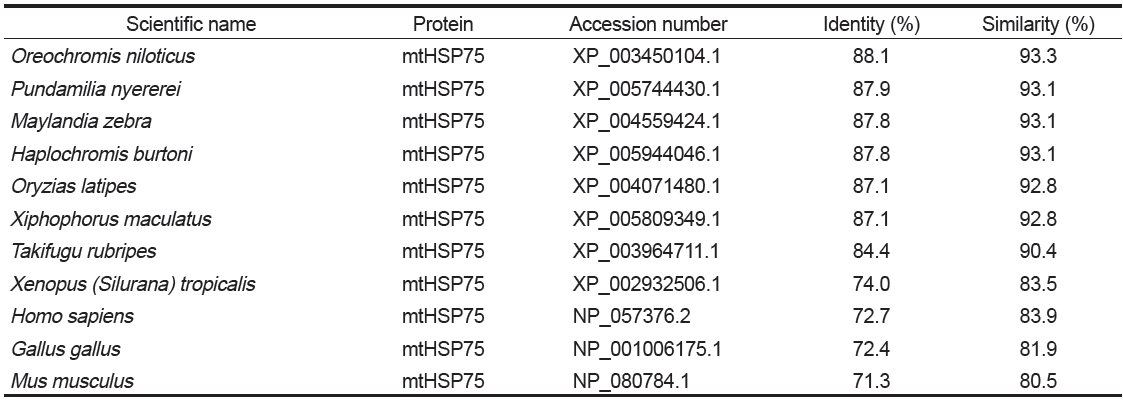
[Table 1.] Percent identities and similarities of BsmtHSP75 with other mtHSP75 counterparts
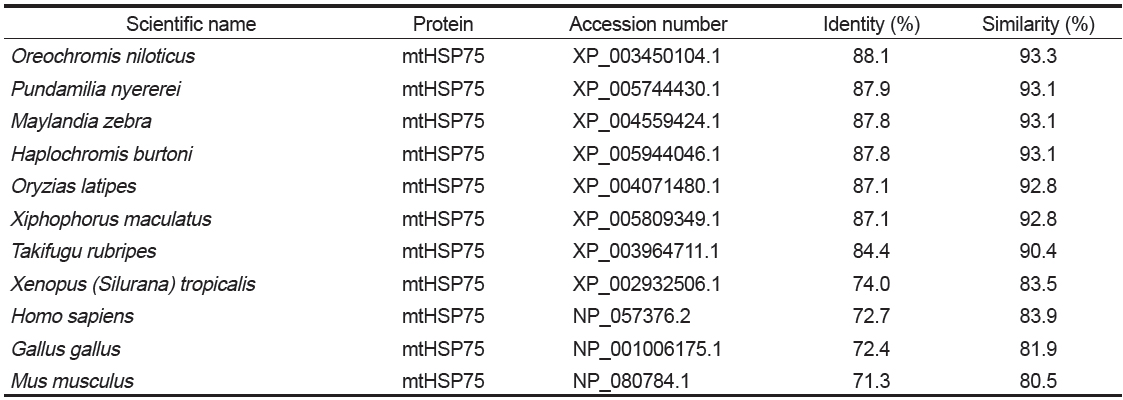
Percent identities and similarities of BsmtHSP75 with other mtHSP75 counterparts
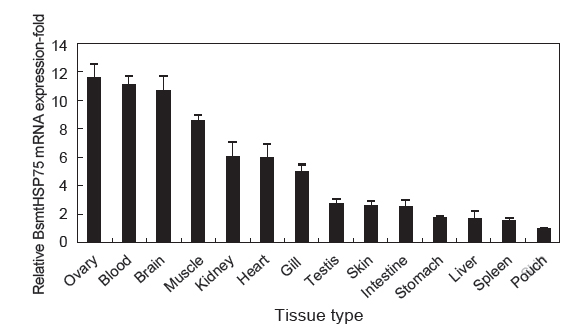
mtHSP75는 모든 세포에 기본적으로 존재하고 있으며 이는 BsmtHSP75 유전자의 조직별 발현 분석에서도 잘 나타나고 있다. BsmtHSP75 유전자는 모든 조직에서 발현하고 있으며 다른 조직에 비해 ovary, blood, brain 순으로 높은 발현을 보이고 있었다. 척추동물인 돼지와 토끼의 HSP90유전자는 생식기관에서 가장 높게 발현하였으며, 무척추동물인 새우에서도 생식기관에서 가장 높게 발현되었다(Quraishi and Brown, 1995; Huang et al., 1999; Li et al., 2012). 이는 HSP90이 생식기관의 발달과 성숙에 관여하기 때문으로 보이며(Wu and Chu, 2008), 따라서 ovary에서 HSP90계열인 BsmtHSP75가 생식기관의 발달과 성숙에 관여하는 것으로 생각된다. 이 뿐만 아니라, 포유류의 mtHSP75는 혈액에서 보편적으로 존재하고 있는 단백질로 보고되어 있다(Stamova et al., 2009). 포유류의 뇌에서도 mtHSP75가 발현되는데 그것은 열충격과는 관계없이 평상시에도 mtHSP75가 발현되어 있어 뇌의 뉴런 기능에 관여하는 것으로 보인다(Quraishi and Brown, 1995). 이는 빅벨리 해마의 혈액과 뇌에서 mtHSP75 유전자가 보편적으로 발현하고 있으며 뇌에서는 뉴런 기능에 관여하는 것으로 사료된다.
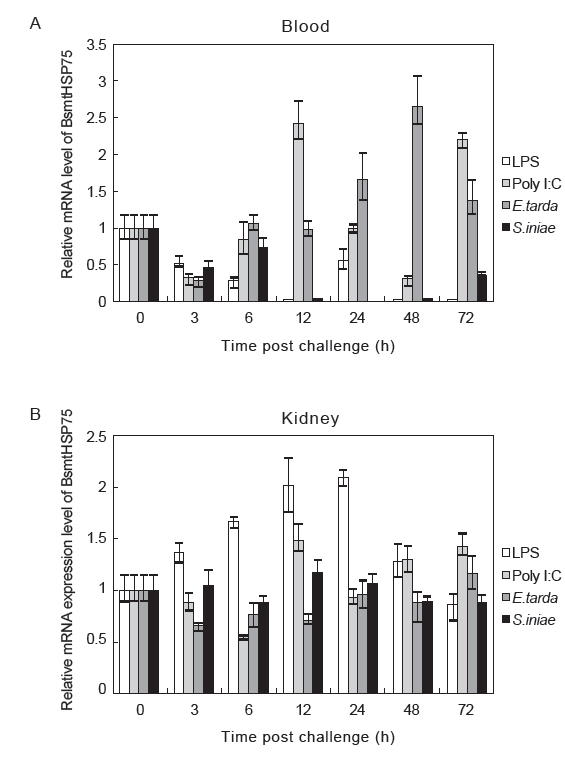
병원체 감염 시 일어나는 면역반응을 조사하기 위해 조직별 분석 결과를 토대로 하여 대표적인 면역기관인 blood와 kidney에서 LPS, Poly I:C, 병원균을 접종한 실험동물의 mtHSP75 mRNA 발현을 분석하였다. 그 결과, blood에서는 Poly I:C 접종 후 12, 72 h에서,
바이러스와 세균 감염에 의한 ROS 발생은 단백질을 변성시키고 세포자살을 야기한다(Feuer et al., 2003; Saraste et al., 2003; Donati et al., 1991). 이러한 ROS의 발생은 mtHSP75를 발현을 유도한다고 보고되어 있으며(Jönsson and Schill, 2007), mtHSP75는 손상된 단백질과 결합하여 원래의 구조로 회복시킨다(Gao et al., 2008). 결국 mtHSP75는 바이러스와 세균의 감염에 의해 유발된 세포자살을 억제함으로써 바이러스와 세균로부터 세포를 보호한다(Wang et al., 2009). 이 연구에서는 바이러스 유사물질인 Poly I:C를 사용하여 접종하였고 blood와 kidney 두 조직에서 BsmtHSP75의 발현이 유의적인 경향을 보였다. 또한
LPS는 그람 음성균의 외막에 존재하는 내독소로서 어류에 LPS자극 시 면역 반응을 일으킨다(Magnadóttir, 2006). Kidney에서 LPS자극 시 BsmtHSP75가 3 h부터 유의적으로 증가하다가 48 h에서 감소하는 경향을 나타내고 있으며, 이는 kidney에서 LPS자극에 의한 면역 반응에 mtHSP75가 관여하는 것으로 사료된다. 그러나 송어에서 LPS자극 시 단핵구/대식세포에서 발현이 억제된다고 보고되어 있으며(MacKenzie et al., 2006), 빅벨리해마의 blood에서 LPS자극에 의해 BsmtHSP75의 발현이 억제된 것으로 생각되어진다.
LPS처럼 직접적으로 세포의 면역 반응에 영향을 끼치는 것과는 달리 세균의 경우, 면역 반응을 회피하기 위한 여러 메카니즘을 가지고 있으며(Finlay and McFadden, 2006), blood와 kidney에서 세균 감염시 유의적인 경향을 보이지 않았던 것은 세균의 면역회피 가능성으로 보여진다.
결론적으로, 빅벨리해마(