면역반응에 작용하는 세포로써 염증 및 숙주의 방어에 대식세포(macrophages)의 역할은 잘 알려져 있다. 또한 병원체의 감염 및 조직손상에 의해 유발된 염증반응을 해소하고 손상된 조직을 회복하는 과정에도 대식세포는 중요한 역할을 한다. 이러한 다양한 생리학적 기능을 수행할 수 있는 근거는 대식세포가 주변의 국소적인 환경에 따라 다른 형태로 변형(macrophage polarization)될 수 있는 특성에 따른 것이다(Ferrante and Leibovich, 2012).
최근 이러한 대식세포 표현형(phenotypes)의 변화에 대해 많은 연구들이 이루어지고 있고, 활성화된 두 가지의 형태의 주요 표현형, 즉 M1 및 M2의 형태를 가지고 있음이 확인되었다(Ferrante and Leibovich, 2012). 고전적 활성화(classically activated) 형태인 M1 표현형은 세균의 lipopolysaccharides (LPS) 및 peptidoglycan과 같은 외인성 pathogen-associated molecular patterns (PAMPs) 및 괴사된 세포에서 유리되는 단백질 및 핵산과 같은 damage-associated molecular patterns (DAMPs), 그리고 T helper 1 (Th1) cell에서 분비되는 cytokine인 interferon (IFN)-γ에 의한 자극에 의해서 유도되고, 이에 의해 염증촉진성 cytokines 및 매개체[nitric oxide (NO) 및 superoxide radical]의 생성량이 많아지는 염증촉진성(pro-inflammatory) 특성을 가진다(Mosser, 2003; Bystrom et al., 2008; Colin et al., 2014). 다른 형태인 M2 표현형은 염증을 억제(anti-inflammatory)하는 특성을 가지고 있고, 이는 IL-4 및 IL-13과 같은 Th2 cytokines에 의해서 유도된다(Chang et al., 2015). 이들 cytokines 이외에 glucocorticoids 및 resolvins과 같은 항염증성 및 염증 해소성 자극 또한 M2 phenotype을 유도한다(Titos et al., 2011; Zhang et al., 2009). M2 대식세포는 IL-10과 같은 항염증성 cytokine을 분비하고 염증반응부산물의 소거에 관련된 CD36의 발현이 증가하게 되고, 그에 따라 상처의 회복 및 조직의 리모델링과 같은 항상성을 유지하는데 작용함으로써 염증을 해소하는데 주된 역할을 한다. 따라서 염증반응 동안 대식세포의 활성화 상태는 염증의 지속여부를 결정짓는데 중요한 역할을 하고, 표현형의 적절한 변화(macrophage polarization)가 이루어지지 않을 경우 만성염증상태로 발전하게 된다(Ferrante and Leibovich, 2012; Bystrom et al., 2008). 병리학적으로 만성적인 염증을 동반하는 죽상동맥경화(atherosclerosis), 천식, 관절염과 같은 질환에서 염증촉진성 M1 표현형이 주로 관찰되는 것이 보고되었다. 최근 이러한 염증성질환의 예방 및 치료를 위한 새로운 접근법으로써 약물 및 식이성분 등을 이용하여 대식 세포를 M2 표현형으로의 유도하거나 M2 표현형을 더욱 증강시키는 방법들이 연구되고 있다(Camell and Smith, 2013; Li et al., 2013; Chen et al., 2014; Chang et al., 2015).
해조류는 육상식물에서는 발견되지 않는 물질들을 함유하고 있어 다양한 생리활성을 나타내는 것으로 알려져 있다(Kim et al., 2009; Lee et al., 2012; Wijesinghe and Jeon YJ, 2012). 그 중 갈조류는 엽록소와 갈색을 띄는 xanthophyll계 caroteinods의 일종인 fucoxanthin과 fucoidan 등의 다당류, fucosterol, phlorotannins과 같은 다양한 생리활성 물질들을 가지고 있는 것으로 보고되었다(Kang et al., 2003; Hosokawa et al., 2004; Kim et al., 2012;Brown et al., 2014). 본 연구실에서는 이전에 수행한 실험에서 다양한 갈조류의 주정추출물 및 유기용매 획분들을 분획하였고, 또한 분리한 화합물을 이용하여 다양한 활성을 분석하여 보고하였다. 특히, 곰피(
부산 기장에서 채취한 곰피(
ICR 마우스를 이용하여 Alleva et al. (1998)의 방법에 따라 복강대식세포(peritoneal macrophages, PEM)을 분리하였다. 즉 10주령 마우스를 이용하여 대식세포 분리 3-4일 전에 복강에 4% thioglycollate (w/v) 3 mL을 주사하였다. 이후 마우스를 마취하여 경추탈골한 뒤 복강의 내피를 노출시키고, 주사기를 이용하여 3% bovine calf serum (BCS, Gibco, Rockville, MD, USA)을 주입하여 복강의 대식세포를 회수하였다. 이 과정을 2-3회 반복한 이후 원심분리하고 phosphate-buffered saline (PBS)로 세척하였다. 분리한 복강대식세포는 10% fetal bovine serum (FBS)와 penicillin (100 units/mL), streptomycin (100 μg/mL)을 첨가한 Dulbecco’s modified Eagle’s medium (DMEM, WellGene, Daegu, Korea)을 사용하여 5% CO2, 37℃에서 1일 배양한 뒤 이후 시료를 처리하였다. 각 시료들은 100% dimethyl sulfoxide (DMSO)에 녹여 사용하였고, IL-4와 IL-13 (R&D systems, Minneapolis, MN, USA), LPS (Sigma-Aldrich, St. Louis, MO, USA)는 PBS에 녹여 사용하였다.
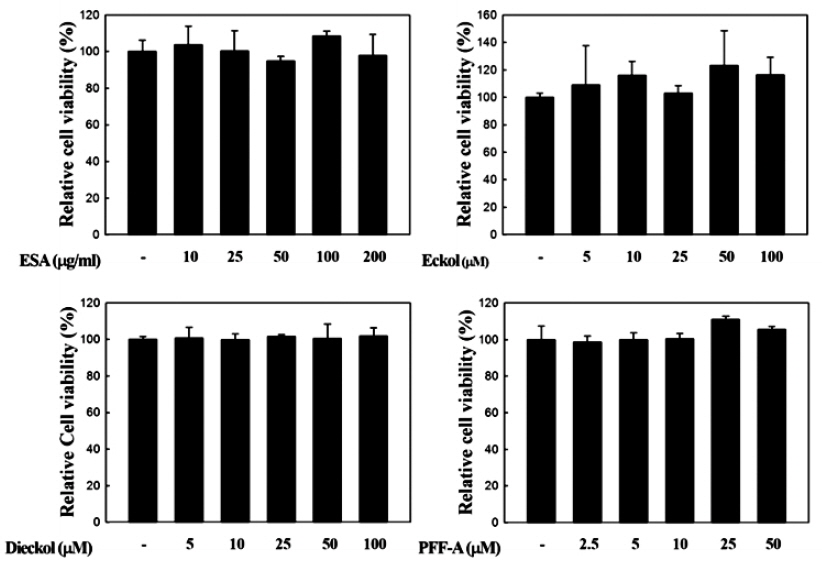
복강대식세포를 96-well plate에 2×105 cells/well로 분주하고 37℃에서 24시간 동안 배양하였다. 이후에 각 시료들이 농도별로 희석된 DMEM 배지로 교체하여 다시 24시간 배양하였다. 이후 CellTiter96® Aqueous 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS) 시험 키트(Promega, Madison, WI, USA)를 사용하여 제조사의 방법에 따라 세포생존율을 분석하였다. MTS 용액은 FBS-free DMEM에 5% (v/v)의 농도로 섞어 100 μL씩 처리하였다. 1시간 후에 microplate reader (Glomax Multi Detection System, Promega, Madison, WI, USA)를 이용하여 490nm 파장에서 흡광도를 측정하였다.
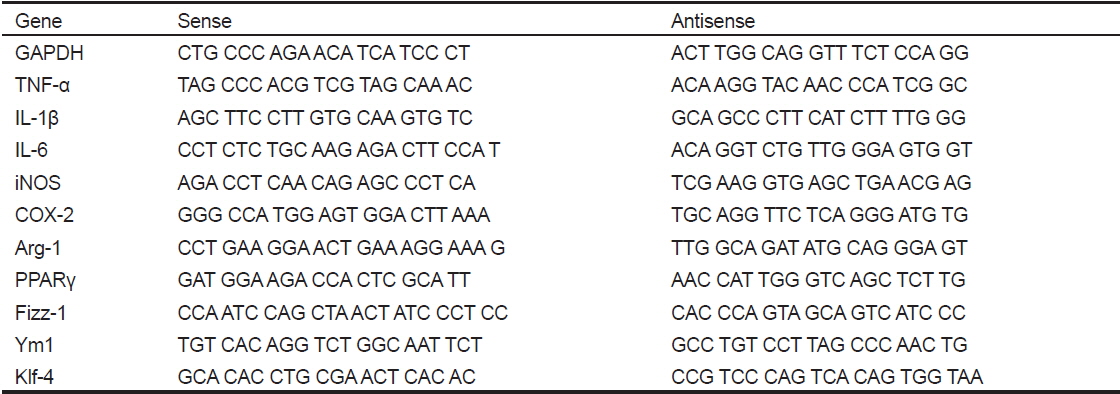
복강대식세포(1×106 cells/well)에 시료들을 4시간 동안 처리한 이후에 Quiazol 시약(Quiagen, Valencia, CA, USA)을 이용하여 total RNA를 분리하였고, 1 μg의 total RNA에 GoScript™ Reverse transcriptase (Promega, Madison, WI, USA)를 사용하여 제조사의 방법대로 cDNA 합성을 진행하였다. 합성된 cDNA와 TOPreal™ qPCR 2× PreMIX (Enzynomics, Daejeon, Korea), 표적유전자 특이적인 primers를 사용하여 real-time reverse transcription-polymerase chain reaction (real-time RT-PCR, Rotor-Gene Q, Quiagen, Valencia, CA, USA) 방법을 통해 유전자 발현양을 분석·비교하였다. 유전자 발현의 비교는 상대적인 비교를 위해 ΔΔCt 방법을 이용하였으며, real-time RT-PCR에 이용된 각 primers의 염기서열은 Table 1에 나타내었다.
[Table 1.] Primers used for real-time RT-PCR analysis
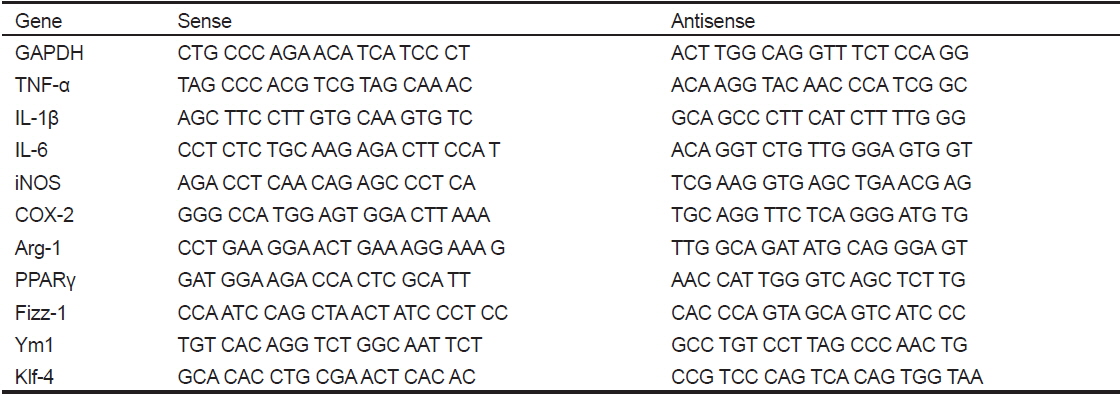
Primers used for real-time RT-PCR analysis
본 연구의 모든 실험은 세 번 이상 반복하였으며, 얻어진 결과들을 평균값과 표준편차(mean±SD)를 계산하여 나타내었다. 실험군 간의 유의성 검증은
곰피(
>
복강대식세포의 염증촉진성(M1) 및 항염증성(M2) 표현형의 유도
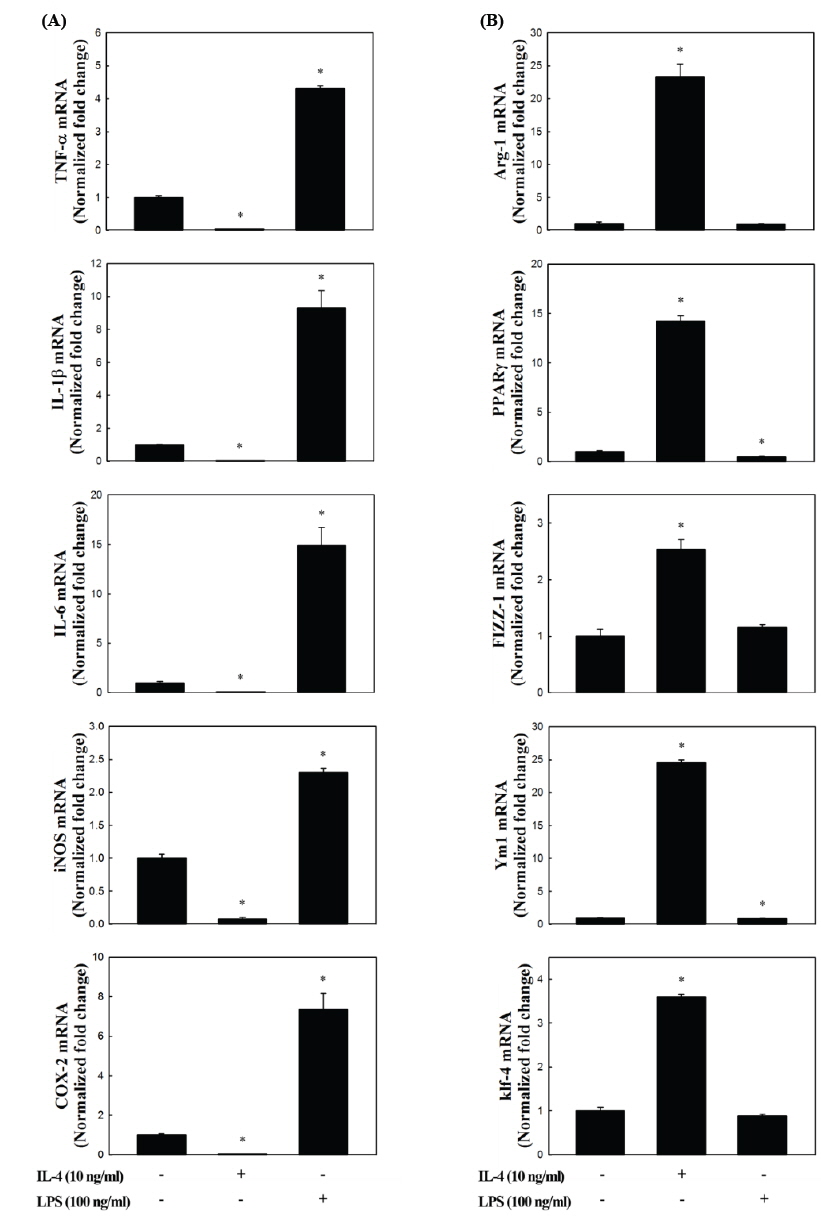
상기에서 분리한 복강대식세포(PEM)에 LPS 또는 IL-4를 4시간 동안 처리하고, 이들 세포들이 M 1 및 M2 형태로 유도되는지 알아보기 위해서 RNA를 추출하여 real-time RT-PCR 방법을 통해서 각각의 marker 유전자들의 발현 profile을 분석하였다. M1에 대한 markers (Mosser., 2003; Bystrom et al., 2008; Colin et al., 2014)로는 IL-1β, IL-6, TNF-α와 같은 cytokines 이외에 NO 및 prostaglandin E2 (PGE2)와 같은 염증촉진성 매개체를 생성하는 inducible nitric oxide synthase (iNOS) 및 cyclooxygenase- 2 (COX-2)를 분석하였다. M2에 대한 marker 유전자는 arginase (Arg)-1과 found in inflammatory zone (Fizz)-1, chitinase-like 3 (Ym1), peroxisome proliferator-activated receptor (PPAR)-γ, Krüppel-like factor (Klf)-4와 같은 염증상태 개선 및 조직복구에 관여하는 유전자들(Liao et al., 2011; Ferrante and Leibovich, 2012; Liu et al., 2014)을 분석하였다.
Fig. 2에 나타내었듯이, LPS 처리에 의해 M1의 특징적인 marker 유전자들의 발현이 현저하게 증가하였고(
>
복강대식세포의 항염증성 표현형에 대한 곰피-유래 시료의 효과
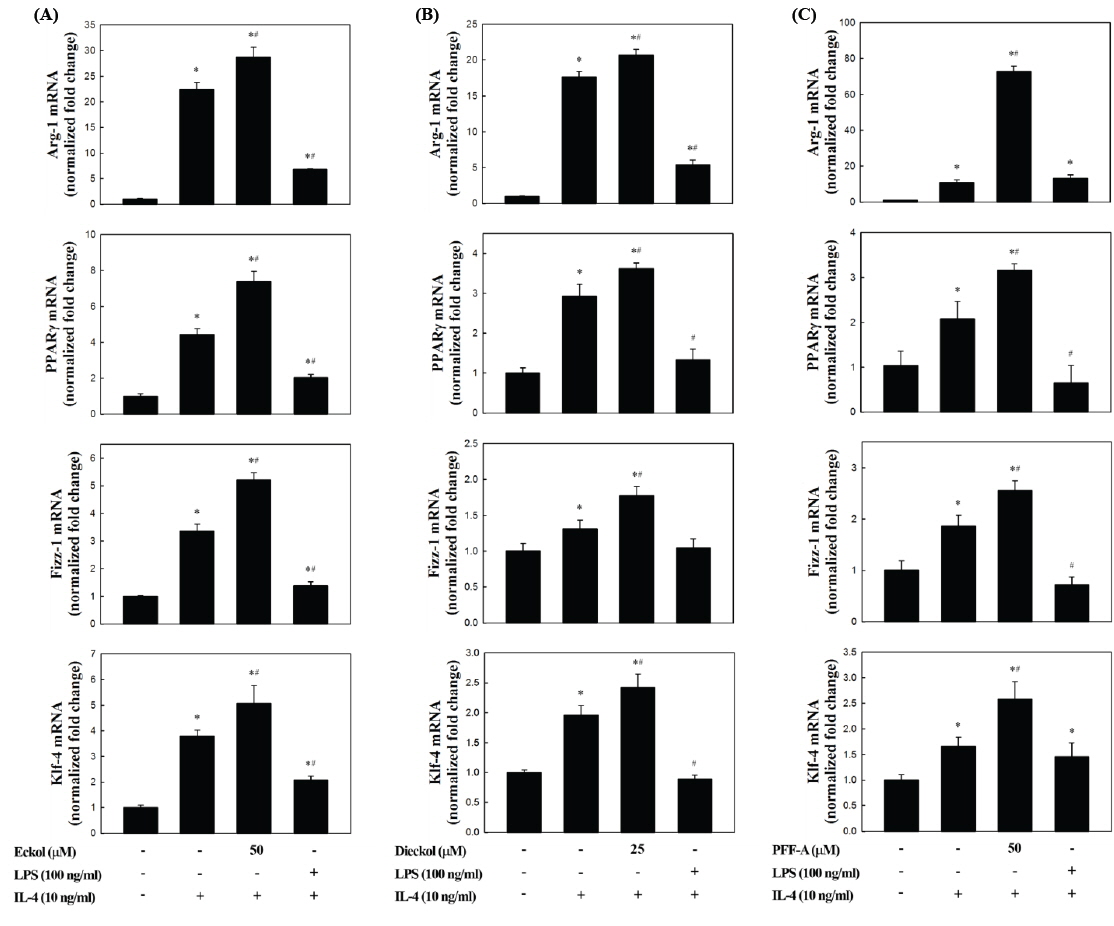
복강대식세포의 M2 polarization에 대한 곰피-유래 eckol, dieckol, PFF-A의 직접적인 유도효과를 분석한 결과, 일부의 시료에서 M2 marker 유전자의 발현이 증가하는 것으로 나타났지만 유의적인 효과는 관찰되지 않았다(data not shown). 그러나, 복강대식세포를 이들 화합물로 전처리한 이후 IL-4로 자극하였을 경우 M2 marker 유전자의 발현이 현저하게 증가하는 것으로 나타났다(Fig. 3). Fig. 2와 마찬가지로, IL-4만을 처리하였을 때 M2 marker 유전자의 발현이 유의적으로 증가하는 것이 확인되었고(
M2 marker 유전자의 하나인 Arg-1은 가장 잘 알려진 M2 marker이다(Munder et al., 1999). 이 효소는 Arg을 L-ornithine으로 변환시키고 이후 상처회복 및 matrix 침착에 사용될 수 있는 polyamines과 proline의 전구체를 제공해주는 역할을 한다(Munder, 2009). Arg은 iNOS의 기질이기도 하기 때문에 Arg-1의 발현이 증가할 경우 iNOS에 의한 NO의 생성을 경쟁적으로 억제하는 역할을 하게 된다(Corraliza et al., 1995; Morris, 2007). Fizz-1의 경우 세포외부(extracelluar) matrix의 침착을 촉진시킴으로써 손상된 조직의 회복을 돕는 것으로 알려져 있다(Raes et al., 2002). Klf-4는 최근 연구에서 M2 대식세포에서 현저하게 증가하고 반면 M1 형태에서는 감소하는 것으로 확인됨으로써 대식세포의 M1/M2 polarization에 중요한 조절인자로 작용한다는 것이 보고되었다(Liao et al., 2011). Ym1은 extracellular matrix 성분의 분해를 저해함으로써 조직손상을 막는 것으로 보고되었다(Chang et al., 2001, Hung et al., 2002). 이상과 같이 M2 marker 유전자들의 공통적인 특성은 염증상태의 해소 및 조직손상의 회복에 관련된 항염증 활성을 나타낸다. 따라서 이들의 발현이 곰피-유래 phlorotannins에 의해 더욱더 높은 수준으로 증가한다는 것은 M2 표현형이 강화되고 그에 의해 강력한 염증억제효과를 나타낼 수 있음을 의미하는 것이다.
최근 대식세포의 M2 표현형 유도를 위해 식이지방산의 이용 가능성을 검토한 연구가 보고되었다. Oleic acid (C18:1 n-9) 처리에 의해 대식세포에서 Klf-4 및 Arg-1의 전사수준이 유의적으로 증가하는 것이 관찰되었고(Camell and Smith., 2013), n-3 고도불포화지방산인 docosahexaenoic acid (DHA, C22:6 n-3) 처리에 의해서 RAW264.7 세포의 M1 표현형이 억제되는 반면, M2 표현형이 증가하는 것으로 확인되었다(Chang et al., 2015). DHA의 경우 PPARγ ligand로 작용함으로써 PPARγ의 활성화를 일으키고 M2 polarization을 유도하는 것으로 확인되었다. 또한 항산화 및 항염증 등의 다양한 생리활성을 가진 것으로 알려져 있는 curcumin의 경우 RAW264.7 세포에 처리하였을 때 Klf-4 및 Fizz-1의 발현을 증가시키는 것으로 나타났고, 이러한 M2 phenotype 유도는 PPARγ의 활성화를 통해서 일어나는 것으로 보고되었다(Chen et al., 2014). PPARγ는 M2 형태로의 변환을 유도하는데 중추적인 역할을 하는 전사인자이고(Bouhlel et al., 2007), 본 연구에서 관찰된 PPARγ의 발현증가는 곰피-유래 화합들이 M2 polarization 유도에 효과적임을 의미하는 것이다(Fig. 3).
이상의 결과에서 만성염증을 병리학적 특성으로 하는 염증성 질환의 치료 및 예방을 위한 새로운 접근법으로써 대식세포의 표현형을 항염증성으로 유도하는데 곰피-유래 phlorotannins이 효과적임을 확인할 수 있었다. 향후 보다 광범위한 marker 유전자들의 분석 및 관련 신호전달기전의 구명이 필요한 것으로 판단된다.