대한민국과 중국을 원산지로 하는 대표적 식량자원인 대두는(
본 연구는 가열가공 시 대두류 내 주요 기능성 성분인 이소플라본 개별 화합물의 조성 변화를 구명하여 대두류 섭취시 기대할 수 있는 건강한 식생활에 대한 조리 및 가공방법 개발에 기여하고자 한다.
실험에 사용된 water, acetonitrile 및 methanol은 HPLC급(Fisher Scientific, NJ, USA)으로 사용 하였으며, 분리능을 높이기 위한 formic acid는 Junsei (Kyoto, Japan)를 사용하였다. 전처리 시 산화방지를 위해
농촌진흥청 농업유전자원센터로부터 분양 받은 중산간지용 개량 품종인 대풍(Daepung, 수원215호, IT214696), 선유(Sunyoo, 수원227호, 미확정), 청자3호(Cheongja 3, 밀양 136호, IT214708)를 본 시험의 시료로 사용하였다. 각 시료는 가공방법에 따라 생시료(fresh), 증자처리 시료(boiled) 및 121℃에서 30분간 열처리한 시료(HTHP)로 처리법을 달리하여 사용하였으며, 가공 후 각 시료는 동결건조한 후 곱게 분말화한 다음 추출단계 전까지 -80℃에서 보관하였다.
전처리방법은 Rosa (Rosa
각 이소플라본 화합물의 정성, 정량 분석을 위해 photodiode array (PDA) detector를 장착한 ultra performance liquid chromatography (UPLC, Waters Co. Milford, MA, USA)와 time of fly-mass spectrometry (ToF/MS, Waters Co. Milford, MA, USA)를 사용하였다. Acquity UPLC BEH C18 (2.1 150 mm, i.d., 1.7 ㎛, Waters Co. Milford, MA, USA) 컬럼을 사용하였으며, 이동상으로는 용매 A (0.1% formic acid in water) 및 용매 B(0.1% formic acid in acetonitrile)를 사용하였다. 유속은 0.4 ㎖/min으로 일정하게 흘려주었으며, 10%의 B용매로 시작하여 2분까지 12%, 5분까지 17%로 증가시킨 후 15분까지 17%를 유지하였다. 그리고 20분까지 25%로 증가시킨 후 26분까지 25%를 유지하였으며, 이어서 27분까지 50%로 증가시킨 후, 30분까지 50%를 유지하였다. 마지막 단계에서 다시 2분 동안 10%로 설정하여 3분간 안정화시켰다. 관측에 사용된 UV값은 단일파장 259 nm이고, 시료주입량은 1 ㎕으로 하였다. 시료 중 각 성분의 면적은 relative response factors(RRF)를 고려하지 않고 각 표준품인 genistein, glycitein 및 daidzein의 면적을 이용하여 상대적으로 정량(mg/g dry weight, DW)하였다. 이소플라본 배당체를 동정하기 위한 MS 분석조건은 cone voltage 30 V, source temperature 120℃, desolvation temperature 450℃, N2 가스 1100 L/h 이었으며, 분자량 측정 범위는 100-1200
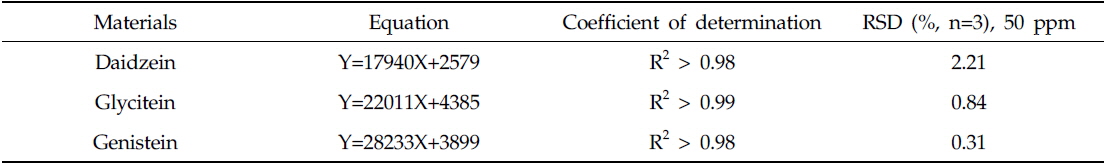
시료 내 플라보노이드는 외부 및 내부 표준법을 함께 사용하여 정량하였다. 외부표준물질 3종은 각각 1, 5, 10, 50 ppm의 농도 단계로 제조하여 검출된 면적을 기준으로 선형방정식 도출에 사용되었다. 내부표준물질은 galangin을 1000 ppm으로 제조한 후, 분석 시 최종 농도가 50 ppm이 되도록 하였다. 실험 중 발생하는 오차 보정을 위해 RF (Response factor, RF)값을 구하여 아래와 같은 함량 계산식에 적용하였다. 모든 자료정리 및 단순통계는 EXCEL 프로그램을 사용하여 도출 하였고, 정량에 사용된 표준물질들의 방정식과 상관계수 및 50ppm 기준의 재현성은 Table 1과 같다.
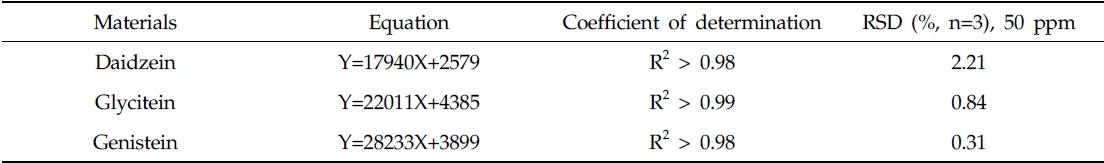
Equations and Relative standard deviation (RSD) for the quantification with representative standards
시료 내 개별 플라보노이드 화합물 함량(mg/100 g dry weight)= (Y=aX+b)×RF×전체용매량 시료중량/1000
Y: ppm (㎍/㎖), X: peak area (counts)
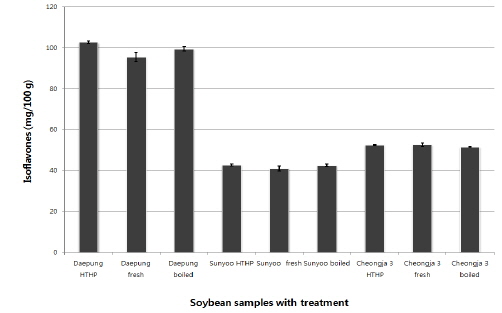
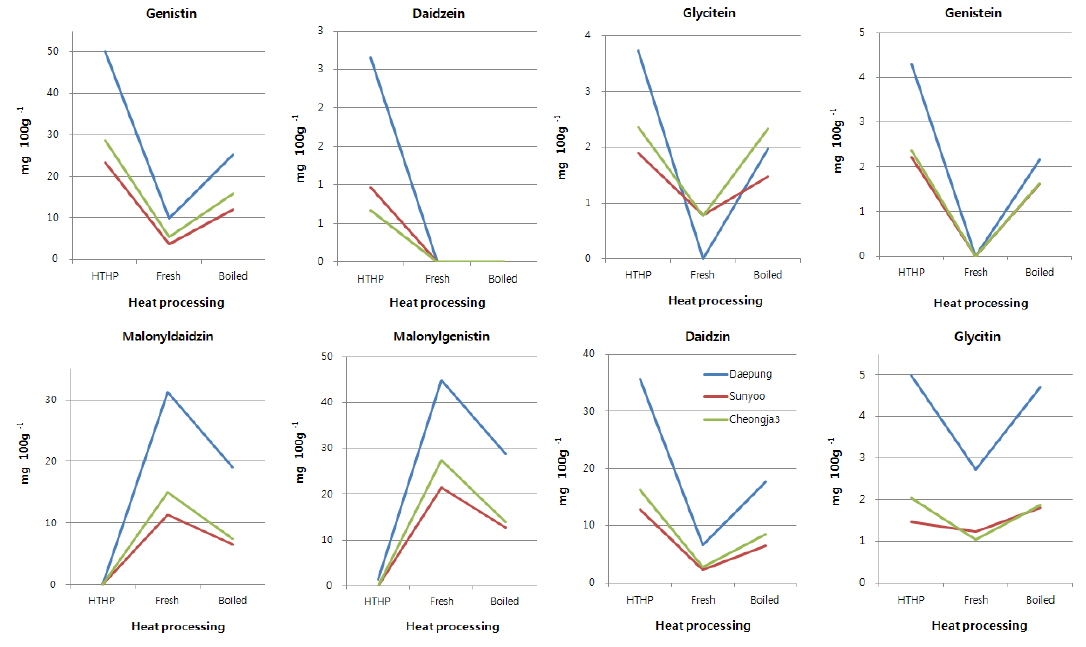
분석된 대두류 3종 내 이소플라본 화합물의 열처리별 총 함량은 Fig. 2와 같으며, 품종별로는 현저한 차이가 있었으나, 열처리별로는 차이가 미미하여 가열이 이소플라본 보호단백질의 불능화로 대두류 내 이소플라본 화합물 감소를 야기할 수 있다는 Malaypally & Ismail (2010)의 결과와 상이하였으나, 각 이소플라본 화합물의 함량에는 영향이 있었으나 총 이소플라본 함량에 영향이 없었던 Slavin 등 (2013)의 결과와 같은 경향을 나타냈다. 대풍의 총 이소플라본 함량은 고온고압 처리 시 102.66±0.29 mg/100 g, 삶았을 시 99.44±0.87 mg/100 g 그리고 무처리 시료의 경우 95.40±3.11 mg/100 g이었고, 선유는 고온고압 처리 시 42.67±0.34 mg/100 g, 삶았을 시 42.48±0.45 mg/100 g, 그리고 열처리를 하지 않았을 때 40.94±1.30 mg/100 g이었다. 검정콩인 청자3호는 고온고압 처리 시 52.50±0.39 mg/100 g, 삶았을 시 50.89±0.15 mg/100 g, 그리고 열처리를 하지 않았을 때 52.51±1.43 mg/100 g의 이소플라본을 함유하고 있었다. Sakthivelu 등 (2008)은 인디아 종의 대두에 55.82-104.86 mg/100 g, 불가리아 종의 대두에 62.79-171.69 mg/100 g 의 이소플라본이 함유되어 있고, 국내 품종의 경우 Moon 등(1996)은 대두 품종에 따라 30.8-113.4 mg/100 g, Kim 등(2000)과 Lee 등 (2002)은 평균 53.28과 80.9 mg/100 g의 이소플라본이 함유되어 있음을 보고하여 본 시험과 결과와 비슷한 수준이었다. 이에 반해 대두 내 이소플라본 함량 변화는 대두 품종, 지역, 재배년도(Wang and Murphy, 1994; Hong 등, 2010) 등의 요인에 따라 차이가 있다는 보고와 같이, Lee 등 (2013)이 제시한 대두 내 이소플라본 함량은 약 631.7-676.3 mg/100 g과 178.09-344.42 mg/100 g으로 본 시험 결과와 차이가 있었다. 또한 서리태에서 이소플라본(daidzein과 genistein)이 검출되지 않았고, 황태에서는 약 310.37 mg/100 g의 이소플라본(daidzein과 genistein)이 검출되었다는 보고도 있었다(Oh 등, 2002).
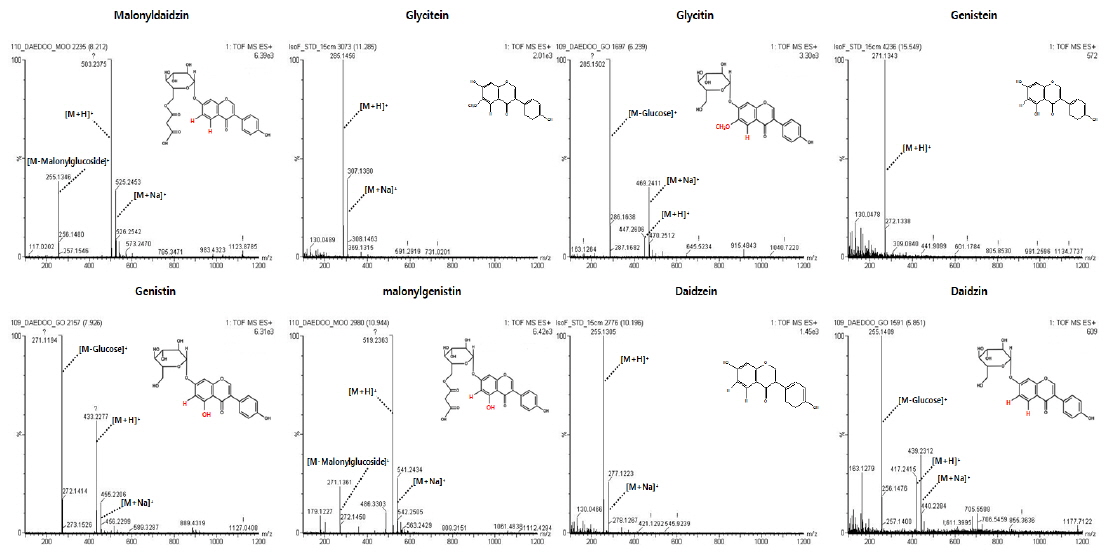
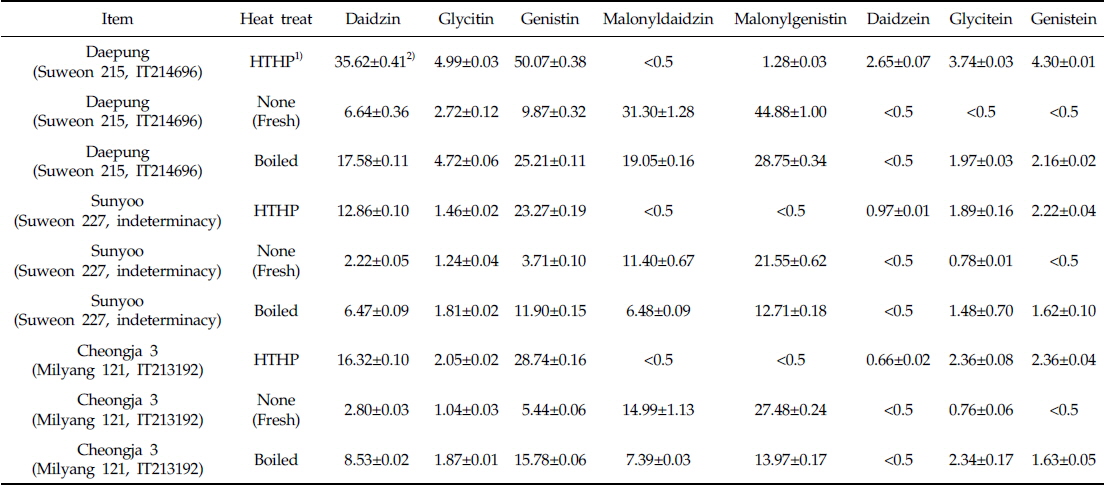
본 시험에서 검출된 주요 이소플라본 화합물은 daidzin, glycitin, genistin, malonyldaidzin, malonylgenistin, daidzein, glycitein 및 genistein이었고, Table 2는 각 열처리에 대한 세 품종의 대두가 함유한 각각의 이소플라본 화합물의 정량값이며, 함량변화 추이를 도식화 한 결과는 Fig. 3과 같다. 다이드제인 어글리콘과 포도당 한 분자가 결합되어 있는 형태의 다이드진(daidzin)은 대풍의 고온고압 처리에서 35.62±0.41 mg/100 g으로 다른 품종 및 처리구 중에 가장 높은 함유량을 나타냈고, 증자처리와 무처리 시 각각 17.58±0.11 mg/100 g과 6.64±0.36 mg/100 g으로 열처리 시 함량이 증가되었다. 선유와 청자3호에서도 가열의 세기가 증가함에 따라 daidzin의 함유량이 증가하는 경향을 나타냈다. 검출된 이소플라본 화합물 중 glycitin, genistin, glycitein 및 genistein 함량변화는 열처리에 대하여 daidzin과 같은 경향을 나타냈고, 아글리콘 형태의 daidzein은 무처리와 증자처리 시 거의 검출되지 않았으나, 고온고압 열처리에서만 대풍 2.65±0.07, 선유 0.97±0.01, 청자3호 0.66±0.02 mg/100g이 검출되었다. 이는 25, 80 및 100℃로 온도가 상승할수록 beta-glycosides의 형태가 늘어나는 Mathias 등(2006)의 결과와 100℃ 20분과 143℃ 60초의 열처리에서 beta-glycosides의 양이 유의적으로 늘어난 Xu & Chang(2009)의 결과와 유사하였다. 또한 Wally-Vallim 등(2014)이 보고한 열처리가 이소플라본 화합물 중 아글리콘 형태의 물질추출에 효과적이라는 결과와도 유사한 결과를 나타냈다. Malonyldaidzin은 daidzein에 malonlyglucosyl기가 결합한 구조로, 고온고압으로 열처리한 모든 시료에서 검출되지 않거나 미량(0.5 mg/100 g 미만)만 검출되었고, 증자로 열처리 시 대풍 19.05±0.16, 선유 6.48±0.09, 청자3호 7.39±0.03 mg/100g이 검출되었다. 반면, 열처리 하지 않았을 시 malonyldaidzin이 가장 크게 검출되어 대풍 31.30±1.28, 선유 11.40±0.67, 청자3호 14.99±1.13 mg/100 g 이었다. 또한 malonyldaidzin과 같이 malonlyglucosyl기가 genistein에 결합되어 있는 구조의 malonylgenistin도 열처리 하지 않았을 시 각 품종 내 검출함량이 가장 높았으며, 그 양은 대풍 44.88±1.00, 선유 21.55±0.62, 청자3호 27.48±0.24 mg/100 g이었다. Malonylgenistin의 함량은 malonyldaidzin에 비하여 모든 시험구에서 약 40%-100% 가량 함량이 높았으나, 열처리에 따른 함량변화 형태는 malonyldaidzin과 매우 흡사한 형태를 가지고 있어, 열처리하지 않은 시험구, 증자 열처리구, 고온고압 열처리구 순으로 함량이 점차 낮게 검출되었다. 이러한 결과는 80℃에서 30분동안 가열 시 malonylglucoside의 함량이 유의적으로 감소하 였다는 Huang & Chou (2008)의 결과와 같은 경향이었으며, 또한 압력밥솥에서 전기밥솥보다 alonylglucosides가 20% 이상 감소된 Im 등(2014)의 결과와 같은 경향을 나타냈다.
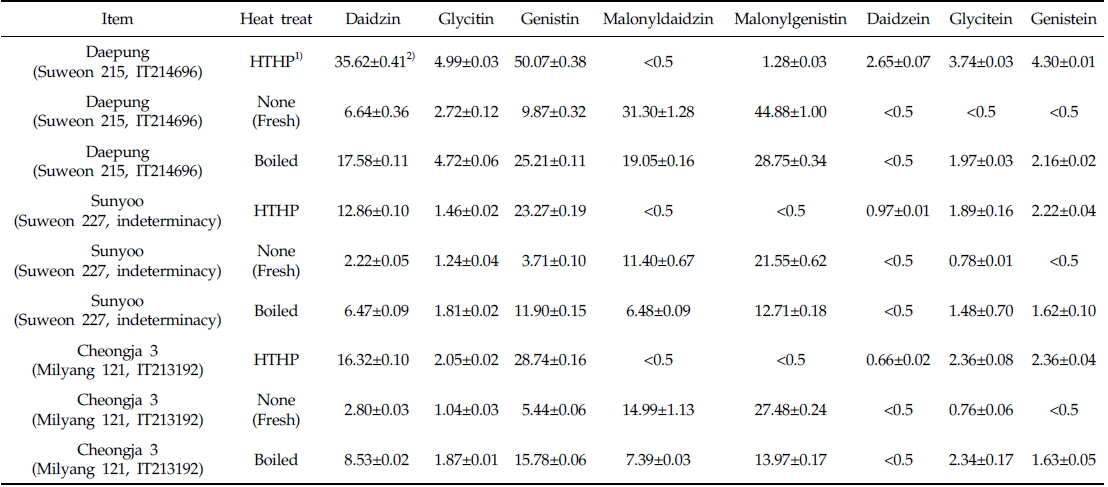
The composition and concentrations (mg/100 g) of representative isoflavone compounds in Three kinds of Korean soybeans within each thermal treats
국내산 3종류의 두류자원에 상이한 열처리 또는 열처리를 하지 않았을 시 두류자원 종류에 따라 이소플라본 화합물의 총 함량 차이가 있었으나, 처리방법에 따른 변화는 총 이소플라본의 함량차이는 크지 않았다. 이에 반해 각 이소플라본 화합물은 두류자원 종류와 열처리 방법에 따라 함량 차이가 크게 나타났다. Daidzin, glycitin, genistin, daidzein, glycitein 및 genistein은 고온고압과 증자 열처리 시 함량이 크게 증가하였으나, malonyldaidzin, malonylgenistin과 같은 malonylglucoside 형태의 이소플라본 화합물은 고온고압과 증자 열처리 시 함량이 크게 감소하였다. 이러한 결과는 콩을 이용한 효과적인 식단과 이소플라본을 이용한 기능성식품 개발에 이용 가능할 것으로 판단된다.