해양생태계에서 와편모조류(dinoflagellates)는 harmful algal blooms (HABs)의 주요 원인이며, 많은 biotoxins들의 주요 생산자이다(Glibert et al., 2005). 이러한 와편모조류들 중에서 Alexandrium 속 적조생물종들이 잠재적으로 신경성 독소들(neurotoxins)을 생산하고, 이러한 독소들(toxins)을 축적한 어패류를 섭취한 해양생물종과 심지어 인간에게까지 심각한 피해를 끼친다(May et al., 2010; Anderson et al., 2012). 특히 Alexandrium catenella는 paralytic shellfish poisoning (PSP)을 야기시키는 주요 원인종이다(Glibert et al., 2005). 이러한 이유로 전 세계적으로 많은 연구자들이 A. catenella에 대해 많은 연구를 하고 있다(Bravo et al., 2008; Toulza et al., 2010). 유독성 와편 모조류인 Alexandrium 속은 전 세계적으로 30여종이 보고되고 있으며, 종에 따라 독성의 차이는 있지만 화학적으로 유사한 20여종의 신경성 독소를 생산한다. 특히 A. catenella가 생산하는 마비성 패독(PSP)은 saxitoxin (STX)과 gonyautoxin (GTX) 및 그 유도체들을 포함하는 신경성 독소로서 먹이연쇄 과정에서 농축되어 패류 양식 산업은 물론 식품위생 등에도 심각한 피해를 끼치고 있다(Kamikawa et al., 2007).
한국 연안에서 출현하는 적조생물종은 34종 이상이 보고되고 있는데, 산업화가 가속화된 1981년부터 Alexandrium, Cochlodinium, Gymnodinium 및 Heterosigma 속 등의 와편모조류가 우리나라의 주요 적조 원인생물로 출현하고 있다(Kim, 1997). Alexandrium 속의 유독종으로는 A. tamarense, A. catenella 및 A. minutum 등이 알려져 있고, 이중 우리나라에서는 진해만과 여수만에서 A. tamarense와 A. catenella 등이 출현하는 것으로 보고되고 있다(Kim, 1995; Kim and Kim, 2004; Lee et al., 2006).
최근 적조 피해를 최소화하기 위한 적조생물의 구제 또는 제거 방법에 대한 연구로서 해양미생물을 이용하는 환경친화적인 생물학적 방제 방법에 대한 연구가 활발히 진행되고 있다(Imai et al., 1993; Yoshinaga et al., 1995, 1997, 1998; Lovejoy et al., 1998; Park et al., 1998; Kim et al., 1999; Jeong et al., 2000, 2003; Mitsutani et al., 2001; Wang et al., 2005; Kim et al., 2009; Jeoung et al., 2012). 그러나 지금까지 보고된 적조생물에 대한 살조미생물의 연구에 있어서 A. tamarense를 제어하는 미생물에 대한 연구(Wang et al., 2005, 2012; Su et al., 2007a, 2011)는 몇몇 연구자들에 의해 보고되고 있으나, A. catenella를 제어하는 미생물에 대한 연구(Jeoung et al., 2012)는 전 세계적으로도 미진한 실정이다.
이에 본 연구에서는 우리나라 연안에서 적조 및 마비성 패독을 일으켜 문제시되고 있는 유독성 적조생물인 A. catenella에 대한 살조미생물을 분리, 동정하고, 분리균주가 생산하는 살조물질을 분리, 정제하여 살조능과 살조범위를 조사함으로써 환경친화적 적조 구제법 개발의 기초 자료를 제공하고자 한다.
해수 sampling 장소는 울진 연안 해역으로 표층해수를 Niskin 개량형 채수기인 MB 채수기를 이용하여 광구병으로 무균(180℃에서 2시간 건열 멸균)적으로 채수하였으며, 채수 된 시료는 ice-box에 보관하여 3시간 이내에 연구실로 옮겨 실험하였다. 본 실험에 사용할 살조미생물을 분리하기 위해, 해수 시료를 십진희석법으로 희석하여 PPES-Ⅱ (yeast extract 1 g, proteose peptone 1 g, polypeptone 2 g, soytone 1 g, 0.1% ferric citrate 10 mL, seawater 1 L, initial pH 7.6) 배지(Taga, 1968)에 평판도말법으로 도말하여 20℃에서 7일간 배양 후, 형성된 특징적인 형태의 colony를 모두 선별하여 순수분리 하였다. 이들 분리균주들의 A. catenella에 대한 살조능(algicidal activity)을 알아보기 위해 f/2-Si (Guillard and Ryther, 1962) 배지를 넣은 24 well microplate에 전배양한 A. catenella 배양액(8.0 X 103 cells/mL) 0.9 mL씩을 각각 분주하고, PPES-Ⅱ 액체배지에서 전배양한 분리균주들의 배양액(103-104 cells/mL) 100 μL를 접종하여 살조능을 가지는 균주들을 선별하였다.
본 연구에서 사용한 A. catenella는 한국미세조류은행으로부터 분양받았으며, 하기의 무균배양법으로 순수 분리하였고 배양조건은 온도 20℃, initial pH 8.2, 광량 70 μEm-2s-1, 광주기 12 L:12 D의 조건으로 f/2-Si 배지에서 계대 배양하며 실험하였다. A. catenella를 순수분리 또는 무균배양 (axenic culture or bacteria-free culture)하는 방법은 다음과 같다: Droop (1967), Fontana와 Haug (1982), Cottrell과 Suttle (1993), Su 등(2007b) 및 Jeoung 등(2012)의 방법을 응용하여 A. catenella를 무균배양 하였다. 즉, 한계희석법으로 전 배양한 A. catenella 세포들을 원심분리하여 집적하고 멸균된 신선한 f/2-Si배지로 3번 반복 수세한 후, lysozyme (0.5 mg/mL, 20℃, 10 min)과 sodium dodecyl sulfate (SDS, 0.25%, 20℃, 10 min)를 순서대로 첨가한 후 상기의 조건으로 3회 계대 배양하였다. 이 후 antibiotic complex (gentamycin, streptomycin, cephalothin: each 100 μg/mL)에 노출시켜 3시간 정도 배양하여 세균과 곰팡이 등을 제거한 후, 다시 항생제를 첨가하지 않은 새로운 f/2-Si 배지에서 3회 계대 배양하였다. 이와 같은 조작을 수회 반복하여 얻은 무균 배양주를 무균 검사법에 의해 아래의 여러 가지 배지에서 오염 미생물이 검출되지 않는 것을 확인한 후 모든 실험에 사용하였다. 무균 검사에는 nutrient agar, PPES-Ⅱ, ST-10 agar (저영양, 종속영양 세균용), YM agar (Yeast용), PDA (곰팡이용)를 사용하였다. 사용한 배지의 조성은 다음과 같다: nutrient agar (peptone 5 g, meat extract 3 g, NaCl 3 g, agar 15 g, distilled water 1 L, initial pH 7.0), ST-10 agar (tripticase peptone 0.5 g, yeast extract 0.05 g, agar 12 g, seawater 1 L), YM agar (glucose 10 g, peptone 5 g, yeast extract 3 g, malt extract 3 g, agar 20 g, distilled water 1 L, initial pH 6.2), PDA agar (potato 200 g, glucose 20 g, agar 20 g, distilled water 1 L, initial pH 5.6).
분리한 살조미생물의 형태 및 배양학적 특성을 조사하기 위해, 분리균주들을 PPES-Ⅱ agar에 도말하여 20℃에서 48시간동안 preculture시킨 후, 증식한 균주를 PPES-Ⅱ broth가 20 mL 포함된 100 mL 삼각 플라스크에 접종하여 25℃, 200 rpm으로 24시간 배양하였다. 모든 실험은 대수증식기의 균주를 사용하였고, gram staining은 광학현미경(Zeiss Co. RMS 16)으로 검경하여 형태적 특징을 관찰하였다. 분리균주들의 생리 및 생화학적 특징은 MacFaddin (1980)과 Gerhardt 등(1981)의 방법을 준용하였다. 특히 분리한 살조미생물 균주 중 가장 살조능이 우수한 NH-3 균주는 산 생산유무, 탄소원 확인 및 생산 효소의 확인을 위해 API 20NE와 API 32GN kits (Biomerieux, France)를 이용하였으며, 그 결과를 apiwebTM database (http://apiweb.biomerieux. com)를 참조하여 1차적으로 분류학적 유사성을 검토하여 속 level까지 동정하였다. 실험 방법과 결과 해석은 API kit 제조사에서 제공하는 사용설명서를 준용하였으며, 결과 판독은 25℃에서 24시간과 48시간 배양 후 관찰함으로서 판정하였다.
또한 보다 정확한 동정을 위하여 16S rRNA gene을 이용한 염기서열 분석을 행하였다(Dunbar et al., 2000). 선별된 NH-3 균주를 PPES-II 배지에서 18시간 배양한 후, AccuPrepTM Genomic DNA extraction kit (Bioneer)를 사용하여 total genomic DNA를 추출하여 template로 사용하였다. 16S rRNA 유전자의 증폭에 이용된 primer쌍은 27F (5'-AGAGTTTGATCMTGGCTCAG-3')와 1492R (5'-GTGGATCCGGYTACCTTGTTACGACTT-3')을 사용하였다. 이때 forward primer의 5'에는 제한효소 EcoRI의 인식부위를, reverse primer의 5'에는 BamHI의 인식부위를 첨가하였다. PCR 반응은 AccuPower PCR Premix (Bioneer)를 사용하여 Minicycler (MJ Research, USA)로 실시하였다. 먼저 94℃에서 5분간 변성시킨 후, 94℃에서 1분, 61℃에서 1분, 72℃에서 1분씩 30회 반복하여 DNA를 증폭시키고, 마지막으로 72℃에서 5분간 extension시켜 PCR 반응을 종결시켰다. 정제된 16S rRNA gene의 PCR 반응물을 pGEM-T vector (Promega)에 ligation시켜 반응물을 미리 준비한 200 μL의 Escherichia coli XL1-blue 숙주세포에 형질전환 시킨 후 alkaline lysis 순수분리 방법(Sambrook et al., 1989)으로 plasmid를 mini-prep하였다. 또한 Termination Sequencing Ready Reaction kit (Perkin Elmer, USA)와 ABI 377 genetic analyzer (Perkin Elmer, USA)를 이용하여 염기서열을 분석하고, CLUSTAL W software Ver. 1.7 (Thompson et al., 1994)로 align하였다.
이와 같이 16S rRNA gene 분석을 통하여 염기서열을 결정한 후, National Center for Biotechnology Information(NCBI)의 GenBank 데이터베이스(http://www.ncbi.nlm.nih.gov/blast/) 및 Ribosomal Database Project (http://rdp.cme.msu.edu)에서 가장 상동성이 높은 균주들과 염기서열을 비교하여 계통 분석을 하였다. Kimura’s twoparameter model (Kimura, 1980)로 진화 거리(evolutionary distance)를 측정하였고, 계통도는 MEGA 5 package (Tamura et al., 2011)를 이용하여 neighbor-joining method (Saitou and Nei, 1987)로 작성하였고, 이때 Bootstrap은 1,000회 반복하여 분석하였다.
살조미생물의 성장단계에 따른 살조능을 알아보기 위해 NH-3 균주를 PPES-Ⅱ 액체배지에 접종하여 최적 조건(25℃, initial pH 7.0, 2.0% NaCl)에서 39시간 배양하면서 균의 증식에 따른 살조능을 조사하였다. 즉, 대수증식기로 배양한 A. catenella 배양액(8.0 x 103 cells/mL) 0.9 mL에 최적 조건에서 배양한 NH-3 균주 배양액을 각 3시간 간격으로 0.1 mL씩 접종하여 48시간 배양 후 살조능을 조사하였다. 이 때 control에는 균주 배양액 대신 동량의 PPES-II 배지를 넣어 주었다. 살조능은 A. catenella의 생존상태를 광학현미경하에서 관찰하여 48시간 후에 살아있는 A. catenella 세포수를 counting하는 bioassay법으로 측정하였으며 다음과 같이 구하였다: Algicidal activity (%) = {1 - (시료를 첨가한 test tube의 세포수/control의 세포수) X 100}.
NH-3 균주가 생산하는 살조물질의 농도에 따른 살조능을 알아보기 위해, 균주 배양여과액의 첨가 농도에 따른 살조능을 조사하였다. 먼저 PPES-Ⅱ 액체배지에서 최적조건(25℃, pH 7.0, NaCl 2.0%)으로 배양한 대수증식기 후기(27시간 배양)의 NH-3 균주의 배양액을 원심분리(3,000 x g, 10 min)하여 상등액을 0.2 μm pore size의 polycarbonate membrane filter로 여과하였다. A. catenella 배양액(8.0 x 103 cells/mL)에 균주 배양여과액을 각각 최종농도가 1, 3, 5 및 10%가 되도록 접종한 후, 상기의 A. catenella의 배양조건으로 배양하며 매 6시간마다 살조능을 측정하였다. 배양액을 첨가하지 않고 계속 배양한 것을 control로 하였으며, 이 때 control에는 배양여과액 대신에 동량의 신선한 PPES- Ⅱ 액체배지를 첨가하였으며, 3회 반복 실험을 통하여 결과를 산출하였다.
NH-3 균주가 생산하는 살조물질을 분리, 정제하기 위하여 상기의 배양조건으로 20 L을 배양하여 배양여과액을 준비하였다. 배양여과액은 에틸아세테이트로 이층분배하여 추출하였으며, 에틸아세테이트 분액은 감압농축하여 -20℃에서 다음 실험 전까지 보관하였다. 이후 에틸아세테이트 추출물은 silica gel chromatography에 loading하여, 클로로포름과 메탄올로 용출하였다. 클로로포름-메탄올(9:1) fraction에서 우수한 살조활성이 확인되었으므로, 이 분획층을 preparative silica gel TLC (Kieselgel 60F254, 20 x 20 cm, Merck)에 loading하고 용매로서 클로로포름-메탄올(8:2)을 사용하였다. 살조활성을 보인 prep-TLC 분획층을 preparative HPLC (Inertsil ODS-3, GL Sciences Inc., 10 x 250 mm, flow rate 2.0 mL/min, 35% MeOH, UV detector set at 210 nm)를 이용하여 최종적으로 순수한 살조물질(algicide)을 분리, 정제하였다.
이상의 결과로 얻은 순수분리 살조물질의 살조범위 또는 살조특이성을 조사하기 위하여 실험한 유해성 적조생물종(Harmful Algal Bloom Species)은 다음과 같다: Chattonella marina, Cochlodinium polykrikoides와 Heterosigma akashiwo는 NFRDI (National Fisheries Research & Development Institute, Republic of Korea) 에서 분양받았으며, Gymnodinium sanguineum, G. impudicum, Fibriocapsa japonica, Prorocentrum micans, P. minimum과 Scrippsiella trochoidea는 the South Sea Institute of KORDI (Korea Ocean Research & Development Institute, Republic of Korea)로부터 분양 받았다. NH-3 균주가 생산하는 살조물질의 살조특이성은 각 각의 적조생물을 상기의 조건으로 배양하며, 살조물질의 최종 농도가 100 μg/mL이 되도록 첨가하여 12시간 후의 살조능 을 측정함으로서 판단하였다.
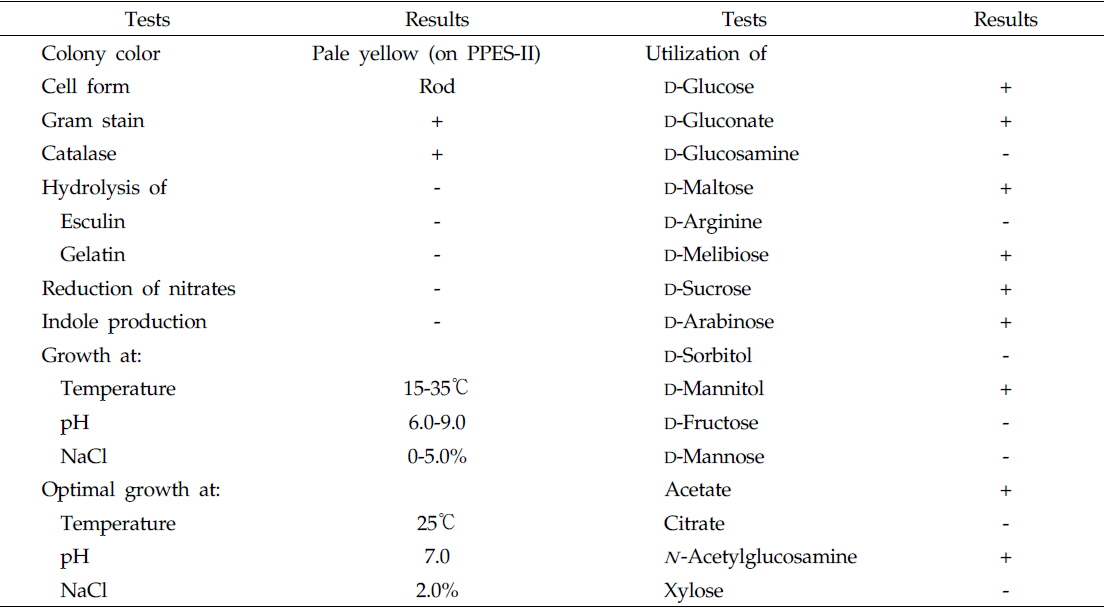
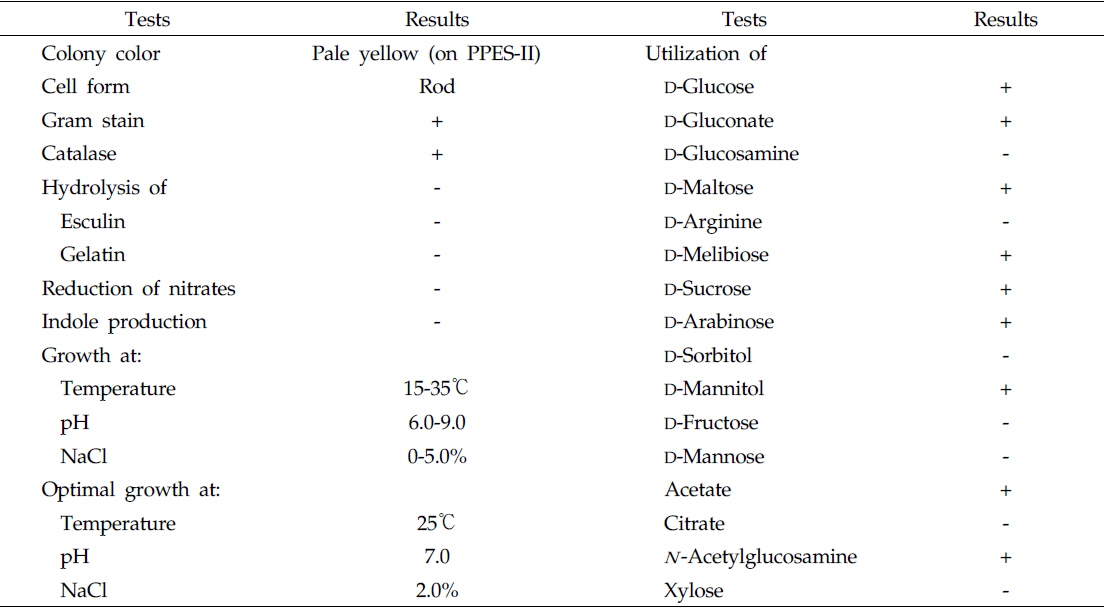
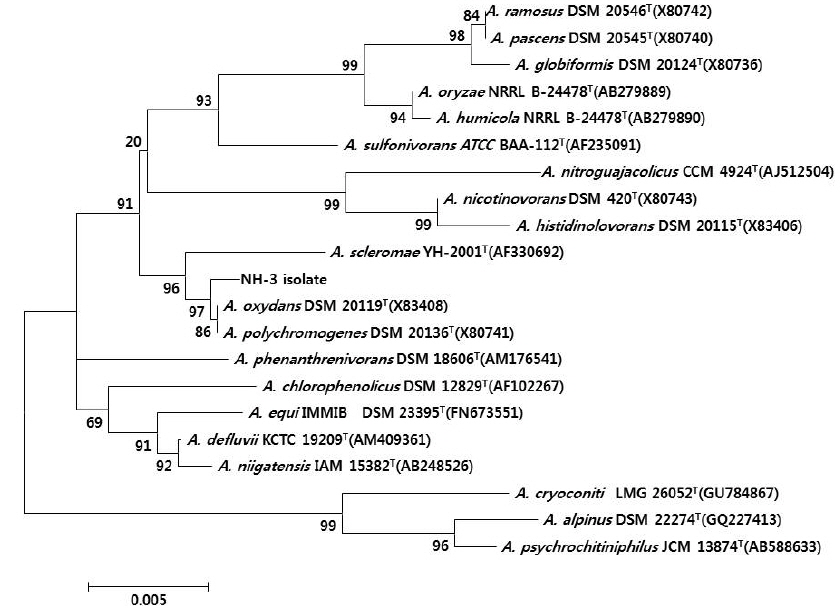
울진 연안 해역의 해수로부터 서로 다른 colony색과 형태를 가진 100여개의 미생물 균주를 분리하였으며, 그 각각의 colony를 PPES-II 평판배지에서 순수분리하여 A. catenella에 대한 살조능을 조사하였다. 그 중 가장 뛰어난 살조능을 보인 NH-3 균주를 선정하여 배양학적, 형태학적 특성 및 API kits를 이용한 생화학적 특성을 조사하여 1차적으로 분류학적 유사성을 검토하였다. NH-3 균주는 Gram 양성, 간균(rods)으로(Fig. 1), PPES-II agar에서 엷은 노란색 colony를 형성하였다. 또한 catalase는 양성이었으며, esculin과 gelatin은 가수분해하지 않았고 nitrate 환원능은 없었다. 최적 배양조건은 25℃, pH 7.0, 2.0% NaCl 농도였으며, 10℃이하와 37℃ 이상, pH 5.0 이하와 10.0 이상 및 7.0%(w/v) 이상의 NaCl 농도에서는 증식하지 못 하였다. 또한 D-Glucose, D-Gluconate, D-Maltose, Melibiose, D-Sucrose, D-Arabinose, D-Mannitol, Acetate 및 N -Acetylglucosamine을 유일한 탄소원 및 에너지원으로 이용하였다(Table 1). 이상의 결과, 본 균주는 Arthrobacter 속과 가장 유사하였으며, 보다 정확한 동정을 위하여 16S rRNA gene 염기서열(1,418bp)을 분석하여, NCBI GenBank와 RDP (Ribosomal Database Project)에 등록된 Arthrobacter 속 균주들과 유전자간의 상동성을 조사하였다. 그 결과, NH-3 균주는 Arthrobacter polychromogenes (DSM 20136: X80741) 및 A. oxydans (DSM 20119: X83408)와 가장 높은 상동성(99% 이상)을 나타내어(Fig. 2), 본 살조미생물을 Arthrobacter sp. NH-3로 명명하여 이후의 실험을 진행하였다. 또한 본 균주의 16S rDNA 염기서열은 GenBank database에 등록하여 accession No. KR921582를 부여받았다.
현재까지 보고된 적조생물을 제어하는 대표적인 살조미생물들로는 Alteromonas 속(Imai et al., 1995), Bacillus 속(Jeong et al., 2003), Brachybacterium 속(Kim et al., 2009), Flavobacterium 속(Yoshinaga et al., 1995), Micrococcus 속(Park et al., 1998; Jeong et al., 2000), Pseudomonas 속(Wang et al., 2005), Pseudoalteromonas 속 (Lovejoy et al., 1998; Lee et al., 2000; Mitsutani et al., 2001; Skerratt et al., 2002; Su et. al., 2007a, 2011; Jeong et al., 2012; Wang et al., 2012) 및 Vibrio 속(Wang et al., 2012) 등이 보고되었으나, 적조생물을 제어하는 Arthrobacter 속 살조미생물에 대한 연구는 아직까지 보고 된 적이 없다.
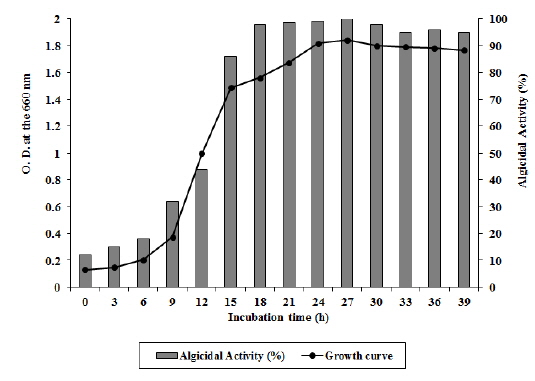
Arthrobacter sp. NH-3은 6시간의 유도기를 거쳐 대수증식기에 접어들고 배양 30시간 이후에 서서히 정지기로 접어드는 성장곡선(growth curve)을 보였다(Fig. 3). 성장단계에 따른 살조능을 비교 실험한 결과 대수증식기 후기(18-27시간 배양), 정지기(30-39시간 배양), 대수증식기 중기(9-15시간 배양), 유도기(6시간 배양) 순으로 살조능이 높게 나타났다. 즉, 유도기에는 A. catenella에 대한 살조능이 20% 이하로 낮게 나타났으나, 대수증식기 중기를 거치면서 활성이 급격히 증가하기 시작하여 32-86%의 살조능을 보이다가, 대수증식기 후기에 살조능이 96-100%로 최고조에 이르렀으며, 정지기에도 95% 이상의 살조능을 유지하였다(Fig. 3). 본 균주는 유도기에는 성장을 위해 살조물질과 같은 2차대사 산물을 거의 생산하지 않으나, 균수가 급격히 증가하는 대수증식기 중기부터 살조물질을 생산하기 시작하여 대수증식기 후기에 살조물질을 가장 많이 축적하는 것으로 판단된다. 또한 정지기에도 살조능이 급격히 감소하지 않는 것으로 보아 배양액속에 축적된 살조물질은 쉽게 분해되거나 영양물질로 재이용되지는 않는 것으로 판단된다. 이러한 결과를 Jeoung 등 (2012)이 발표한 Pseudoalteromonas sp. NH-12의 성장과정에 따른 살조능과 비교해 볼 때, 본 균주는 보다 빠른 성장과 우수한 살조능을 가지고 있는 것으로 판단된다. 또한 본 균주의 A. catenella에 대한 살조유형을 조사한 결과, 살조물질을 세포외로 분비하는 ‘살조인자 분비형’으로 확인되었다 (자료 미제시). 더욱이 본 균주가 유독성 적조생물인 A. catenella와 접촉이 없는 상태에서도 살조물질을 적극적으로 생산하는 것으로 보아, 본 균주가 생산하는 살조물질은 살조특이성이 높지 않고 여러 적조생물에 대해 광범위하게 작용할 것을 시사한다.
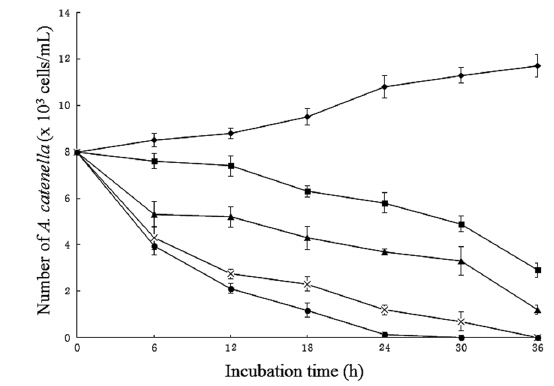
Arthrobacter sp. NH-3은 살조물질을 세포내에 축적하지 않고, 세포외로 분비하는 ‘살조인자 분비형’으로 판단되므로, 본 균주가 생산하는 살조물질의 농도에 따른 살조능을 알아보기 위해, 균주 배양여과액의 첨가 농도(1, 3, 5 및 10%)에 따른 A. catenella (8.0 x 103 cells/mL)에 대한 살조능을 조사한 결과는 Fig. 4와 같다. NH-3의 배양여과액을 1%가 되도록 첨가한 경우 12시간 후에 A. catenella의 개체수 는 7.4 x 103 cells/mL로 살조능은 약하였으나, 이후 개체수 는 서서히 줄어들어 36시간 후에 2.9 x 103 cells/mL로 줄 어들었다. 또한 3%를 첨가한 경우 6시간 후에 5.3 x 103 cells/mL로 급격한 개체수의 감소를 보였으나, 이후 점진적으로 하락하다가 36시간 후에 2.2 x 103 cells/mL로 개체수가 줄어들었다. 특히 5%와 10%가 되게 첨가하였을 경우, 12 시간 만에 개체수가 2.7 x 103 cells/mL 이하로 급격히 떨어졌으며, 5%의 경우 36시간 만에 10%의 경우 30시간 만에 모든 A. catenella의 세포가 100% 사멸되었다. 즉, 배양여과액의 첨가량과 반응시간에 비례하여 A. catenella에 대한 살조능이 증가하는 경향을 보였다. A. catenella에 의한 적조 발생 시 대부분의 양식어류가 72시간 이내에 폐사하는 것을 고려할 때, 1% 첨가 시 36시간 이내에 적조 피해가 없는 2.9 x 103 cells/mL 이하로 개체수가 줄어드는 결과는 적조피해를 저감할 가능성이 높은 상당히 고무적인 결과로 판단된다. 한편 최근 Yang 등(2014)은 Joostella sp. DH77-1이 2% 농도에서 A. tamarense를 24시간 후에 80% 살멸한다고 보고하였는데, 이는 Arthrobacter sp. NH-3보다 우수한 살조능을 보이고 있다.
Arthrobacter sp. NH-3이 생산하는 살조물질을 분리, 정제하기 위하여 PPES-II 배지에서 20 L을 배양한 후, 원심분리 및 filtration을 통하여 얻은 배양여과액을 에틸아세테이트로 추출하여 1.68 g의 에틸아세테이트 추출물을 얻었다. 이 추출물을 silica gel chromatography를 행한 결과, 클로로포름-메탄올(9:1) fraction (130 mg)에서 우수한 살조활성이 확인되었다.
따라서 살조물질을 보다 더 정제하기 위하여, 용매로서 클로로포름-메탄올(8:2)을 사용하여 preparative silica gel TLC를 행하였다. 살조활성을 보인 prep-TLC 분획층(Rf value=0.70)을 preparative HPLC를 이용하여 최종적으로 살조물질 1.65 mg을 순수분리, 정제하였다. 본 물질은 아미노기를 가지는 방향족 화합물로서 현재 물질의 특성과 구조결정을 위해 추가적인 실험을 진행 중이다.
지금까지 많은 살조미생물에 대한 연구가 보고되었지만, 대부분 살조미생물의 분리와 동정, 유독성 적조생물이 아닌 담수(fresh water)종 미세조류의 용조 현상(alga-lysing phenomenon)에 한정되어져 있다. 더욱이 살조미생물이 생산하는 살조물질(algicidal compounds, algicides)을 분리, 정제한 보고는 극히 드문 현실이다. 현재까지 보고된 살조물질에는 antibiotic-like substances (Nakashima et al., 2006), biosurfactants (Ahn et al., 2003; Wang et al., 2005), peptides (Imamura et al., 2000; Jeong et al., 2003), protease (Lee et al., 2000) 및 protein (Mitsutani et al., 2001; Wang et al., 2012) 등이 보고되고 있으나, 아직까지 살조물질들의 살조기작에 대한 연구는 미진한 실정이다.
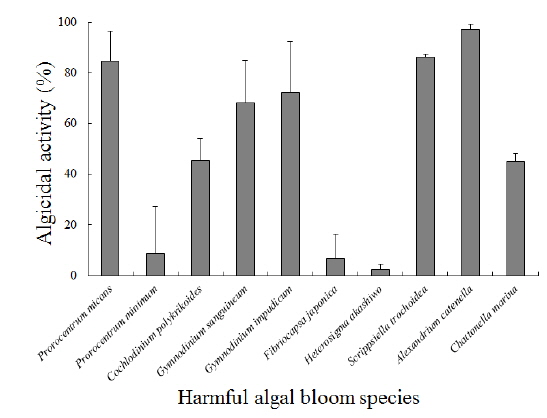
Arthrobacter sp. NH-3이 생산하는 살조물질의 살조범위 또는 살조특이성을 조사하기 위하여, 각각의 유해성 적조생물에 대한 영향을 조사한 결과는 다음과 같다(Fig. 5). 결과의 판정은 각각의 적조생물을 최적 배양 조건으로 배양한 후, 살조물질을 100 μg/mL이 되도록 첨가하여 12시간 후의 살조능을 비교하였다. A. catenella는 배양 12시간 후에 97%이상 사멸되어 가장 높은 살조능을 보였으며, S. trochoidea는 86% 이상, P. micans는 84% 이상 사멸되었다. 또한 G. impudicum과 G. sanguineum은 각각 72%와 68% 이상 사멸되었다. 반면 C. polykrikoides와 C. marina는 둘 다 45% 이상만 사멸되었다. 그러나 P. minimum과 F. japonica에 대해서는 각각 8.6%와 6.7% 이하의 낮은 살조능을 보였으며, H. akashiwo에 대해서는 2.2% 이하로 거의 살조능을 보이지 않았다. 즉, Arthrobacter sp. NH-3이 생산하는 살조물질은 우리나라 연안에서 가장 피해를 많이 주는 적조생물인 C. polykrikoides에 대해서는 45%의 중간정도의 살조능을 보이나, 마비성 패독(PSP)을 생산하는 유독성 적조생물인 A. catenella에 대해서는 12시간 만에 97% 이상 사멸시키는 매우 높은 살조능을 보였다.
이상의 결과, Arthrobacter sp. NH-3이 생산하는 살조물질은 ‘살조인자 분비형’이면서도 살조범위는 넓어 살조특이성은 높지 않은 것으로 판단되나, A. catenella에 대해서는 매우 높은 살조능을 보였다. 반면 지금까지 보고된 ‘살조인자 분비형’ 살조미생물들은 대부분 살조특이성이 높아(specific algicidal activity) 특정 적조생물에만 살조능을 보이고, ‘직접 공격형’ 살조미생물들은 살조특이성이 낮아 광범위한 살조활성(broad algicidal activity)을 보이는 것으로 보고되고있다(Doucette, et. al., 1999; Jeong et al., 2000, 2003; Mitsutani et al., 2001; Mayali and Azam, 2004; Kim et al., 2009). 또한 대표적인 ‘살조인자 분비형’ 살조미생물로는 Alteromonas 속, Bacillus 속, Brachybacterium 속, Flavobacterium 속, Micrococcus 속, Pseudoalteromonas 속 및 Pseudomonas 속 등이 보고되고 있다(Jeong et al., 2000, 2003; Lee et al., 2000; Mitsutani et al., 2001; Skerratt et al., 2002; Mayali and Azam, 2004; Su et al., 2007a, 2011; Kim et al., 2009; Jeoung et al., 2012).
Arthrobacter sp. NH-3이 생산하는 살조물질의 적조생물에 대한 살조특이성을 자세히 살펴보면, 유각종이며 유영세포의 크기가 비교적 큰 적조생물(20 μm 이상)인 A. catenella, S. trochoidea 및 P. micans에 대해서는 84% 이상의 높은 살조능을 보였고, 유영세포의 크기가 비교적 크고 무각종인 G. impudicum, G. sanguineum, C. polykrikoides 및 C. marina에 대해서는 45-72%의 중간 정도의 살조능을 보였다. 또한 무각종이면서 유영세포의 크기가 작은 적조생물(20 μm 이하)인 P. minimum과 F. japonica에 대해서는 6.7-8.6%의 낮은 살조능을 보였고, 특히 H. akashiwo에 대해서는 2.2% 이하의 살조능을 보여 거의 영향을 미치지 않는 것으로 판단된다. 즉, 무각종보다는 유각종에 대해서 높은 살조능을 보였고, 비교적 크기가 작고 개체수의 증가 속도가 빠른 적조생물종에 대해서는 낮거나 살조능이 거의 없는 것으로 판단된다. 무각종은 껍질이 없는 형태(naked type) 또는 단순한 점액질로 덮혀 있는 상태이며, 유각종은 주로 섬유질 성분의 피각(theca)으로 덮혀 있는 갑주형 형태(armored type)이다. 상기의 결과가 나타나는 이유는 Arthrobacter sp. NH-3이 생산하는 살조물질이 유각종의 피각을 인식하고 녹이는 특성이 있거나 피각의 섬유질 성분이 살조물질을 유도하는 성질이 있을 것으로 유추되며, 무각종의 점액질은 살조물질이 인식하지 못 하거나 살조물질의 유도 또는 접합을 방해하는 성질이 있지 않을까 유추된다. 향후 살조물질의 구조를 결정하고, 이러한 현상이 나타나는 이유를 포함하여 살조 메커니즘을 밝힌다면 적조생물의 제어와 현장 적용성의 향상에 많은 도움이 될 것으로 판단된다.
전 세계적으로 적조 및 마비성 패독을 일으켜 문제시되고 있는 유독성 와편모조류인 A. catenella를 살조시키는 해양미생물 NH-3 균주를 울진 연안 해역에서 분리, 동정하고 살조물질을 분리, 정제하여 살조 범위 및 살조능을 조사하였다. 본 균주는 API kits 및 16S rRNA gene 염기서열을 분석하여 계통분류를 행한 결과 Arthrobacter sp. NH-3으로 명명하였으며, 최적 배양조건은 25℃, pH 7.0, 2.0% NaCl 농도였다. Arthrobacter sp. NH-3의 성장 단계별 살조능은 대수증식기 후기, 정지기, 대수증식기 중기, 유도기 순으로 높게 나타났다. 살조물질은 대수증식기 중기 이후에 활발히 생산되기 시작하여 대수증식기 후기에 가장 고농도로 축적되었다. Arthrobacter sp. NH-3은 세포외로 물질을 분비하여 살조시키는 ‘살조인자 분비형’으로 확인되었다. 또한 Arthrobacter sp. NH-3의 배양여과액을 5%와 10%가 되게 첨가하였을 경우, 12시간 만에 개체수가 2.7 x 103 cells/mL 이하로 급격히 떨어졌으며, 5%의 경우 36시간 만에 10%의 경우 30시간만에 모든 A. catenella의 세포가 100% 사멸되었다. 또한 본 균주를 20 L 배양하여 유기용매 추출, prep-TLC 및 prep-HPLC를 이용하여 살조물질 1.65 mg을 순수분리, 정제하였다. Arthrobacter sp. NH-3이 생산하는 살조물질을 100 μg/mL의 농도로 첨가하여 각종 유해성 적조생물들에 대한 살조범위를 조사한 결과, 첨가 12시간 후에 A. catenella는 97% 이상 사멸되었고 S. trochoidea, P. micans, G. impudicum 및 G. sanguineum은 최소 68% 이상 사멸되었다. 반면 C. polykrikoides와 C. marina는 45% 이상만 사멸되었다. 그러나 P. minimum과 F. japonica에 대해서는 각각 8.6%와 6.7% 이하의 낮은 살조능을 보였으며, H. akashiwo에 대해서는 2.2% 이하로 거의 살조능을 보이지 않았다. 이상의 결과, Arthrobacter sp. NH-3이 생산하는 살조물질은 ‘살조인자 분비형’이면서도 살조범위는 넓어 살조특이성은 높지 않은 것으로 판단되나, 마비성패독을 생산하는 유독성 적조생물인 A. catenella에 대해서는 매우 높은 살조능을 보였다. 또한 본 균주가 생산하는 살조물질은 무각종보다는 유각종에 대해 높은 살조능을 보이는 특징이 관찰되었다. 이상의 연구결과를 토대로 살조물질의 구조를 규명하고 살조 메카니즘을 밝힌다면, 보다 효율적인 적조 구제법 개발에 좋은 기초 자료가 될 것이다.