This inquiry was conducted to develop DeNOx catalyst for LNT. In order to develop appropriate catalysts, four catalysts, which do not use PGM (Platinum Group Metal), were carefully selected : Al/Co/Mn, Al/Co/Ni/Mn, Al/Co/Mn/Ca, Al/Co/Ni mixed metal oxides during preliminary experiments. Also, XRD, EDS, SEM, BET and TPD tests were carried as well to evaluate both physicochemical properties of such four catalysts. As a result of the experiment, four catalysts were composed of spinel-shaped crystals and had more than enough pore volume and size to have oxidation-reduction reaction of NOx gases. Additionally, through TPD test, all four types of catalysts were proved to possibly have an oxidation-reduction acid site and NO oxidation activities similar to commercial catalysts. Based on the results above, if we have further change in the composition components and active ingredients according to the catalysts that were chosen in this investigation, then we are more welcomed to expect to have an enhanced DeNox catalyst for LNT.
온실가스 문제로 인한 연비규제가 강화되고 있는 추세에서 디젤엔진은 높은 출력과 연료 경제성 및 CO2 배출량에 대해서 가솔린 엔진 대비 많은 장점을 보유하고 있어 수요가 점차 증가하고 있는 추세이나 디젤엔진의 연소특성에 의해 입자상물질(particulate matter, PM) 및 질소산화물(nitric oxides, NOx)에 대한 배출량이 높기 때문에 이에 대한 대응기술이 필요하다[1].
가솔린엔진에서 배출되는 탄화수소, 일산화탄소 및 질소산화물은 삼원촉매(three-way catalyst)만 사용하여 동시에 배출되는 오염원을 저감하지만, 디젤엔진에서 배출되는 질소산화물 저감을 위한 별도의 기술이 필요한 이유는 디젤엔진은 과잉 산소 분위기에서 운전되기 때문에 배기가스에서 산소와 질소산화물, 산화성 물질이 미연소 탄화수소나 일산화탄소 등 환원성 물질보다 많이 존재하여 배기가스 내에 존재하는 탄화수소, 일산화탄소와 같은 환원제가 질소산화물환원에 이용되기 보다는 산소와 반응하여 연소되는 반응이 우세하여 질소산화물의 환원이 어렵기 때문이다. 이와 같이 산소과잉조건에서 질소산화물을 저감시키기 위해 촉매를 사용하게 되는데, 이때 사용되는 촉매를 DeNOx 촉매라고 한다[2].
디젤엔진 배기가스 탈질방법중 하나인 LNT(lean NOx trap)법은 Toyota 자동차社 등을 중심으로 개발되어 왔는데, 이 방법은 엔진의 산소과잉 상태에서 Ba과 같은 원소위에 질소화합물을 일시 저장한 후 산소과잉이 아니거나 산소부족의 상태에서 저장된 질소 화합물을 순간적으로 분해하는 방법으로 엔진의 구동부분만이 정확히 제어될 수 있다면 잘 적용될 수 있는 방법이다. 그러나 이 방법의 단점은 질소화합물을 저장하는 원소가 연료에 포함되어 있는 황성분과 너무 쉽게 반응하여 황화합물을 형성하는 점과 NOx trap 시간이 질소화합물 분해시간보다 지나치게 길어질 경우에 촉매 부피가 커진다는 단점이 있다[3]. 따라서, LNT용 DeNOx 촉매는 SOx 흡수제와 NOx 환원 촉매로 적합하고 상대적으로 많은 흡수량과 높은 흡착과 탈착 속도를 가져야 함은 물론이고 기계적 특성, 활성 성분의 고른 분포 및 내마모 특성, 피로부식의 저항성 등의 특성 등이 요구되므로 최근의 연구들은 이러한 문제들을 해결하는 방향으로 진행되고 있다[1,4-7]. 이러한 문제를 해결하기 위해서는 무엇보다도 가장 중요한 요소는 촉매를 이루고 있는 금속성분들의 조성비라고 할 수 있으며, 이중 대부분 LNT용 촉매는 Pt 등의 귀금속을 이용한 많은 연구들이 보고되고 있다[1,5,8]. 일반적인 NOx 처리용 촉매로는 최소한 200 ℃ 이상에서 활성을 나타내는V2O5/TiO2 촉매 및 제올라이트(zeolite)계 촉매가 사용되나, 저온 영역의 NOx 산화를 위해서는 고가의 귀금속인 Pt를 사용해야 하므로 경제적인 단점으로 부각되고 있다[9]. 이러한 경제적인 이유로 인하여 Pt 및 Pd과 같은 귀금속(platinum group metals, PGM)의 사용이 배제된 디젤 배가스 산화를 위한 PGM-free 금속 산화물들이 소개되기 시작하였다[10-13]. 특히, 페로브스카이트(pervoskite) 산화물 촉매가 NOx를 제거 또는 감소시키기 위한 PGMs의 사용을 대체시킬 수 있는 가능성을 보여주고 있는 연구 등이 최근에 보고되기 시작하였다[14,15].
이러한 연구의 일환으로 본 연구에서도 PGMs 사용이 배제된 LNT용 DeNOx 촉매를 개발하고자 하였다. 이를 위하여 예비실험을 통해 선정된 4종의 촉매에 대한 기본 물성 및 NOx 전환율 등을 고찰하고자 하였으며, 이를 바탕으로 향후에는 보다 개선된 성능을 발현시킬 수 있는 촉매개발의 기초자료로 활용하고자 하였다.
2.1.1. Al/Co/Mn 촉매
Al/Co/Mn (이하 ACM)촉매는 다음의 일련의 과정을 거쳐서 제조되었다. 먼저 Aluminum nitrate nonahydrate 1 mole (MW=375.13)과 Cobalt(II) nitrate hexahydrate 및 Manganese(II) nitrate hexahydrate를 각각 2 mole, 1 mole 비로 혼합 용해하였다. 이러한 혼합 용액을 미리 제조하여 둔 NaOH 2.5 M과 Na2CO3 0.6 M이 혼재하는 완충용액에 상온에서 서서히 첨가하면서 침전물의 생성을 확인하였다. 이때 혼합 용액 pH가 11 이상이 유지되는지 확인하고, 합성된 침전물은 65 ℃에서 16시간 동안 aging한 후 여과하여 pH가 7이 될 때까지 충분한 세척 과정을 거쳐 촉매 전구체를 얻었다. 이 전구체 화합물을 110 ℃의 건조기에서 12시간 이상 건조하고 분쇄한 후, 소성로(furnace)에 넣고 천천히 온도를 상승시켜 500 ℃에서 4시간 이상 소성(calcination)하여 혼합금속산화물 ACM촉매를 제조하였다.
2.1.2. Al/Co/Ni/Mn 촉매
Aluminum nitrate nonahydrate 1 mole과 Cobalt(II) nitrate hexahydrate, Nickel nitrate hexahydrate 및 Manganese(II) nitrate hexahydrate를 각각 1.3 mole, 0.3 mole, 0.4 mole 비로 용해하여 혼합 용액을 얻었다. 이하 과정은 2.1.1과 동일하게 진행하여 Al/Co/Ni/Mn (이하 ACNM) 촉매를 제조하였다.
2.1.3. Al/Co/Mn/Ca 촉매
Aluminum nitrate nonahydrate 1 mole과 Cobalt(II) nitrate hexahydrate, Manganese(II) nitrate hexahydrate 및 Calcium nitrate tetrahydrate를 각각 2 mole, 1 mole, 1 mole 비로 용해하여 혼합 용액을 얻었다. 이하 과정은 2.1.1과 동일하게 진행하여 Al/Co/Mn/Ca (이하 ACMC) 촉매를 제조하였다.
2.1.4. Al/Co/Ni 촉매
Aluminum nitrate nonahydrate 1 mole과 Cobalt(II) nitrate hexahydrate 및 Nickel nitrate hexahydrate를 각각 1.8 mole, 0.2 mole 비로 용해하여 혼합 용액을 얻었다. 이하 과정은 2.1.1과 동일하게 진행하여 Al/Co/Ni (이하 ACN) 촉매를 제조하였다.
2.2.1. X-선 회절 분석
결정 구조를 확인하기 위한 분말 X-선 회절 분석(X-ray diffraction pattern, XRD)은 Cu tube 및 Graphite-Monochromator가 부착된 Rigaku ultima IV diffractometer로 40 KV, 40 mA에서 Data Collection 하고, PDXL program을 사용하여 data reduction 하였다.
2.2.2. 성분 및 형상 분석
제조된 혼합 금속 산화물 촉매의 조성을 분석하기 위해서, Bruker, Quantax 200 Energy Dispersice X-ray Spectrometer를 이용하여 Energy Resolution : <127 eV, Peak shift (5~300 kcps): < 5 eV, Detector : Si Drift Detector (SDD), Detection : Be (z=4) ~ Am (z=95)의 조건으로 실시하였다. 또한, 주사식 현미경인 Tescan Mira 3 LMU FEG을 이용하여 가속전압 : 20 kV, Coater : Quorum Q150T ES / 10 mA, 120 s Pt coating의 조건으로 시료의 표면 구조 및 형상 분석을 실시하였다.
2.2.3. 기공특성
시료의 기공 특성 및 비표면적은 자동 흡착장치(micrometrics, ASAP 2010)를 통해 액체질소 온도(77 K)에서 질소기체의 흡착등온선을 통해 기공 특성을 분석하였다.
2.2.4. NH3-TPD & NO-TPD Test
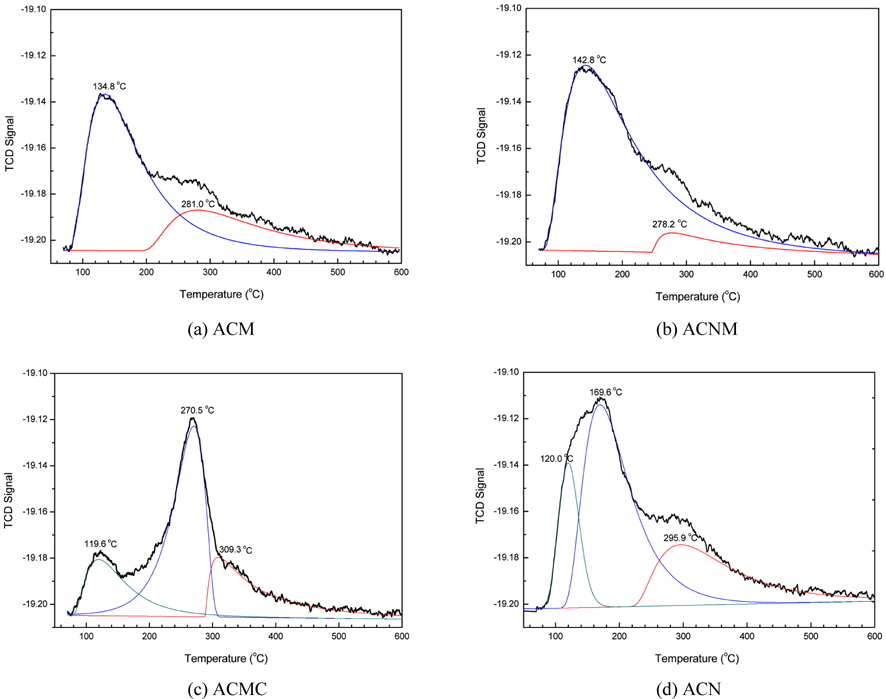
열전도검출기(thermal conductivity detector, TCD)가 장착된 Autochem II 2920 TPD (temperature programing desorption) 장치를 사용하여 4종의 촉매 시료에 대해 암모니아 및 일산화질소에 대한 온도에 따른 탈착 특성을 비교 측정하였다. 소성된 시료들을 일정한 속도로 800 ℃까지 He 25 mL/min으로 outgassing한 후, 70 ℃까지 냉각하고, 이후 암모니아 가스 또는 일산화탄소를 3시간 동안 흘려보내주어 흡착시킨 후 분석기 바탕선(base line)이 안정화 될 때까지 He를 흘리면서 purging하였다. 암모니아 또는 일산화탄소 탈착은 He 25 mL/min를 주입하면서 800 ℃까지 5 ℃/min으로 승온시키면서 탈착되는 기체를 TCD로 분석하였다.
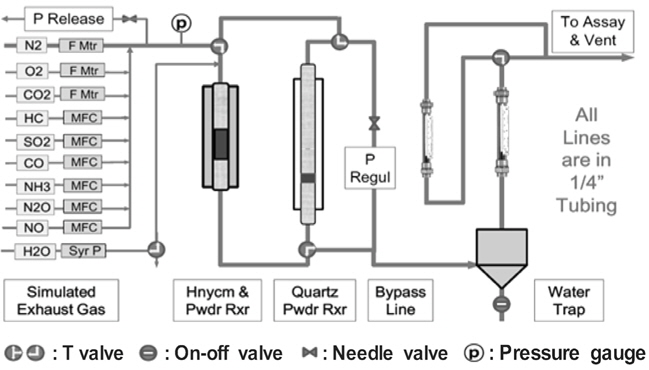
본 연구에서 제시하고자 하는 DeNOx용 혼합 금속 산화물 촉매에 대한 평가중 과잉 산소 조건에서 운전되는 엔진 배기가스 조성 조건에서 별도의 환원제 도입없이 자체 CO만을 환원제로 이용하여 배기가스 조성중에 포함된 NOx의 촉매환원반응을 촉진시켜 NOx 제거에 대한 효율이 매우 중요한 요소이다. 따라서 NOx 제거 효율에 대한 평가를 실시하기 위하여 실제 배기가스 조성과 유사하도록, 산소 10%, NO 300 ppm, CO 900 ppm, HC (=C3H8) 700 ppm의 농도가 유지하도록 MFC (mass flow controller)를 통하여 각각의 기체를 흘려보내주면서 혼합 금속 산화물 촉매가 충진된 반응기의 온도를 20 ℃/min의 속도로 승온시키면서 470 ℃까지 ramp test를 실시하였다. 촉매 반응기층을 통과하고 나온 기체농도는 MK9000 분석기를 통해 각 기체들의 농도 변화를 확인하였다. Ramp test가 진행된 개략적인 반응 계통도는 Figure 1과 같다.
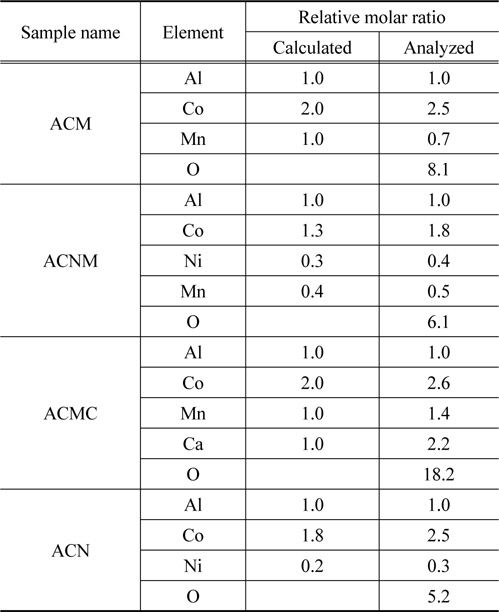
각각의 촉매 시료에 대한 결정구조를 확인하기 위해서 실시한 X-ray 회절 분석 결과를 Figure 2에 나타내었다. Figure 2에서 보여지는 바와 같이, 4종의 촉매 시료 모두에서 스피넬(spinel) 결정 구조를 보여주었다. 스피넬 구조를 가지면서 NO에 대한 높은 선택성으로 인하여 NO의 산화가 보다 원활히 이루어진다고 보고된 연구결과[9]가 있으나, 이 경우에는 Al/Co/Pd 혼합금속산화물로 PGMs을 사용한 사례이므로 본 연구와의 차별성이 있다고 할 수 있다. 또 다른 연구결과로서, 페로브스카이트 산화물 촉매가 NOx를 제거 또는 감소시키기 위한 PGMs의 사용을 대체시킬 수 있는 가능성을 보여주고 있는 최근 연구 결과와도 사뭇 상이한 것으로서[14,15], 스피넬 구조의 혼합 금속 산화물도 PGMs-free DeNOx 촉매로서의 제시 가능성을 갖게 되는 고무적인 결과로 판단되었다. 또한, Figure 2에서 보여지듯이 ACMC 시료의 경우에는 다른 시료들과 마찬가지로 스피넬 결정 구조를 가지는 동시에 탄산칼슘(CaCO3) 구조의 결정세기도 상당히 크게 나타내고 있음을 알 수 있었다. 시료의 원소 조성 분석을 결과를 나타낸 Table 1에서도 알 수 있듯이 각각의 시료들은 스피넬 구조의 결정을 이루기 위한 충분한 원소 조성비를 갖고 있음을 확인할 수 있었다.
[Table 1.] The EDS analysis results and calculated values of mixed oxide catalyst sample
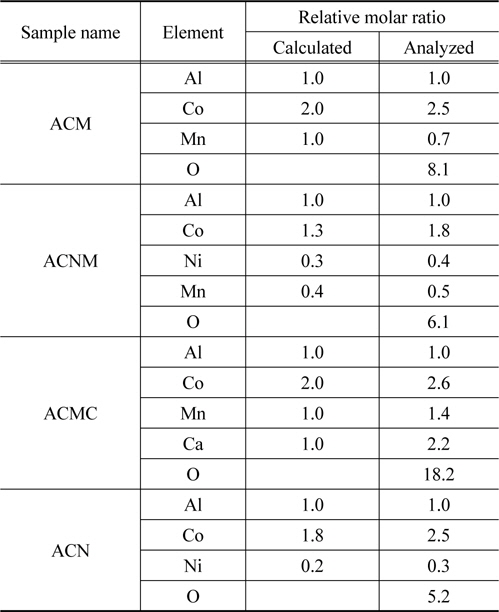
The EDS analysis results and calculated values of mixed oxide catalyst sample
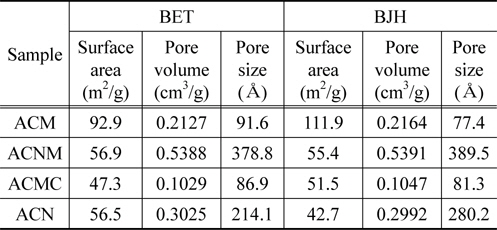
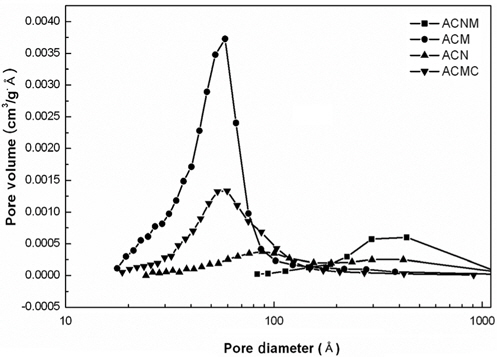
기공특성에 대한 결과들을 Table 2와 Figure 3에 정리하여 나타내었다. 4종의 촉매 시료중 ACM의 경우에만 BET (Brunauer-Emmett-Teller equation, BET equation)식 및 BJH (Barret-Joyner-Halenda equation, BJH equation)식에 의해 계산된 비표면적값이 다른 시료에 비해 약 2배의 값을 나타내고 있는 반면, 다른 3종의 촉매 시료의 경우에는 모두 비슷하게 BET 표면적 53.6 m2/g ± 12%, BJH 표면적 49.9 m2/g ± 15% 범위안의 값들이 나타내고 있다. 그러나 ACNM의 경우에는 다른 3종의 촉매시료들보다 많은 기공부피값을 나타내었다. 또한 평균 기공 크기도 가장 크게 나타내었다. 질소 원자와 산소 원자의 결합 길이는 1.188 Å, 결합각은 126° 가지므로, 4종 촉매 시료 모두가 생성된 기공내에서 반응기체들이 산화 및 환원 반응을 일으킬 수 있는 충분한 기공 부피 및 크기를 가지고 있다고 판단되었다. 더욱이, 비슷한 표면적을 갖는 시료들 중에서는 기공부피 및 기공 크기가 큰 촉매 시료가 짧은 시간 동안에 이루어져야 하는 촉매반응에 유리할 것으로 예상할 수 있으므로, 이후 NO 제거 효율 등의 반응성은 ACNM의 경우가 가장 높을 것으로 기대할 수 있었다. 반면에 ACMC 촉매 시료의 경우에는 Figure 2에서도 볼 수 있었듯이, 스피넬 결정 구조 외에 커다란 탄산칼슘 결정이 생성되어 있음을 확인할 수 있었다. 이러한 이유로 ACMC의 경우에는 상대적으로 적은 기공 부피와 작은 기공크기를 나타내는 것으로 판단되었다.
[Table 2.] The BET & BJH properties of mixed oxide catalyst sample
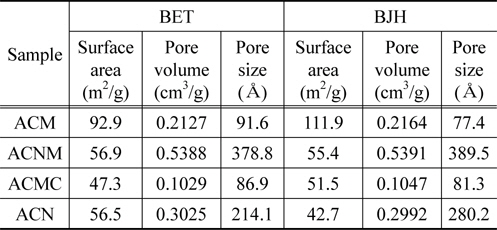
The BET & BJH properties of mixed oxide catalyst sample
생성된 결정 형상을 확인하기 위한 주사식 전자현미경(SEM) 관찰결과인 Figure 4(c)에서도 20 nm 수준의 크기를 갖는 다른 촉매 시료와는 다르게 ACMC는 200 nm 수준의 탄산칼슘 결정의 존재를 보여주고 있다. 또한, Figure 4(b)의 ACNM 시료의 경우에는 다른 시료들보다 특히 2차 기공이 잘 발달되어 있음을 확인할 수 있었다. 이러한 결과는 위에서 설명한 ACNM의 큰 기공부피와 크기를 갖는 결과와도 일맥상통하는 것이라고 판단되었다.
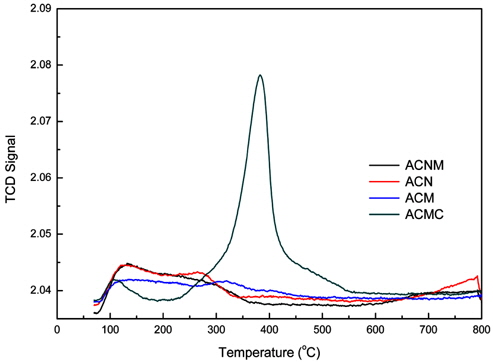
각각의 촉매 시료들의 산화-환원 반응성을 예측하기 위해서 NH3-TPD Test를 실시하여 얻은 결과를 Figure 5에 나타내었다. Figure 5에서 볼 수 있듯이, (d) ACN의 경우가 가장 많은 암모니아 탈착량을 보여주고 있으며, 다음으로는 (b) ACNM > (a) ACM > (c) ACMC의 순으로 나타났다. 또한, Figure 5(a)와 (b)에서 보여지듯이, ACM과 ACNM 촉매 시료의 경우에는 2개의 산점을 나타내는 피크(peak)를 가지고 있는 반면, Figure 5(c)와 (d)의 ACMC와 ACN 시료의 경우에는 3개의 산점을 가지는 것으로 나타났다. 일반적인 LNT용 촉매의 경우에는 NO의 산화 및 NO2의 환원 등이 거의 동시에 진행되는 성능을 발현시킬 수 있는 촉매가 유리하므로 다양한 고체산점을 가지는 (c)와 (d)의 경우가 선택될 수 있다. 그러나 본 연구에서의 ACMC 촉매의 경우에는 X-ray 회절 패턴 분석 및 원소 조성 분석결과 등에서도 보여주었듯이, 스피넬 구조의 혼합 금속 산화물외에 생성된 커다란 탄산칼슘 결정으로 기인하여 다른 시료들에 비하여 작은 기공부피 및 기공크기를 가지고 있었다. 따라서 이러한 결과는 NOx의 제거반응에도 영향을 미칠 것이라고 예상할 수 있었다. Figure 6에는 각각의 시료들의 NOx 제거 반응성을 예측하기 위하여 NO-TPD를 실시한 결과를 나타내고 있다. Figure 6에서 볼 수 있듯이, ACMC 시료는 다른 3종의 시료들과 비교하여 월등히 많은 NO 탈착량을 보여주고 있다. 이는 ACMC 촉매에 함유되어 있는 Ca의 영향으로 일산화질소의 흡착량이 증가된 것으로 판단되나, 탈착되는 온도가 380 ℃의 고온이 필요하게 된다. 이러한 결과는, 보다 저온영역에서 반응을 진행시킬 수 있는 촉매를 선정해야 하는 관점에서 판단한다면 바람직하지 못한 결과라고 할 수 있다. 또한, Kim 등의 연구 결과를 바탕으로[15], 높은 온도에서의 많은 양의 NO 탈착은 구조내의 산소를 동반하여 이루어질 가능성이 높으므로, 촉매의 구조적 안정성에도 문제를 일으킬 수 있다고 판단되었다. 반면에, ACMC를 제외한 나머지 3종의 시료는 탈착량이 ACMC에 비하여 상당히 적은 것으로 나타났으나 상대적으로 낮은 온도 영역에서 탈착하는 경향을 보이고 있었다.
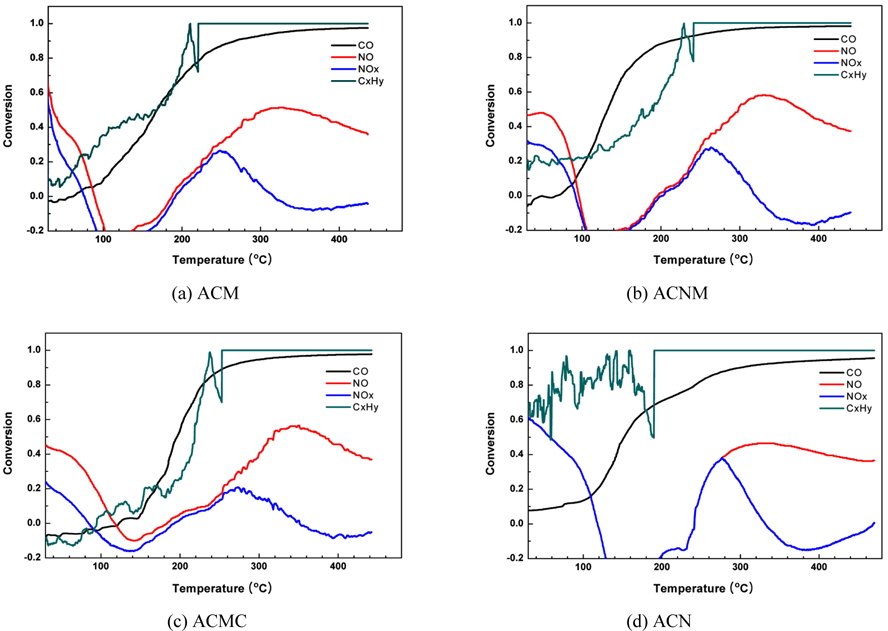
Figure 7은 본 연구에서 사용된 4종의 촉매 시료들의 LNT용 DeNOx 촉매로의 성능을 예측하기 위하여 과잉산소 조건인 린(lean)상태에서의 배가스 조성들로 이루어진 기체들의 전환율을 보여주고 있는 ramp test 결과이다. 앞에서도 언급하였듯이, 이러한 테스트를 실시한 목적은 DeNOx용 혼합 금속산화물 촉매에 대한 평가중 과잉 산소 조건에서 운전되는 엔진 배기가스 조성 조건에서 별도의 환원제 도입없이 자체 CO 만을 환원제로 이용하였을 때 배기가스 조성중에 포함된 NOx에 대한 제거 효율이 매우 중요한 요소이기 때문이다. 따라서 이를 위해서 실제 엔진 운전조건과 유사하도록 각각의 기체농도를 산소 10%, NO 300 ppm, CO 900 ppm, HC (=C3H8) 700 ppm로 조절하여 ramp test를 실시하였다. Figure 7(b)와 7(c)에서도 알 수 있듯이, ACNM 및 ACMC 촉매의 경우에는 NO의 전환율이 320 ℃ 부근에서 약 60%에 도달하고 있음을 알 수 있다. 그러나, 위에서도 언급되었듯이 ACMC 촉매의 경우에는 상대적으로 적은 기공부피와 기공크기를 갖고 있으며, TPD test에서도 높은 탈착 온도를 요구하고 있다. 따라서, 위에서 언급된 여러 분석결과 등을 종합하여 볼 때, 본 연구에서 사용된 4종의 촉매 시료중 ACNM의 경우가 가장 적당하다고 판단되었다. 또한, 본 연구가 LNT용 DeNOx 촉매 개발을 위한 기초연구임을 감안할 때 이러한 ACNM의 NO 전환율 60%라는 촉매적 특성 결과는 상용(commercial) 촉매에 대해 이와 같은 수준의 NO 전환율을 보여주고 있는 다른 논문과 비교하여[15] 상당히 고무적이라고 할 수 있다.
대부분 LNT용 촉매 개발에 대한 연구들은 Pt 등의 귀금속을 이용하고 있다. 이는 저온 영역의 NOx 산화를 위해서는 고가의 귀금속인 Pt를 사용해야 하는 것은 필수적이나 경제적인 이유로 단점으로 부각되고 있다. 따라서 본 연구에서는 이러한 단점을 극복하기 위한 연구의 일환으로 Pt 등의 PGMs 사용이 배제된 LNT용 DeNOx 촉매를 개발하고자 하였다. 이를 위하여 예비실험을 통해 선정된 4종의 촉매에 대한 기본 물성 및 NOx 전환율 등을 고찰하였다.
즉, 예비실험을 통해 PGM (platinum group metal)을 사용하지 않는 4개의 촉매, ACM, ACNM, ACMC 및 ACN가 선정되었고 XRD, EDS, SEM, BET 및 TPD test 등을 실시하여 이들의 물리화학적 특성 분석을 실시하였다. 이러한 분석을 실시한 결과, 4종의 촉매들은 스피넬(spinel)구조를 가지는 결정으로 이루어졌으며 NOx 기체들의 산화-환원 반응이 이루어지기에는 충분한 기공(pore)부피와 기공크기를 갖고 있음을 알 수 있었다. 또한, 4종의 촉매들은 TPD test를 통해서는 산화-환원이 일어날 수 있는 산점을 4종의 촉매가 모두 가지고 있음을 확인하였다. 또한, Ramp test를 통해서, 상용(commercial) 촉매와 비슷한 NO 산화 능력을 가지고 있는 것도 확인할 수 있었다. 특히, 이상의 결과들을 종합하여 볼 때, ACNM의 경우가 가장 적절한 촉매로 사용될 수 있는 가능성을 보여주었다.
따라서, 본 연구에서는 이러한 결과들을 바탕으로 하여 선정된 촉매들을 기본조성으로 하여 조성성분의 변화 및 활성 성분의 첨가 등의 변화에 따른 전환율 변화추이 등에 대한 후속 연구가 이루어진다면, 향후에는 보다 개선된 LNT용 DeNOx 촉매을 얻을 수 있을 것이라 기대할 수 있었다.