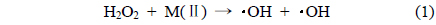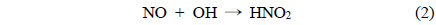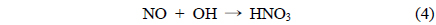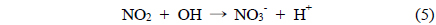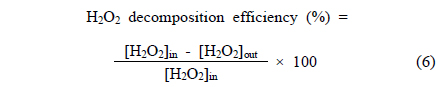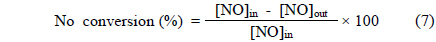The NO oxidation process has been applied to improve a removal efficiency of NO included in exhaust gas. In this study, to produce a dry oxidant for the NO oxidation process, the catalytic H2O2 decomposition method was proposed. A variety of the heterogeneous solid-acidic Mn-based catalysts were prepared for the catalytic H2O2 decomposition and the effect of their physico-chemical properties on the catalytic H2O2 decomposition were investigated. The results of this study showed that the acidic sites of the Mn-based catalysts has an influence on the catalytic H2O2 decomposition. The Mn-based catalyst having the abundant acidic sites within the wide temperature range in NH3-TPD shows the best performance for the catalytic H2O2 decomposition. Therefore, the NO oxidation efficiency, using the dry oxidant produced by the H2O2 decomposition over the Mn-based catalyst having the abundant acidic properties under the wide temperature range, was higher than the others. As a remarkable result, the best performances in the catalytic H2O2 decomposition and NO oxidation was shown when the Mn-based Fe2O3 support catalyst containing K component was used for the catalytic H2O2 decomposition.
NOx는 대표적인 오염물질로서 석탄, 석유 등과 같은 화석연료의 연소과정을 통해 생성 후 대기 중으로 배출된다[1]. 기존 많은 연구자들이 NOx를 효율적으로 제거하기 위한 다양한 연구가 수행 되었으며, 비교적 널리 적용되고 있는 기술로서 선택적 촉매환원법(selective catalytic reduction, SCR)이 있다. 그러나 선택적 촉매환원공정은 촉매가 적용된 가운데, 공정효율을 증대시키기 위하여 높은 온도가 필요하며, 이로 인해 높은 설치 및 운전비용이 소요되어 경제성이 낮다[2]. 선택적 촉매환원법이 적용된 공정에서는 높은 온도가 필요한 이유로서 비교적 전환이 어려운 NO가 존재하기 때문이며, 이를 비교적 용이하게 처리하기 위하여 NO를 NO2 등으로 산화시켜주는 공정이 추가로 요구된다. 본 연구에서는 NO를 NO2로 전환하기 위한 산화공정에 이용 가능한 건식산화제를 제조할 수 있는 H2O2 촉매분해에 대한 연구가 수행되었다. 최근, 다양한 연구결과에서 전이금속인 Fe 및 Zr 등을 주요성분으로 포함하는 불균일계 촉매 상 H2O2 분해반응을 통하여 건식산화제를 제조할 수 있다는 연구결과가 다수 보고된 바 있다[3-5]. 또한, H2O2 촉매분해반응은 비교적 낮은 온도에서 진행됨으로써 운전온도가 낮아지며, 제조된 건식산화제는 산화공정에 적용될 경우, 낮은 온도에서 높은 산화효율을 얻을 수 있는 것으로 알려져 있다[5]. 이러한 간단한 설비로 저온에서 고효율로 운전 가능한 공정의 구현을 통해 기존 선택적 촉매환원법이 적용된 NO 처리공정 상 단점을 보완할 수 있을 것으로 사료된다[6-7]. 본 연구에서는 처리가 어려운 NO 가스를 전환시키기 위하여 NO 산화공정의 도입과 동시에 이에 활용 가능한 건식산화제를 생성시키기 위하여 H2O2 촉매분해가 적용되었다. 따라서 H2O2 촉매분해공정 상 다양한 물성을 지니는 촉매들을 제조 후 적용함으로써 이들이 지니는 물리화학적 특성이 H2O2 촉매분해에 미치는 영향이 조사되었으며, 제조된 건식산화제를 이용하여 연이은 NO 산화공정에 주입함에 따라 얻어진 NO 전환특성이 조사 되었다. 촉매를 이용한 H2O2 분해를 통한 건식산화제 생산 반응식은 식 (1)에 나타내었으며, 이를 통한 NO 산화 반응식을 (2)~(5)에 나타내었다[12-14].
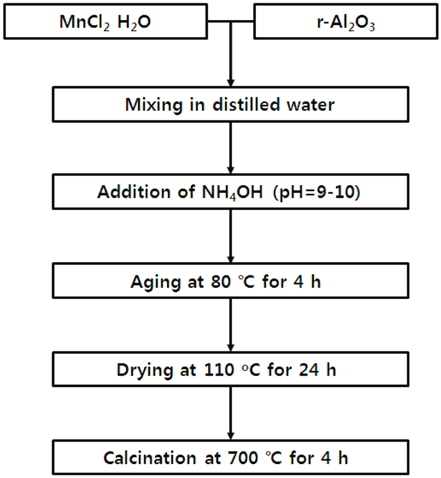
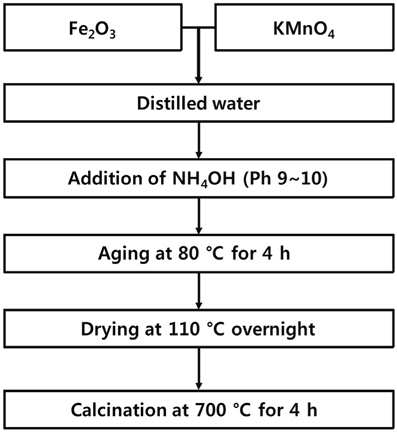
Figure 1은 γ-Al2O3를 담체로 사용하며, Mn계 활성물질이 담지된 촉매가 침전법에 의해 제조되는 과정을 나타낸 것이다. 활성물질의 전구체로서 Mn(NO3)2 (시약급, Aldrich Co., 98% 이상)가 사용되었다. 비이커에 일정량의 Mn(NO3)2를 증류수에 용해시킨 후 담체인 γ-Al2O3를 혼합하였다. 이후 앞서 제조된 슬러리 상태의 혼합액의 pH 값이 9에서 10 사이의 범위에 도달할 때까지 침전제인 NH4OH 용액을 적하하여 침전과정이 진행되었다. 슬러리 상의 침천혼합물은 교반상태에서 약 80 ℃에서 약 4 h 동안 중탕에 의해 숙성되었으며, 이후 110 ℃에서 24 h 동안 건조, 약 700 ℃에서 4 h 동안 소성되었다. 얻어진 고체생성물인 Mn계 γ-Al2O3 촉매를 분쇄하여 체질과정을 통해 약 100~150 µm 범위의 입도를 사용하여 촉매성능평가가 수행되었다. Figure 2는 Fe2O3를 지지체로 사용하여 K 성분이 첨가된 Mn 기반 촉매에 대한 제조과정을 나타낸 것이다. 지지체로 사용한 Fe2O3는 시중에 판매 중인 Fe2O3 (Powder, <5 µm, 시약급, Aldrich Co., 98% 이상)이 사용하였으며, 활성물질의 전구체로는 KMnO4 (시약급, Aldrich Co., 98% 이상)가 사용되었다. 우선, Fe2O3 지지체는 증류수에 혼합과정을 통해 슬러리 상태로 만들어진 후 활성물질의 전구체인 KMnO4 수용액과 혼합되었다. 이후 혼합물은 110 ℃에서 약 12 h 동안 건조 후 700 ℃에서 약 4 h 동안 소성시킴으로써 K 성분이 첨가된 Mn 기반의 Fe2O3 지지체 촉매가 제조되었다.
SO42-/ZrO2 촉매 제조는 Zr(OC3H7)4 (시약급, Aldrich Co., 98% 이상) 를 암모니아수를 이용하여 침전시킨 후 110 ℃에서 12시간 건조하였으며, 건조된 침전물에 1 N H2SO4와 혼합하여 12시간 동안 숙성 후 120 ℃에서 12시간 동안 건조 후 500 ℃에서 소성하여 제조하였다.
제조된 다양한 촉매들이 가진 물리화학적 특성들이 H2O2 분해반응에 미치는 영향을 조사하기 위해 다음과 같은 다양한 기법에 의해 조사되었다. 제조된 촉매들의 결정구조 및 성상을 조사하기 위하여 XRD 분석이 수행되었으며, 촉매를 구성하는 원소들에 대하여 정량 및 정성적 분석이 EDX (energy dispersive X-ray spectrometer for FE-SEM, 미국 FISONS Co., 모델명: LEO SUPRA 55, GENESIS 2000 (Carl Zeiss, EDAX), 분해능: 138 eV/5B-92U)를 이용함으로써 수행되었다. 시료표면의 정성/정량분석 및 구성하는 원소들의 화학적 결합상태를 조사하기 위하여 XPS (X-ray photoelectron spectroscopy, thermo electron사, K-Alpha 모델)가 이용되었다. 추가로 제조된 불균일계 촉매들의 산점 특성을 조사하기 위하여 NH3 기체를 이용한 승온탈착(temperature programmed desorption, TPD) 실험이 다음과 같이 수행되었다. 약 10 vol.%의 농도를 지니는 NH3 기체가 고정층 방식으로 충진된 촉매층을 6시간 동안 통과됨으로써 흡착과정이 진행된 이후 N2 기체를 흘려주면서 상온에서 800 ℃까지 5 ℃/min의 속도로 승온하여 탈착되는 NH3을 열전도성검출기(thermal conductivity detector, TCD)로 정량분석함으로써 산점특성이 분석되었다. 제조된 촉매들의 H2O2 촉매분해 특성을 조사하기 위하여 55 g의 H2O2과 0.1 g의 제조된 촉매를 저울 위에서 반응시켰으며, 이때 시간에 따른 H2O2의 무게변화를 2초 단위로 기록하여 분해량을 비교 평가하였다.
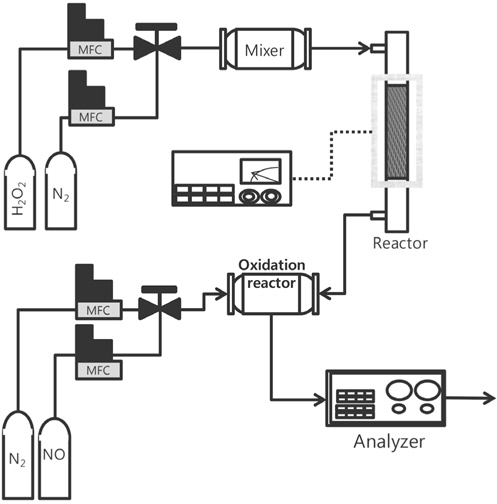
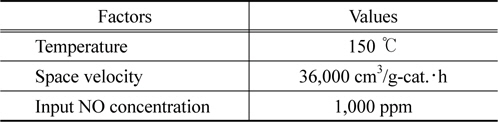
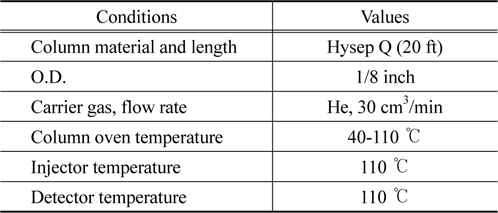
촉매성능을 평가하는 실험 장치는 건식산화제가 생성되는 H2O2 촉매분해공정과 이로부터 제조된 건식산화제가 주입됨으로써 NO를 산화시킬 수 있는 NO 산화공정으로 연계하여 구성되었으며, Figure 3에 나타난 바와 같다. 촉매성능을 평가할 수 있는 H2O2 촉매분해반응은 외경이 1/2 inch인 SUS 재질의 관형 반응기 중심부분에 일정량의 촉매가 고정층으로 충진된 후 승온과 더불어 적당량의 유량으로 H2O2가 통과함으로써 진행되었다. 전기로에 설치되어 있는 열전도대(K-type)를 촉매 충진층과 동일한 지점에 위치시킨 후 자동온도제어기를 이용하여 반응기 내부로의 열적 전달을 통해 반응온도가 제어되었다. 반응물로써 분해대상인 H2O2 (국내산, Duksan Co., 28~30%)는 원하는 양으로 정량펌프를 이용하여 주입하는 과정에서 기화된 상태로 반응기 내부로 주입될 수 있도록 가열되었다. 이후 N2를 운반기체로 이용함으로써 이동시켜, 챔버형 혼합기 내에서 혼합 후 관형 촉매반응기 내부로 주입되었다. 실험에 사용된 가스는 보정된 MFC (mass flow controller, Linetech Co.)를 이용하여 실험 변수에 맞게 조절되었다. 반응기 후단부분에는 열선이 끝나는 지점에 수분제거를 위해서 응축기 및 흡착제 충진층이 사용되었다. H2O2 분해효율(H2O2 decomposition effificnecy, %)은 식 (6)에 대입함으로써 계산되었다. H2O2 촉매분해공정 후단에 연이어 설치된 NO 산화공정을 위한 시스템에는 H2O2 분해에 의해 제조된 건식산화제 및 주반응 대상물인 NO가 원하는 농도로 동시에 공급될 수 있도록 구축되었다. NO 산화공정에서는 주입되는 건식산화제와 NO 가스 사이의 접촉효율이 증대될 수 있도록 2.5 mm 직경의 비드형 알루미나가 고정층으로 충진된 관형반응기(재질: SUS, 외경: 1/2 inch, 길이: 50 cm)가 사용되었다. 이러한 관형반응기 내부로 H2O2 촉매분해에 의해 제조된 건식산화제와 NO 가스를 동시에 반응기 내부로 주입시킴으로써 반응성실험이 수행되었다. 이 때 가스조성은 1,000 ppm의 농도에 해당하는 NO가 이용되었으며 희석 가스로는 N2가 이용되었다. 기본적인 공급가스에 대한 농도값은 Table 1과 같다. 가스유량은 보정된 MFC (mass flow controller, Linetech Co.)를 통해 조절되었으며, 반응조건은 Table 2와 같다. 반응물 및 생성물은 PDD (pulsed discharge detector) 검출기가 장착된 G.C(gas chromatograph, DS science, Korea)에 온라인으로 연결시켜 5 min마다 주입시킴으로써 모니터링하였다. G.C로 NO 및 NO2를 분석하기 위하여 Hayesep Q가 충진된 SUS 재질의 분리관이 사용되었으며, 자세한 G.C에 대한 운전조건은 Table 3에 나타내었다. 반응성 결과를 얻기 위한 NO 전환율(NO conversion, %)은 다음과 같이 반응 전/후의 NO 및 NO2 등 기체들의 농도를 식 (7)에 대입함으로써 계산되었다.
[Table 1.] Basic composition in the gas bomb

Basic composition in the gas bomb
[Table 2.] Basic reaction conditions for the catalytic H2O2 decompositon
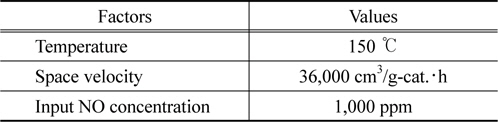
Basic reaction conditions for the catalytic H2O2 decompositon
[Table 3.] Basic operation conditions of G.C
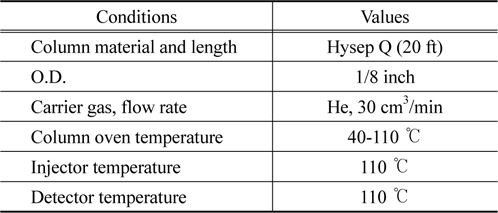
Basic operation conditions of G.C
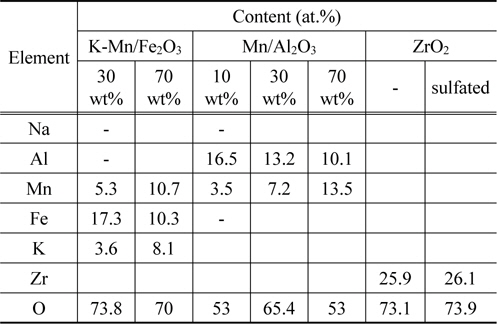
Table 4는 H2O2 분해를 위하여 제조된 K-Mn/Fe2O3, K-Mn/Al2O3, Mn/Al2O3, ZrO2 촉매들이 지니는 구성성분들과 이들의 함량을 조사하기 위한 EDX 분석결과이다. 지지체인 Fe2O3에 약 30 및 70 wt% 함량에 해당하는 K와 Mn 성분이 담지된 K-Mn/Fe2O3 촉매 상에는 Mn 성분이 각각 5.3과 10.7 at.%, Fe 성분이 17.3과 10.3 at.%, K 성분이 약 3.6 및 8.1 at.%로 존재함을 알 수 있다. Al2O3 지지체에 각각 10, 30, 70 wt%로 담지된 Mn/Al2O3 촉매들에는 Mn 성분의 담지량이 증가할수록 각각의 함량이 3.5, 7.2 및 13.5 at.%순으로 증가하였다. 황산에 의한 표면처리 여부에 따른 ZrO2와 SO42-/ZrO2 촉매의 경우에는 표면처리 여부에 관계없이 약 25~26 at%에 해당하는 Zr 성분이 구성되어 있음을 알 수 있으며, O 성분을 제외한 S 성분은 표면처리됨에도 불구하고 그 함량이 매우 적어 검출되지 않은 것으로 사료된다.
[Table 4.] EDX analysis of the various catalysts for the catalytic H2O2 decomposition
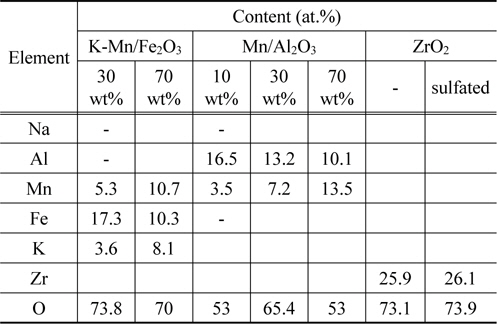
EDX analysis of the various catalysts for the catalytic H2O2 decomposition
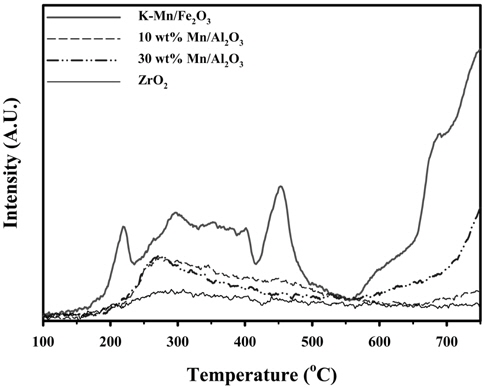
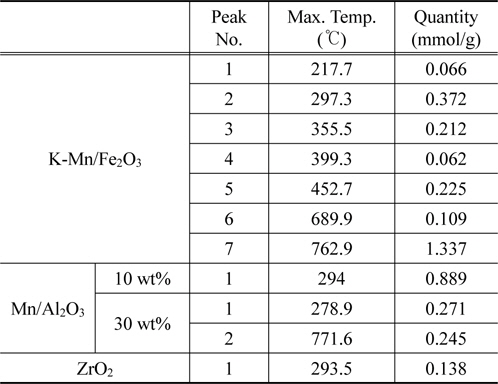
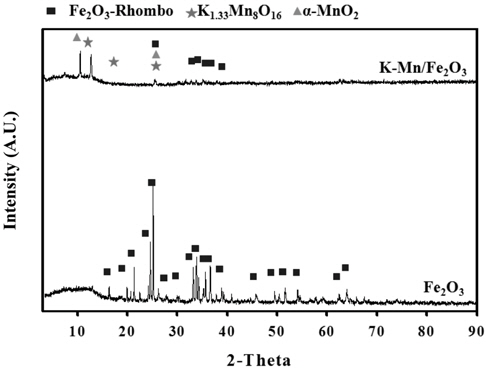
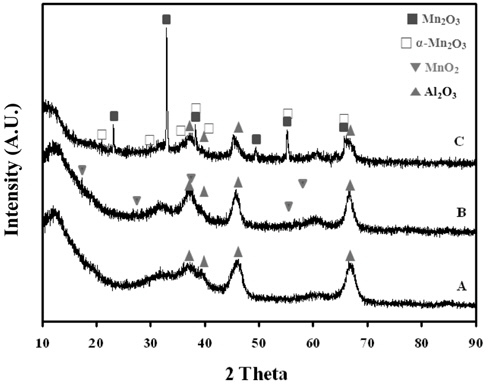
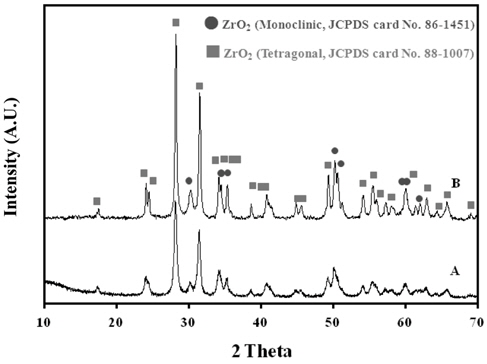
전체 NH3 흡착량에 대응하는 산점의 양은 온도에 따라 변화하는 NH3 탈착량에 해당하는 선형그래프에 대한 적분값으로 판단할 수 있으며, 이에 대한 산점의 총량은 Fe2O3 < ZrO2 < 10 wt% Mn/Al2O3 < 30 wt% Mn/Al2O3 < K-Mn/Fe2O3의 세기순으로 나타낼 수 있다. 산점의 총량과 더불어 산점의 세기와 분포 등을 Figure 4로 나타낼 수 있다. Figure 4와 Table 5에서 보는 바와 같이 각 촉매에 해당하는 산점의 세기에 해당하는 NH3 탈착온도를 살펴보면, 우선 가장 낮은 산량을 가지는 ZrO2 촉매는 약 293 ℃으로 비교적 낮은 세기에 해당하는 산점을 가지며 이 때 산점의 양 또한 비교적 0.138 mmol/g으로 적음을 알 수 있다. ZrO2 촉매에 비해 다소 많은 양의 산점을 지니는 10 wt% Mn/Al2O3 촉매 또한 산점의 총량은 다소 0.889 mmol/g으로 많으나, 산점의 세기는 약 294 ℃에 해당하는 탈착온도에서 나타내는 것으로 보아 약산점에 해당하는 것으로 판단된다. 이에 비해 다소 많은 산점을 지니는 30 wt% Mn/Al2O3 촉매는 약 270 ℃과 370 ℃에 이르는 비교적 센 산점을 지니며, 산점의 양 또한 각각 0.392 및 1.424 mmol/g로 각 산점에 해당하는 양이 많은 것으로 나타났다. 비교적 많은 산점을 지니는 K-Mn/Fe2O3 촉매는 약 217, 297, 355, 399, 452, 689, 762 ℃에 해당하는 다양한 세기의 산점을 지니고 있어 그 분포가 다양하게 존재하며, 산점의 양 또한 0.066에서 1.337 mmol/g으로 비교적 다양한 세기의 산점을 고르게 지니고 있음을 알 수 있다. K-Mn/Fe2O3 촉매는 H2O2 촉매분해반응 시 반응속도를 결정하는 전자이동이 빠르게 진행되며, 이는 촉매 상 H2O2가 지니는 비공유전자를 받을 수 있는 Lewis 산점인 강/약산점의 분포가 K 성분으로 인해 골고루 풍부하게 존재하기 때문이다. K는 환원후 ionic형태로 되어 담체 또는 Mn상에 위치하게 되어 Mn의 전자적 성질을 변화시킨다. K가 Mn의 활성점을 점유하게 되어 이 활성점이 감소하고 NH3-TPD을 통해 보면 촉매의 산점의 세기가 약해져서 약산점의 분포가 증가하게 된다[15,16]. 또한 포함된 MnO4 구조 상 높은 산화상태로 인해 전자 및 산소이동성이 풍부하기 때문이라 사료되므로 H2O2분해 반응에 유리할 것이라 판단된다. 촉매를 기반으로 하는 Al2O3 담체 기반의 MnO2 촉매를 사용하는 경우에는 MnO2 함량이 증가될수록 Mn2O3에 해당하는 상대적으로 높은 산화상태로 전환되는 특성이 있어 반응성이 향상되나, 촉매성능을 향상시키는 데는 한계가 있을 것으로 판단되며, 상기 언급되는 Lewis 산점의 양 및 세기를 풍부하게 하는 데 촉매 설계 상 한계가 있기 때문이라 사료된다. 기타 Mn 성분이 포함된 여러 촉매들의 성능시험 결과, 반응성이 낮은 것으로 사료되며, 이는 H2O2 촉매분해 상 기본 활성물질인 Mn 성분 함량이 낮아 높은 활성이 기대하기 어려우며, 특히 SO42-/ZrO2 촉매의 경우, 강산점이 기대되기는 하나 기본 활성물질인 Mn 성분의 부재와 동시에 Brӧnsted 산점의 종류에 해당되므로 낮은 성능으로 H2O2 촉매분해에는 적당하지 않는 것으로 사료된다. Figure 5는 Fe2O3, Al2O3, K-Mn/Fe2O3, Mn/Al2O3촉매에 대한 XRD 분석결과를 나타낸 것이다. Fe2O3 촉매의 경우에는 Rhombohedrol 구조의 결정성을 지니는 것으로 얻어졌으며, 이를 지지체로 사용하여 제조된 K-Mn/Fe2O3 촉매상에서는 Rhombohedrol 구조의 Fe2O3가 존재하며, 동시에 K1.33Mn8O16 화합물 형태와 α-MnO2 화합물 형태가 공존하는 것으로 나타났다. Al2O3는 γ-Al2O3 화합물로 존재하며, 이를 지지체로 하는 Mn/Al2O3 상에서는 γ-Al2O3과 동시에 K1.33Mn8O16형태의 화합물이 존재하며, α-MnO2 화합물은 존재하지 않는 것으로 나타났다. Figure 6은 지지체인 Al2O3와 Mn 성분을 함량에 따라 담지시켜 제조한 Mn/Al2O3 촉매에 대한 XRD 분석결과이다. Al2O3는 γ-Al2O3 형태의 화합물로 존재하는 것을 알 수 있으며, 이를 지지체로 이용하여 10 wt% Mn 성분이 담지된 10 wt% Mn/Al2O3 촉매의 경우에는 MnO2 화합물 형태를 XRD 분석을 통해 추가로 존재함을 알 수 없었다. 또한 30 wt% Mn/Al2O3 촉매의 경우에는 지지체인 γ-Al2O3 형태의 화합물과, Mn2O3 형태의 화합물이 존재하며, MnO2 및 α-Mn2O3 형태의 화합물은 XRD 분석에서는 확인할 수 없었다. 이를 통해서 Al2O3 지지체에 Mn 성분을 담지시켜 화합물로 제조할 경우, Mn 성분의 함량이 증가할수록 다른 산화상태의 화합물로 전환됨을 알 수 있으며, 이는 H2O2 분해반응의 특성 상 산화-환원반응이 주된 반응경로가 될 것으로 사료되며, 활성물질인 Mn 성분의 산화상태가 큰 영향인자로 작용할 것으로 사료된다. Figure 7은 ZrO2 촉매와 황산으로 표면을 처리하여 제조된 SO42-/ZrO2 촉매에 대한 XRD 분석 결과이다. 그 결과, ZrO2 촉매는 monoclinic 및 tetragonal 구조가 공존하는 형태의 ZrO2 화합물임을 알 수 있으며, 황산으로 표면처리된 SO42-/ZrO2 촉매의 경우 sulfate 관능기 및 관련 ZrO2 화합물 자체의 결정변화를 가져오기 어려우므로 결정구조 및 관련 특성의 변화를 확인할 수 없다.
[Table 5.] Acidic properties of the various catalysts by NH3-TPD
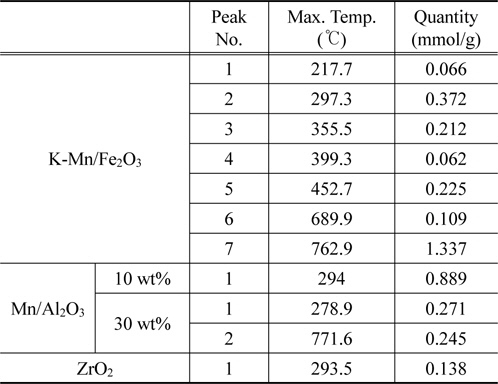
Acidic properties of the various catalysts by NH3-TPD
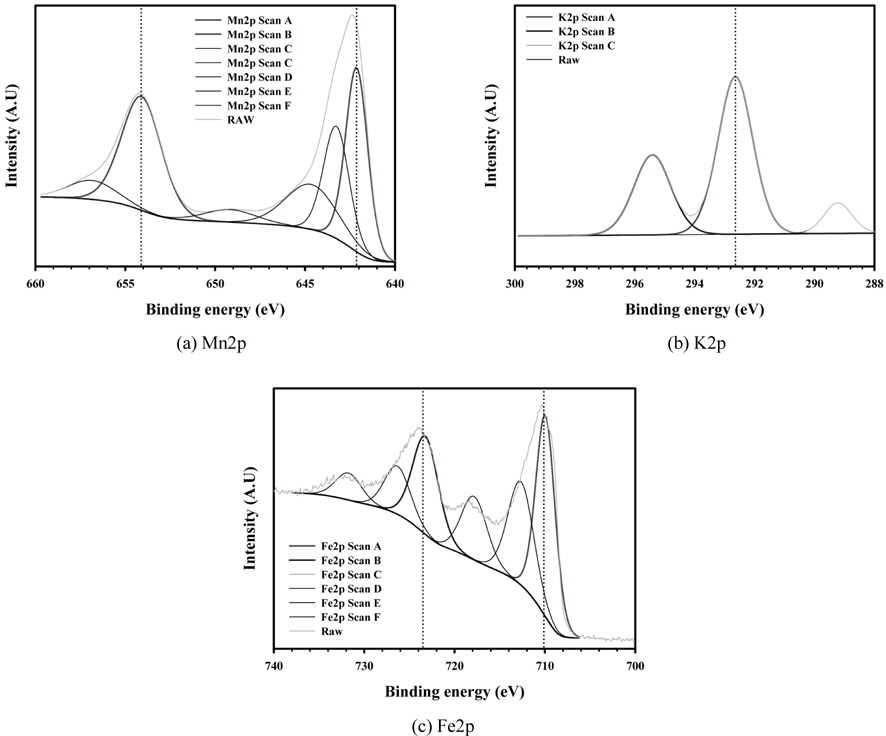
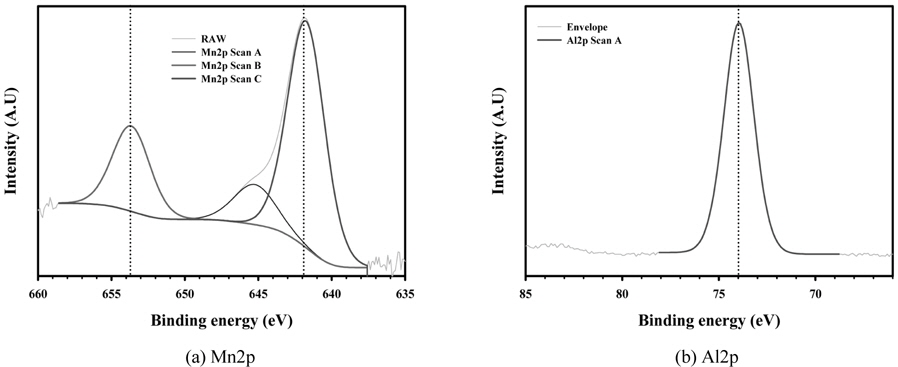
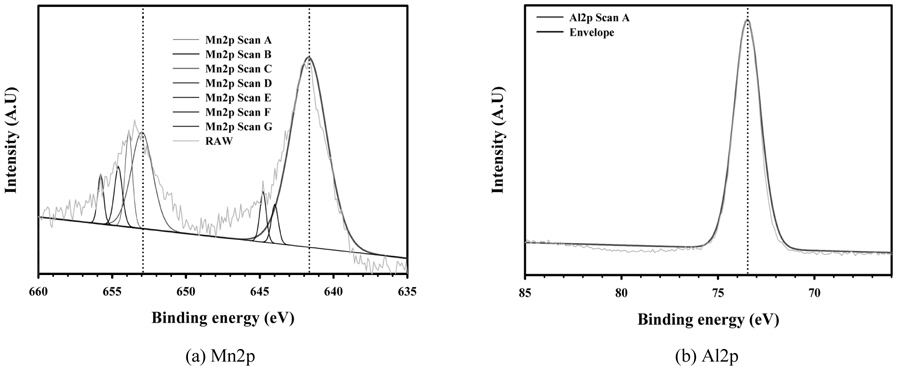
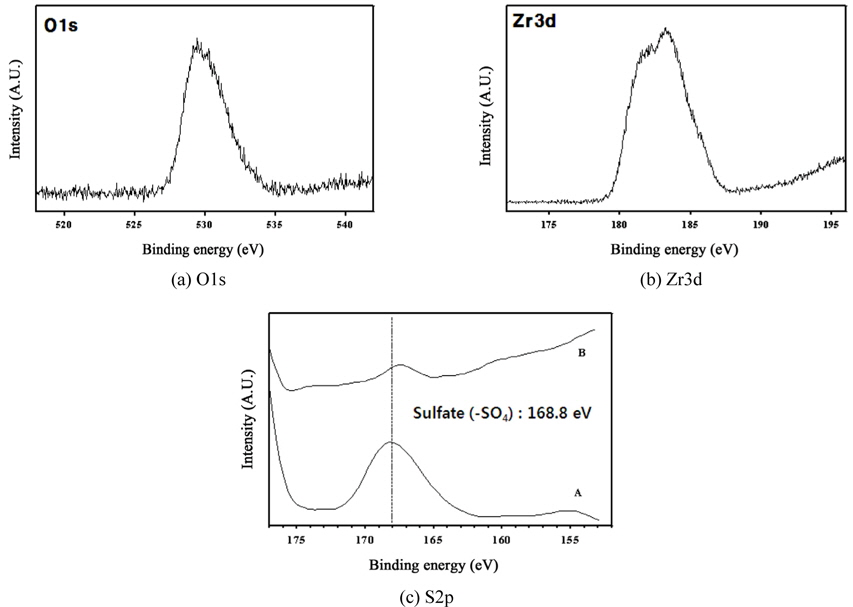
Figure 8은 지지체인 Fe2O3에 K와 Mn 성분이 포함된 K-Mn/Fe2O3 촉매에 대하여 구성된 원소들의 결합상태를 확인하기 위한 원소 성분들에 대한 각각의 결합에너지를 측정한 XPS 분석결과이다. Figure 8(a)에서 나타낸 바와 같이 Mn 성분이 가지는 결합에너지의 피크는 다양하게 얻어졌으나, 약 642.2와 654.1 eV에 해당하는 결합에너지 위치에서 나타났으며, 이러한 결합에너지 위치에 해당하는 Mn 성분이 포함된 화합물의 형태는 KMnO4인 것으로 나타났다. 또한 이는 K 성분에 대한 결합에너지를 측정한 결과인 Figure 8(b)에서 292.6 eV에 해당하는 결합에너지 피크의 위치가 얻어짐에 따라 K 성분 또한 KMnO4 형태의 화합물에 포함된 결합구조를 나타낸 것임을 확인할 수 있다. Figure 8(c)에서 얻어진 Fe 성분에 대한 결합에너지는 약 710.05 및 723.5 eV에 해당하는 두 개의 피크가 관찰되었으며, 이러한 결합에너지는 Fe2O3 화합물에 포함된 Fe 성분의 결합에너지로 판명되었다. 따라서 K-Mn/Fe2O3 촉매의 성상은 지지체인 Fe2O3에 KMnO4 성분이 대부분 포함된 성상으로 이루어져 있는 것으로 사료된다. Figure 9는 지지체인 γ-Al2O3에 10 wt%에 해당하는 Mn 성분을 담지하여 제조된 10 wt% Mn/Al2O3 촉매에 대하여 구성 원소들이 지니는 결합에너지를 측정한 XPS 분석 결과이다. Figure 9(a)에서 보는 바와 같이 Mn 성분이 지니는 결합에너지의 위치가 약 641.8과 653.8 eV로서 이러한 결합에너지를 지니는 주된 Mn 화합물은 MnO2임을 알 수 있다. 그리고 Figure 9(b)를 통해 또 다른 성분인 Al2O3내에 포함된 Al 성분에 대한 결합에너지는 73.9 eV에서 단일피크로 나타남을 알 수 있다. 이러한 피크 위치는 Al2O3 화합물로서 제조 전 투입된 화합물 형태가 지지체로서 그대로 유지함을 알 수 있다. Figure 10은 지지체인 Al2O3에 Mn 성분이 담지된 70 wt% Mn/Al2O3 촉매에 대하여 구성 원소들의 결합에너지를 측정한 XPS 분석 결과이다. Figure 10(a)에서 앞서 언급된 10 wt% Mn 성분이 담지된 촉매에 비해 비교적 많은 숫자의 결합에너지 피크를 확인할 수 있으며, Mn 성분의 함량이 증가할수록 MnO2 성상 이외에 다양한 성상의 Mn 화합물이 형성되었음을 알 수 있다. 그러나 가장 주된 결합에너지의 위치는 각각 641.7과 652.8 eV에 해당하는 피크가 관찰되었으며, 이러한 결합에너지 경향은 MnO2 화합물의 경우에 얻을 수 있는 결과라 할 수 있다. Figure 10(b)에서 나타난 바와 같이 Al 성분에 대한 결합에너지 위치는 73.6 eV로서 전형적인 Al2O3 화합물로 존재함을 의미한다. 이러한 결과를 토대로 Mn 성분이 MnO2 성상으로 존재함과 동시에 이들이 지지체인 Al2O3에 담지된 촉매가 제조된 것으로 사료된다. Figure 11은 황산에 의한 표면처리 여부에 따라 제조된 ZrO2 및 SO42-/ZrO2 촉매에 대하여 구성하고 있는 원소들에 대한 결합에너지를 측정한 XPS 분석결과이다. Figure 11(a)와 (b)에서 보는 바와 같이 표면처리 여부에 관계없이 Zr 성분이 지니는 결합에너지에 해당하는 피크의 위치는 186.5 eV로서 ZrO2 화합물로 구성되어 있음을 알 수 있다. Figure 11(c)에서 알 수 있듯이 황산으로 표면처리된 SO42-/ZrO2 촉매에 존재하는 S 성분에 대한 결합에너지의 피크 위치가 약 168.8 eV이다. 이는 SO42- 관능기를 형성할 경우에 해당하는 결합에너지로서 황산에 의한 표면처리과정으로 인해 ZrO2 표면에 SO42- 관능기가 형성되어 있음을 의미한다. 이러한 SO42- 관능기로 처리된 촉매의 경우 산점의 세기 및 양을 더욱 강화시킴으로써 관련 반응기작이 포함된 반응에서 촉매 효과를 증대시켜주는 역할을 하는 것으로 알려져 있다.
3.2. 촉매 종류에 따른 H2O2 분해 및 NO 전환
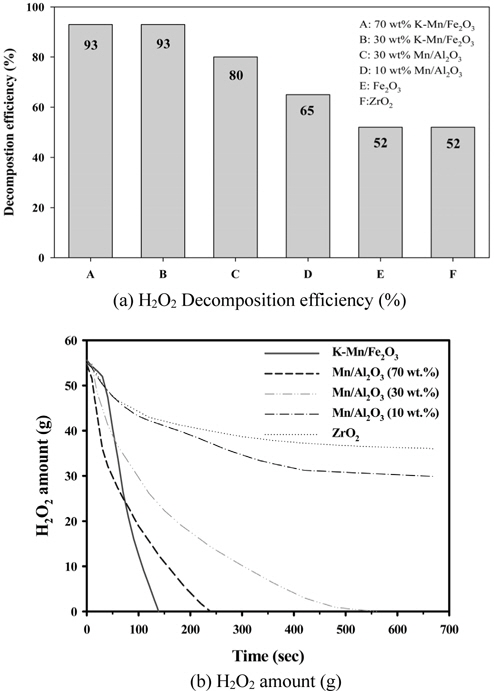
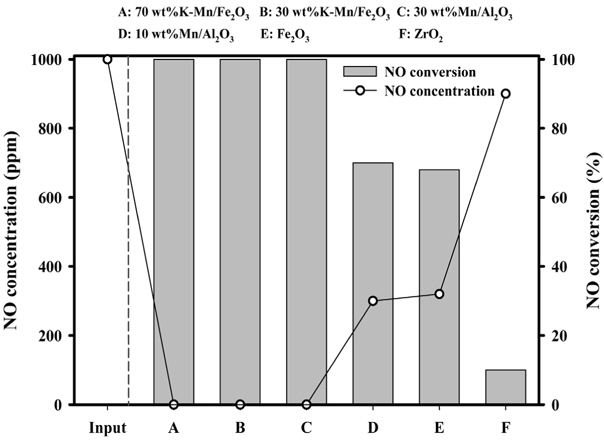
촉매에 의한 H2O2 분해율 확인을 위해 실험을 진행한 결과, H2O2 분해효율이 높았던 촉매는 K-Mn/Fe2O3와 Mn/Al2O3 촉매였으며, 그 다음으로 30 wt% Mn/Al2O3 > 10 wt% Mn/Al2O3 > Fe2O3 > SO42-/ZrO2의 순으로 나타났다. 활성물질의 종류에 따라 H2O2 분해율이 달라지며 이때 발생하는 건식산화제의 양도 달라지게 된다[9-11]. Figure 12(a)는 건식산화제 제조를 위하여 수행된 촉매 종류에 따른 H2O2 분해효율로서 전환율을 나타낸 것이다. 이러한 결과는 제조된 다양한 촉매들이 지니는 물리화학적 특성 중에서 특히 H2O2 분해반응이 지니는 특성과 가장 연관성이 높은 흡착점에 해당하는 촉매의 산점분포에 의해 큰 영향을 받는다고 할 수 있다. H2O2 분해반응 특성 상 전자의 이동성에 의한 산화-환원반응에 기인하여 반응 여부 또는 반응성이 달라지며, 이러한 반응특성이 곧 고체촉매의 루이스 산점과 연관이 있기 때문이다. 또한 산점 중에서 반응 대상물인 H2O2의 특성상 약 산점의 분포 및 양에 따라 반응성 크기가 결정되는 것으로 사료된다. Figure 12(b)는 건식산화제 제조를 위한 촉매 종류별 H2O2 촉매분해에 따른 H2O2 분해량을 나타낸 것이다. 사용된 촉매는 K-Mn/Fe2O3 촉매와 함량이 각각 다른 10, 30, 70 wt% Mn/Al2O3 촉매, 그리고 SO42-/ZrO2 촉매 등이었다. 그 결과, 촉매의 종류에 관계없이 시간에 따라 H2O2 분해효율이 점차 증가함을 알 수 있으며, 촉매의 종류에 따라 H2O2 촉매분해효율이 안정될 때까지 걸리는 시간, 즉 반응속도에 차이가 있는 것으로 나타났다. 반응성 크기순서는 K-Mn/Fe2O3 > 70 wt% Mn/Al2O3 > 30 wt% Mn/Al2O3 > 10 wt% Mn/Al2O3 > SO42-/ZrO2 등의 순으로 나타났으며, 이는 상기 촉매성능테스트 결과와 동일한 경향으로 얻어졌다. 상기 수행된 촉매 종류에 따라 수행된 H2O2 분해반응특성에 따라 제조된 건식산화제를 이용하여 후단에서 연계 가능한 산화공정 상에서 진행되는 NO 산화반응에 대한 특성을 조사하고자 하였다. Figure 13은 상기 촉매종류에 따라 수행된 H2O2 분해반응 후 얻어진 건식산화제를 산화공정에 모사 배가스와 함께 주입함으로써 NO 전환효율(그래프 내 수치, 단위: %)을 조사한 것이다. 반응온도는 150 ℃로 제어하였으며, H2O2 분해공정 상에서 H2O2 주입량, 촉매 충진량은 각각 0.3 g/min, 0.5 g이었다. 산화공정 또한 반응온도를 150 ℃로 제어한 가운데 주입된 모사 배가스의 유량과 이에 포함된 NO 농도는 각각 300 ml/min, 1,000 ppm이었다. 촉매 종류에 따라 산화공정에서 NO가 전환되는 효율이 다르게 나타났으며, H2O2 분해공정에서 얻어진 촉매의 성능에 따라 NO 전환율이 달라짐을 알 수 있다. 이러한 경향으로 H2O2 분해공정에서 사용된 촉매 종류별 산화공정에서 NO 전환 효율이 가장 높은 촉매는 K-Mn/Fe2O3, Mn/Al2O3 촉매였으며, 이때 산화공정에서 얻어진 NO 전환율은 약 100%에 도달하였다. 그리고 H2O2 분해공정에서 사용된 촉매별 산화공정에서의 NO 전환율 크기는 K-Mn/Fe2O3 ≈ Mn/Al2O3 >> 30 wt% Mn/Al2O3 > 10 wt% Mn/Al2O3 > Fe2O3 > SO42-/ZrO2 등의 순으로 나타났다.
본 연구에서는 H2O2촉매분해 상에서 얻어진 건식산화제 생성과 더불어 이로부터 얻어진 건식산화제를 연이은 NO 산화공정에 주입하여 NO 전환특성이 조사되었다. 우선 다양한 촉매를 제조하여 H2O2 분해반응에 적용한 결과, 촉매가 지니는 산점 특성이 H2O2 분해효율에 가장 큰 영향을 미치며, 촉매표면에 존재하는 산점의 세기가 약산점으로부터 강산점에 이르기까지 고르게, 그리고 양적으로 풍부하게 존재할수록 H2O2 분해효율이 높게 나타났다. 또한 이로부터 얻어진 건식산화제를 NO 산화공정에 주입하여 활용한 경우, H2O2 분해 효율이 증대될수록 NO 전환효율이 상승되는 결과를 얻었다. 따라서 제조된 다양한 촉매들 가운데, 가장 약산점으로부터 강산점에 이르는 고르고 풍부한 산점을 지니는 촉매로서 K 성분이 첨가된 Mn 기반 Fe2O3 촉매가 가장 높은 H2O2 분해효율을 나타내었으며, 이를 적용한 H2O2 분해공정 상 생성된 건식산화제를 활용한 NO 산화공정 상에서 최적화된 운전조건으로 얻어진 NO 전환율이 약 100%에 도달하였다.