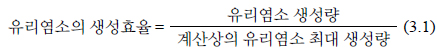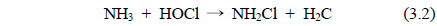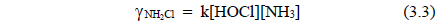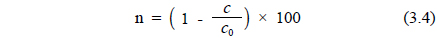We have introduced switching poles in the conventional electrolysis for the removal of ammonia in aquaculture wastewater to prevent the fouling on the electrode surface by the deposition of insoluble metallic compounds. We have also tried to locate the optimal period of switching poles considering the effect of the current loss during switching poles on the free chlorine generation. First, we have observed the decrease of free chlorine generation with the decrease of the period of switching poles due to the expected current loss, and this would lead to the decrease of ammonia removal efficiency. Meanwhile, the measurement of calcium and magnesium concentration in wastewater vs. the period of switching poles have demonstrated that a properly low level of fouling on the electrode surface could be retained with a period of switching poles of less than 60 sec by the decomposition of metallic compounds during switching poles. In a summary, we have optimized the period of switching poles to gain a high level of free chlorine generation and a high level of fouling prevention on the electrode at the same time.
순환여과식 양식법은 양식 폐수를 물리적, 생물학적 처리를 통해 외부로 배출하지 않고 재이용하여 사육조로 다시 유입되는 폐쇄적인 시스템의 양식 방법이다. 최소의 유입수를 이용하여 어류를 고밀도로 사육할 수 있는 장점을 가지고 있는 반면 순환되는 사육수 내의 오염물질의 효과적인 처리가 필요하다. 사육조 내에 발생하는 오염물질 중 단백질로부터 분해되는 암모니아성 질소는 순환여과식 시스템의 수처리 부분에 있어서 가장 중요한 요소이다. 이를 제거하는 여러 가지 방법 중에 화학적 처리가 많이 선호되고 있는데 그 중에 염소를 이용한 오염물질 제거에 대한 연구가 활발히 일어나고 있다. 최근에는 전해반응을 이용하여 생성된 중간생성물에 의한 간접 산화 반응에 대해 관심이 모이고 있는데 특히 해수중에 존재하는 염소이온의 Cl2 및 HOCl/OCl−의 생성이 연구되고 있다. 이들에 의한 간접 산화 효과 및 OH-의 첨가에 따른 영향에 대해 다양한 연구가 이루어졌으며[1], Czarnetzki and Janssen[2]은 양극에서 유리염소 이온(OCl−)의 생성은 염소이온의 물질전달에 의존한다는 것을 밝혔다. 또한 Chang 등[3]은 유리염소 이온의 생성이 양극의 재질과 전류 밀도 및 염소의 농도와 밀접한 상관관계가 있다고 보고하였다.
전기를 가함으로써 산화, 환원 및 석출 반응을 이용하는 전기 화학적 처리 공정은 많은 선행 연구들을 통하여 쓰레기 침출수, 중금속 폐수 및 난분해성 유기 오염물 등의 산업폐수 처리에 있어 오염물질을 제거하는 데 성능이 뛰어난 것으로 알려져 있다[4,5]. 전기화학적 반응을 이용하여 순환여과 양식장의 배출수 중 암모니아를 처리할 경우에는 일반적으로 담수와 달리 자체적으로 전해질 역할을 하는 이온이 많다. 뿐만 아니라 높은 농도의 염소이온이 존재하므로 타 방법에 비해 암모니아 제거속도가 높을 뿐만 아니라 장치의 소형화가 가능하다. 또한 직접적, 간접적 살균력을 가지므로 소독의 효과를 가진다[5]. 연구결과에 의하면 전해반응에 의한 유리염소 생성 및 제거 효율은 90% 이상으로 높게 나타났다. 하지만 이들 연구는 주로 암모니아 제거에 미치는 미반응 유리염소 이온에 의한 영향에 중점을 두고 있으며[4,6] 이러한 전해반응 시스템에 있어서 반응기 내에 생기는 분극 현상에 대해서는 아직 언급된 바가 없다. 일반적인 전해반응기에 있어서 해수 중의 금속이온은 산화·환원 반응을 일으켜 불용성 금속화합물을 형성함으로써 전극 표면에 달라붙게 된다. 이로 인해 전해반응을 일으키는 전극의 단면을 줄여서 저항이 늘어나게 된다. 특히, 장시간 동안 전해반응기의 운전시 동일한 전압에서 초기 전류가 점차 감소하게 되어 전류에 따른 유리염소이온의 생성 효율을 떨어뜨린다. 뿐만 아니라 전극의 교체시기를 짧아지게 하고 전해반응에서 오염물 처리를 위한 생성물의 농도를 일정하게 유지하기 위하여 더 많은 전력비를 요구하게 된다.
해수의 전기분해에 있어서 양극에서 염소가스가 발생된다. 환원 반응에서는 물이 분해되어 음극에서는 OH−가 발생하고 양극에서는 H+가 생성된다. 전기분해 반응기 내의 두 전극에서 일어나는 전극 반응은 식 (1.1)-(1.4)과 같다.
∙ 양극
∙ 음극
위와 같은 전해 반응에서 암모니아를 포함한 오염물질들은 양극에서 직접 산화 또는 간접 산화 과정에 의해 분해되고, 이 두 가지 과정을 Figure 1에서 보여주고 있다[7,8]. 양극에서의 직접 산화 과정에서의 오염물질 분해는 오염물질이 양극의 표면에 흡착되고 나서 양극의 전자 전달반응에 의해서 분해된다. 반면 간접 산화과정에서는 전해반응에 의해 생성된 유리염소 이온이나 산화된 금속이온과 같은 강한 산화제에 의해 오염물질이 분해된다. 일반적으로 전해반응을 이용한 암모니아 제거는 Figure 1의 간접 산화 과정의 생성물인 산화제에 의한 분해 반응을 이용하는 것을 말하며 파과점 염소주입법(breaking point chlorination)의 메커니즘과 동일하다.
이에 본 연구에서는 일반 전해반응기의 단점인 불용성 염의 생성을 최소화하며 암모니아를 제거하기 위하여 극전환 전해반응기의 극전환 주기와 암모니아 제거 특성을 실험하여 최적 조건을 도출하고자 하였다. 양극과 음극이 고정된 일반적인 전해반응에서 금속이온이 전자를 얻어 환원되거나 수조 내에서 산소와 결합하여 불용성 염이 생성되는 것을 막고자 극전환을 이용하여 역반응을 일으켜서 부반응에 의해 생성된 오 염물질을 분해하고자 하였다. 따라서 극전환으로 인해 나타나는 전류의 손실로 인한 유리염소 이온의 생성량 감소를 확인함으로써 암모니아 제거를 위한 최적의 극전환 주기를 찾는 연구를 동시에 수행하였다.
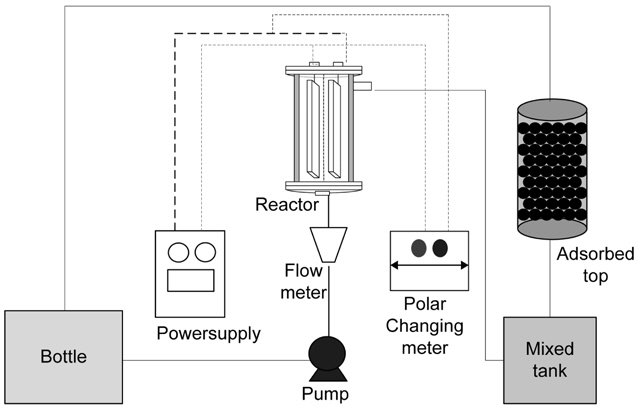
본 연구에 사용된 전해시스템의 공정 흐름도를 Figure 2에 나타내었다. 반응장치의 구성은 크게 수조, 직류전원공급기 (DC power supply), 전기분해 반응기, 극전환 장치, 혼합조 및 미반응 유리염소 제거를 위한 활성탄조로 구성되어 있다. 암모니아 제거 및 잔류 염소 생성을 위한 반응기는 원통구조(50 mm (ϕ) × 140 mm (H))로 두께 4 mm의 아크릴 관을 사용하여 제작하였다. 반응기 내부에 설치된 전극은 양극, 음극 모두 plate형 DSE (dimensionally stable electrode, Ir coated titanium plate)를 사용하였으며, 전극의 크기는 20 mm × 100 mm, 전극간의 거리는 10 mm를 유지하였다. 수조는 개방형 수조를 사용하였으며, 암모니아와 유리염소 이온의 충분한 반응을 위한 혼합조를 설치하였다. 또한 미반응 유리염소 이온을 제거하기 위한 활성탄조(70 mm (ϕ) × 150 mm (H))는 두께 5 mm의 아크릴 원통 관을 사용하였다. 전기분해 반응을 위해 정전압 직류 전원공급기(GP-4305DU)를 사용하였으며, 자체 제작된 극전환 장치를 사용하였다. 극전환에 의한 전압 및 전류량을 측정하기 위해 digital multimeter (protek 506)를 PC와 연동하여 데이터를 수집하였고, 수조에서 반응기로 또한 혼합조에서 수조로 흐르는 유량을 조절하기 위하여 2개의 정량펌프(Cole Parmer, Masterflex Model. 7623-47, 7620-47)를 사용하였다.
본 실험은 극전환 주기에 따른 불용성 염의 생성에 의한 오염(fouling) 현상을 관찰하고 생성물인 유리염소 이온의 생성효율을 확인하고자 하는 실험이다. 극전환에 대해 전극 표면 및 반응기 내부에 생성되는 불용성 염의 영향을 확인하기 위하여 시간에 따른 전류의 감소를 확인하는데, 극전환 주기를 0~120초로 변화시키면서 240분간 전류밀도의 변화를 관찰하였다. 불용성 염 조성을 확인하기 위하여 반응기 내부의 시수(2.0 L)를 GF/C 필터를 이용하여 여과시킨 후, 필터에 걸러진 고형물을 세척·건조하여 X선 형광분석기(X-ray fluorescence, XRF-1700, SHIMADZU (Japan))로 정성 분석을 하였다. 여과된 해수는 희석 후 원자흡광도기(atomic absorption spectroscopy, AA-700F, SHIMADZU (Japan))를 이용하여 알칼리 토금속인 마그네슘과 칼슘의 농도를 측정함으로써 생성되는 불용성 염의 제거 효율을 확인하였다. 극전환 주기에 따른 전류의 손실로 인한 유리염소 이온의 생성량 감소를 확인하기 위한 실험으로 초기 유량을 6.67 L/hr, pH 7.8(일반 해수 기준)로 고정하여 극전환 주기를 0~120초로 변화시키면서 60분간 실험하였다. 극전환 주기에 따른 유리염소 이온의 생성량을 알아보기 위하여 N,N-diethyl-p-phenylenediamine (DPD) 방법[9]을 이용하여 유리염소 이온의 농도를 측정하였다.
3.1. 극전환 주기에 따른 전류밀도 변화 및 유리염소 이온의 생성 효율
전해반응에서는 전자의 흐름에 따른 산화·환원 반응에 의하여 수중에 존재하는 금속이온이 금속 및 불용성 염으로 생성되어 전극에 부착되거나 수중의 탁도를 높이는 현상을 일으킨다. 이러한 현상과 더불어 정전압 상태에서 초기에 주어진 전류는 시간에 따라 감소하는 것으로 나타난다. 해수의 전해반응에 있어서는 유리염소 이온의 생성 효율만큼 유리염소 이온의 일정 생성농도를 맞추기 위해 동일 전압에서 정전류 상태를 유지하는 것이 중요하다.
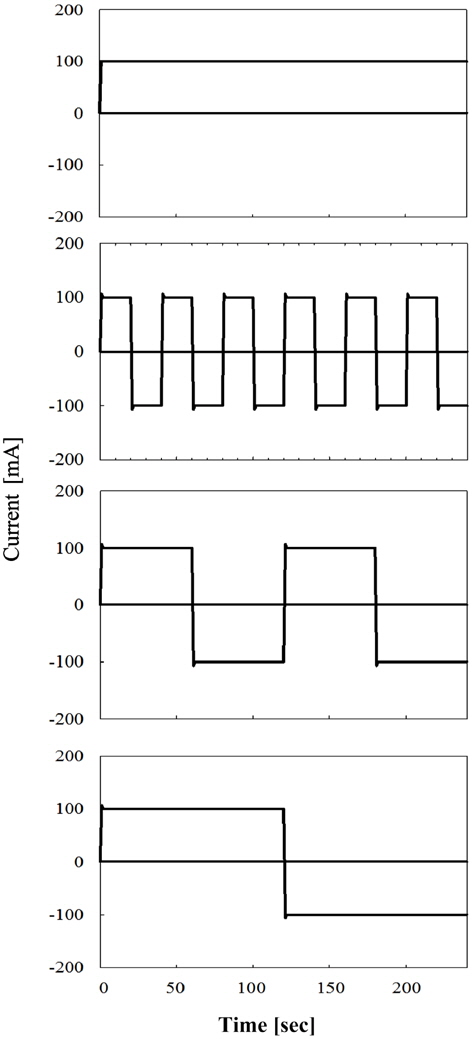
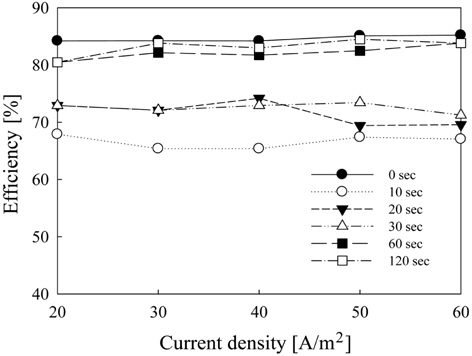
Figure 3에서는 극전환 주기에 따른 전류의 형태를 확인하기 위하여 극전환 주기를 0, 10, 20, 30, 60, 120초로 변화시키면서 전류를 측정하였다. 극전환 주기 변화시키면서 240초간 전류를 측정하였을 때 Figure 3에서 볼 수 있듯이 매 단계 전류 흐름이 시작되고 정상상태까지 도달하는데 약 0.1초의 지연이 발생하며 이 때 전류 손실이 발생하므로 실제 생성물의 농도보다 낮은 농도의 생성물이 나오게 된다. Figure 3에서 전류의 값이 음수(−)를 가지는 이유는 극전환으로 인한 전류의 흐름이 반대로 이루어지기 때문이다.
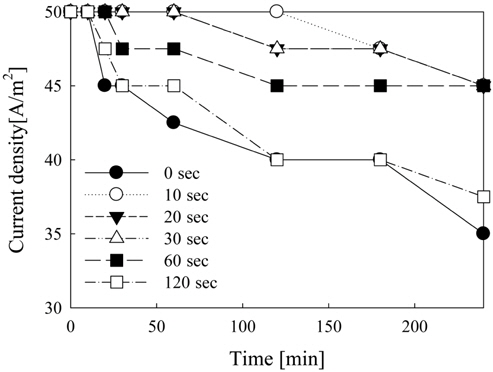
Figure 4에서는 극전환 주기를 0, 10, 20, 30, 60, 120초로 변화시키면서 전기분해 반응 시 생기는 분극 현상으로 인한 전류밀도의 감소를 4시간 동안 관찰한 결과를 나타내었다. 전극 면적을 기준으로 계산한 초기 전류 값은 100 mA(전류밀도: 50 A/m2) 이며 극전환을 하지 않았을 경우(0초) 전류밀 도가 70 mA(전류밀도: 35 A/m2)까지 떨어진다. 이것은 수중에 존재하는 금속류가 전자를 받아 환원되어 금속 형태로 석출되거나 전해반응에 의해 수중의 산소나 OH-와 만나 금속산화물 및 수산화물이 생성되어 물에 잘 녹지 않고 전극표면에 부착되기 때문인 것으로 보여진다. 극전환을 하였을 경우, 극전환 주기가 짧을수록 시간에 따른 전류밀도의 감소현상이 줄어들었다. 특히, 240분간의 전해반응에서는 극전환 주기가 60초일 때 전류는 10 mA 정도 감소하였으며 그 이하의 극전환 주기에서도 이와 유사한 결과를 보였다.
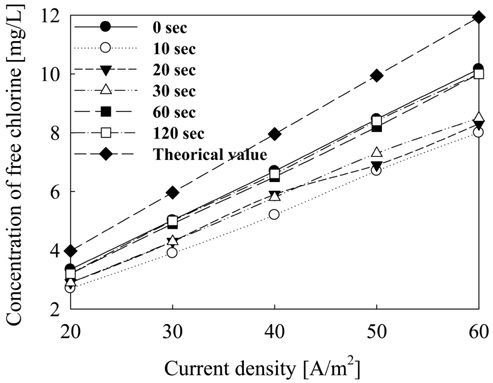
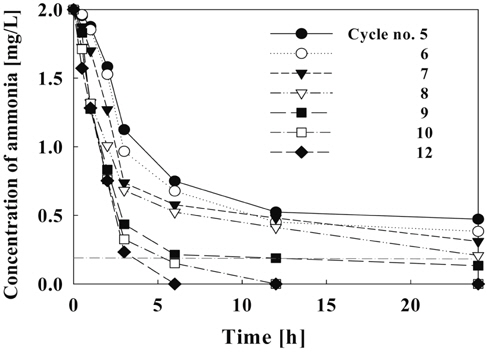
Figure 5에서는 수중의 pH를 일반 해수 기준인 7.8로 유량을 순환식 반응기의 1일 8회 순환 기준인 6.67 L/hr로 고정시킨 후 극전환 주기에 따른 유리염소 이온의 생성량을 측정하여 나타내었다. 유리염소 이온의 생성량에 있어서 전류 밀도가 증가함에 따라 수중에 발생되는 유리염소 이온의 농도는 증가하지만 극전환 주기가 짧아질수록 전류 손실에 의해 생성물의 농도가 낮아짐을 확인할 수 있다. 이에 Figure 6에서 극전환에 따른 유리염소 이온의 생성 효율을 구해 보았다. 극전환을 하지 않았을 경우 유리염소 이온 생성 효율은 80-85%를 유지하고 있으나, 극전환을 하는 경우에는 극전환 주기가 짧아질수록 유리염소 이온 생성 효율이 낮아짐을 알 수 있다. 극전환을 하지 않았을 때 유리염소 이온의 생성 효율 약 85% 이상이었고, 극전환 주기가 60과 120초일 때 유리염소의 생성효율은 약80%, 주기가 10초일 때는 약 65%로 나타났다. 따라서 생성물인 유리염소 이온의 생성효율은 극전환을 하지 않거나 극전환 주기가 길수록 높아진다. 유리 염소의 생성 효율은 식 (3.1)과 같이 나타난다.
결과적으로 극전환 주기를 길게 함으로써 유리염소 이온의 생성 효율을 높게 유지하는 것이 바람직하나 장시간 전해반응에 있어서 동일전압에서 오염 현상으로 인한 전류밀도의 감소 또한 중요한 인자이므로 전류밀도의 하락폭이 작으면서 유리염소 이온의 생성효율은 높은 극전환 주기 60초가 가장 적합한 것으로 판단된다.
3.2.1. 전류밀도에 따른 암모니아 제거 특성
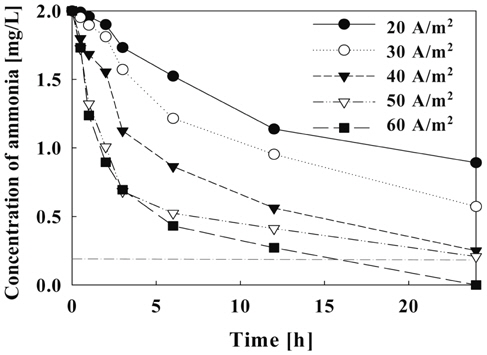
본 연구에서는 전류밀도에 따른 유출수 중의 암모니아 농도, 제거 효율 및 제거속도를 Figure 7-9에 나타냈다. 전류 밀도에 따른 암모니아 제거를 확인하기 위하여 초기 암모니아 농도를 2.0 mg/L로 하여 24시간 수조내의 암모니아 농도를 측정하였다. Figure 7은 전류밀도에 따른 암모니아의 농도 변화를 나타낸 것으로 시수를 24시간 순환하였을 때 전류밀도가 증가할수록 수중의 암모니아 농도는 줄어드는 것을 확인할 수 있다. 전류밀도 높을수록 생성되는 유리염소의 농도가 높아지므로 수중의 암모니아를 모노클로라민 형태로 바꾸어 수중의 암모니아를 제거하는 것으로 알려져 있다. 이는 암모니아가 유리염소에 의해 제거 되는 첫 단계로써 식 (3.2)의 모노클로라민의 생성반응으로 설명할 수 있다.
이 반응은 암모니아와 유리염소에 대하여 2차 반응으로서 식 (3.3)과 같은 속도식으로 나타낼 수 있다[11]. 전류밀도가 증가할수록 유리염소 생성량이 증가하여 암모니아 농도가 감소하는 것을 확인할 수 있다.
전류밀도에 따른 암모니아 제거량에 있어서는 초기 반응시작 후 3시간 동안 수조내의 암모니아 농도가 급격히 떨어지며 각 전류밀도에서의 최종 제거량의 50% 이상을 제거함을 확인할 수 있었다. 이것은 전류밀도에 따라 생성된 유리염소가 3시간 이내에 수조내의 많은 양의 암모니아를 제거함을 보여준다.
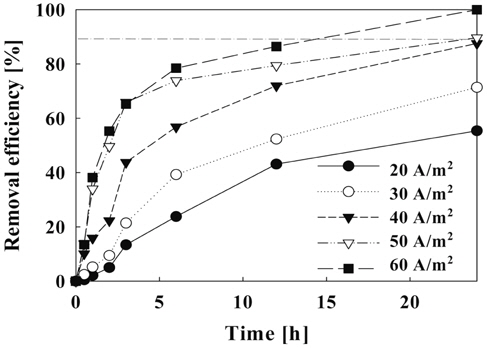
Figure 9는 일정한 유량에서 전류밀도가 증가할수록 암모니아제거 효율은 증가하였으며, 최종 24시간 후에는 전류밀도에 따라 55.4~100%의 제거율을 나타내었다. 이 결과 암모니아 제거율은 60 A/m2 에서 가장 높게 나타났지, 본 실험조건에서 전류밀도가 50 A/m2에서 유량이 6.67 L/hr(순환횟수: 8회) 이상일 때 암모니아의 제거 효율이 약 90% 이상으로 나타났다.
여기서, n : 암모니아 제거효율 Co : 초기 암모니아 농도(mg/L) C : 처리수 암모니아 농도(mg/L)
Figure 9에서는 전류의 세기 및 시간에 따른 암모니아 제거속도를 나타낸다. 암모니아 제거속도는 식 (3.5)에 따라 계산된다.
여기서, −rTan : 암모니아 제거속도(mg/L·hr) C0 : 초기 암모니아농도(mg/L) C : 처리 후 암모니아 농도(mg/L) V : 반응기 부피(L) Q : 부피 유량(L/hr)
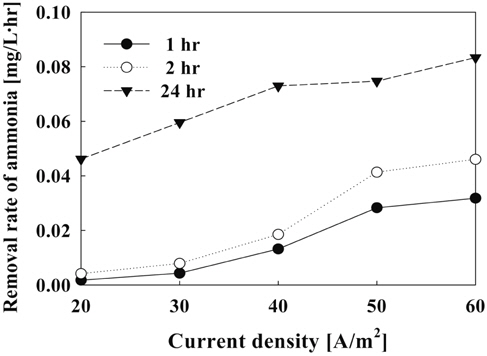
전류밀도에 따른 암모니아 제거속도에 있어서 1시간 반응시켰을 때 제거속도는 1.75 × 10−3~3.182 mg/L·hr로 나타났으며 24시간 후에는 4.62 × 10−3~8.33 × 10−3 mg/L·hr의 제거속도를 보였다. 이 결과 제거속도도 전류밀도가 높을수록 증가하는 것으로 나타났다. 전류밀도가 60 A/m2일 때 제거속도는 가장 높았지만 본 실험에서는 50 A/m2 이상에서는 거의 비슷한 결과를 나타냈다. 최종 24시간 후에는 전류밀도가 30 A/m2에서 40 A/m2로 바꾸었을 때 제거속도가 다소 증가하였지만 시간당 제거량이 가장 많은 2시간 이내의 반응에서는 40 A/m2에서 50 A/m2로 변화시켰을 때 제거속도가 50% 이상 증가함을 확인할 수 있었다. 따라서 암모니아 제거에 있어서 전류밀도는 50 A/m2이 적합한 것으로 나타났다.
전류밀도에 따른 암모니아 제거에 있어서 우선 낮은 전류밀도에서는 유리염소의 생성속도가 낮아 암모니아와 반응하는 잔류염소가 적게 되어 상대적으로 암모니아 제거효율도 적었으며, 높은 전류밀도에서는 유리염소의 생성속도가 증가하여 암모니아와 반응하는 잔류염소 많이 생성되어 제거효율이 증가하게 된다[12-14].
3.2.2. 순환횟수에 따른 암모니아 제거 특성
일반적으로 수중의 암모니아 제거를 위한 유리염소 생성에 있어서 동일 전류 일 때 유리염소 생성 효율은 유량에 반비례한다. 따라서 순환하지 않는 1회 반응시스템에서는 유량을 낮춰서 체류시간을 증가시켜 주는 것이 유리염소 생성 농도에 있어서 유리하다. 그러나 순환횟수에 따른 수중의 암모니아 농도를 확인한 결과 Figure 10과 같이 나타났다. 이 결과에서 순환횟수가 증가함에 따라 암모니아 농도가 줄어드는 것을 확인할 수 있다. 일반적으로 순환횟수가 높아질수록 유량이 높아지므로 암모니아 제거율이 떨어질 것으로 보이지만, 50 A/m2의 전류밀도에서 생성된 유리염소가 암모니아와 반응하여 클로라민 형태로 바뀌면서 활성탄 흡착탑에서 제거되는 것으로 보여진다. 디클로라민과 활성탄의 반응은 다음 식 (3.6)~(3.7)과 같다.
디클로라민과 활성탄의 반응은 다른 염소 종류보다 매우 빠르게 진행된다. 여러 종류의 염소와 활성탄의 반응속도는 NHCl2 > HOCl > OCl− > NH2Cl > NH3의 순서를 갖는다[15-17].
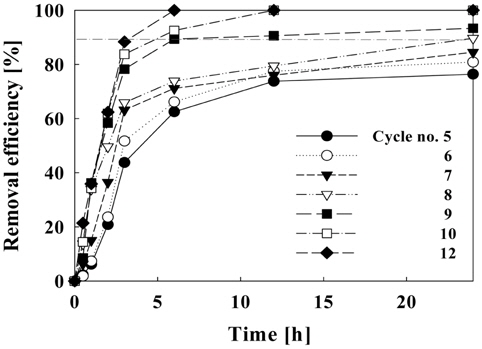
Figure 11에서는 순환횟수에 따른 제거효율을 나타내고 있다. 순환횟수가 9회 이상일 때 6시간 이내에 수조 내의 암모니아가 90% 이상 제거되고, 순환횟수가 8회일 때 24시간 후에 암모니아 제거 효율이 90%에 도달하였다. 또한 1일 7회 이하의 순환을 할 경우에는 수중의 암모니아 농도가 권장기준인 0.2 mg/L-NH4+ 이상 존재하는 것으로 나타났다. 따라서 순환횟수의 조절에 따른 수조내 암모니아 농도를 0.2 mg/L 이하로 유지하기 위해서는 1일 순환횟수를 8회(6.67 L/hr) 이상으로 하여야 할 것으로 나타났다.
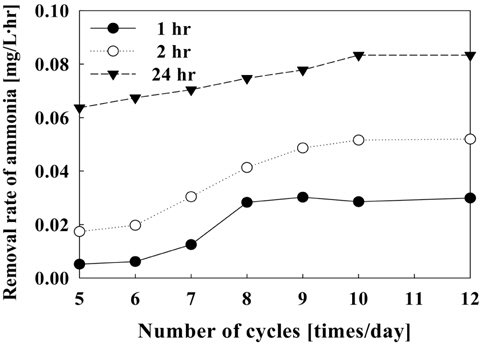
Figure 13은 1일 순환횟수에 따른 수조내의 암모니아 제거속도를 나타내었다. 일정한 전류밀도에서 순환횟수가 증가할수록 제거속도는 증가하였으며, 1일 순환횟수가 5~12회(4.17~10.0 L/hr)에서 24시간 운전시 6.37 × 10−2~8.33 × 10−2 mg/L·hr의 제거속도를 보였다. 시간당 제거량이 가장 많은 1시간 이내의 반응에서는 순환횟수에 따라 5.17 × 10−3~2.9 × 10−2 mg/L·hr로 나타났으며, 12회에서 가장 높은 제거속도를 보였으나 8회 이상의 순환횟수로 운전시에는 제거속도가 거의 비슷하였다.
순환횟수에 따른 암모니아 제거에 있어서 순환횟수가 1일 8회 이상이 적합하였으며 순환횟수가 적을 경우, 수중의 암모니아가 제거되는데 오랜 시간이 소요되므로 빠른 시간 내에 높은 제거를 필요로 하는 폐쇄형 시스템에서는 부적절할 것으로 판단된다.
3.2.3. 초기 암모니아 농도에 따른 암모니아 제거 특성
수중의 암모니아 농도에 따라 필요한 유리염소의 양이 달라진다. 본 실험은 초기 암모니아 농도에 따른 제거 효율을 확인하고자 하는 실험으로 암모니아 농도를 1.0~4.0 mg/L으로 하여 전류 밀도를 50 A/m2, 유량을 1일 순환횟수 8회 기준인 6.67 L/hr로 하여 24시간 반응시켰다.
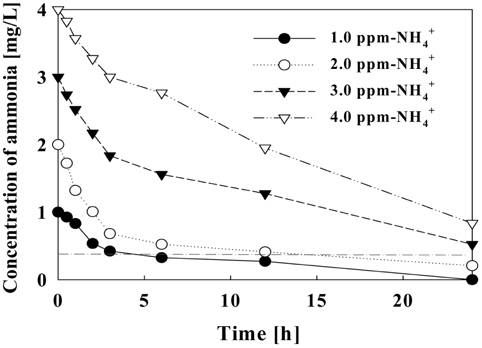
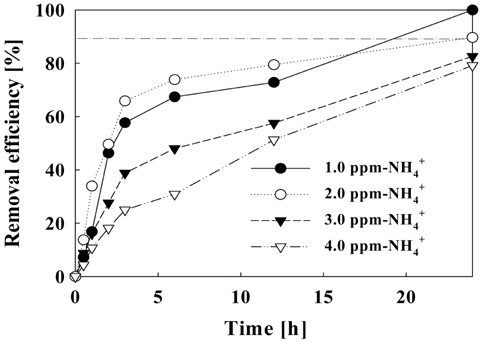
Figure 13-14에서는 초기 암모니아 농도에 따른 제거량 및 제거효율을 나타낸다. 암모니아 초기 농도가 1.0 mg/L일 때 6시간 이내에 0.2 mg/L 이하로 유지하였고 24시간 반응 후에는 완전한 제거 효율을 보였다. 초기농도가 2.0 mg/L 이하일 경우에는 24시간 후에 90% 이상의 제거율을 보였다. 초기 암모니아 농도가 낮을 때 짧은 시간 내에 높은 제거율을 보였지만 시간이 지남에 따라 제거 효율을 보여주는 곡선의 기울기가 점차 낮아짐을 확인할 수 있었다. 초기 농도를 3.0 mg/L-NH4+ 이상으로 하였을 때, 24시간 동안 약 80%의 제거 효율을 보였다.
초기 농도에 따른 제거 효율을 나타내는 Figure 14에서는 주어진 조건(전류밀도: 50 A/m2, 순환횟수: 8회)에서 24시간 후의 암모니아 농도를 0.2 mg/L 이하로 유지하기 위한 암모니아의 최고 농도가 2.0 mg/L임을 확인하였고, 초기 농도가 3.0 mg/L 이상일 경우 더 높은 전류가 필요할 것으로 판단된다.
본 연구에서는 해수의 전해반응에서 부반응에 의해 생성되는 불용성 염에 의해 일어나는 오염 현상을 확인하고, 이러한 현상을 제거하기 위하여 일정한 주기로 극을 전환하여 유리염소 이온을 생성하고자 하였다.
전해 반응에서 장시간 운전 시 오염 현상에 의해 전류가 감소하는 현상을 막기 위하여 극전환을 도입하였으며, 극전환 주기에 따른 전류의 감소를 확인한 결과 극전환 주기가 짧을수록 감소하는 전류밀도의 폭도 작았다. 극전환에 따른 전류의 손실이 유리염소 이온의 생성에 미치는 영향을 확인한 실험에서는 극전환 주기가 길수록 유리염소 이온의 생성 효율은 상승하였다. 따라서 최적의 극전환 주기는 오염 현상에 의한 전류밀도의 감소를 감안하여 60초로 결정되었다.
1) 전류의 세기 및 순환횟수에 따른 암모니아 제거에 있어서 전류밀도가 50 A/m2에서 유량이 6.67 L/hr(순환횟수: 8회) 이상일 때 암모니아의 제거 효율이 90% 이상으로 수조내의 암모니아 농도를 0.2 mg/L 이하로 유지할 수 있었다.
2) 초기 암모니아 농도에 따른 제거 효율에 있어서 초기 암모니아 농도가 낮을수록 짧은 시간에 높은 효율을 보였으며, 3.0 mg/L 이상의 암모니아를 제거하기 위해서는 8회 순환의 경우 50 A/m2 이상의 전류밀도가 필요하다.
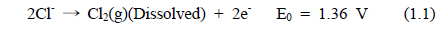
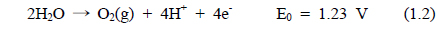

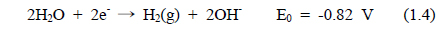
![Schemes of two pollutants removal pathways in electrochemical oxidation process[4,10].](http://oak.go.kr/repository/journal/15524/CJGSB2_2015_v21n1_45_f001.jpg)