In this study, we investigated the proliferative and adhesional effect of human osteoblast like MG-63 cell treated with low intensity pulsed ultrasound (LIPUS). We tested the effectiveness of LIPUS in human osteoblast like MG-63 cells. Cell proliferation was measured using a water soluble tetrazolium salts-1 assay. The mRNA expression of alkaline phosphate, vascular endothelial growth factor (VEGF), integrin alpha 2, colla 1A1 were performed by reverse transcription-polymerase chain reaction. LIPUS was no cytotoxicity in human osteoblast like MG-63 cells. In addition, the data show that treatment with 1 MHz and 3 MHz LIPUS on increased proliferation 7 days after. There were significant increased in mRNA expression of alkaline phosphatase, osteocalcin, VEGF, integrin alpha 2 and colla 1A1 (p<0.05). Therefore, the LIPUS significantly increased differential expression of mRNA levels in osteoblast like MG-63 cell and new possibilities in dental clinical practice.
현재 치과용 임플란트는 치료 후 상실된 무치악 부위에서 심미적, 기능적으로 많이 쓰여 오고 있다. 임플란트는 식립 후 골 유착이 매우 중요하며, 이는 임플란트와 골 조직 표면에 자연치아와 같은 치은 열구가 없고, 띠 형태로서 부착하기 때문이다. 이렇듯 골 유착은 임플란트의 초기 고정에 있어 중요하며, 임플란트와 골 조직은 골 유착 형태로서 결합하게 되며 임플란트와 치조골 사이의 골 유착은 임플란트의 성공률에 있어 큰 영향을 미치게 된다. 골 유착 시 임플란트와 주위 조직 간의 반응은 현재 여러 연구를 통해 발표되고 있는데, 임플란트 식립 시 뼈 유착에서 세포가 분비하는 인자들과 주위 조직은 임플란트의 표면에 반응하고 영향을 받게 된다1,2). 최근 연구에 따르면 저 출력 초음파를 이용하여 골절치유3)나 림프종, 암치료4), 골육종 세포5)에서의 연구와 함께 세포의 이동이나 뼈 치유 촉진 및 혈관 신생과 관련한 연구가 발표되고 있다6,7).
최근 치과계에서 주목 받고 있는 치료용 저 출력 초음파는 여러 성장인자, 골 형성 단백질 등의 생물학적 자극뿐만 아니라 물리적인 자극에도 민감한 것으로 알려지고 있다2). 즉 낮은 전류, 저 출력 초음파 에너지 영역, 그리고 특수한 파장의 전자장에 의해 골 형성이 촉진될 수 있다고 보고되고 있는데, 이는 비침습적이고 임상적으로 제공이 용이한 장점이 있다. 이러한 이유로 인하여 최근 골절의 치유를 촉진하기 위하여 저 출력 초음파(low intensity pulsed ultrasounds, LIPUS) 등을 개발하고 사용하고 있다8). 치과계의 저 출력 초음파의 치유촉진에 대한 보고는 최근에 보고되기 시작하였으며, 초음파는 의료분야, 수술이나 진단 영역에서 폭넓게 사용되고 있다. 또한, 초음파는 각각의 사용 용도에 적합하게 출력 조절이 가능하여 각 영역에 맞게 조절되어 사용할 수 있는 장점이 있다2). Duarte8)와 Pilla 등9)의 연구에 따르면 초음파를 동물의 골 조직에 처리시 골 성장과 치유에 대한 효과가 보고되었으며, 저 출력 초음파 처리 후 골 치유 촉진에 대한 응용연구가 최근 활발히 이루어지고 있다2).
이에 본 연구는 저 출력 초음파를 human osteoblast-like cell에 처리하였을 때, 뼈 치유 과정에서 발생하는 뼈 생성 촉진 단백질들의 발현 정도와 부착관련 인자들을 알아보고자 한다.
본 실험에 사용한 MG-63 세포는 human osteoblast-like cell로서 서울대학교 의과대학 한국세포주은행에서 분양 받아 본 실험에 사용하였다. 분양 받은 MG-63 세포는 10% fetal bovine serum (FBS), 100 IU/ml penicillin, 그리고 100
Human osteoblast-like MG-63 세포는 6-well 배양용기에 3×105으로 분주한 뒤 골 형성유도배지로 교체하였다. 실험에 사용된 저 출력 초음파는 임상에서 쓰이는 BR-Sonic(ITO Co., Tokyo, Japan) (Fig. 1)으로 human osteoblastlike cell에 저 출력 초음파를 처리하지 않은 대조군과 저 출력 초음파를 처리한 실험군으로 정하여 진행하였으며, 사용된 초음파 출력은 40 mW/cm2로, 각각 주파수를 1 MHz, 3 MHz로 나누어 15분씩 처리하였다.
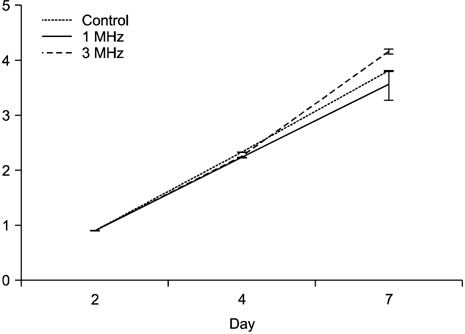
저 출력 초음파가 세포 성장률에 미치는 효과를 측정하기 위하여 water soluble tetrazolium salts (WST)-1 방법을 이용하였다. 6-well plate에서 3×105으로 분주한 뒤 24시간 배양하였다. 24시간 뒤 세포의 상층 배지를 골 형성유도배지로 교환한 다음, 초음파를 1 MHz, 3 MHz로 처리하였다. 처리된 세포는 2일, 4일, 7일을 배양한 다음 각각의 well에 water soluble tetrazolium salts-1 용액을 처리하여 2시간 동안 37℃, 5% CO2 배양기에서 반응시켰다. 이후, ELISA Reader (Sunrise Remote Control, Tecan, Austria)로 450 nm 파장에서 흡광도를 측정하였으며, 각각의 분석은 독립적으로 세 번씩 시행되었다.
4. Reverse transcription-polymerase chain reaction
총 mRNA를 저 출력 초음파가 처리된 세포에서 TRIzol reagent (Invitrogen, Carlsbad, CA, USA)를 처리하여 추출하였고 One-step PreMix kit (iNtRON Biotechnology Inc., Seongnam, Korea)를 이용하여 제조사의 지시대로 cDNA를 합성하였다. 합성된 cDNA로부터 2× polymerase chain reaction (PCR) master mix (Doctor Protein Corp., Seoul, Korea)를 이용하여 PCR 증폭을 실시하였다. 증폭한 산물은 1.5% agarose gel을 사용하여 전기영동으로 확인한 다음 mRNA 발현은 LAS (Fujifilm, Tokyo, Japan)를 통하여 나타내었다. PCR 실험에 사용한 primers는 Table 1과 같다.
[Table 1.] Detailed Information of Primers

Detailed Information of Primers
저 출력 초음파가 처리되지 않은 대조군과 처리된 실험군의 결과는 통계프로그램인 SPSS Window ver. 12.0 (SPSS Inc., Chicago, IL, USA)에 의해 paired t-test statistical method를 적용하여 분석하였다. 또한 p<0.05를 통계적으로 유의한 차이가 있는 것으로 판단하였다.
저 출력 초음파가 조골세포에 처리 후 증식에 미치는 효과를 보기 위하여 WST-1 분석을 시행하였다. 저 출력 초음파를 처리 후 2일, 4일, 그리고 7일째 분석하였으며, 2일과 4일째에 분석된 대조군과 저 출력 초음파가 처리된 1 MHz, 3 MHz 실험군에서는 서로 별다른 변화가 없었다. 그러나 7일째부터 대조군과 비교 시 저 출력 초음파가 처리된 3 MHz 군이 유의하게 증식됨을 확인하였다(Fig. 2, p<0.05).
2. 저 출력 초음파가 조골세포의 분화와 관련된 유전자 발현 분석
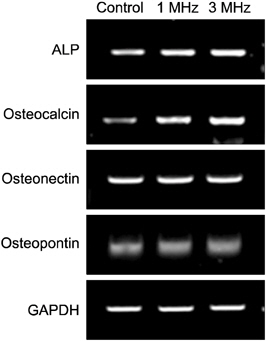
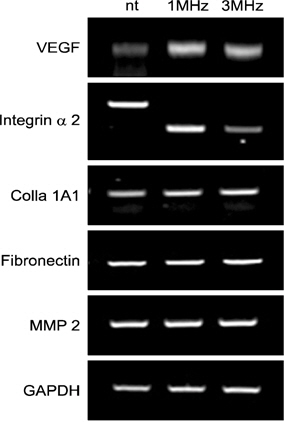
저 출력 초음파가 조골세포의 분화와 관련된 발현의 정도를 확인하기 위하여 reverse transcription-PCR 분석을 시행하였다. 저 출력 초음파를 처리 후 7일 째에 대조군, 1 MHz, 그리고 3 MHz 실험군을 분석하였다. 대조군에 비하여 1 MHz, 3 MHz 실험군에서 alkaline phosphatase (ALP), osteocalcin, vascular endothelial growth factor (VEGF), colla 1A1은 모두 유전자의 발현이 증가함을 확인했으며, integrin alpha 2의 경우 3 MHz 실험군에서의 발현량은 적었으나, 대조군과 1 MHz 실험군에서 유사한 발현의 양을 보이는 것을 확인하였다. 반면 osteonectin, osteopontin, fibronectin 그리고 matrix metalloproteinase (MMP)2의 유전자 발현의 차이는 없었다(Fig. 3, 4).
저 출력 초음파에 대한 골절치유 장애의 치료와 치유촉진에 대한 연구는 정형외과에서 오래전부터 보고되어 왔다10). 또한 치과계에서도 뼈의 골절이나 손상 시 자연치유 만으로는 회복과정이 매우 오래 걸리므로 치유속도를 증진시키기 위해 비침습적인 뼈의 재생 촉진을 위한 연구가 보고되고 있다. 이러한 많은 수의 임상 증례를 통하여11-13) 치과분야에서 저 출력 초음파의 효과에 주목하고 있으며, 임플란트 등 의 매식 시 가해지는 하악골 및 상악골의 손상 부위에서도 본격적으로 연구가 이루어지고 있다. 임플란트 매식 시 골의 치유속도는 임플란트 성공에 매우 큰 영향을 미치므로 골 치유가 적절히 진행되지 않을 시 골의 흡수, 골 유착의 실패, 그리고 치유의 지연이 발생할 수 있다.
저 출력 초음파는 세포의 자극이 적고 비침습적 창상 치유 방법으로서, 주로 1 MHz, 3 MHz의 주파수를 주로 사용하고 있다8). 본 연구에서는 human osteoblast-like MG-63 세포에 1 MHz, 3 MHz 강도의 초음파를 처리하여 조골세포 의 증식과 분화와 관련된 발현 정도를 파악하였다. 본 연구에서 사용한 저 출력 초음파 장치를 human osteoblast-like MG-63 세포에 처리 후 7일째부터 3 MHz 실험군에서 유의하게 조골세포가 증식하는 것은 골 치유를 촉진시킴에 있어 3 MHz의 주파수가 효과적이며 이때 발생하는 열적, 전기적 효과가 세포증식에 효과적임을 알 수 있다14). 이에 본 연구는 human osteoblast-like MG-63 세포에 초음파 처리 시 발현되는 조골세포의 분화와 관련된 인자를 검증하고자 하였다.
조골세포는 Type I collagen, ALP, osteocalcin, osteonectin, osteoopontin 등의 뼈기질 성분들을 합성하고 효소를 분비하며 골과 관련된 여러 유전자들의 연속적인 발현에 의해 조절된다15-17). 즉, 경조직의 중요한 구성요소이며 광화 조직의 증식 분화 시에 발현이 증가되는 효소로서18) 저 강도 초음파 처리시 조골세포의 분화와 관련된 ALP의 활성의 증가와 뼈의 석회화에 관여하는 뼈의 단백질 성분인 osteocalcin 19)의 발현이 증가가 확인되었으며, 이는 저 강도 초음파 장치가 뼈생성 인자들을 촉진시키는 것으로 생각된다. 또한, 혈관 형성에 관여하는 혈관내피 성장인자인 VEGF는 뼈 파괴 세포를 유도하여 뼈의 재형성을 촉진하는 것으로 보고되고 있으며20), 저 출력 초음파 처리 시 VEGF 발현의 증가는 이처럼 혈관의 신생은 골의 치유와 밀접한 연관이 있을 것으로 보인다.
Integrin은 두 소단위의 이형이합체로 구성되는 당 단백질로서21) 세포부착에 관여를 하고 세포와 세포 간의 접착에 중심적인 역할을 하는 것으로 알려져 있다. 또한 integrin은 세포 외 기질(extracellular matrix)과 세포 골격인 액틴 섬유 와 결합할 수 있도록 하며 세포의 성장 및 분화를 조절하는 역할을 한다22). 본 연구에서 3 MHz를 처리한 군에서 integrin alpha 2의 발현량은 다른 군에 비하여 낮은 발현을 보인 것으로 관찰되었다. 반면 1 MHz의 초음파 처리 시 대조 군에서 나타나는 integrin alpha 2와의 발현 차이가 나지 않는 것으로 보아 1 MHz 처리 시 3 MHz를 처리한 군보다 세포의 부착과 이동에 밀접한 관련이 있는 것으로 생각된다.
생체 고분자인 colla 1A1은 세포 외 기질 중 가장 많은 단백 부분을 차지하며, 골을 형성 및 무기질을 침착시키는 역할23)을 하며, 본 연구 결과 저 출력 초음파 처리 시 증가되어 발현되는 것을 확인하였다. 즉, ALP, osteocalcin, VEGF, integrin alpha 2, colla 1A1 등의 인자 등은 골 형성을 촉진하는 것으로 보고되고 있으며, 본 연구에서도 저 출력의 초 음파를 osteoblast-like MG-63 세포에 7일간 처리 후 세포의 증식이 유의하게 증가하는 것을 알 수 있다(p<0.05). 또한 연골기질 분해 효소인 MMP는 연골에서 세포 외 기질을 구성하는 콜라겐과 proteoglycan을 직접적으로 분해하는 효소로서 연골의 퇴행성 관절염의 원인 인자로 알려져 있으며24), 본 연구에서 저 출력 초음파 처리 시 변화가 없음을 증명하였으며 이는 저 출력 초음파 장치가 골의 손상을 억제시키고 골세포의 증식 및 분화를 촉진시키는 것으로 생각된다. 반면 뼈에 존재하는 비 콜라겐성 단백질인 osteonectin 과 osteiopontin, 세포 외 기질 단백질인 fibronectin 인자들은 변화가 없었으며 이에 대한 추가적인 연구가 필요할 것 으로 생각된다. 본 결과를 종합하여 볼 때 임플란트 식립 후 저 출력 초음파 처리 시 초기 치유 과정에서 활발하게 뼈의 활성이 일어날 수 있음을 유추할 수 있었으며, 골다공증 환자 등의 골질환 환자들에게 적용시 치유의 촉진과 초기 뼈 세포의 활성과 골 형성 촉진을 증가시킬 수 있을 것으로 생각된다. 그러나 in vitro에서 실험을 진행하여 동물실험을 통한 in vivo 실험 시 미칠 수 있는 부작용이나 활성인자들에 대해 추가적인 연구가 필요하며, 저 출력 초음파 명확한 mechanism에 대한 지속적인 연구가 필요할 것으로 생각된다.