Dental plaque resides passively at a site and makes an active contribution to the maintenance of health. The bacterial composition of plaque remains relatively stable despite regular exposure to minor environmental stress. This stability, homeostasis is due to a dynamic balance of microbial interactions. However, the homeostasis can break down, leading to shifts in the balance of the microflora. This change can be a sign of initial dental caries. It is proposed that disease can be prevented or treated not only by targeting the putative pathogens but also by interfering with the processes that drive the breakdown in homeostasis. It is essential to understand the plaque as a mixed species biofilm. In this essay I reviewed an extension of the caries ecological hypothesis to explain the relation between dynamic changes in the phenotypic/genotypic properties of plaque bacteria and the demineralization and remineralization balance of the dental caries process. We will have the strategies to impact significantly on clinical practice as understanding dental biofilm.
구강의 양대 질환인 치아우식증과 치주질환을 잘 관리하기 위해서는 치면세균막(dental plaque)에 대한 정확한 이해가 필수적이다. 과거에는 구강 질환의 발생 기전을 밝히기 위해 발병에 영향을 미치는 특정 미생물을 동정하는 데 주력하였다. 그 결과, 치아우식증에 관여하는 Streptococcus species (sp.)와
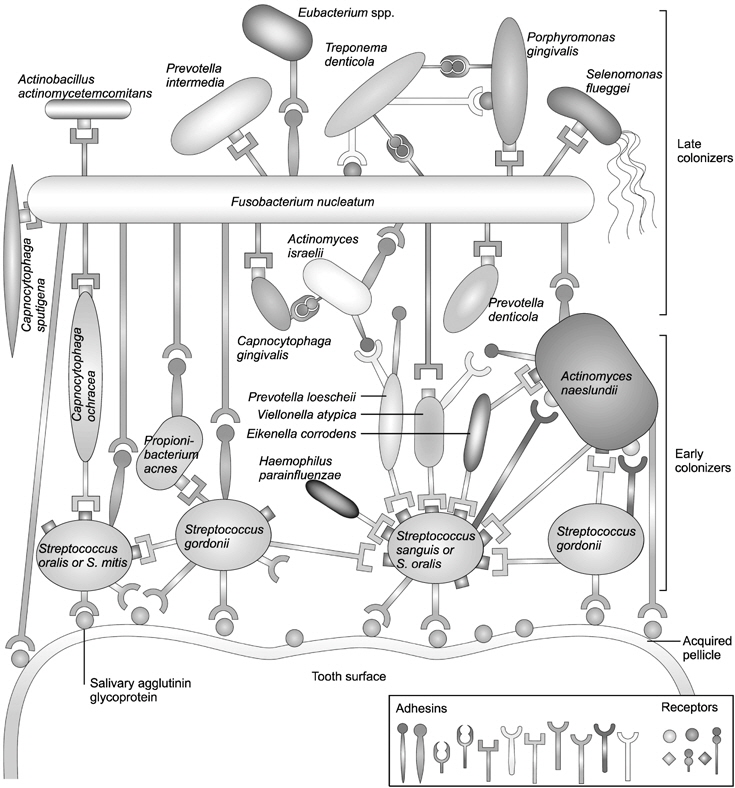
자연계에 존재하는 대부분의 표면은 액체성 물질과 닿는 순간 세균성 바이오필름(microbial biofilm)을 형성하기 시작한다. 바이오필름은 단단한 표면 위에 다양한 종류의 미생물들이 축적된 복합체이다2). 세균 부착과 관련된 바이오필름 내의 생리학적 및 생화학적 상호 작용은 구강 내에서 치면세균막이 형성되는 과정 중에도 재현된다. 치면세균막은 수백여 종의 미생물이 구강 내 표면 위에 부착하면서 지속적으로 상호작용을 하고, 숙주 및 외부 환경에 따라 끊임없이 변화하며 구강 건강에 영향을 미친다(Fig. 2)3).
바이오필름을 형성한 세균 집단은 부유성 세균(planktonic cell)에 비해 영양분의 고갈, 산성도의 변화, 삼투압의 증감, 온도의 변화, 독성물질의 노출 등 여러 환경적인 스트레스에 대한 저항성이 현저히 증가된다고 알려져 있다4,5). 따라서 환경 조건의 변화에 따른 바이오필름의 성격 변화는 질병 발생 요인에 결정적 역할을 할 것으로 추론되었다. 최근 선행 연구는 바이오필름의 특성을 고려한 미생물 생태계의 총체적인 변화를 기반으로 하는 우식 생태학적 가설 (extended caries ecological hypothesis)을 활용하여 치아우식증의 발생 기전을 재조명하고 있다6). 그러므로 본 연구에서는 치면세균막이 바이오필름으로서 가지는 특성에 대해 알아보고, 치아우식증을 유발하는 균주에 대한 변화된 관점을 생태학적으로 이해하고자 한다.
구강뿐만 아니라 인체 내의 모든 점막 표면에는 광범위하게 미생물들이 정착하고 있다. 그럼에도 불구하고 우리 인간의 건강은 정상적으로 유지된다. 이것은 인체와 정착 미생물이 서로 양생(amphibiosis)하기에 나타날 수 있는 결과이다7). 구강 내 환경을 예로 들어보면, 인간은 지속적으로 분비하는 타액과 섭취하는 음식을 통하여 미생물이 생장하는데 필요한 당분과 아미노산 등의 영양분을 제공하고 구강내 정착 미생물은 병인으로 작용할 수 있는 해로운 미생물이 인체 내로 침입하는 것을 방어하는 보호작용을 한다. 이러한 양생관계가 잘 유지되기 위해서는 생태계의 균형 관계(equilibrium)가 매우 중요하다. 구강 내에는 약 700 여종의 미생물이 존재하는데, 이것들은 구강 내의 서로 다른 미세환경(micro-environments) 내에서 복잡 다양한 환경 조건에 적응하며 서식하고 있다. 사람은 항상 식사를 하고 치아를 닦는 등 일상적인 행동패턴으로 구강 미생물에게 간헐적인 스트레스를 가하지만, 구강 내에 서식하는 미생물의 종류나 그 구성 비율은 항상 일정하게 유지되려고 하는 항상성(homeostasis)을 지닌다. 이러한 미생물 생태계의 항상성은 인체의 면역시스템이 정상적으로 가동되면서 미생물 집단에 과도한 스트레스 요인만 제공하지 않는다면 구강 상태를 건강하게 유지하면서 지속될 수 있다.
치아우식증은 앞서 설명하였듯이, 미생물계의 항상성이 파괴되었을 때 나타날 수 있는 대표적인 구강질환이다. 잦은 발효성 탄수화물 섭취와 더불어 적절한 구강 관리가 수행되지 못하고, 여기에 타액 분비량까지 감소된다면 구강내 산도(pH)는 낮아질 수 밖에 없다. 이러한 환경에 처하게 되면 치면의 탈회가 시작되고 가속화되어 결국은 치아우식증의 임상적 증상이 나타나기 시작한다.
수많은 선행연구들은
일반적으로 세균은 자연환경에서 고립된 세포로 존재하는 것이 아니라, 유기적으로 조직된 공동체(community)를 형성하며 성장한다. 고체 또는 공기와 액체 간의 계면에서 형성되는 이러한 미생물 공동체를 우리는 바이오필름(biofilm)이라고 부른다. 바이오필름의 가장 큰 특징은 생물 고분자 물질의 이동 및 확산을 가능하게 하는 개방형 구조를 유지하며 공동체를 이루는 것인데, 각 개체 간에 매우 상이한 대사조건을 필요로 하는 세균들이 이 공동체 안에서 미세 환경을 구축하며 상호 공존한다22). 이와 더불어 바이오필름은 부유성 세균에 비해 외부 환경 변화에 대한 방어력이 월등히 우수하고 항생물질(antimicrobials)에 대한 내성 또한 뛰어나다22).
구강 바이오필름 즉, 치면세균막의 형성 과정은 발달 주기로 설명할 수 있다(Fig. 3)23). 발달주기의 각 단계는 물리적, 생물학적 및 환경적인 요소에 의해 좌우된다. 가장 첫 단계는 타액에서 유래된 당단백질(glycoprotein)에 의해 1 μm 미만의 무세포성 막인 획득 피막(acquired pellicle)이 치면에 형성되는 것이다. 이러한 조건이 갖추어지면 구강 내 미생물들의 초기 부착이 시작된다. 이후 지속적으로 새로운 세균들이 부착하고 상호응집하면서 연결 막(linking film)을 형성하고, 동시에 초기 집락체 내의 세균은 표현형에 변화를 일으키며 바이오필름 내부 환경에 적응하게 된다. 이 연결 막 위로 새로운 세균들이 상호부착하게 되고, 계속해서 다른 종의 세균들이 상호응집하면서 후기 집락체가 형성되기 시작한다. 이러한 증식 과정은 일정한 미생물 구성을 갖는 세균의 공동체가 형성되는 가장 기본적인 원리이다. 하나의 공동체를 형성하는 세균 종들은 서로 간에 분자신호를 주고 받으며 그 안에서 상호 경쟁하거나 협력하는데, 이러한 과정(정족수 감지, quorum sensing)을 통해 영양소를 확산시키고, 최종 대사 산물인 노폐물을 용이하게 제거할 수 있도록 적정 표면적ㆍ부피 비율을 유지하며 자신들의 생태계를 유지한다22). 이렇게 형성된 구강 바이오필름은 세포외기질(extracellular matrix)을 형성하여 외부 환경 변화에 대한 물리적ㆍ전기적 보호막 작용을 증진시킨다22). 따라서 부유성 세균과 비교했을 때, 치약이나 구강 양치액에 함유되어 있는 항생물질에 대한 내성이 바이오필름에서 증가하는 것이다. 구강 영역에 이용하는 대표적인 물질인 클로르헥시딘(chlorhexidine digluconate)에 대해서는 300배, 불화아민(amine fluoride)에 대하여는 75배의 저항성을 보인다22).
4. 치아우식증 유발 균주에 대한 이해의 변화: 우식 생태학적 가설
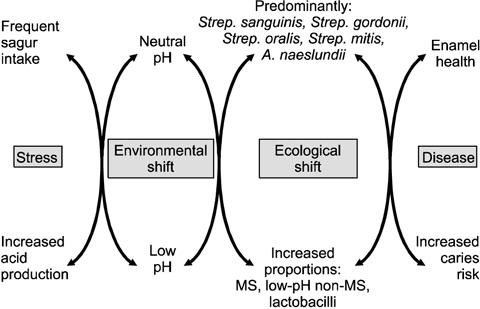
구강 질환은 세포 혹은 분자 수준에서 숙주와 미생물 간균형이 깨질 때 발생한다. 이러한 과정에는 미생물학적인 영향뿐만 아니라 생화학적이고 생태학적인 영향 요인들까지 관여한다. 따라서 최근 10여 년 간에 걸친 미생물군(microbiome)에 대한 혁신적인 연구 성과에 힘입어, 우식학자들은 치아우식증의 원인을 이러한 총체적인 관점에서 규명하기 위해 우식 생태학적 가설(extended caries ecological hypothesis)에 주목하기 시작했다(Fig. 4)6,24). 이 가설은 바이오필름 내의 생태계의 변화, 즉 구성 미생물들의 상대적 비율 변화가 치아우식증 발생의 신호가 될 수 있다는 것을 시사한다. 즉, 치면세균막 내의 세균이 나타내는 표현형(phenotype)과 유전자형(genotype)이 변화됨에 따라 치아우식병소의 진행 단계가 설명될 수 있는 것이다.
1) 동적 안정상태(dynamic stability stage)
발효성 탄수화물을 섭취하면 구강 내 미생물은 발효성 대사 과정을 거쳐 구강 내 pH를 떨어뜨린다. 그러나 탄수화물의 섭취 횟수가 빈번하지 않고 보통의 수준이라면 치면세균막 내의 항상성은 파괴되지 않는다. 따라서 구강 내 치면에서 무기질의 동적 평형상태는 안정적으로 유지될 수 있다. 이 때, 치면세균막 내의 미생물은 주로 non-MS나
2) 산생성 상태(acidogenic stage)
구강 내에 당이 더 자주 공급되거나 타액 분비가 원활하지 않으면, non-MS나
3) 내산성 상태(aciduric stage)
구강 내 환경이 점점 산성화되면 낮은 pH 상태에서도 견딜 수 있는 극소수의 non-MS나
이를 종합해 보면, 잦은 음식물 섭취, 타액 분비율의 저하, 국소적 자극 및 면역력 저하 등에 의해 구강 바이오필름의 생태계에 스트레스를 가하게 되면 결국은 이들 생태계 환경에 변화를 야기하게 되고, 세균들이 이 환경에 적응하기 위해 표현형 및 유전자형에 변화를 일으킴으로써 최종적으로 치면의 무기질이 소실되면서 치아우식증이 발병될 수 밖에 없다(Fig. 5)7,25,26).
아무리 치아를 깨끗이 닦는다 하더라도, 수 초 내에 치면에는 다시 치면세균막이 형성된다. 따라서 환자의 구강 건강을 최상으로 유지하기 위해서는 치면세균막의 생태 환경을 안정시키고, 치면세균막 내의 세균이 사람에게 이로운 영향을 미치는 균종으로 구성될 수 있도록 관리하여야 한다. 이렇게 치면세균막이 잘 관리된다면 초기 상태의 치아우식증은 특별한 치료 없이도 회복될 수 있다. 이러한 구강건강관리가 가능하기 위해서는 치아우식증의 발병에 영향을 미치는 요소를 일정 세균에만 한정시키지 말고, 환자와 미생물 간의 양생관계를 저해하는 통합적인 요인들에 관심을 가져야만 한다. 불소나 자일리톨을 이용하여 치면세균막내 pH가 산성화되는 것을 막고, 식이상담을 통해 당의 섭취횟수나 식이의 질을 조절하고, 타액이 잘 분비될 수 있도록 관리한다면, 환자의 구강환경은 건강한 상태를 유지할 수 있을 것이다. 또한 더 나아가 치면세균막을 구성하는 미생물 공동체 내의 신호 체계 기작과 주요 세균 간의 상호관계 등을 이해함으로써 세균 간의 응집이나 부착을 컨트롤할 수 있는 유효한 생화학적 제어 방법을 찾을 수 있다면, 치면세균막이 침착되는 것을 사전 차단함으로써 구강질환을 예방할 수 있을 것이다. 따라서 우리는 치면세균막을 바이오필름이 가지는 특징과 견주어 이해할 필요가 있으며, 이와 더불어 치아우식증 유발의 원인을 치면세균막의 생태학적 관점으로 접근함으로써 치아우식증의 관리 방법에 대한 새로운 지침을 마련할 수 있을 것으로 사료된다.