The aim of this study was to examine the effect of polycan-calcium gluconate complex on the levels of immune and inflammatory mediators in gingival crevicular fluid and serum from patients with periodontitis. A total of 39 patients with periodontitis took placebo (placebo group) or polycan-calcium gluconate complex (treatment group) twice a day for 4 weeks. At baseline and 4 weeks, gingival crevicular fluid (GCF) and blood was collected from each subjects. The secretion level of interleukin IL-1β in GCF was measured by enzyme-linked immunosorbent assay (ELISA). Western blot analysis was conducted to determine the expression of matrix metalloproteinase (MMP)-8 and tumor necrosis factor TNF-α in GCF. Serum samples were analysed for MMP-8 by ELISA and C-reactive protein (CRP) by turbidimetric immuno assay. MMP-8 and TNF-α were significantly decreased in the treatment group at 4 weeks. The level of IL-1β in the treatment group was significantly lower than those of the placebo group. No differences were observed in CRP levels. Taken together, these data indicate that taking of polycan-calcium gluconate complex led to reduction of inflammatory biomarkers in serum and GCF of periodontitis patients.
치주질환은 치면세균막 내 세균에 의해 치아지지조직에 발생하는 염증성 병변으로, 과도하게 성장한 세균에 의해 방어기전이 파괴되고 세균과 숙주 방어반응 사이의 균형이 깨짐으로 인해 발생한다1-3). 이와 같은 과정에는 interleukin (IL)-1β, IL-6, IL-8, tumour necrosis factor (TNF)-α와 같은 염증성 사이토카인(cytokines)과 단백질분해효소인 matrix metalloproteinases (MMPs)가 관여한다4,5). 특히 IL-1β는 섬유모세포를 자극하여 중요한 염증 유발인자인 prostaglandin E2의 생성을 증가시키고 여러 종류의 세포 활성을 통해 MMPs의 방출을 유발하여 염증반응을 증대시키는 것으로 알려져 있다. 뿐만 아니라 파골세포(osteoclast)의 형성을 촉진함으로써 결합조직의 부착과 지지골의 소실을 초래하여 결국 치아상실에 이르게 한다6,7). MMP 역시 치주조직의 주요 구성물질인 Type I collagen을 분해함으로써 치주조직을 파괴하는 주요 물질로 여겨진다. 그중에서도 MMP-8은 만성치주질환자의 치은열구액 내에 존재하는 콜라겐 분해효소의 80%를 차지한다고 보고되고 있어 IL-1β와 더불어 치주조직 파괴의 주요 마커로 인식되고 있다8,9). 최근에는 치주질환이 심혈관질환의 위험인자인 혈장 속의 C-reactive protein (CRP)와 관련이 있다는 연구들도 증가하고 있다. Sanders 등10)과 Fitzsimmons 등11)은 치주염 환자들의 치은열구액과 타액 속에서 CRP가 확인되었다고 하였고, Paraskevas 등12)은 systemic review을 통해, 치주질환을 가지고 있는 환자의 혈청 내 CRP 수치가 치주질환이 없는 환자의 CRP 수치보다 높다는 것을 확인하였다.
따라서 이들 염증물질들의 감소를 통한 치주질환 치료제 개발의 필요성이 강조되고 있으며, 최근에는 천연추출물에 대한 관심도가 높아지면서 이들 물질을 이용한 치주질환 예방 및 치료제 개발이 활발히 진행되고 있다. 현재 상품화되어 시판되고 있는 대표적인 생약제제의 하나인 옥수수 추출물은 치조골 흡수 및 치주인대 파괴 예방, 치아동요도 감소, 치주낭 깊이 감소 등을 통해 치주질환과 치은염, 유년형 치주염을 완화시키는 데 효능이 있다고 알려져 있으나13,14), 과학적 근거가 빈약하고 임상적 효과도 충분하지 않아 전문적인 처방은 미비한 실정이다. 이러한 현실을 반영할 때 새로운 천연추출물을 이용한 치주질환 개선제의 개발과 함께 생약제제에 관한 보다 과학적이고 체계적인 접근과 분석이 요구된다.
현재 각광을 받고 있는 천연추출물 중 β-glucan은 내성이 없는 면역조절제와 항암 및 항산화에 대한 생리활성 효과를 바탕으로 다양한 분야에서 활용되고 있다15-17). 특히 흑효모 Aureobasidium pullulans SM-2001에서 유래한 정제된 β-glucan인 polycan의 경우18), 항염증 작용과 함께 골소실을 억제하고 골생성을 촉진하는 능력을 가진다는 것이 입증되었고19,20), 10일간 polycan을 투여한 쥐에서 농도 의존적으로 치조골 소실이 억제되고 치주염이 개선된다고 발표되었다21). 또한 calcium gluconate는 항산화 효과를 통해 치조골 소실을 억제하고22), IL-6와 TNF-α와 같은 염증성 사이토카인을 감소시키며23), 비스테로이드 항염증제(non- steroidal anti-inflammatory drugs)의 항염증활성을 증가시키는 효과가 있다고 보고되었다24).
이에 본 연구에서는 흑효모균으로부터 분리한 polycan에 항염증활성 효과를 가지는 calcium gluconate를 첨가한 복합제제를 인체에 적용하여 치주질환과 관련된 염증물질들에 미치는 영향을 평가하고자 한다.
본 연구는 2012년 8월부터 2013년 6월까지 치주염 치료 및 예방용 건강기능성 식품의 개발 연구(IRB No. KNUH 201207023- 001)에 자발적으로 참여한 치주질환자 41명을 대상으로 하였다. 연구 초기 만 40세 이상 성인 남녀 95명을 모집하였으며, 이들을 대상으로 구강검사와 설문조사를 실시하여 심혈관계 질환자, 치조골재생술 또는 치은박리술을 시행해야 할 정도의 중증 치주질환자, 3개월 이내 치주질환 치료자를 제외하고, 치주낭 탐침 깊이가 4 mm 이상인 부위가 1개 치아에 존재하거나 임상적 부착치은 소실이 2 mm 이상인 부위가 1개라도 있다고 진단된 48명을 대상자로 선정하였다. 대상자는 각각 대조군 26명과 시험군 22명으로 무작위 배정되었으며, 연구진행 과정 중 동의 철회로 총 7명(대조군 5명, 시험군 2명), 이상값을 가지는 대조군 2명이 탈락되어, 39명의 피험자(대조군 19명, 시험군 20명)의 데이터가 분석에 사용되었다. 모든 대상자에게는 매 방문시 구강위생교육을 실시하였으며, 구강용품과 소정의 인센티브를 제공하였다.
1) 구강검사
첫 방문 시 치주질환 여부를 파악하기 위하여, 조사원칙에 대한 훈련과정을 거친 치과의사 1인이 치주낭 탐침깊이와 임상적 부착 치은소실을 측정하였다. 치주낭 탐침깊이는 치주낭 탐침소자(WHO probe)를 이용하여 각각의 대상치아에서 협측과 설측의 근원심면, 중앙면의 6부위를 조직의 저항력이 느껴질 정도까지 근단방향으로 삽입한 후, 치은변연부부터 치주낭 기저부까지의 깊이를 1.0 mm 단위로 측정하였으며, 임상적 부착수준은 치은퇴축 양의 측정치와 측정된 치주낭 탐침깊이를 합산하여 측정하였다.
2) 시험제품 투여
시험제품은 베타글루칸 16 mg, 글루콘산칼슘 768 mg을 함유한 2 g의 흰색 원형 츄어블 정으로 구성되었으며, (주)아리바이오(Aribio, Seoul, Korea)로부터 제작 및 지원을 받았다. 플라시보 제품은 시험 제품과 성상 및 맛이 동일하도록 제작되었으며, 각 대상자에게 4주간 1일 2회, 1회당 1정을 식사 후에 씹어서 복용하도록 하고, 1주 간격으로 방문이 이루어지도록 하였다. 대상자는 매일 치주질환의 증상에 대해 피험자 일지를 작성하도록 하였으며, 방문 검진 시 피험자 일지를 가져오도록 하여 면접자가 순응도와 이상반응을 관찰하였다. 순응도 확인은 배부한 피험자 일지에 매일 2회 복용여부를 체크하도록 하고, 매주 방문 시 면접자가 복용여부를 재차 확인하는 방법으로 수행하였다.
3) 치은열구액 채취 및 IL-1β 분석
각 환자의 구취부에 타액으로 인한 오염을 방지하기 위하여 cotton roll로 방습한 후 미약한 저항감이 느껴질 때까지 micro pipette tip을 치은열구액 내로 삽입하여 치은열구액을 채취하였다. 채취한 치은열구액은 0.5 ml eppendorf tube에 모아 4℃ 상태로 실험실로 옮겨졌으며, 분석에 사용되기 전까지 -70℃에 보관하였다. 각 환자의 치은열구액 샘플에 saline 60
4) Western blot을 통한 MMP-8, TNF-α 분석
대조군 및 실험군에서 무작위로 5명을 선택하여 western blot을 시행하였으며, 이 중 대표적인 발현양상을 나타내는 결과를 선택하여 제시하였다. 각 sample은 Bio-Rad Bradford Protein Assay kit (Bio-Rad Laboratories, Hercules, CA, USA)을 이용하여 단백질을 정량하였으며, 6× sample loading buffer (0.125 M Tris-Cl; pH 6.8, 20% glycerol, 4% sodium dodecyl sulfate [SDS], 10% 2-mercaptoethanol, 0.2% bromophenol blue)를 섞어 100℃에서 10분간 denaturation시킨 후 12% SDS-PAGE mini acrylamide gel에서 전기영동하였다. Gel상의 단백질은 transfer buffer (25 mM Tris, 192 mM glycine, 20% methanol) 내에서 nitrocellulose membrane (Schleicher & Schuell Bio-Science, Dassel, Germany)으로 이동시키고 membrane은 blocking solution (5% skim milk, 0.1% Tween-20 in phosphate buffered saline)에서 1시간 동안 blocking하였다. MMP-8 (Abcam Inc., Boston, MA, USA), TNF-α (Novus Biologicals, Marlborough, MA, USA) 항체를 결합시킨 후, 2차 항체로 anti rabbit immunoglobulin G-horseradish peroxidase (IgG-HRP)-linked antibody (Amersham Pharmacia Biotech, Winchester, MA, USA)를 반응시키고, Pierce ECL Plus Western Blotting Substrate (Thermo Scientific, Tewksbury, MA, USA)와 Chemi-Doc (Vilber Lourmat, Torcy, France)을 이용하여 단백질 발현을 관찰하였다.
5) 혈액 채취 및 MMP-8과 CRP 분석
각 대상자로부터 6 ml의 혈액을 채취하였으며, 3,000 rpm에서 10분간 원심 분리 후 eppendorf tube에 상층액 500
수집된 자료는 IBM SPSS Statistics ver. 19.0 for Window (IBM Co., Armonk, NY, USA)를 이용하여 분석하였으며, 통계적 유의성 판정을 위한 유의수준은 5%로 설정하였다. Mann-Whitney 검정법과 Wilcoxon’s signed rank test를 이용하여 시험 제품 투여 전과 투여 후의 염증지표 변화량 및 그룹 간 차이를 검정하였다.
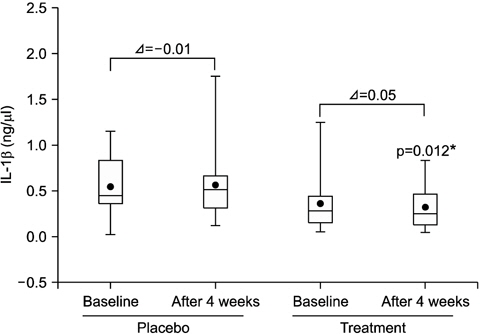
대조군의 경우 초기와 4주째 치은열구액 내 IL-1β의 양에 유의한 차이가 없었으며(p>0.05), 시험군은 초기에 비해 4주째 IL-1β가 감소하는 경향을 보였으나, 감소 정도는 통계적으로 유의한 차이가 없었다(p>0.05). 또한 각 시점에서 두 그룹을 비교하였을 때, 초기에는 유의한 차이가 없었으나(p>0.05), 4주째에는 대조군에 비해 시험군이 유의하게 낮았다(p<0.05). 초기와 4주째 IL-1β level의 변화 정도는 두 그룹 간에 유의한 차이가 없었다(p>0.05; Fig. 1).
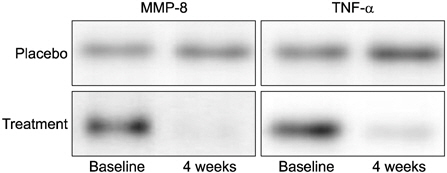
Western blot을 사용하여 치은열구액 내 MMP-8과 TNF-α의 발현 양상을 살펴본 결과 역시, 대조군에서는 IL-1β와 마찬가지로 초기와 4주째 MMP-8과 TNF-α에 별다른 차이를 보이지 않았으나, 시험군에서는 4주째 MMP-8과 TNF-α가 초기에 비해 뚜렷하게 감소하였다(Fig. 2).
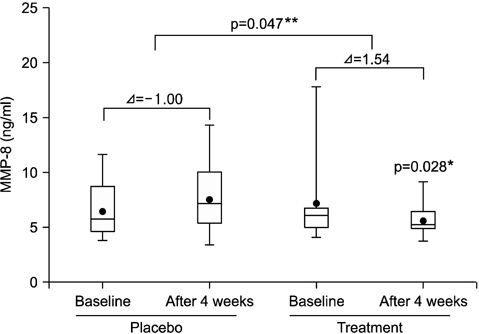
혈액 내 MMP-8의 경우 대조군과 시험군 모두 시점에 따른 유의한 차이는 없었으나(p>0.05), 각 시점에서 두 그룹을 비교하였을 때 초기에는 유의한 차이가 없는 반면 4주째에는 대조군에 비해 시험군이 유의하게 낮았다(p<0.05). 각 그룹에서 초기와 4주째 MMP-8 level의 변화정도를 비교한 결과, 대조군은 초기에 비해 1.00 ng/ml 증가한 반면 시험군은 1.54 ng/ml 감소하였으며, 증감정도는 두 그룹 간 유의한 차이를 보였다(p<0.05; Fig. 3).
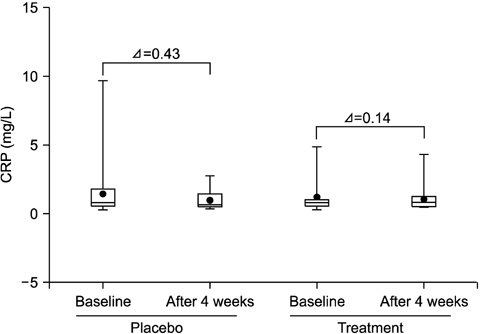
혈액 내 CRP의 경우에는 두 그룹 모두 시점별, 그룹별 유의한 차이가 없었다(p>0.05; Fig. 4).
기존의 치주질환의 진단은 전적으로 임상지표들의 평가와 방사선학적 결과에 의존해왔다25). 그러나 최근 많은 연구들을 통해서 치주질환자들의 치은열구액 내에 염증물질과 면역물질들이 증가되어 있다는 사실이 밝혀지면서 치은열구액 내의 염증지표들의 변화를 진단에 활용하고 있으며, 치료 효과를 평가하는 데까지 그 활용 범위를 넓혀가고 있다26). Konopka 등27)은 치면세마와 치근활택술 이후 치료효과를 평가하기 위하여 치은열구액 내 IL-1β와 MMP-8의 level을 평가함으로써 이들 물질이 상당히 감소한다는 것을 확인하였고, Marcaccini 등28)도 MMP-8, MMP-9, tissue inhibitor of MMP (TIMP)-2와 같은 염증지표들을 모니터링함으로써 치주치료 이후 그 양이 감소함을 보고하였다. 본 연구에서도 polycan 및 calcium gluconate 복합제제를 한 달간 복용한 군에서 치은열구액 내 MMP-8과 TNF-α가 현저하게 감소함을 확인하였다. 또한 치은열구액 내 IL-1β의 양이 초기에 비해 유의하게 감소하지는 않았지만, 복합제제 복용이후 대조군과 비교하였을 때 유의한 차이를 보였다. 따라서 polycan 및 calcium gluconate 복합제제가 염증물질의 감소를 통해 치은 건강 개선 효과를 나타내는 것으로 판단되며, polycan 및 calcium gluconate 복합제제의 직접적인 치은건강 개선 효과는 이전 연구에서 치주낭 깊이 및 치면세균막이 감소한다는 사실을 통해 확인한 바 있다29). 이는 치주치료 이후 MMP-8이 치주낭 깊이 및 치은출혈 감소와 유의한 상관관계를 가진다고 보고한 Konopka 등27)의 결과와도 일치한다.
하지만 치은열구액 내 IL-1β의 경우 대조군과는 유의한 차이를 보였지만 초기에 비해서는 뚜렷한 감소를 보이지 않았는데, 이는 polycan과 calcium gluconate 복합체가 의약품보다는 건강기능성 식품으로서의 성격을 가지고 있기 때문에 복용기간인 1달 이내에 뚜렷한 효과를 관찰하기에는 다소 무리가 있었기 때문이라 생각된다. 또한 염증성 사이토카인의 양은 치주조직의 파괴정도 및 치주질환의 심도와 밀접한 연관성을 가지므로 중증의 치주질환자에게서는 뚜렷한 효과를 나타낼 수 없었던 것으로 보인다.
본 연구에서 사용한 polycan과 calcium gluconate 복합제는 치면세마, 치근활택술과 같은 기존의 치료법과는 달리 치주에 직접적인 처치를 하는 것이 아니라 씹어서 복용하는 방식이다. 따라서 단순히 치은열구액 내의 변화 이외에 전신에 상당한 영향을 미칠 것으로 예상할 수 있으며, 혈청이 치은열구액의 기원이라는 것을 감안할 때 혈청 내 변화가 치은열구액에도 반영되었으리라 예측할 수 있다. 이와 같은 사실을 직접 확인하기 위하여 혈액 내 MMP-8과 CRP 양의 변화를 측정한 결과, MMP-8의 경우 치은열구액 결과와 마찬가지로 시험군에서 뚜렷한 감소를 보였으며, 대조군과도 유의한 차이를 보였다. 이는 polycan과 calcium gluconate 복합제가 전신적인 염증인자들의 감소를 통하여 치은열구액 내의 염증인자들도 감소시키고, 결과적으로 치은건강개선에 도움을 주는 것으로 생각된다. 그러나 혈액 내 CRP의 경우에는 MMP-8과는 다르게 4주 이후에도 특별한 변화가 관찰되지 않았는데, 본 연구대상자들의 치주상태가 급성염증보다는 만성염증 상태인 것을 고려할 때 polycan과 calcium gluconate가 급성염증지표인 CRP에는 큰 효과를 미치지 못한 것으로 판단된다.
이상과 같이 본 연구는 치주질환이 조직파괴가 수반되는 만성질환임을 고려할 때, 약제만으로 조직재생을 기대하기는 어려움에도 불구하고 polycan 및 calcium gluconate의 복용을 통해 치주조직의 미세한 염증과 관련된 일부 생체지표의 긍정적인 변화를 관찰할 수 있었으며, 이를 확인하는 과정에 있어서 기존의 방법과는 구별되는 치은열구액과 혈청 내의 염증변화를 활용하였다. Hwang 등30)이 언급한 바와 같이 지역사회치주지수(community periodontal index)와 같은 임상지표들은 검사자의 주관이 개입될 수 있는 지표이므로 오히려 치은열구액 내 염증지표들의 농도가 보다 객관적인 지표일 가능성이 있기 때문이다. 이를 검증하기 위해서는 염증지표와 임상지표 변화의 직접적인 관련성에 대한 추가 분석이 필요할 것으로 사료된다.
이 연구의 제한점으로는 치은열구액 양의 변화를 평가하지 못하였다는 점을 들 수 있다. 치은열구액은 혈청에서 유래된 삼출물로 치주질환자의 경우 정상인에 비해 많은 양을 가지고 있지만31), 치주치료 이후에는 다시 감소하는 것으로 알려져 있어 염증지표들과 함께 치주질환을 진단하는 마커로 인식된다. 하지만 워낙 소량이라 양을 측정하기 어렵고, 채취 시 손실량도 상당해 직접적인 양을 측정하지 못하였으며, 이로 인해 대상자들마다 채취한 치은열구액의 양이 동일하지 않았고 실험을 위해 이를 희석하는 과정에서 다소 오류가 있었을 가능성이 있다. 또한 대상자들의 순응도와 전신상태를 체크하고 결과에 영향을 미칠 수 있는 요소들을 통제하기 위해 노력하였으나 연구의 특성상 이를 완벽하게 통제하고 제어할 수는 없었다. 특히 복용 시 가능하면 입안에 오랜 시간 머무르도록 3∼5분 간 녹여 먹도록 지시했음에도 불구하고 씹어먹거나 물로 삼켜서 복용하는 등 복용방법의 통제가 어려웠다. 향후 연구에서는 이러한 제한점을 보완하고 염증지표와 임상지표 변화의 직접적인 관련성에 대한 분석을 함께 진행한다면 polycan과 calcium gluconate 복합체를 치주질환의 고전적인 치료방법인 기계적인 치료방법에 보조적으로 사용할 수 있는 근거를 마련할 수 있으리라 생각된다.
본 연구에서는 체내 염증지표 변화를 모니터링 함으로써 새로운 천연추출물인 polycan 및 calcium gluconate 복합제제의 치주질환 개선 효과를 평가하고자 하였으며, 다음과 같은 결론을 얻었다.
1. 치은열구액 내 IL-1β는 대조군과 시험군 모두 시간에 따른 유의한 차이는 없었으나(p>0.05), 4주째 시험군이 대조군보다 낮았다(p<0.05).
2. 치은열구액 내 MMP-8과 TNF-α는 4주째 시험군에서 초기에 비해 감소하였으며, 시험군이 대조군보다 낮았다.
3. 혈액 내 MMP-8은 4주째 시험군에서 유의하게 감소하였고(p<0.05), 대조군에 비해 통계적으로 유의하게 낮았다(p<0.05). 그러나 혈액 내 CRP는 유의한 변화가 관찰되지 않았다(p>0.05).
이상의 결과들을 종합해 보았을 때, polycan을 함유한 calcium gluconate 복합제 복용이 전신적인 염증성 생체지표에 영향을 미쳐 치은열구액 내의 염증매개물질들을 감소시킴으로써 치은건강에 긍정적인 효과를 나타내는 것으로 사료된다.