In this study, the
Therefore, we suggest that AIE samples and SRE samples used in this study may have no genotoxicity in the
최근 농산물에 살포된 농약의 작물체내 잔류성으로 인해 인체 노출에 대한 우려가 커지고 친환경농산물 생산을 위한 유기농업자재의 사용이 늘어나고 있다(Woo
우리나라에 공시 및 품질인증 되는 충해방제용 유기농업자재는 평가 단계에서 인체에 대한 안전성을 확인하고자 급성독성 및 자극성시험 결과를 확인하고 있다(농촌진흥청 고시 제2013-13호). 그러나 이는 최종 유기농업자재 제품에만 제한되어 평가되는 것으로, 실제 원제로 사용되고 있는 식물성 추출물에 대한 안전성은 식물원료의 추출부위 및 추출용매 등으로 확인되고 있을 뿐 인체에 미치는 장기적인 영향에 대한 연구 및 평가는 미비한 실정이다(Wang
한편, 유전독성시험은 특정 화학물질 노출이 DNA, 유전자 혹은 염색체 수준에서 유전적 손상을 유발하는지를 평가하는 방법으로, 보다 장기적인 독성인 발암성을 모니터링 하는데 유효한 방법으로 알려져 있다(OECD, 2012). 그 중 소핵시험은 염색체의 구조적 이상과 수적이상까지 검출해낼 수 있다는 점에서 다른 유전독성 시험법에 비해 상대적으로 더 넓은 범위의 유전독성을 검출할 수 있다는 장점이 있다(Corvi
최근 동물대체시험이 활성화되고 국제적인 시험법으로 인정받으면서, 기존의
본 연구에서는 국내 유통되고 있는 님추출물과 고삼추출물 시료 각 2종에 대해서 CHL(Chinese Hamster Lung)cell을 이용하여 vitMN 시험을 수행함으로써 우리나라 유기농업자재의 원제로 활용도가 높은 식물성추출물에 대한 인체의 안전성을 확인하고자 하였다.
본 시험에서는 유기농업자재 제조를 위해 사용되는 님추출물과 고삼추출물 시료 각 2종을 구입하여 시료로 사용하였다. 님추출물 시료는 2종 모두 인도산으로 시료 A와 B의 총 azadirachtin 함량은 각각 0.03%와 0.35% 였으며, 고삼추출물 시료는 모두 중국산으로 시료 A와 B의 총 martine 함량은 각각 0.31%와 0.26% 였다. 시험물질은 사용기간 동안 빛이 통하지 않는 불투명한 용기에 담아 실온에서 보관하였으며, 사용직전 0.22 μL membrane filter로 여과하여 사용하였다.
사용 세포주는 CHL cell을 American Type Culture Collection(ATCC)로부터 구입해 사용하였다. 배양액은 10% Fetal Bovine Serum(Gibco)을 포함한 MEM(Minimum Essential Medium, Gibco)을 사용하였으며, 5% CO2, 37℃ 조건에서 2∼3일 간격으로 계대배양하여 사용하였다. 액틴의 polymerizationatin 저해제로 사용되는 cytochalasin B(cyto B)는 Sigma에서 구입하여 사용하였다. 양성 대조물질로는 염색체의 구조적 이상을 유발하는 mitomycin C(MMC, Sigma)와 수적 이상을 유발하는 colchicine(Sigma)을 사용하였다. 님추출물 시료는 난용성으로 물에 용해되지 않아 전체 농도가 3% 이내인 경우 유전독성이 없다고 보고된 acetone (Tedia)으로 물질을 용해하였기에(OECD SIDS, 1999), acetone을 음성대조군으로 사용하였으며, 고삼추출물은 멸균증류수를 음성대조군으로 하였다.
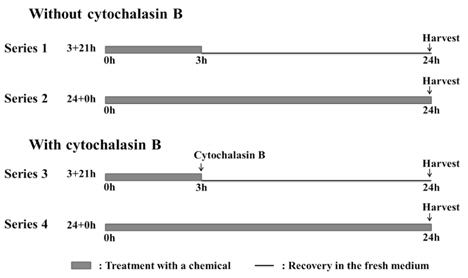
본시험의 물질 처리를 위한 최고농도를 선정하고자 예비시험을 시행하였다. 소핵을 가지는 세포가 최소한 1회 이상분열한 상태에서 계수되는 조건도 같이 확인하기 위해서 cyto B를 처리한 시험도 같이 진행하였다. Cyto B 적용군과 미적용군은 각각 RI(Replicative Index)와RPD(Relative Population Doubling)가 55±5% 인 농도를 본 시험의 최고 농도로 선정하고 공비 2로 하위 시험농도 2개로 총 3개의 농도를 시험농도로 선정하였다.
시험은 OECD TG 487의
시험방법으로 cyto B 미적용군은 1.0 x 105세포를, cyto B 적용군은 2.0 x 105 세포를 직경 60 mm plate에 파종하여 24시간 배양한 다음 시험물질을 처리하였다. Cyto B 적용군인 series 3과 4는 cytokinase-block method에 따라 cyto B(3 μg/ml)를 시험물질과 함께 첨가하였다.
시험물질 처리 개시로부터 24시간 후 세포를 수거하여 고정액(methanol:acetic acid, 3:1)으로 2회 고정시켰으며 최종적으로 1% acetic acid를 포함한 고정액으로 추가 고정한 후 공기 건조법으로 세포표본을 만들었다. 10% Giemsa(Fluka)염색액으로 염색 후 현미경(Nikon, Eclipse 80i, Japan)으로 1,000배에서 관찰하였다.
소핵의 판독은 Fenech 등(2003)이 제시한 기준에 따라 판정하였다. Cyto B 미적용군은 각 농도군당 2,000개의 단핵세포(mononucleated cell)로 부터 소핵을 가진 세포(micronucleated cell, MNC)를 계수하였다. Cyto B 적용군은 단핵세포(mononucleated cell), 이핵세포(binucleated cell), 다핵세포(multinucleated cell)의 합계가 500개가 될때까지 세포를 계수하였으며, 이핵세포가 1000개가 될때까 지 소핵을 계수하여 기록하였다. 결과 해석을 위해 cyto B 미 적용군은 RPD와 RICC(Relative Cell Count), RCC (Relative Increased Cell Count)를 이용하여, cyto B 적용군은 RI와 CBPI(Cytokinesis-Block Proliferation index)를 산출하여 평가하였다.
통계처리 및 판정은 SPSS(Statistical Package for the Social Sciences, version 18.0)를 이용하여 양성대조물질 검증을 위해서 Chi-square test를, 시험물질의 농도별 검증을 위해서 one-way ANOVA(Analysis of variance)를 실시하였으며, 유의수준 0.05에서 유의성을 검증하였다. 판정기준은 시험물질 처리군이 소핵 발생빈도가 용량상관성을 나타내면서 음성대조군에 비해 3배 이상의 소핵 형성과 통계적인 유의성을 보일 때 양성으로 판정하였다(Miller
님추출물과 고삼추출물 시료에 대해 예비시험을 통해 세포증식 억제를 cyto B 미적용군은 RPD 55±5% 유발농도를, cyto B 적용군은 RI 55±5% 농도를 본 시험의 최고농도로 선정하였다.
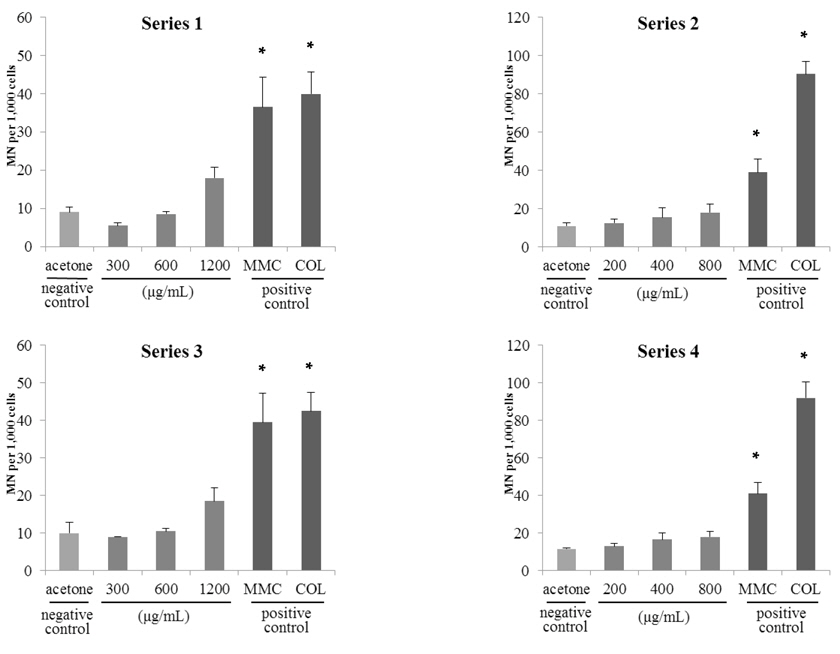
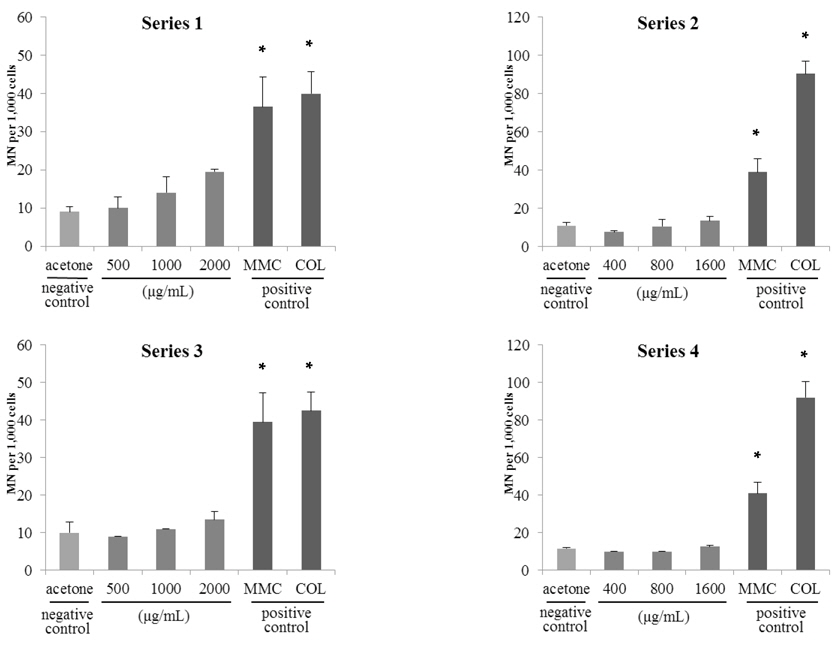
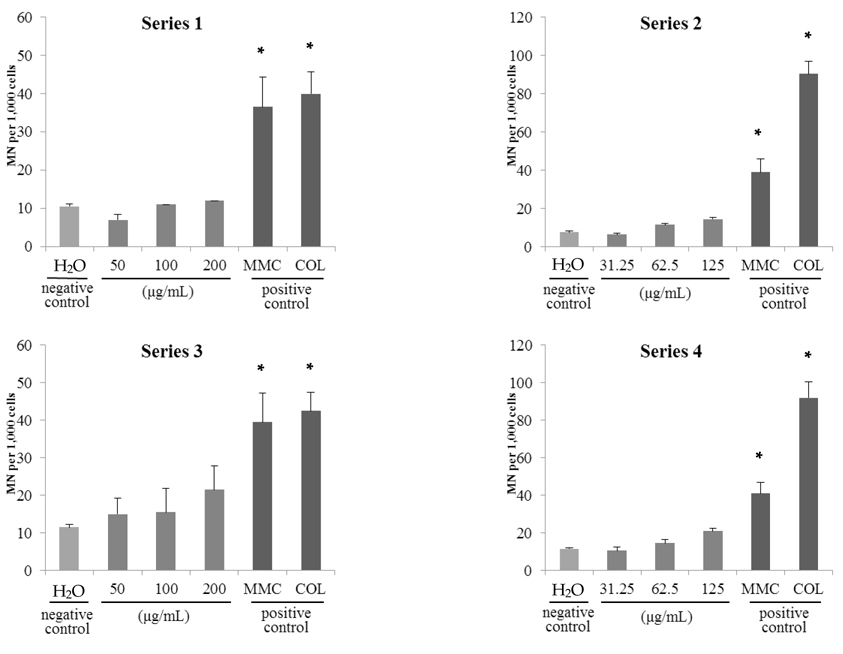
예비시험을 통해 Series1, 3과 Series 2, 4에서 님추출물은 시료 A에 대해 각각 1,200 μg/mL와 800 μg/mL, 시료B에 대해 2,000 μg/mL와 1,600 μg/mL 을, 고삼추출물은 시료 A에 대해 200 μg/mL와 125 μg/mL, 시료 B에 대해 250 μg/mL와 250 μg/mL 을 최고농도로 선정하였다.
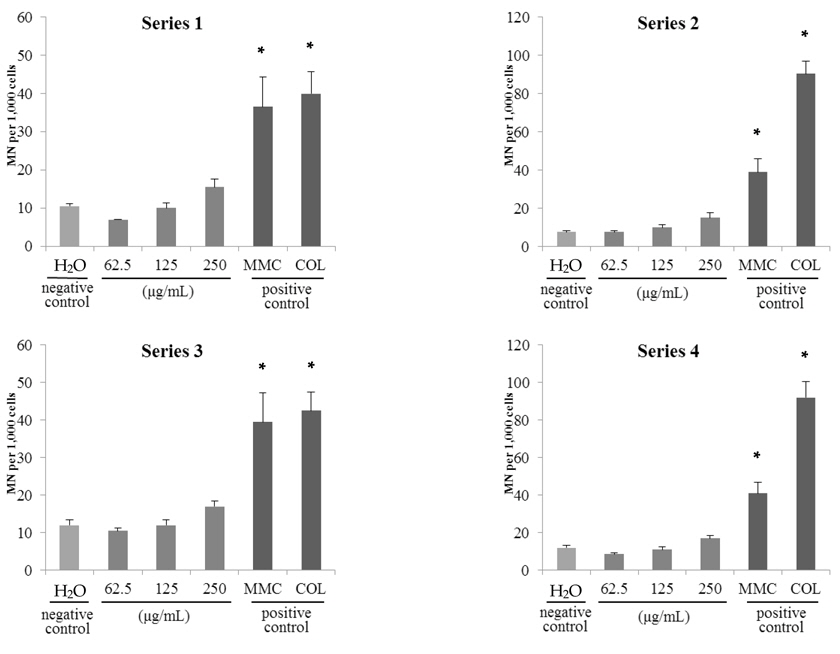
음성대조군으로 사용된 아세톤에 대해 4개의 Series로 시험한 결과 발생된 소핵은 최대 11.5±0.7개로 1,000개의 세포중에 1-2% 의 소핵발생 빈도를 보였다(Fig. 2.와 Fig.3.). 염색체의 구조이상을 유발하는 양성대조물질로 사용된 MMC와 염색체 숫적 이상을 유발하는 양성대조물질로 사용된colchicine 처리군은 36.5±7.8∼92.0±8.5개의 소핵을 유도하여, 음성대조물질로 사용된 아세톤 처리군에 비해 소핵 발생 빈도가 약 4-8배로 유의적인 증가를 보임에 따라
님추출물 시료 A의 시험결과는 Fig. 2.와 같이 물질처리 농도가 증가함에 따라 소핵발생이 증가하는 경향을 보였으나, 모든 처리군(200-1200 μg/mL)에서 전체 소핵발생율이 2% 미만으로 관찰되었다. Cyto B는 세포분열기에 시험물질에 의해 소핵이 형성됨을 알 수 있으나, cyto B에 의해 소핵이 유도될 수 있으므로 cyto B 처리군과 미처리군으로 구분하여 동시에 진행하였다. 그 결과, 본 시험에서는 cyto B 처리 유무에 따라 차이가 없는 것으로 나타났다. 님추출물 시료 B의 시험(Fig. 3.) 결과에서도 시료 A와 유사한 경향을 보였다. 또한, 시험에 사용된 님추출물 시료 2종 모두 소핵발생 빈도가 음성대조군과 비교할 때 2배 미만으로 나타남에 따라 모든 시료가 소핵형성을 유발시키지 않는 것으로 확인되었다. 따라서 vitMN 결과 님추출물 시료 2종 모두 음성으로 최종 판정하였다. EFSA(European Food Safety Authority)에서도 시판되고 있는 님추출물 시료 3종에 대한 유전독성평가에서
유전독성 시험 및 데이터 해석을 위한 지침인 International Conference on Harmonization(ICH)의 유전독성 battery system에 의하면, 2개의
음성대조물질로 사용된 증류수 처리군에 대해 4개의 Series로 시험한 결과 발생된 소핵의 수는 최대 12.0±1.4개로Wakata 등(2006)의 연구결과와 유사한 수준이었다. 양성대조물질로 사용된 MMC와 colchicine 처리군은 음성대조물질로 사용된 증류수 처리군과 비교하여 소핵 발생빈도가 약 4-8배로 유의적인 증가를 보였다(
고삼추출물 시료 2종의 시험결과, 시료 처리 농도에 따라 소핵발생 비율이 증가하는 경향을 보였으나 모든 시료 처리군에서 전체 발생률이 2.2% 미만이었으며 음성대조군 대비 3배 미만의 소핵이 관찰되었다(시료 A; Fig. 4., 시료 B; Fig. 5.). 이는 cyto B 처리 유무에 따른 차이가 없었다. 따라서, 본 연구에서 사용된 고삼추출물 시료 2종에 대한 vitMN 결과 음성으로 판정하였다. 이는 고삼추출물 분말 시료에 대해 ICR mouse를 이용한
본 연구에서 진행된 고삼추출물 2종은 선행연구를 통해 복귀돌연변이 시험결과 모두 음성으로 나타난 바 있다(Cho