For the oral acute toxicity test, Sprague-Dawley rats were gavaged with 2.0 g/Kg bw of AIE. The LD50 value was greater than 2.0 g/Kg bw for both male and female rats. For the subacute toxicity study, rats were treated with AIE at doses of 0.5, 1.0, 2.0 mg/Kg bw once a day for 4 weeks(n=10 animals per each group). There were no significant changes in body weight, food intake and water consumption observed during the experimental duration. In addition, no difference of relative kidney weight was observed among all treated groups. Serum creatinine level in the AIE 2.0 g/Kg group increased significantly compared with that of control group in male rats, but serum blood urea nitrogen was significantly decreased in a dose-dependent manner (
On the basis of results, it could be concluded that oral administration AIE didn’t cause any toxic response in kidney, except the increased serum cholesterol.
경제 성장 및 소득의 증가로 인해 소비자의 건강에 대한 인식과 관심이 높아짐에 따라 친환경농산물 생산을 위한 유기농업자재 사용 비율도 증가하고 있다(Choi
님추출물은 유기농업자재 외에도 농약으로 등록된 Azadirachtin을 함유하는 식물추출물로 병충해방제효과가 우수하다고 알려져 있으며(Das
님추출물은 효능연구 뿐만 아니라 과량 사용에 대한 독성 연구도 활발히 진행되어 왔다. 그 결과로 님오일에 대한 랫드와 토끼의 LD50은 각각 14 mL/Kg과 24 mL/Kg으로 보고 되고 있으며(Gandhi et al., 1988), 님을 10주간 랫드에 투여시 간접적으로 생식능을 저해한다고 보고된 바 있다(Parshad
반면, 최근에는 님추출물에 대한 여러 안전성시험 결과, Deng 등(2013)은 님 추출물을 최고 1.6 g/Kg bw로 28일간 반복투여 경구투여 하였을 때 간 뿐만 아니라 신장에서 조직 병리학적 이상을 관찰하였다고 보고한 바 있으며, Rahman 등(2002) 또한 90일간 투여시험에서 신장조직에서 LDH(lactate dehydrogenas) 활성이 감소하고 괴사가 관찰되었다고 보고하는 등 님추출물이 신장에 미치는 독성에 대한 결과가 다수 보고되고 있다.
따라서, 본 연구에서는 님추출물이 신장에 미치는 독성 여부를 확인하고자 우리나라에서 유통되는 님추출물 시료를 이용하여 랫드에서 급성경구독성시험을 진행하고 이를 근거로 4주 반복투여 경구독성시험을 수행하여 님추출물이 신장관련 혈액생화학적 지표 및 신장 조직에 미치는 영향을 관찰함으로써 유기농업자재로 사용되는 님추출물의 안전성을 확인하고자 하였다.
시료는 시중에 유통되는 미얀마산 님추출물을 구입하여 시험에 사용하였다. 시험물질은 사용기간 동안 빛이 통하지 않는 불투명한 용기에 담아 실온에서 보관하였으며, 사용직전 0.22 μL filter를 이용하여 정제 후 멸균증류수에 희석하여 사용하였다.
시험에 사용된 님추출물 시료의 정확한 유효성분 함량의 확인을 위해 유기농업자재의 유효성분으로 목록공시 및 품질 인증되는 azadirachtin 및 그 이성질체 4종을 분석하였다. 시료의 정제 및 정량분석은 Lee 등(2013)의 방법에 따라 수행하였다.
본 동물시험은 국립농업과학원의 동물윤리위원회 승인(NAAS 1305)을 얻어 연구를 진행하였다. 시험동물은 SPF Sprague-Dawley(SD)계 랫드를 ㈜Koatech (Gyeonggi-Do, Korea)으로 부터 분양 받아 1주일간 순화 후 사용하였다. 시험동물은 평균체중의 ±20% 범위 내에 있는 암컷과 수컷으로, 급성경구독성 시험에서 8주령의 군당 3마리, 반복투여 경구독성시험에서 5주령의 군당 10마리의 동물을 사용하였다. 시험실 조건은 온도 23±2°C, 상대습도 55±5 %, 조명시간 12시간으로 하였다. 전 시험기간 동안 폴리카보네이트 사육상자에 2∼3마리씩 넣어 시험하였으며, 물과 사료는 자유 섭취시켰다.
급성경구독성시험은 실험동물 수를 줄여서 실험하기 위하여 개발된 농촌진흥청 고시 제2012-37호 「농약 및 원제의 등록기준」의 급성독성등급법에 근거하여 시험하였다. 시험 전날 물을 제외하고 금식시켰고, 시험물질은 존데를 이용하여 1회 위 내에 강제 경구투여 하였다. 시험물질 투여 후 14일 동안 독성징후의 종류, 회복시기 및 치사 시간 등 모든 관찰사항을 기록하였으며, 시험 종료 후 시험 절차를 따라 LD50을 산출하였다. 급성독성시험에 사용된 모든 시험동물의 체중은 투여 전과 투여기간 중 0, 3, 5, 7, 14일에 측정하였다.
아급성경구독성시험은 농촌진흥청 고시 제 2012-37호의 반복투여경구독성 시험에 준하여 시행하였으며, 시험용량을 급성독성시험을 통해 판정된 LD50용량을 포함해 LD50의 1/2와 1/4에 해당하는 농도를 선정하여, 0.5, 1.0, 2.0 g/Kg bw/day로 투여하였다. 시험물질은 존데를 이용하여 4주간 1일 1회, 주말을 제외한 주 5회 투여하되 매일 오전 위 내 강제 경구투여 하였으며, 대조군은 멸균수를 사용하였다.
임상 증상은 모든 시험동물에 대해 매일 1회 이상씩 일정 시간에 일반상태의 변화, 중독증상발현, 사망동물의 유무 및 시험물질 투여 후 시험물질에 의해 나타날 가능성이 있는 증상에 대하여 주의하여 관찰하였다. 또한, 시험에 사용된 모든 시험동물에 대하여 체중을 시험기간 중 매주 2회, 사료 섭취량과 물 섭취량은 주 1회 측정하였다.
뇨 채취를 위해 부검 전일 대사케이지에 넣어 뇨 시료를 수집하였다. 모든 시험물질 투여군의 생존동물에 대하여 시험물질 투여 개시일로부터 4주 후에 부검을 실시하였으며, 부검을 위해 CO2로 마취하여 혈액 채취 한 후 해부하여 육안으로 신장을 검사하여 이상소견을 기록하고 신장의 중량을 측정하였다.
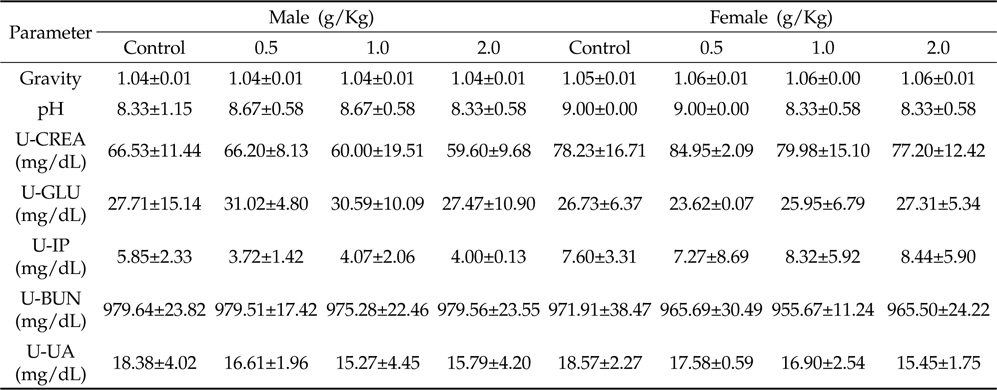
채혈한 혈액은 4°C 냉장 보관 한 후 10,000 rpm에서 15분간 원심분리(Hanil, Supra 22K, Incheon, Korea)하여 자동생화학검사기(Beckman coulter, AU480, Miami, USA)를 이용하여 Blood urea nitrogen(BUN), Cholesterol(CHO), Creatinine(CREA), Inorganic phosphorous(IP), Triglycerol(TG), Total protein(TP), Uric acid(UA) 등을 측정하였다. 뇨 검사는 비중, pH, Urine-Creatinine(U-CREA), Urine-Glucose(U-GLU), Urine-Inorganic phosphorous(U-IP), Urine-Blood urea nitrogen(U-BUN), Urine-Uric acid(U-UA)에 대해 행하였다.
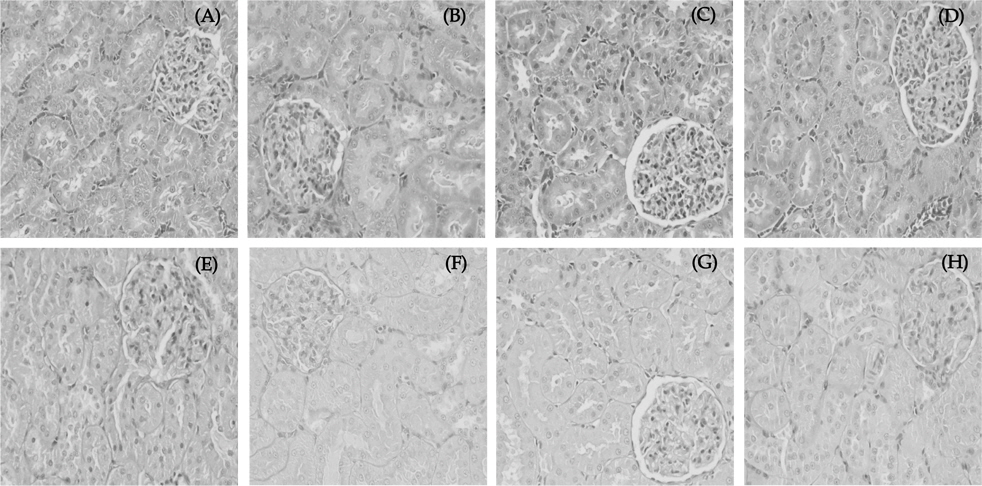
시험동물에서 적출한 신장은 10% 중성 포르말린으로 고정시켜 Hematoxylin-Eosin(H&E)염색과 Periodic Acid Schiff(PAS)염색을 하여 조직을 관찰 후 광학현미경으로 400배에서 관찰하였다.
자료에 대한 통계분석은 SAS(version 9.2, SAS Institute Inc., Cary, NC, USA) 프로그램을 이용하였다. 시험물질 투여군과 대조군의 차이를 비교하기 위하여 general linear procedure로 분석하였으며 pairwise t-test를 이용하여 유의차 0.05 수준에서 평가하였다.
본 시험에서 사용된 님추출물 시료의 유효성분을 분석한 결과, azadirachtin A 8.2 g/Kg, azadirachtin B 3.45 g/Kg, deacetylsalannin 1.65 g/Kg, salannin 5.12 g/Kg으로 총18.42 g/Kg의 azadirachtin을 함유하였다(Table 1).
[Table 1.] Composition of active ingredients in Azadirachta indica extract used in this study

Composition of active ingredients in Azadirachta indica extract used in this study
급성경구독성시험을 통한 반수치사량(LD50) 측정을 위해 1단계로 2.0 g/Kg 투여하여 암수의 체중변화를 살펴본 결과 Fig. 1과 같이 모든 군에서 체중이 정상적으로 증가하였다. 님추출물 투여 후 2주 동안 시험동물의 임상학적 변화를 관찰한 결과 암수 모든 시험물질투여군에서 특별한 이상 증상이나 사망동물이 관찰되지 않았다.
추가로 2.0 g/Kg의 님추출물에 대해 2단계 시험을 진행한 결과 1단계와 동일한 결과가 나타남에 따라 랫드를 이용한 님추출물의 LD50은 최종적으로 2.0 g/Kg 이상으로 판단 하였다. 선행연구로서 랫드에 대한 급성독성연구에서도 님오일의 LD50 이14.1 mL/Kg이라고 보고하였다(Gandhi
님추출물 0.5, 1.0, 2.0 g/Kg을 랫드에 4주간 경구투여 하였을 때 체중의 변화는 Fig. 2와 같다. 시험기간 동안 암수 모든 군에서 체중이 정상적으로 증가하였으며, 투여용량간의 유의적인 차이는 보이지 않았다. 투여기간 동안 사료 및 물 섭취량 또한 암수 모든 시험물질 투여군이 대조군에 비해 유의적인 차이는 보이지 않았다(자료 미기재). 이는 수용성 님추출물 0.01, 0.03, 0.10 g/Kg을 마우스에 21일간 경구투여 결과 시험물질 투여군 간에 체중 변화가 나타나지 않았다는 연구결과(Ray
시험 종료 후 모든 시험동물을 부검하여 신장을 육안으로 관찰한 결과 님추출물을 투여한 암수 모두에서 신장에 대한 외관상의 어떠한 이상 병변은 보이지 않았다. 또한, 암수 모든 시험 물질 투여군에서 신장의 상대중량 차가 나타나지 않았다(Table 2). Deng 등(2013)도 마우스에 28일간 님종실류에서 추출한 님오일 0.177, 0.533, 1.600 g/Kg을 경구투여한 결과 신장의 상대중량에 차이가 나타나지 않았다고 보고하여 본 연구결과와 유사한 경향을 나타내었다. 반면, Ashafa 등(2012)은 수컷 Wistar 랫드에 님나무줄기의 에탄올 추출물을 21일간 0.05, 0.1, 0.2과 0.3 g/Kg으로 경구투여 하였을때 신장의 상대중량이 투여용량이 증가함에 따라 유의적으로 증가한다고 보고하였다. 본 시험에서 사용된 최고용량은 Ashafa 등(2012)의 연구에서 사용된 최고용량인 0.3 g/Kg에 비해6.6배 높은 수준으로 유사한 기간 동안 투여했음에도 신장 중량의 유의차가 나타나지 않은 것을 고려할 때, 님추출물을 14일간 경구를 통한 반복 투여 시 나타나는 신장 중량의 차는 단순히 님추출물의 투여용량 에서 기인하는 것은 아니며, 추출에 사용된 용매나 님원료의 부위, 함유하는 azadirachthin양 등 다른 요인들에 의한 것임으로 생각된다.
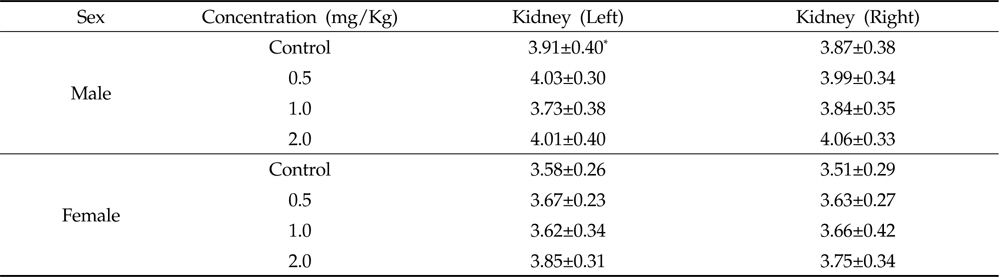
Relative kidney weights of oral administration of Azadirachta indica extract in male and female Sprague-Dawley rats for 4 weeks
시험동물의 혈액 중 신장기능과 관련된 지표(BUN, CREA, IP, UA) 및 혈중 지질 성분(CHO, TG)는 결과는 Table 3과 같다. CREA는 수컷에서 대조군과 비교했을 때 저용량 및 중간용량 투여군은 유의적인 차이가 없었으나 고용량 투여군에서 유의적으로 증가하는 양상을 보인 반면, BUN은 투여용량이 증가함에 따라 유의적으로 감소하였다(
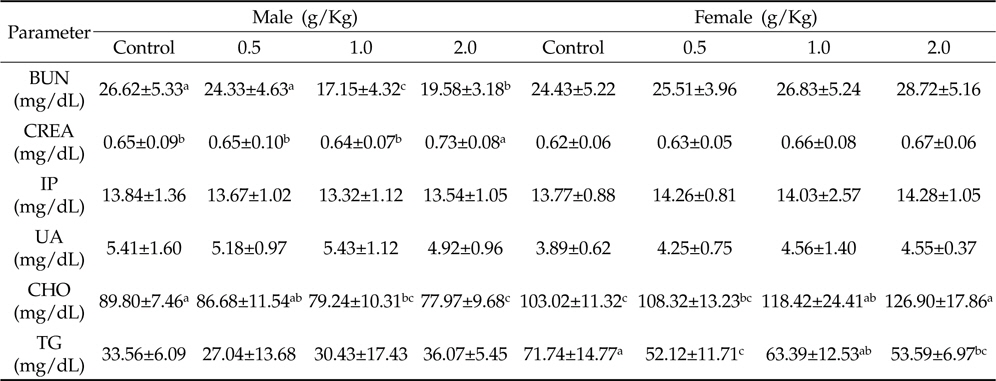
Effects of Azadirachta indica extract on kidney markers and lipid profiles in male and female Sprague-Dawley rats for 4 weeks
선행연구로서 님종실류를 마우스에 0.177, 0.533, 1.6 g/Kg투여하였을 때 BUN과 CREA이 투여용량에 따라 차이를 보이지 않았으며(Deng
한편, 고지혈증이 수컷 랫드에서 신장질환을 유도하며(Selim
채취된 뇨 시료의 검사결과는 Table 4와 같이 모든 동물의 시험물질 투여군에서 유의적인 차이는 보이지 않았다.
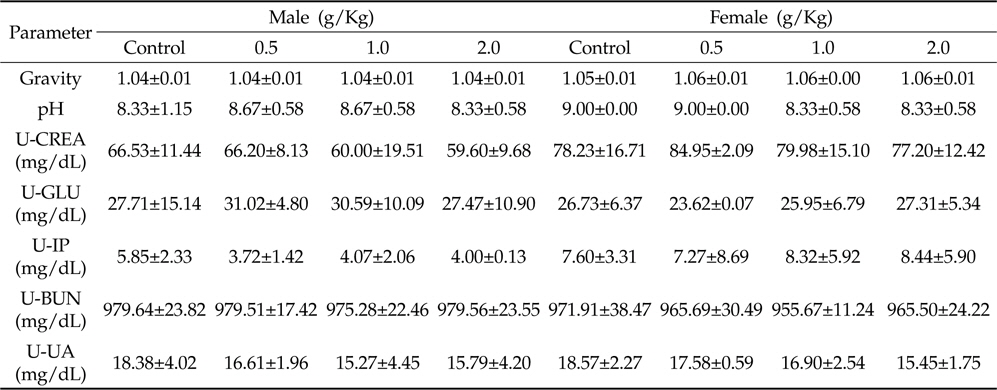
Urinalysis of oral administration of Azadirachta indica extract in male and female Sprague-Dawley rats for 4 weeks
또한, 신장의 손상 여부를 조직병리학적인 변화로 확인하고자 H&E와 PAS염색하여 400배로 관찰한 결과는 Fig. 3과 같다. 시험결과, 일부 실험동물에서 초자양 물질(hyaline cast)이 관찰되기는 하였으며 이는 장기간 사육에 의한 자연발생 병변으로 판단되었다. 또한, 대조군을 포함한 모든 시험물질 투여군에서 사구체와 세뇨관 구조가 정상적인 것으로 나타났고 사구체 혈관과 모세관 또한 다른 이상을 보이지 않았다. Ezz-Din 등(2011)의 연구에서도 님 잎의 메탄올 추출물 0.5 g/Kg 을 랫드에 각각 5일과 10일간 경구 투여한 결과 신장의 병리학적 변화는 관찰되지 않았다고 보고하였다. 반면, 님제품(vepacid)을 90일 동안 0.08, 0.16, 0.32 g/Kg을 투여한 경우 신장조직에서 괴사가 관찰되었고(Rahman
이상의 결과를 종합하여 볼 때 본 시험에서 님추출물의 급성경구독성시험을 통해 LD50은 5 g/Kg 이상으로 판정하였다. 또한, 4주간의 반복투여기간에 걸쳐 님추출물 0.5, 1.0, 2.0 g/Kg을 랫드에게 경구투여한 결과, CREA이 고용량의 님추출물 투여군에서 유의적으로 증가하였으나 또 다른 신장손상 지표인 BUN은 용량의존적으로 감소하였다. 또한 암컷에서 혈중 지질 관련 지표인 TG가 모든 시험물질투여군에서 감소하였으며 님추출물의 투여용량이 증가할수록 CHO가 증가함으로서 lipolysis 저해가 진행되는 것으로 생각된다. 신장의 조직병리학적 관찰 결과 모든 시험물질투여군에서 이상 병변이 관찰되지 않았다. 따라서 님추출물의 반복투여 시 암컷에서 혈중 콜레스테롤 증가가 나타난 것을 제외하면 신장에 독성영향을 미치지는 않는 것으로 판단된다.
한편, Han과 Kim (2013)은 유기농자재로 사용되는 님원재료(unprocessed materials), 종자오일, 수성과 비수성추출물 및 순수화합물(pure compound)과 같은 다양한 재료들의 독성을 평가한 결과 종자오일과 순수화합물의 독성이 소원재료나 추출물보다 낮으며, 추출에 사용된 님의 부위나 추출 및 제조공정에 따른 영향이 크다고 보고하였다. 따라서, 유기농업자재의 생산 및 수입 시 사용된 님의 추출부위와 추출용매 등을 구체적으로 기재하도록 하고 목록공시 및 품질인증 단계에서도 이를 명시하게 하여, 유기농업자재 제조업자가 님추출물을 유기농업자재의 원료로 사용함에 있어 해당원제에 대한 안전성 확인이 용이하도록 제도화 하는 것이 도움이 될 것이다.