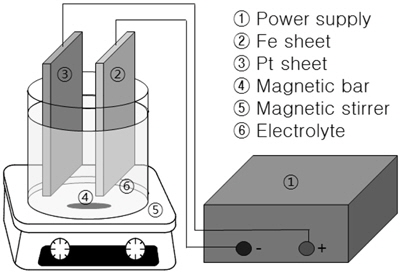
We synthesized the self-organized nanoporous oxide with potentiostatic anodization of iron foil. The iron oxide nanocomposite (INCs) were fabricated in 1M Na2SO4 containing 0.5wt% NaF electrolyte holding the potential at 20, 40 and 60 V for 20min, respectively. Field Emmision Scanning Electron Microscopy (FESEM) and X-ray Diffractometer (XRD) were used to evaluate the micromorphology and crystalline structure of INC film. Also, this study was performed to evaluate the fenton reaction using INC film with hydroperoxide for degradation of cyanide dissolved in water. In case of INC-40V in the presence of H2O2 3%, the first-order rate constant was found to be 1.7×10−2 min−1, and indicated to be 1.2×10−2min−1 on commercial hematite powder. This result is shown to be good performance enough to replace the powder type for treatment of wastewater.
시안(cyanide)는 도금, 의학, 채광 및 자동차 산업에서 광범위하게 사용되고 있으며, 또한 이들 공정에서 많이 발생되고 있다(Mudliar et al., 2009; Zagury et al., 2004). 시안이온(free cyanide)은 자체로 매우 유독할 뿐 아니라 카드뮴(Cd), 구리(Cu), 니켈(Ni) 등의 전이금속(transition metal) 등과 강한 복합체를 형성하며, 이러한 시안화합물은 생물체에 악영향을 주는 것으로 알려져 있다. 따라서 시안이 함유된 폐수의 처리는 도금 공업 등에서 가장 중요한 현안으로 인식되어 왔다(Choi and Park, 1997; Kim et al., 2000). 이러한 시안 및 시안화합물을 처리하기 위한 다양한 연구가 이루어지고 있는데, 화학적 산화기술(Beattie and Polyblank, 1995), 오존산화기술(Gurol and Holden, 1988; Zagury et al., 2004), 생물학적 처리기술(Dash et al., 2009) 등이 이전에 보고된 바 있다. 그러나 생물학적 또는 물리적 처리공정은 수용액상에서의 시안이온을 완벽하게 처리할 수 없다고 알려져 있으며(Sarla et al., 2004), 반면 알칼리 염소주 입법, 과산화수소(H2O2) 산화처리법 등의 화학적 처리공정은 이산화탄소, 질소 그리고 물 등으로 완전분해가 가능하다고 보고되고 있다(Choi and Park, 1997; Beattie et al., 1995). 시안이온과는 달리 전이금속과 강력한 복합체를 형성하고 있는 시안화합물 등은 위에서 언급한 처리공정으로 그 완전분해의 한계를 가지고 있다. 따라서, 이러한 문제점을 극복하기 위한 방법으로는 산화제를 투입한 물리-화학적 공정(Haag and Yao, 1992), 오존(ozone) 산화법(Gurol and Holden, 1988; Zeevalkink et al., 1980), 광촉매(photocatalysis)인 titanium dioxide (TiO2)를 이용한 처리공정(Pedraza-Avella et al., 2008), ferrate (Ⅵ) 산화공정(Yngard et al., 2008) 등이 연구되고 있다.
이 중 고도산화처리공정(advanced oxidation processes; AOPs)은 시안화합물을 효율적으로 처리할 수 있는 공정으로 각광을 받고 있다. 이러한 고도산화처리방법들 중 펜톤산화(fenton oxidation)공정은 높은 처리효율로 다양한 환경오염처리에 이용되고 있다(Chang et al., 1999; Haber and Weiss, 1934; Kim and Lee, 1998; Lim et al., 2005). 기존의 Fenton 공정은 낮은 pH 영역에서만 활성이 가능한 단점을 가지고 있으며, 이를 보완한 modified Fenton 공정은 중성 pH에서 촉매인 철이온의 안정성을 확보함으로서 펜톤(Fenton) 공정의 단점을 극복하였다(Chang et al., 2000; Watts et al., 1999; Watts and Dilly, 1996). 그러나 이들 공정은 철이온의 지속적인 주입이 필요하며, 이를 통해 다량의 철슬러지가 발생하는 단점을 가지고 있다. 따라서 철 분말을 사용하기 보다는 박막형태로 철이온을 고정화시킨 펜톤반응의 활용에 대한 연구가 필요하다(Kitajima et al., 1978). 박막형태를 이용한 펜톤의 연구는 전무한 실정이며, 국외에서 고분자 매질에 철이온을 고용하는 연구가 있었으나, 제조방법이 까다롭고 처리효율이 떨어지는 문제가 있었다(Fernandez et al., 2003). 나노튜브형태의 나노구조박막은 그의 높은 비표면적과 크기에 따른 물성 변화로 인해 큰 관심을 끌고 있다(Tratnyek and Johnson, 2006). 특히 양극산화(anodization)에 의한 금속산화물이 나노튜브(nanotube)형태를 갖는다는 연구로 인해 이에 대한 연구가 활발히 이루어지고 있으며, 양극산화(anodization)에 의해 제조된 박막은 밀착성의 측면에서 우수한 특성을 가질 뿐만 아니라, 간단한 전기장치만으로 그 제조가 가능하다(Ghicov et al., 2005).
본 연구에서는 양극산화법을 이용하여 산화철 나노구조박막(iron oxide nanocomposite, INCs)을 제조하고, 이를 유사 펜톤공정에 이용하여 도금폐수 내의 시안 및 시안화합물을 처리하고자 한다. 또한 기존의 상용마그네타이트 파우더를 이용한 펜톤산화 및 과산화수소만을 이용한 고도산화처리 등과 시안제거효율을 비교하고자 한다.
INC 박막을 제조하기 위해 두께 300 μm, 90.0% 순도로 광양제철에서 공급받은 철(Iron) 박막을 40 mm × 100 mm로 절단하여 사용하였다. 전해질로는 Na2SO4와 NaF를 Showa에서 구매하였고, 표면 유기분의 오염물질을 제거하기 위한 chemical etching을 위해 HF(48-51%, Baker), HNO3(60%, 대정화금)에서 구매하여 사용하였다. 인공폐수를 만들기 위해 사용한 시안은 NaCN (98%, Aldrich)을 사용하였고, pH의 조절을 위한 용액은 1N H2SO4와 10N NaOH는 (주)덕산에서 구매하여 사용하였다. 펜톤실험을 위해 과산화수소(30%)와 펜톤비교실험을 위해 상용헤마타이트(commercial hematite powder, CHP)는 Aldrich사 (Fe2O3; powder, < 5um)에서 주문하여 사용하였다. 모든 실험에서 사용되어진 수용액의 제조는 millipore system을 사용하여 18 mΩ-cm까지 정화된 증류수를 사용하였다.
2.2.1. 양극산화법에 의한 Iron oxide nanocomposite(INC)박막의 제조
Chemical etching을 위해 HF : HNO3 : H2O 을 각각 1:4:5의 부피비로 혼합하여 20초에서 30초간 침지시켜 화학 에칭 후 아세톤과 탈이온수로 각각 20분간 초음파 세척을 진행하고 건조시켜 양극산화를 진행시켰다(Fig. 1). 전해액으로 황산나트륨(Na2SO4) 1 M과 불화나트륨(NaF) 0.5wt%을 사용하였으며, 음극은 99.9%의 백금(Platinum)을 사용하였고 두 극의 간격은 5cm로 고정하였다. 최대 전류 5 A, 최대전압 160 V까지 공급할 수 있는 Regulated DC Power Supply (EP1605, PNCYS)를 사용하여 20 V, 40 V, 60 V에서 각각 정전압법으로 20분간 양극산화를 진행하였으며, 시간당 전압과 전류량을 측정하기 위해 장비의 소프트웨어인 EP-1을 사용하였다. 전해액의 온도는 냉각수를 통해 조절하였으며 15℃를 유지하였으며, 양극산화가 끝난 박막샘플은 증류수로 표면세척 후에 Vacuum Desiccator에 보관하였다.
2.2.2. CHP와 INC를 이용한 펜톤산화실험
각 실험은 원통형의 250 mL 회분식 반응기에 INC박막 1개를 고정하여 실험되어졌으며, magnetic bar를 이용하여 용액을 균등하게 stirring하였다. 반응이 개시된 이후, 일정한 반응 시간에 맞추어 각 반응기에서 10 mL의 sample을 채취하였고, 10 N NaOH 100 ㎕를 첨가하여 pH를 12이상으로 조정하여 cyanide (CN-)를 용액 내에서 안정화시켰다. 또한, 과산화수소(H2O2)의 분석을 위한 시료의 채취는 반응기 내의 상등액을 2 mL를 취하여 분석하였다. 시안이온은 산성 조건하에 HCN 가스로 발생하기 때문에 pH를 12이상으로 조절하였으며, sodium cyanide (NaCN)을 이용하여 인공폐수 수용액를 제조하였다. 제조된 용액의 초기오염농도는 100 mg/L로 설정하였다. 시안화합물을 처리하기 위한 총 반응시간은 6시간으로 하였으며, 과산화수소의 농도는 29.4 mM (0.1%), 147 mM (0.5%), 294 mM (1%), 882 mM (3%)로 변화를 주어 실험을 진행하였다.
현장 폐수의 sample은 반월공단 내에 있는 도금폐수처리업체에서 채취하여 4℃ 이하에서 냉장보관 하였다. 현장폐수를 이용한 적용성 평가는 총시안 분석 시에 많은 양의 시료채취가 필요함에 따라 stainless steel 소재로 제작되고, 2.7 L의 원통형 반응기에서 scale-up하여 실험을 수행하였다. 또한, 과산화수소 주입과 동시에 반응을 개시하여 cyanide와 과산화수소의 분해를 측정하였다.
2.2.3. 분석
Field Emission Scanning Electron Microscope (FE-SEM, JSM-6330F)을 이용하여 양극산화로 제조된 산화철 나노구조박막의 표면을 관찰하였고, X-ray diffeaction (XRD, Rigaku D/MAX RINC 2500)을 수행하였으며, Cu Kα radiation 40kV, 100 mA의 조건에서 2theta가 20°에서 80° 사이를 분석하였다. 시안이온은 ion-selective electrode (ISE, Neonet Dual pH meter) method에 의해 분석하였으며, 총시안 (total cyanide)에 대한 분석은 수질오염공정시험법(MOE, 2008)에 의해 전처리를 진행하였고, Spectronic 20+ (Milton Roy Com pany) 측정 기기로 파장 620 nm에서 분석하였다. 잔존하는 과산화수소 측정은 colorimetric method(Kong et al., 1998)를 적용하였으며, 파장 476nm에서 Spectronic 20+ 을 사용하여 분석하였다.
Fig. 2는 양극산화로 제작된 나노튜브를 SEM을 이용하여 분석한 결과이다. Fig. 2(a)는 20V로 20분간 진행하였을 때 50 ~ 100nm 정도의 공극크기(pore size)를 가지는 나노튜브(nanotube) 형태를 나타내었다. 그러나 40V로 20분간 진행하였을 때는 Fig. 2(b)에서와 같이 튜브형보다는 망상구조(net structure)를 나타낸다. 이는 양극산화 시 결정핵에서 튜브형태가 성장하기 전에 결정핵 주변으로 응집하여 성장함으로써 망상구조형태를 이루게 된다. 또한, 이러한 망상구조 나노튜브의 경우, 기존에 그린 러스트(green rust)로 알려져 있는 철의 부분이 확대되어 좀 더 환경의 이용에 유리한 것으로 알려져 있다(Antony et al., 2008; Moon et al., 2003). 정전압 60 V로 양극산화를 진행하였을 경우, 전해질과 박막의 고열로 인한 절단 및 손상으로 추가실험을 진행하지 않았다.
Fig. 3의 (a)는 양극산화 전 철 박막의 XRD 패턴, (b)는 20 V에서 양극산화 후 박막 표면의 결정형을 나타낸 것이고, (c)는 40 V에서 양극산화 후 박막의 표면의 결정형을 나타낸 것이다. 분석은 Rigaku의 XRD 장비에서 널리 사용되고 있는 Jade 프로그램(Materials Data, Inc.)을 이용하여 가장 유사한 결정형을 확인하였다. 각각의 결정형을 결정짓는 peak의 위치는 상부에 표기하였으며, 전체적으로 양극산화 이후에는 amorphous한 형태를 가지나, 전압별 특징적인 결정형의 변화는 20 V에서 FeO 결정형인 Wustite의 결정형을, 40 V에서는 Fe2O3인 Hematite의 결정형을 갖는 것을 확인하였다.
전압에 따라 다른 결정형을 갖는 INC 박막을 평가하기 위해 20 V와 40 V에서 각각 제작된 INC 박막을 이용하여 시안제거실험을 수행하였다. Fig. 4는 각 전압에 따라 제작된 INC 박막을 과산화수소(H2O2) 농도가 882 mM로 고정하여 실험을 수행한 결과이다. 시안농도를 측정한 결과, 20 V에서 제작된 INC 박막의 경우 반응시간 6시간 후에 82%의 처리효율을 보였다. 그러나 40 V에서 제작된 INC의 경우 반응시간 3시간에 시안이 완전히 제거된 것을 확인할 수 있었다. 따라서 20 V에서 제작된 FeO 결정형 INC 박막보다, 40 V에서 제작된 Fe2O3 결정형 INC 박막의 경우 펜톤반응을 위한 촉매로써 사용가능성이 높은 것으로 판단된다.
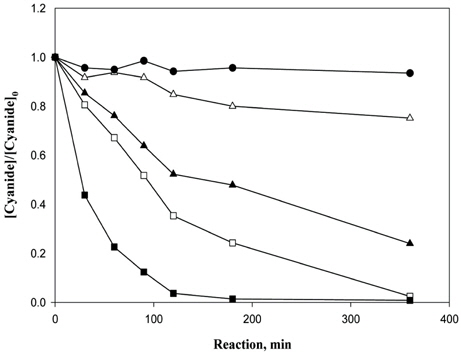
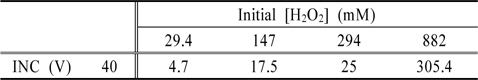
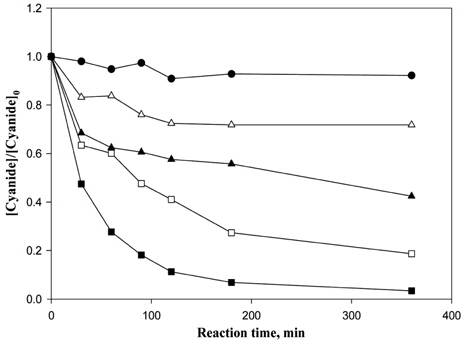
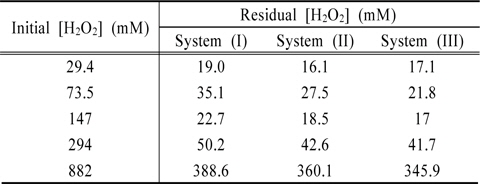
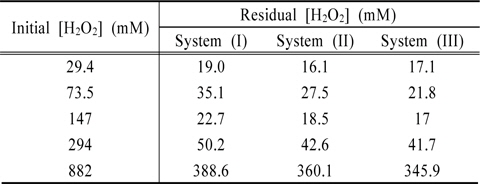
Fig. 5는 Fe2O3의 결정형을 갖는 INC 박막과 과산화수소(H2O2)의 농도변화에 대한 실험을 수행한 결과이다. 시안농도를 측정한 결과, 과산화수소 29.4 mM일 때 79%, 147 mM일 때 36.2%, 294 mM일 때 97.6%, 882 mM일 때 99.2% (0.95 mg/L)의 제거효율을 보였다. 또한 총시안 농도를 병행하여 측정하였을 때, INC 박막은 360 분의 반응시간 이후, 방류수 기준 농도인 1 mg/L 이하를 만족하였다. Table 1은 잔존 과산화수소 농도를 나타내었고, Table 2는 시안의 분해속도상수를 나타내었다.
[Table 1.] Residual concentrations of hydrogen peroxide using INC-40V
Residual concentrations of hydrogen peroxide using INC-40V
[Table 2.] First-order rate constants (k, min?1) for cyanide degradation on INC-40V

First-order rate constants (k, min?1) for cyanide degradation on INC-40V
Fig. 6에서는 CHP와 제조된 INC와의 처리효율을 비교하였다. 사용된 CHP의 양은 0.9 g으로, 앞서 실험된 결과와 동일한 조건하에서 실험을 수행하였다. 입자상의 hematite의 경우도 INC 박막과 마찬가지로 360 분의 반응시간 이후, 방류수 기준 농도인 1 mg/L 이하를 만족하였다. 이러한 결과는 INC 박막이 입자상의 hematite 철촉매와 비슷한 처리효율을 나타냄으로써, 충분히 실제공정에 이용이 가능함을 보여주었다. 잔존하는 과산화수소의 양은 Table 3에 나타내었고, 그에 따른 시안의 분해상수는 Table 4에 나타내었다.
[Table 3.] Residual concentrations of hydrogen peroxide on commercial hematite powder (CHP)

Residual concentrations of hydrogen peroxide on commercial hematite powder (CHP)

First-order rate constants (k, min?1) for cyanide degradation on commercial hematite powder (CHP)
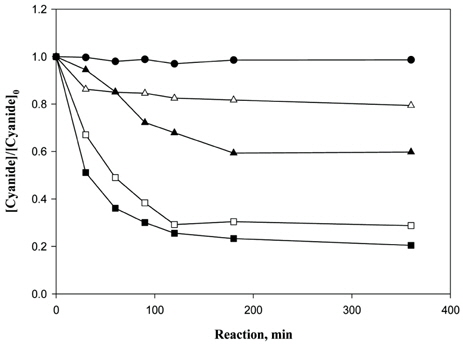
본 실험은 시안이온의 분해에 있어 과산화수소만의 영향을 평가하기 위하여 수행되었다. Fig. 7의 결과를 살펴보면, 우선 증류수로 진행한 control실험의 경우 시안이온의 농도에 영향을 주지 않았다. 이 후 H2O2의 주입량이 증가함에 따라 시안이온의 처리효율이 증가함을 확인할 수 있다. 그러나 반응시간 120 분 이후로는 분해되는 반응속도 변화가 미비하였으며, 과산화수소의 농도 882 mM에서 84.7%의 처리효율을 보였다.
이들 연구결과들을 확인하기 위해 과산화수소만에 의한를 측정한 결과, 반응시간 360 분 후의 잔존농도가 18.6 mg/L으로 목표달성농도 1 mg/L 이하를 만족하지 못하였다. 따라서, 과산화수소(H2O2)만을 이용한 처리보다는, INC 박막이나 CHP 등의 촉매적용을 통하여 처리효율을 향상시키는 것이 바람직한 것으로 판단된다.
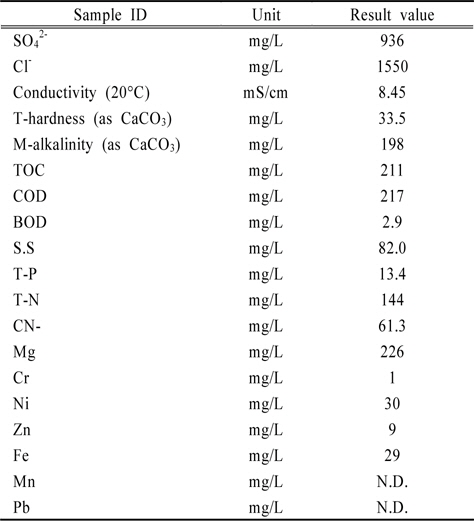
실제 현장에서의 적용성을 높이기 위하여 반월공단에 자리한 도금업체에서 폐수원수를 수집하여 실제폐수에 대한 적용성을 평가하였다. 실제 도금폐수의 성상은 다음 Table 5와 같다(MOE, 2008). 본 연구에서 중점을 두고 있는 총시안의 경우, 61.3 mg/L으로 비교적 높은 농도로 오염되어 있었다.
[Table 5.] Concentration of elements in samples
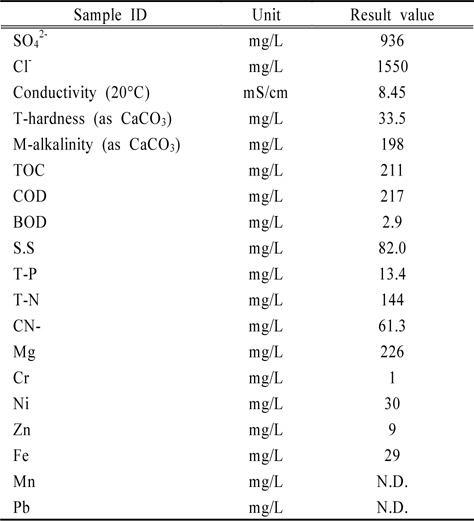
Concentration of elements in samples
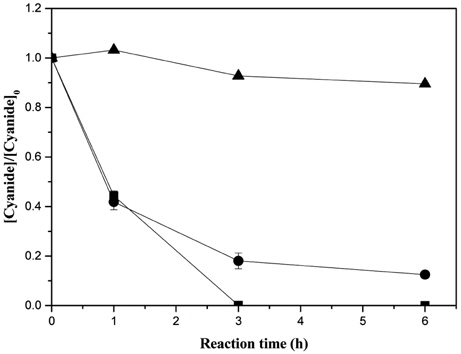
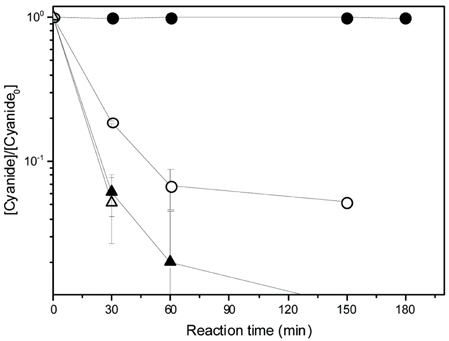
실제 도금폐수처리를 위한 적용성 평가를 위하여 3 system을 테스트하였다. System Ⅰ은 H2O2만 적용하였을 경우, System Ⅱ에서는 CHP + H2O2을 적용하였을 경우, 그리고 System Ⅲ에서는 INC-40V + H2O2을 적용하였을 경우로 분류하였다.
Fig. 8에서는 과산화수소 882 mM (3%)에서의 시안분해를 보여주는데, System Ⅰ에서는 30분 후에 18.6 mg/L와 60분후에 6.7 mg/L의 총시안이 검출되었고, System Ⅱ와 System Ⅲ에서는 60분 후에 모두 방류수 수질기준을 만족하였다. 그러나 그림과 같이 log-scale에서의 경우, System Ⅲ에서와 달리 System Ⅱ에서는 60분에 총시안의 잔류량이 존재하는것을 확인하였다. 따라서 INC-40V와 과산화수소 882 mM (3%)를 사용한 Systme Ⅲ에서 가장 높은 처리율을 보임을 확인할 수 있었다. Table 6은 반응시간 360분에서의 잔존 과산화수소 농도를 나타내고 있다.
[Table 6.] Residual concentration of hydrogen peroxide in plate wastewater
Residual concentration of hydrogen peroxide in plate wastewater
본 연구에서 제작된 INC 박막은 양극산화에 의하여 제작되었으며, 20 V, 40 V와 60 V에서 각각 정전압법으로 제조하였다. 이 때, 60 V에서 양극산화 수행시 철 박막의 절단이나 손상 등의 문제가 발생하여 20 V와 40 V에서 실험을 수행하였으며, 양극산화 이후에는 전체적으로 amorphous한 형태를 가진다. 전압별 특징적인 결정형의 변화는 20V에서 FeO 결정형인 wustite의 결정형을, 40V에서는 Fe2O3인 hematite의 결정형을 갖는 것으로 나타났다. 펜톤반응 시에 40 V에서 제작된 INC의 경우 20 V에서 제작된 INC에 비해 촉매로서 높은 효율을 나타냈고, H2O2 882 mM에 INC-40 V의 경우 1차반응속도상수가 1.7 × 10−2 min−1, CHP에서는 1.7 × 10−2 min−1로 나타났다. 따라서 펜톤반응을 통한 시안제거실험 시에 같은 질량을 갖는 입상의 hematite와 비슷한 처리효율을 나타내는 것으로 나타났으며, 360분 내에 총시안의 방류수 기준 농도인 1 mg/L 이하를 만족하였다. 따라서 이 결과를 토대로 기존의 펜톤공정에 사용되던 입자상의 철촉매를 INC 박막이 대체가능할 것으로 사료되며, 추후 INC 박막의 재생 및 재사용 실험을 통해 실제 폐수처리 시스템에 적용할 계획이다.