The purpose of this study was to investigate the effects of clothianidin on the soil in terms of clothianidin dissipation and degradation to evaluate its safety in order to provide an analytical foundation for clothianidin and the 5 metabolites related to it.
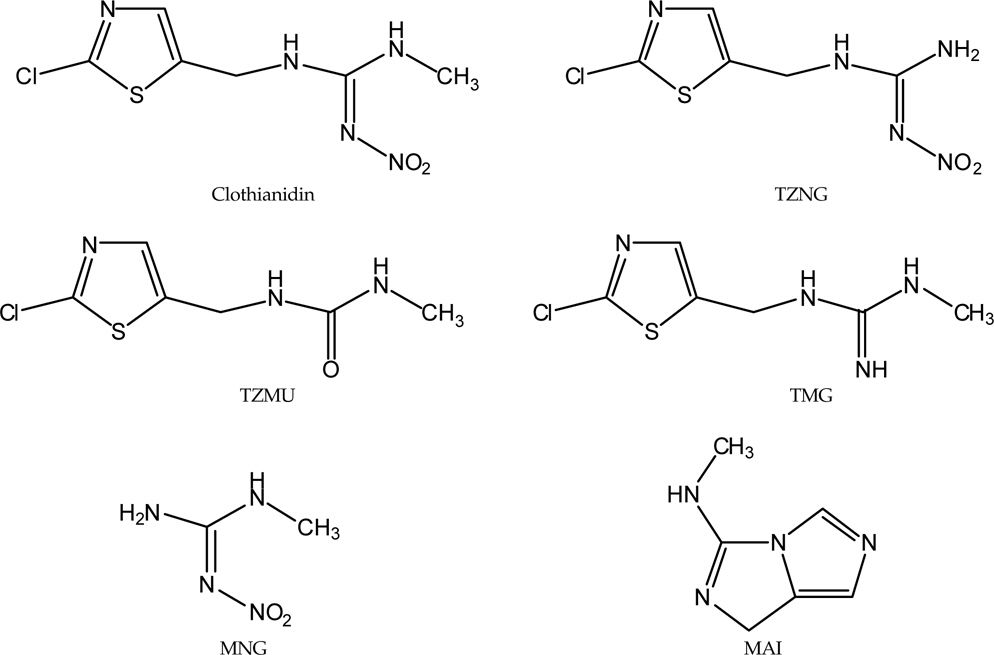
High-performance liquid chromatography(HPLC) was used to separate clothianidin and its metabolites in this study. In soil, after suppressing dissociation-proned ions with weak alkalic NH4OH and extracting the metabolites with methanol, clothianidin, Methylaminoimidazole(MAI), Methylnitroguanidine(MNG), Thiazolylmethylurea(TZMU) and Thiazolylnitroguanidine(TZNG). Thiazolylmethylguanidine(TMG) were extracted with the addition of neutral NH4OAC to increasing the intensity of ions. Compounding elements were separated by using Hydrometrix (ChemElutTM) and ion-exchanging Solid-phase extraction(SPE) Strong cation-exchanger(SCX) and C18 were used. The recovery rates of clothianidin and 5 metabolites in soil and water ranged from 87.4% to 104.3%. A standard deviation of our analysis for the soil and water samples were less than 5%.
Well accepted detection limits for clothianidin and 5 metabolites in soil samples based on a dissipation analysis is 0.005 mg/kg and 0.001 mg/L in water samples. The dissipation concentration of this study was decided to be enough to evaluate the dissipation levels of clothianidin and its metabolites.
농약은 작물 생산에 위해한 해충, 병균 및 잡초의 방제와 농산물의 질적 향상 및 농산물의 안정적인 공급에 필수적으로 요구되는 농업자재이지만 대부분이 생물학적 활성이 높은 화합물이며, 재배 환경 중에 살포될 경우 토양을 비롯한 환경요소 및 수확 농산물 중에 모화합물 또는 분해 대사산물의 형태로 잔류할 가능성이 높아 인체 및 환경에 위해를 일으킬 수 있기 때문에 보다 철저한 관리가 필요하다.
Clothianidin((E )-1-(2-chloro-1,3-thiazol-5-ylmethyl)-3-methyl-2-nitroguanidine)은 1995년 Takeda Chemical Industries(현재 Sumitomo Chemical Takeda Agro Co. Ltd, Japan)에서 개발된 2세대 neonicotinoid 계통 농약으로(Tomlin, 2009) 유기인계나 carbamate계 살충제, ATPase저해에 의한 axonal transmission을 방해하는 합성 pyrethroid계 등 기존의 다량 사용되는 살충제에 저항성을 나타내는 해충에 대하여 특히 탁월한 약효를 나타내며 nicotine보다 환경 파괴 가능성 또한 낮은 장점을 가지고 있다(EPA report, 2003). 따라서 국내에서는 지속적인 사용량을 나타내고 있으며(KCPA, 2012), 현재 액상수화제(suspension concentrate, SC), 입제(granule, GR), 수용성입제(soluble granule, SG)및 수화제(Wettable powder, WP)가 콩류, 인과류, 핵과류, 장과류, 결구엽채류, 엽채류, 엽경채류, 근채류, 박과이외채소류, 박과채소류 등에 사용⋅등록이 되어 있으며(KCPA, 2012), 그에 따라 잔류허용기준(Maximum residue limit, MRL)도 41개 농산물 또는 농산물 그룹에 기준이 설정되어 있다(MFDS, 2013).
한편 현재까지 알려진 Clothianidin의 대사과정으로는 쥐와 같은 포유동물에서 Thiazolylnitroguanidine(TZNG),Methylnitroguanidine(MNG), 2-methylthiothiazole-5-carboxylic acid(MTCA), Thiazolylmethylurea(TZMU), Thiazolylurea(TZU), Nitroguanidine(NTG) 및 Methylguanidine(MG)가 대사산물로 생성되었으며(Yokota
본 연구에서 사용한 Clothianidin과 주요 대사산물로 알려진 MAI, MNG, TMG, TZNG, TZMU의 표준품은 Sumitomo Chemical Company(Japan)로부터 분양 받았으며 그 순도는 각각 99.7%, 99.0%, 99.3%, 98.9%, 100.0% 및 99.3%이었다. 이들 표준품을 각각 Acetonitrile(Clothianidin, TZNG, TZMU), methanol(MNG, MAI) 및 Deionized water(TMG)에 용해시켜 1,000 mg/L의 표준용액을 조제, 4℃에서 냉장보관 하였으며 필요시마다 일정량을 취하여 Deionized water에 희석, 사용하였다.
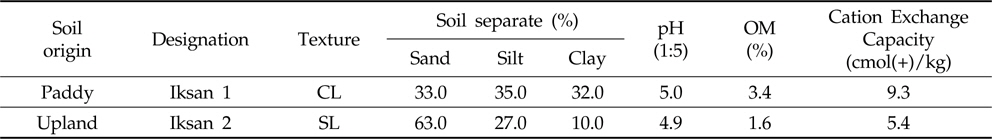
본 연구의 시험토양으로는 전북 익산지역 인접 지점의 논과 밭포장으로부터 토양의 표토를 채취하여 음건한 후 2 mm체를 통과시킨 다음 실온에서 건조시킨 풍건세토를 사용하였으며, 시험에 사용된 토양은 각각 식양토(Clay loam) 및 사양토(Sandy loam)로 국내 논토양과 밭토양의 대표적인 토양이었다(Table 1).
[Table 1.] Physicochemical characteristics of soils used
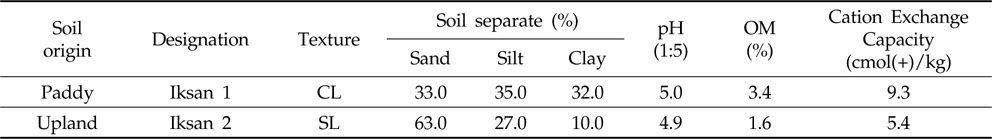
Physicochemical characteristics of soils used
토양수시료는 논토양 잔류시험에 사용되어지는 토양의 표토를 채취하여 음건한 후 2 mm 체를 통과시킨 다음 실온에서 건조시킨 풍건세토를 시험 pot(27 cm X 20 cm X H13.5 cm)에 3 cm 높이(1750 ± 10 g)로 채우고 지하수를 가한 다음 토양을 저어 써레질한 후 물 표면의 부유물을 제거하고 지면을 고른 다음 물 높이를 5 cm 높이로 조정한 후 14일간 방치한 다음 토양입자 등이 혼입되지 않도록 토양수시료를 1 L 이상 채취하여 사용하였다. 이 때 방치기간 동안 물은 소실량 만큼 매일 보충하였다.
본 연구에서 사용한 농약의 추출 및 정제용 유기용매는 잔류분석용 또는 High-performance liquid chromatography (HPLC)용을, 무기 시약은 분석용 특급을 사용하였다. Solid-phase extraction(SPE) Cartridge로는 SupelcleanTM LC-18(500 mg, 3 mL, Supelco, USA)및 LC-Strong cation-exchanger(SCX) (500 mg, 3 mL, Supelco, USA)와 Hydromatrix media(ChemElutTM 20 mL, Varian, USA)는 구입 후 전용의 Vacuum manifold 장치에 장착하여 사용하였다. 또한, 본 연구에서 사용한 주요 기구 및 기기는 HPLC(Hewlett Packard 1100 series, USA), Ultraviolet-visible(UV-VIS)Scanning spectrophotometer(Shimadzu UV-2101 PC, Japan), High-speed refrigerated centrifuge(Hitachi Himac CR21, Japan) 등이었다.
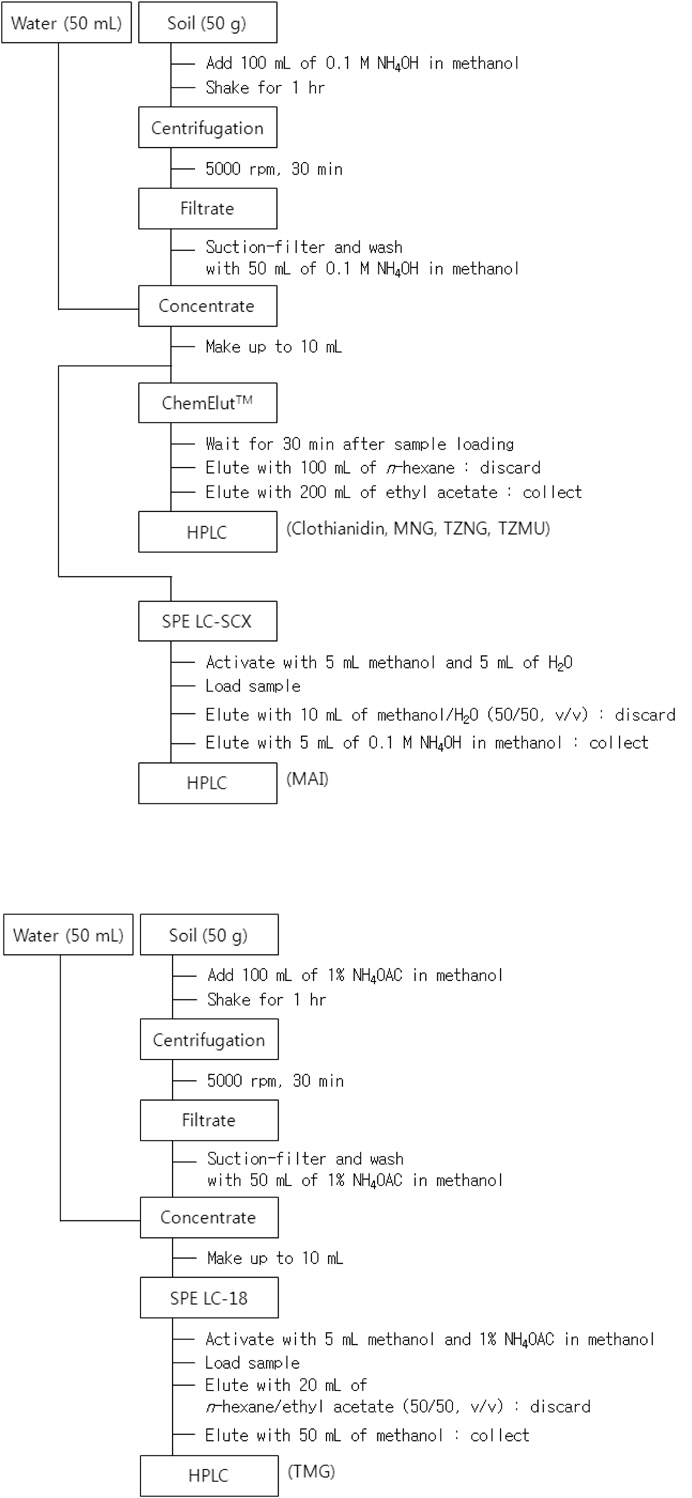
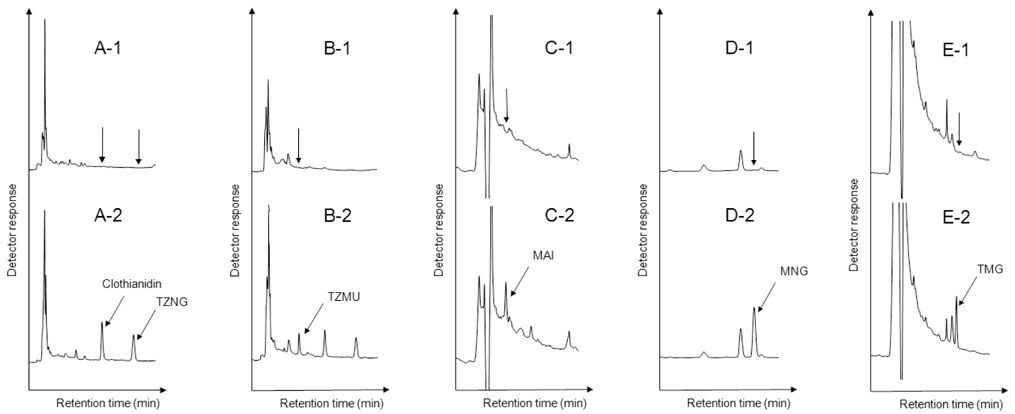
토양 중 Clothianidin과 그 대사산물의 잔류량 측정에 사용한 분석법을 Fig. 2에 도시하였다. Clothianidin, MAI, MNG, TZNG 및 TZMU의 경우 토양시료 50 g에 증류수 50 mL를 가하여 10분간 습윤화하였다. 토양시료에 추출용매(0.1 M NH4OH를 함유한 Methanol 용액) 100 mL를 가하 고 1시간 동안 진탕한 후 5,000 rpm에서 30분간 원심분리하였다. Büchner funnel을 사용하여 상등액을 감압 여과한 다음 여분의 50 mL 추출용매로 용기 및 잔사를 다시 씻어 내려 앞서의 여액과 합하였다. 추출액을 50℃에서 5 mL 정도 남을 때까지 농축한 후 10 mL Volumetric flask에 옮기고 증류수로 눈금을 맞추었다. Clothianidin, MNG, TZNG 및 TZMU 정제를 위하여 Vacuum manifold 위에 ChemElutTM를 올려놓고 정용액 10 mL 중 5 mL를 취하여 가한 다음 30분간 방치한 후
토양수 중 Clothianidin 및 대사산물의 잔류량 분석에 사용한 분석법을 Fig. 2에 도시하였다. 토양수시료는 논토양 잔류시험에 사용되어지는 토양의 표토를 채취하여 음건한 후 2 mm 체를 통과시킨 후 실온에서 건조시킨 풍건세토를 시험 pot(27 cm X 20 cm X H13.5 cm)에 3 cm 높이(1750 ± 10 g)로 채우고 지하수를 가한 후 토양을 저어 써레질한 다음 물 표면의 부유물을 제거하고 지면을 고른 후 물 높이를 5 cm 높이로 조정한 다음 14일간 방치한 후 토양입자 등이 혼입되지 않도록 토양수시료를 1L 이상 채취하였다. 이 때 방치기간 동안 물은 소실량만큼 매일 보충하였다. 토양수 분석법을 위해서 시료 50 mL를 300 mL Round-bottomed flask에 취한 다음 Methanol 50 mL를 가하여 50℃에서 5 mL정도 남을 때까지 농축한 후, 10 mL Volumetric flask에 옮기고 증류수로 눈금을 맞추었다. 분배 및 정제방법은 토양시료 조제 시와 동일한 방법으로 수행하였다.
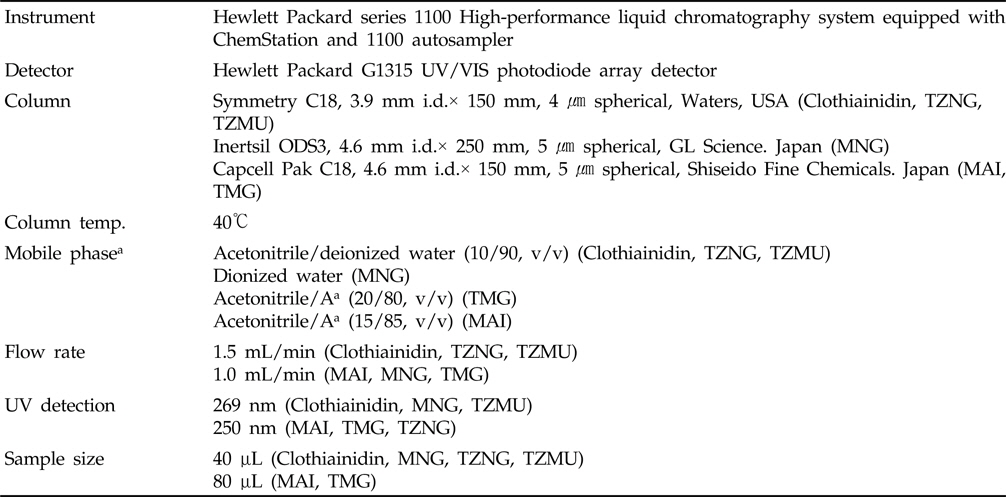
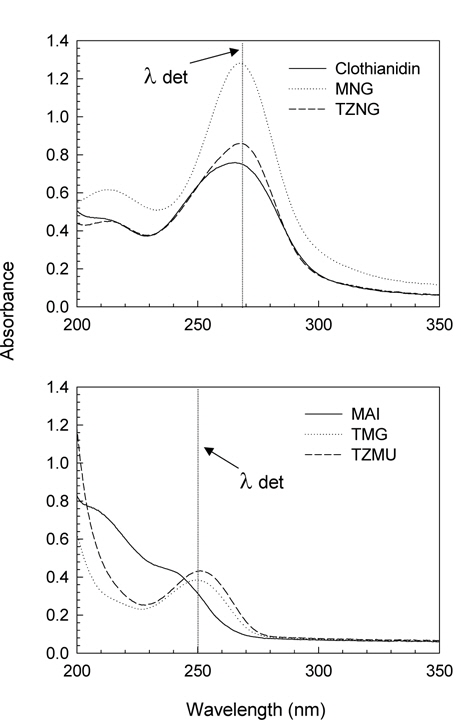
본 연구에서 Clothianidin 및 대사산물 분석 시 사용한 HPLC의 분석조건은 Table 2와 같다. 이 기기분석 조건하에서 모화합물인 Clothianidin의 머무름시간은 9.8분이었으며, 대사산물 MAI, MNG, TMG, TZMU 및 TZNG의 머무름 시간은 각각 4.0분, 7.9분, 7.2분, 4.4분 및 6.9분이었다.
[Table 2.] HPLC operating parameters for the analysis of clothianidin and its metabolites
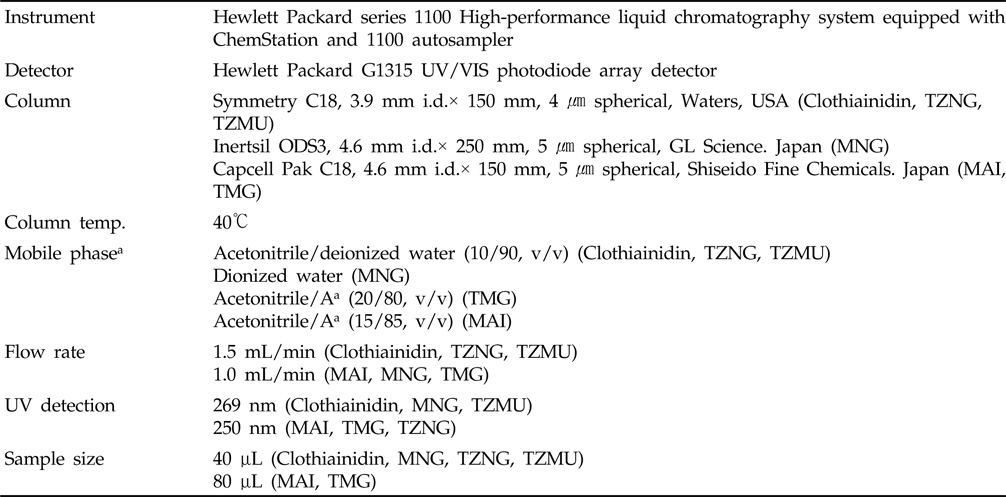
HPLC operating parameters for the analysis of clothianidin and its metabolites
각 시료별 잔류분석법을 검정하기 위하여 무처리시료에 대하여 회수율 시험을 실시하였다. 즉, 공시한 토양 2종 및 토양수 무처리시료에 Clothianidin과 대사산물 5종의 표준용액을 0.05-0.25 mg/kg 및 0.01-0.05 mg/L 범위에서 각각 2수준 3반복으로 처리하고 앞서 기술한 분석과정을 수행, 회수율 및 분석오차를 산출하였다.
Clothianidin은 증기압이 3.8 × 10-8 mPa (20℃)이고 옥타놀/물 분배계수인 logPow가 0.7 (25℃)로 보고되어(Tomlin, 2009, FAO Report, 2010) 비휘발성 극성화합물 부류에 속한다. 또한 주요 대사산물들도 초기 대사반응이 일어남에 주로 극성이 높은 작용기(Functional group)가 분자내에 도입, 그 극성이 Clothianidin과 동등 또는 그 이상일 것으로 예측하였다. Clothianidin과 주요 대사산물들의 물 및 유기용매에 대한 용해도를 살펴보면 물과 Methanol 등 극성 용매에 대한 용해도가 높고
기기분석 시 분리용 컬럼으로는 일반적으로 Buffer 를 이용하여 pH 를 조절할 수 있으며 중성화합물 뿐만 아니라 이온성을 띄고 있는 물질들도 ion-pair 기법을 이용하여 분리 할 수 있는 Octadecyl silica 컬럼을 이용하여 모화합물과 대사산물의 동시분석을 시도하였으나 MNG의 경우 다른 대사산물에 비해 극성이 높아 C18 column에서의 머무름 시간이 너무 짧고 시료중의 불순물에 의한 간섭이 관찰되었다. 또한MAI와 MNG를 제외한 모화합물 및 기타 대사산물들은 화학구조에서 Guanidine기와 Chlorothiazole ring을 모두 보유하고 있고, Chromatogram 상의 머무름 시간을 좌우하는 극성차이를 크게 유발할 구조상의 차이가 크지 않아 Peak overlapping 현상이 관찰되었다. 따라서 본 연구에서는 UV최대 흡수파장과 화합물간 분리 및 분석시간을 감안하여 Clothianidin과 TZNG는 동시 분석하고 TZMU, MAI, MNG 및 TMG는 개별적으로 분석하는 방법을 개발하였다.
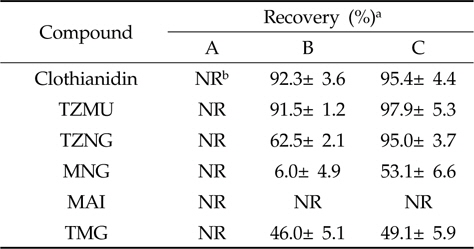
Clothianidin 및 5종 대사산물들은 모두 질소를 함유하는 화합물로 질소원자의 포화여부에 따라 중성 또는 약염기성을 나타낸다. 해리 혹은 해리 가능한 화합물을 추출하기 위하여는 이온억압(Ion-suppression)조건 하에서 유기용매로 추출하는 방법 또는 이온화(Ionization)조건 하에서 수용액으로 추출하는 방법을 사용할 수 있는데 본 연구에서는 중성 화합물들과의 동시 추출을 위하여 전자의 방법을 채택하였다. 즉, 약염기성 NH4OH를 첨가하여 해리 가능한 작용기를 이온억압하고, 극성특성을 고려하여 methanol을 이용하여 모화합물, MAI, MNG, TZMU 및 TZNG를 동시 추출하였으며, TMG의 경우에는 NH4OH보다는 중성의 NH4OAC를 첨가, 이온강도를 증가시키는 방법으로 추출하였다. 추출액의 분배과정으로는 분액여두상에서 서로 섞이지 않는 극성/비극성 용매조합을 사용하는 것이 일반적이나 Clothianidin 및 대사산물은 극성 용매에는 가용되는 반면 비극성 용매에는 난용으로 추출용매를 제거하지 않고서는 이 방법의 적용이 어려울 것으로 예상되어 분배효율을 높이기 위해 추출용매를 농축한 후 Sodium chloride로 포화시켜 유기용매로 액액분배를 시도하였다. 분배용매의 조성을 달리한 유기용매로 분배효율을 측정해 본 결과를 Table 3에 나타내었으며, 각 화합물모두 Dichloromethane에 비해 Ethyl acetate를 이용하는 것이 더 높은 분배효율을 보였으나 MNG, MAI만은 분배효율이 50% 미만으로 낮았다.
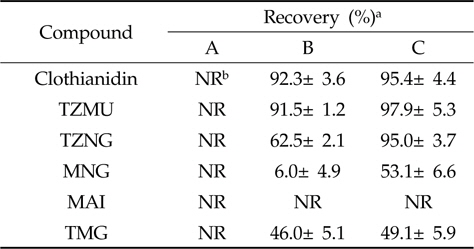
Recovery of clothianidin and its metabolites from liquid-liquid partition of saturated saline water
따라서 분배효율을 향상시키고자 비흡착성 규조토를 매질로서 이용한 표면분배(Surface partition)법을 시도하였다. ChemElutTM와 같은 Hydromatrix media에 추출 수용액을 가하면 흡수되어 표면적이 넓은 규조토 표면에 균일한 피막을 형성한다. 여기에 물과 섞이지 않는 유기용매를 가하면 수용성 피막의 두께가 매우 얇으므로 유기용매간에 보다 높은 분배효율을 얻을 수 있다. 예비시험 결과 Table 4와 같이 n-hexane 용출시 용출되는 분석대상 화합물이 없었으며 Ethyl acetate 용출시 MAI를 제외하고 모두 90% 이상이 용출되어 본 분석법의 분배법으로 이용가능성이 우수하였다.
[Table 4.] Recovery of clothianidin and its metabolites on a hydromatrix column, ChemElutTM
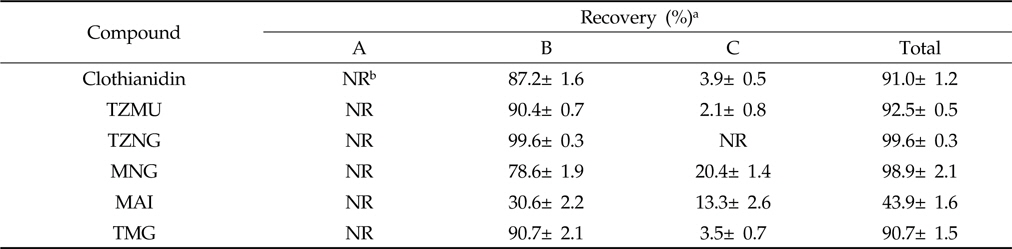
Recovery of clothianidin and its metabolites on a hydromatrix column, ChemElutTM
또한 분석대상 성분이 용출되지 않는
확립되어진 잔류분석법의 Clothianidin 및 5종 대사산물에 대한 검출한계는 토양시료에서 0.005 mg/kg으로 이러한 검출농도는 토양 10 cm 깊이를 기준으로 한 초기 살포농도 0.24 mg/kg의 약 1/50을 검출할 수 있어 토양 중 Clothianidin의 잔류성을 구명하는데 충분한 수준으로 판단되었다. 또한 토양 수시료의 검출한계는 0.001 mg/L으로 논물깊이 5 cm를 기준으로 한 최대 가능농도 0.48 mg/L의 1/480을 검출할 수 있어 Clothianidin의 토양수를 통한 이동성을 정밀하게 추적 할 수 있는 감도였다.
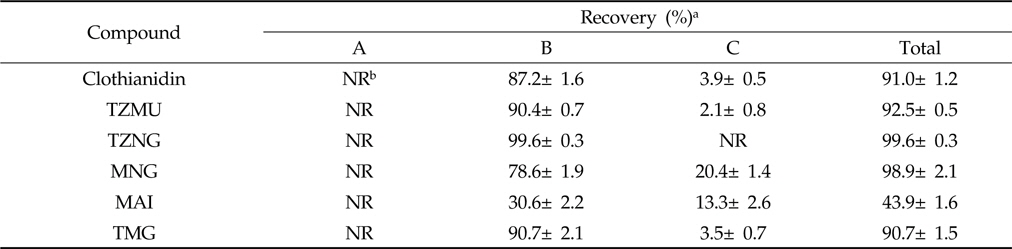
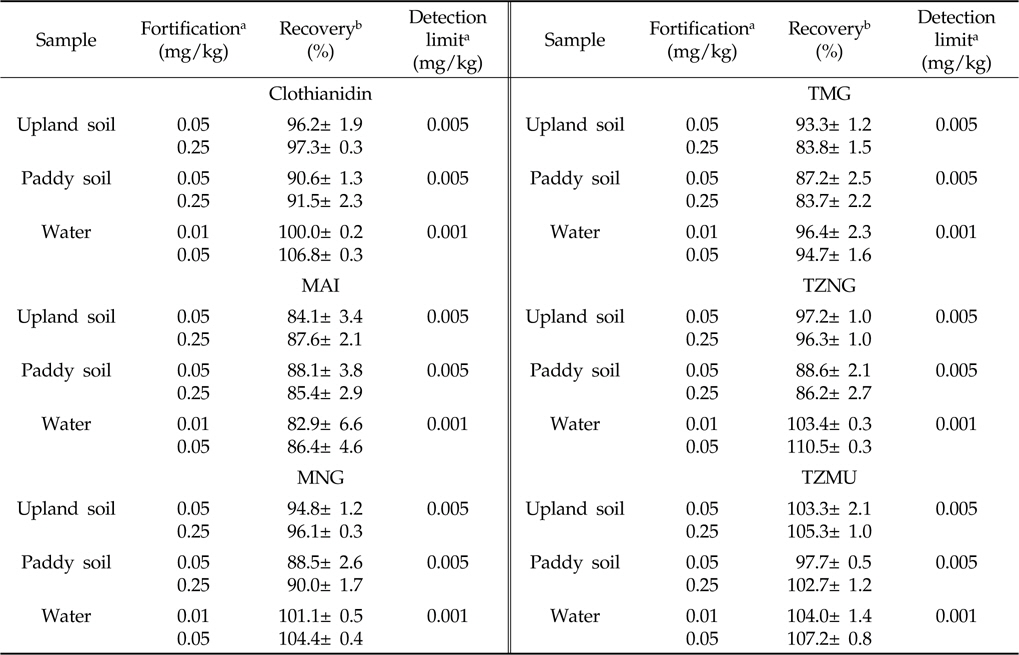
무처리 토양시료에는 0.05와 0.25 mg/kg, 무처리 토양수시료에는 0.01과 0.05 mg/L의 농도로 Clothianidin과 그 대사산물들을 각각 2수준 3반복으로 처리하여 분석법의 회수율 및 분석오차를 조사한 결과는 Table 5와 같다.
[Table 5.] Recovery of clothianidin and its metabolites from fortified soil and water samples
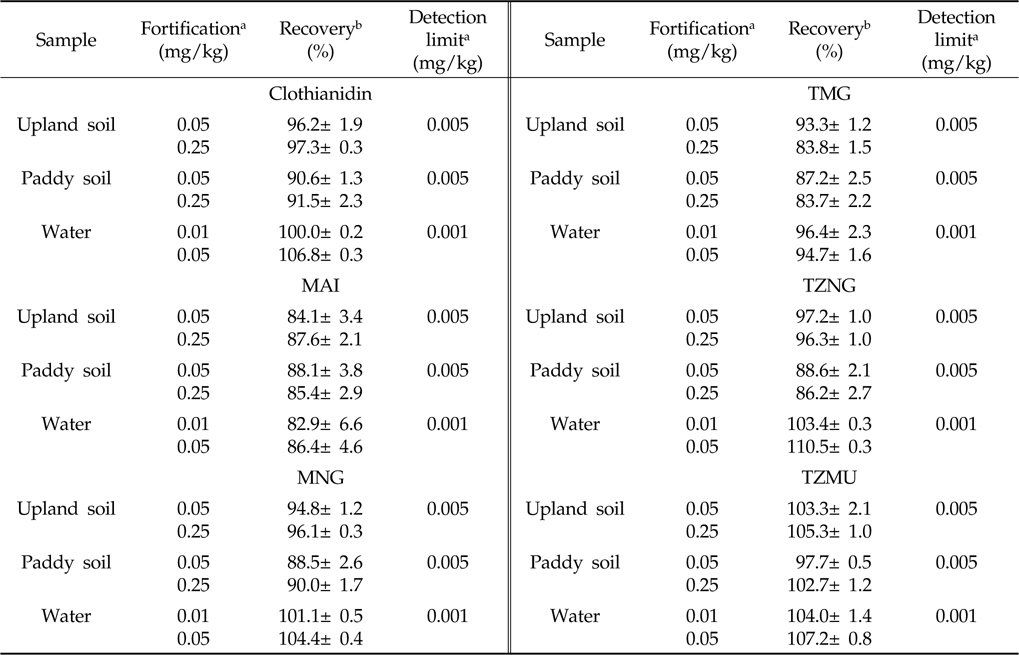
Recovery of clothianidin and its metabolites from fortified soil and water samples
토양 및 토양수시료의 경우 Clothianidin 및 5종 대사산물의 회수율은 87.4-104.3% 범위로 잔류분석 기준인 회수율 70-120% 이상을 모두 만족하였으며 분석법의 오차도 토양 및 토양수시료에서 5% 미만으로 나타나 높은 재현성을 보였다[농진청고시 제2012-13호. 농약의 등록기준(별표 14) 잔류성 시험의 기준 및 방법]. 따라서 본 연구에서 확립한 Clothianidin과 5종 대사산물의 잔류분석법은 우수한 검출감도, 분석효율 및 재현성을 나타내어 환경 중 Clothianidin의 행적 및 잔류수준을 평가하는데 적합하다고 판단되었다.