The aim of this study was to investigate the nutrient removal and biomass productivity in the wastewater using MMBR (Microalgae Membrane Bioreactor). MMBR process was combined OPPBR (Optical Panel Photobioreactor) and MBR (Membrane bioreactor). The OPPBR and MBR were operated 3 days and 9h HRT (Hydraulic retention time), respectively, using microalgae as
하수의 영양염류의 불완전한 제거는 하천의 부영양화를 유발하고, 이로 인한 문제점과 부작용은 다양한 형태로 나타나고 있다. 이러한 문제들을 해결하기 위해 하수처리장 신설 및 기존의 하수처리 공법 개선 등의 대책이 요구되고 있다. 기존에 적용해왔던 여과설비, 약품 응집, 침전, 오존분해, 자외선 소독 등의 물리화학적인 방법은 기존 처리시설 설비에 큰 변화를 주지 않고 부가적으로 설치하여 사용할 수 있으며 안정적이고 높은 효율의 처리효과를 얻을 수있다는 장점이 있으나 경제적 측면과 기술적인 측면에서 대규모 처리설비를 설치운영 하기에는 무리가 있고, 경우에 따라 다량의 처리 부산물이 발생한다는 단점이 있다(Seviour et al., 2003). 주로 활성슬러지가 저류된 생물반응조 내에서 미생물의 대사과정을 극대화하여 각종 오염물질을 제거하는 생물학적 처리방법은 비용대비 처리효율측면에서 물리화학적 방법보다 유리하여 국내 하수 처리장에서 많이 사용하고 있으나 유입수의 운전방법 및 슬러지 팽화 등의 다양한 문제점을 가지고 있으며, 현탁고형물과 유기물질을 제거할 수는 있지만 질소 및 인과 같은 영양염류의 제거가 유입성상에 따라 효율이 많이 달라진다(Abbgglen et al., 2008; Borghei et al., 2008). 분리막 생물반응조(membrane bioreactor, MBR) 공정은 특히 작은 규모에서도 충분히 경제성을 확보할 수 있고 자동화가 용이하며 운전이 간편하면서도 높은 처리효율을 보이기 때문에 소규모 하수처리장에 적합한 공정이다(Singh and Thomas, 2012). 또한 미세한 크기의 기공을 갖는 분리막을 응용하여 마이크로 단위이하 수준의 입자성 오염물질을 완벽히 걸러낼 수 있으며, 오염정화에 필요한 미생물의 유실을 방지하여 생물학적 처리 능력이 극대화됨으로써 일반 공정에 비해 처리속도가 빠르다(Choi et al., 2012; Rusten et al., 2006). 이러한 장점에도 불구하고 그 적용이 활발히 이루어지지 않는 가장 큰 원인은 분리막의 오염에 따른 막의 세정 및 교체 비용에 있다(Abbegglen et al., 2008). 이러한 기존 처리시스템의 단점을 보완하고자 다양한 공정들을 적용하는 시도들이 증가하고 있다(Kang et al., 2012). 그 중 하나가 하수의 영양염류를 제거할 수 있고, 생성된 부산물을 바이오에너지로 사용할 수 있는 미세조류를 이용한 처리공정이 하수처리공법에 적용, 시도되고 있다.
미세조류는 하수내의 유기물과 질소, 인등의 성분을 흡수하여 성장할 수 있기 때문에 하수의 영양염류를 제거함과 동시에 유용한 바이오매스를 생산할 수 있다. 미세조류의 생장에 가장 많이 소요되는 원소인 C, H, O 등은 물과 대기 중의 이산화탄소로부터 계속적으로 공급이 되므로 결국 N, P, K 등의 공급양에 의해 미세조류의 생장이 조절될 수있다. 특히 P는 DNA, RNA, ATP 등의 구성물질로서 조류와 식물의 생장에 절대적인 영향을 미치는 필수 요소이며, 질소는 미세조류의 중요한 구성 성분으로 지수적 생장에서 유기물의 10%를 차지한다(Chen et al., 2011; Schindler, 2012). 미세조류의 질소 섭취 기작은 먼저 세포에 의해 섭취된 nitrate는 nitrate reductase에 의해 nitrite으로 환원되고 다시 nitrite reductase에 의해 nitrite를 ammonium으로 환원시킨다. 그리고 ammonium은 glutamine synthetase와 glutamate synthetase에 의해 aminoacids 형태로 축적된다(Jin et al., 2003; Shi et al., 2007). 미세조류를 대량생산하기 위해서는 적당한 조도의 빛, CO2, 무기 영양소, 적정한 온도 및 pH를 필요로 한다. 특히 미세조류는 광합성 생물로서 빛의 균일한 분포가 미세조류의 증식에 많은 영향을 미친다 (Choi and Lee, 2011; Wijffels and Barbosa, 2010). 미세조류의 대량배양 시스템은 밀폐형과 개방형으로 나뉘는데, 개방형 시스템은 대기 중 이산화탄소의 비효율적 사용과 배양액의 불완전한 혼합으로 바이오매스의 농도가 밀폐형에 비하여 낮으며, 외부 미생물에 대한 오염의 가능성과 환경적인 영향을 많이 받는 단점이 있다(Haag, 2007; Woertz et al., 2009). 반면 광생물 반응기는 외부적 요인에 대한 오염문제가 적고, 시설이 용이하며, 반응기의 부피 대비 표면적을 최대화 할 수 있어서 널리 사용되고 있다(Choi et al., 2013; Hsieh and Wu, 2009). 그러나 이러한 광생물 반응기들은 초기 셀 농도가 증가함에 따라 셀의 비증식 속도는 반대로 감소하는 현상을 보였는데, 이는 각 셀의 그림자효과로 인해 광합성의 저해현상이 발생되었기 때문이다(Moreno-Garrido, 2008; Wu and Shi, 2007). 이러한 그림자효과로 인한 광합성 저해효과를 극복하기 위하여 반응기에 도광판(optical panel)을 삽입하고 광원으로 LED(Light Emitting Diode)를 사용하여 반응기 내부에 빛의 분포를 균일하게해 줌으로써 바이오매스 증식률을 향상시키고자 개량된 것이 OPPBR (Optical Panel Photobioreactor)이다(Choi et al., 2013). 선행연구 결과 OPPBR 반응기에서의 바이오매스 증식률은 일반 다른 반응기와 비교하여 높은 바이오매스 증식률을 나타내었다(Choi et al., 2013; Choi and Lee, 2012). 그러나 OPPBR만을 단독으로 이용하여 일반하수를 처리한 결과 다른 공정과 비교하여 영양염류의 제거율이 낮았고 실제하수처리장에 적용하기에는 환경인자의 영향이 많아 처리효율의 변동성 많은 문제점이 있었다(Abdel-Raouf et al., 2012; Boonchai et al., 2012; Choi and Lee, 2014).
따라서 본 연구에서는 이러한 문제점을 보완하고자 미세조류를 이용하여 하수 처리를 할 수 있는 OPPBR 공정과 MBR 공정을 결합한 새로운 MMBR (Microalgae Membrane Bioreactor)공정을 이용하여 하수처리의 효율성을 향상시키고, 하수의 영양염류를 안정적으로 제거함과 동시에 바이오 디젤 추출과 이산화탄소 고정 등으로 유용한 미세조류의 바이오매스 수확을 동시에 하고자 하였다. 본 연구는 MMBR 공정을 상용화하고자 일반하수를 이용하여 MMBR 공정에서 미세조류의 바이오매스 생산성과 영양염류의 제거율을 알아보고자 하였다.
2.1. Microalgae cultivation and characterization of wastewater
본 연구에 사용된 미세조류는 3-8 μm 크기의 구형
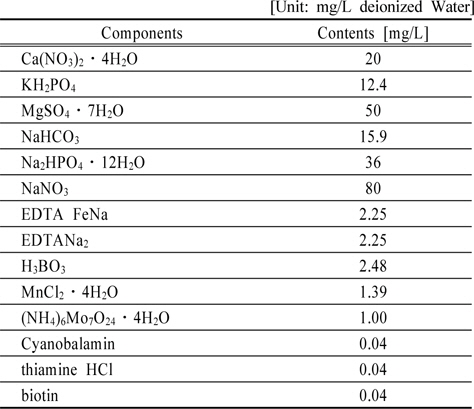
[Table 1.] A chemical composition of Jaworski's Medium

A chemical composition of Jaworski's Medium
본 실험은 MMBR공정을 실제 하수처리장에 적용하기 위하여 lab scale로 진행된 선행 실험이다. 실험에 사용된 하수는 G 시의 생활하수이며 전처리가 끝난 하수를 채집하여 원생동물과 미생물의 오염을 막기 위해 필터링하여 사용하였다. G 시의 하수성상은 MLSS 2530.8 ± 158.7 mg/L, BOD 140.3 ± 11.1 mg/L, COD 267.7 ± 18.5 mg/L, TN 24.3 ± 8.6 mg/L, NO3-N 10.8 ± 3.3 mg/L, TP 5.0 ± 2.5 mg/L 그리고 PO4-P 2.2 ± 0.7 mg/L 이였다.
2.2.1. Characteristics of optical panel
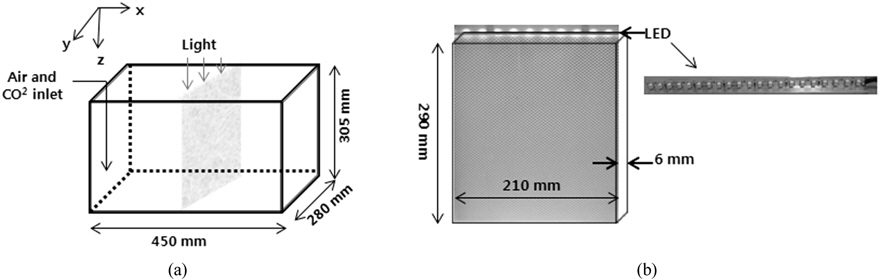
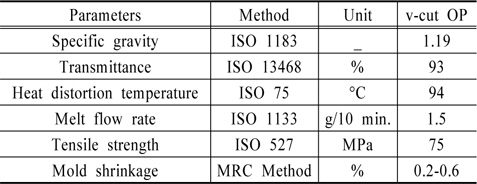
Fig. 1(b)에 도광판의 모식도를 나타내었다. 실험에 사용한 도광판은 210 mm (가로) × 290 mm (세로) 크기이며, 빛의 투과율이 좋은 Poly-MethylMethAcrylate (PMMA)로 제작하였다. 일반적인 v-cut 방식은 후면에 홈을 내어 반사판을 이용하여 전면으로 빛을 방출시킨다. 그러나 본 실험에서는 도광판 양면에 v-cut 을 제작하여 빛이 양면으로 분산되게 하였다. 도광판에서는 Lamp로부터 입사되는 빛을 효과적으로 반사를 시키기 위해 도광판의 배면(뒷면)에 인쇄방식 또는 v-cut 등의 방법을 통해 특유의 반사체를 형성시킨다. 이 반사체들은 모두 입사 되는 빛을 앞부분으로 반사시키는 역할을 하는데 인쇄방식은 아크릴 뒷면에 특수잉크를 소재로 하여 점들을 인쇄하여 입사되는 빛을 그 점들에서 반사를 시키는 방법이다. 반면, v-cut 방식은 아크릴 뒷면에 홈을 내어 그 홈들이 반사체 역할을 하여 빛의 방향을 바꾸어 전면으로 방출시키는 방법을 사용한다. v-cut 방식은 빛의 분포를 최대한 균일하게 분사시키기 위해 광원으로부터 멀어질수록 v-cut의 간격을 줄이고, 깊이를 늘리는 방법을 사용한다. 그래서 v-cut 방식은 홈의 간격과 홈의 각도를 이용하여 빛의 분산도를 조절하기 때문에 홈이 없는 flat plate에 비해서 빛의 효율이 높다(Choi and Lee, 2012). Table 2에 v-cut 도광판의 특성을 나타내었다. 선행연구(Choi and Lee, 2014) 결과 도광판은 6 mm 두께가 경제성이나 빛의 분산율에서 다른 두께보다 뛰어나 본 실험에서는 6 mm 두께의 도광판을 사용하였다.
[Table 2.] Characteristics of optical panel (OP)
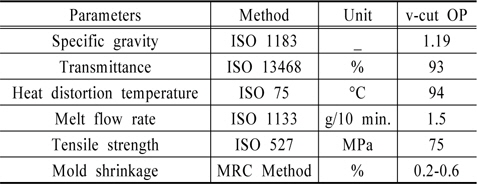
Characteristics of optical panel (OP)
2.2.2. Optical Panel Photobioreactor (OPPBR) construction and operation
OPPBR 반응기(Fig. 1(a))는 450 mm(가로) × 280 mm (세로)× 305 mm (높이)이며, 반응기의 총용량은 40 L이다. 공기는 0.5 L/min로 지속적으로 주입했으며, 공기 주입률에 따른 CO2의 주입량은 0.02 vvm 이였다. 도광판은 반응기의 정 가운데에 삽입하여 빛이 반응기 전체에 균일하게 전달되도록 하였고, 도광판 설치에 따른 양쪽 반응기의 거리는 각각 225 mm 였다.
미세조류 배양을 위하여 개방형 배양기는 광원으로 주로 태양광이 사용되나 밀폐형 배양기의 경우 일반적으로 형광 등을 많이 사용하였다. 그러나 형광등의 경우 높은 유지비용과 과도한 열이 발생하는 문제점으로 인해 최근에는 LED (Light Emitting Diode)를 많이 사용한다. LED는 미세조류에 필요한 파장의 빛을 선택적으로 사용할 수 있어 효율적이다. 실험에 사용한 LED 램프는 도광판에 삽입되는 빛의 집중도를 향상시키기 위해 bar 형식의 LED 램프를 특별 제작하였으며(Fig. 1(b)), LED에 공급되는 전원은 모델 FP-60-12 파워공급기(AD & Lighting, Suwon, Kyonggi-Do, Korea)를 사용하였다. 모든 광원은 위에서 아래로 공급하였다. LED는 white 색상을 사용하였으며 LED bar의 광량은 1,700 Lux이다. 광합성에 사용되는 빛의 양을 나타내는 광량은 56 μmol/m2/s 였으며, 초기
2.2.3. Microalgae Membrane Bioreactor (MMBR)
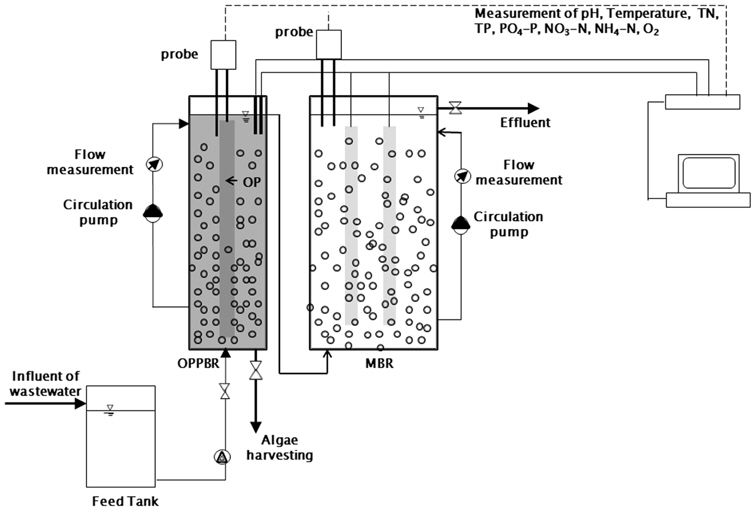
MMBR 공정은 1차 처리공정으로 OPPBR 공정과 2차 처리공정으로 MBR 공정을 결합하여 만든 공정으로써 membrane은 0.2 μm (PES, Milipore) 기공사이즈의 평막을 사용하였고, 반응기 안에 2개의 분리막을 설치하였다(Fig. 2). MBR공정의 기본 운영 조건을 Table 3에 나타내었다. MBR반응기의 크기는 OPPBR의 크기와 같으며 반응기의 총용량은 40 L 였다. MBR 유입수의 성상은 MLSS (650 ± 83.7mg/L), COD (168.3 ± 23.7 mg/L), BOD (30.24 ± 5.1 mg/L), TN (14.65 ± 2.7mg/L), NO3-N (5.42 ± 2.1 mg/L), TP (0.86 ± 0.02 mg/L) 그리고 PO4-P (0.43 ± 0.12 mg/L) 였다.
[Table 3.] The operating conditions of membrane bioreactor

The operating conditions of membrane bioreactor
Fig. 2에 OPPBR 공정과 MBR 공정을 결합한 MMBR 공정을 나타내었다. 하수의 원수는 Feed tank에 모아 부유물을 제거한 후에 OPPBR 공정으로 공급하였다. OPPBR 공정에서 성장한 미세조류는 Iron sulphate(II)를 이용하여 응집 처리하여 수확하였으며, 상등액은 펌프를 이용하여 MBR 공정으로 이송하여 처리하였다. OPPBR 공정의 기간은 3 days, MBR 공정에서는 9 hr의 HRT를 이용하여 처리하였다. MMBR 공정은 OPPBR 공정이 MBR공정의 전처리를 대신하기 때문에 전처리를 따로 할 필요가 없고, 전처리에 사용되는 화학약품을 절약할 수 있으며, MBR의 파울링을 현저하게 감소시킬 수 있는 장점이 있다. 따라서 미세조류의 대량증식 및 MBR과 OPPBR의 단독공정과 비교하여 하・폐수처리의 처리효율을 향상시키는 일거양득의 효과를 누릴 수 있다. 그러나 MBR을 OPPBR의 전단에 설치할 경우 MBR의 파울링이 심해서 시간이 지나면서 압력변화가 크게 나타났다. 또한, MBR 공정에서의 영양염류 제거율이 높아 OPPBR에서 미세조류의 바이오매스 생산량이 OPPBR + MBR 과 비교하여 현저히 낮았다.
바이오매스의 증가량을 알 수 있는 미세조류의 건조 질량은 10 mL의 샘플을 GF/C (Watmann, 영국)로 여과한 후 105℃에서 24시간 건조한 후 그 질량을 측정하였다.
CB 는 바이오매스의 양, Cb 및 Cb0 는 t와 t0 때의 바이오매스의 양을 나타낸다.
수중광량은 조도계(HOBO-Light Intensity, Onset Computer, USA)를 이용하여 수중광량을 측정하였다. 조도계는 LI-193SA센서와 LI-1400 기록계(Li-COR, Inc., Lincoln, Nebraska, USA)를 이용하여 영점조정을 하였으며, 측정 시 센서위의 미세조류를 제거하여 미세조류로 인한 수중광량의 오류를 최소화하였다. 측정된 수중광량을 계산하여 광효율을 나타내었다.
COD, TN, TP는 공정시험법과 (주) 휴마스 Kit 로 측정하여 평균값을 사용하였으며, PO4-P, NO2-N, NO3-N은 IC (ShimadzhuTM SIL-10AP)로 측정하였다. 실험은 총 10번을 반복 실험하여 평균 데이터를 사용하였다.
3.1. Light transmittance and biomass productivity in OPPBR (Optical Panel Photobioreactor)
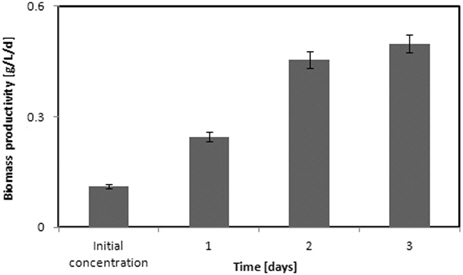
미세조류의 성장은 종에 따라 다양한데 일반적으로 광합성에 의한 성장 및 증식에서 온도와 빛의 강도는 매우 중요한 성장요인이며, 특히 광의 균일한 분포는 반응기에서 미세조류를 대량 증식할 수 있는 중요한 요건이다(Choi and Lee, 2011; Ogbonna and Tanaka, 2000). 즉, 미세조류는 스스로 내부의 온도 조절 기능이 없기 때문에 주변 환경의 온도와 빛은 미세조류의 바이오매스 성분, 신진대사, 그리고 신진대사의 반응속도에 직접적으로 영향을 미치는 것으로 알려져 있다(Grobbelaar, 2000; Masojidek and Torzillo, 2008). 본 실험은 광 반응기 안의 빛의 균일한 분포를 향상시키고 그에 따라 미세조류의 증식을 향상시키고자 도광판을 삽입한 OPPBR을 이용하였다. 실험결과 반응기 안의 빛의 분포는 305 mm 깊이에서 92%가 측정되어 반응기 내부까지 90%이상의 빛이 확산되었음을 알 수 있었다. Fig. 3에 OPPBR 반응기에서의 3일 동안 바이오매스 생산량을 나타내었다. 바이오매스 생산성은 초기 농도 0.112 g/L/d에서 1일째 0.245 g/L/d, 2일째 0.454 g/L/d 그리고 3일째 0.498g/L/d을 나타내어 초기농도와 비교하여 1일째에 2.2배, 2일째에 4.05배 그리고 3일째에 4.45배 증가하였고, 2일째까지 는 폭발적으로 증가하였으나 3일째에 바이오매스 생산량이 둔화되었음을 알 수 있다.
Hsieh and Wu (2009)는 투명한 사각형 반응기에 일반 flat panel과 LED를 이용하여
3.2. Substrate consumption and nutrient removal in MMBR process
3.2.1. Consumption of COD and BOD
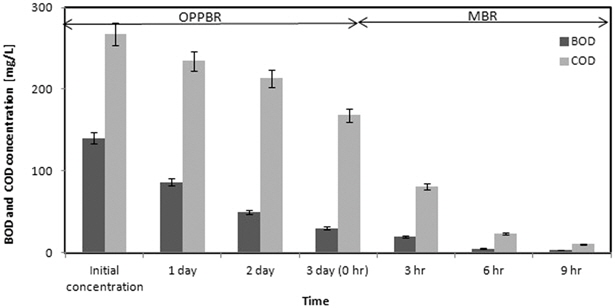
Fig. 4에 MMBR 공정에서 BOD와 COD의 제거과정을 나타내었다. BOD는 초기농도 140.3 mg/L에서 OPPBR 공정에서 3일 동안 처리한 후 30.2 mg/L가 남아 78.45%의 제거효율을 나타내었다. MBR 공정에서는 9h 후에 3.4 mg/L가 측정되어 MBR 공정에서는 전체 공정의 19.11% 제거효율을 나타내었고, 전체 MMBR 공정에서는 97.56%의 제거효율을 나타내어 일반 생물학적 처리와 비교하여 높은 제거효율을 나타내었다. Wang et al. (2006)은 BAF (Biological Biological Aerated Filter)공정을 이용하여 BOD를 처리한 결과 61.5%의 처리효율을 보고하였고, Abdel-Raouf et al. (2012) 는 도광판을 사용하지 않고 미세조류만을 이용하여 일반하수에서 BOD를 처리한 결과 68.4%의 처리효율을 보고하였다. 또한 활성슬러지를 이용하여 BOD를 처리한 결과 처리효율은 약 60-70%인 것으로 보고하였다(Choi et al., 2012). 도광판을 이용한 OPPBR 공정은 도광판을 사용하지 않은 미세조류만을 이용한 처리와 일반 활성슬러지 공정과 비교하여 높은 BOD 처리효율을 나타내었다.
COD는 초기농도 267.7 mg/L에서 OPPBR 공정을 거친후 168.3 mg/L가 남아 OPPBR 공정에서 37.12%의 낮은 제거효율을 나타내었다. 미세조류가 종속영양을 할 경우에 는 유기수소를 공여체로 이용하며, 유기분자를 탄소원으로 이용한다. 그러나 미세조류가 독립영양을 할 경우에는 다른 미생물과는 달리 외부 유기물을 파괴하여 에너지를 얻지않고 직접 물과 대기 중의 이산화탄소 및 빛 에너지로부터 유기물을 생산하여 살아가기 때문에 COD의 양이 많이 감소하지 않았을 것으로 생각된다. Klausmeier et al. (2004)는 COD가 없는 인공하수를 만들어
3.2.2. TN and NO3-N removal
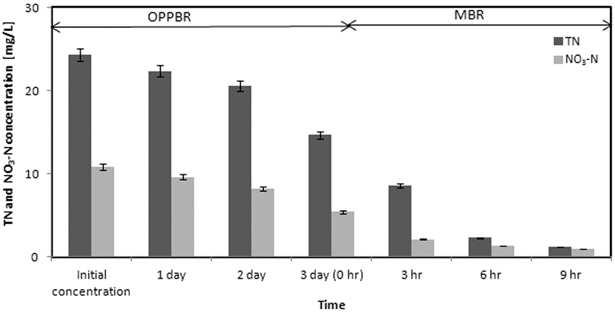
Fig. 5에 MMBR 공정에서 TN과 NO3-N의 제거효율을 나타내었다. TN과 NO3-N은 각각 초기농도 24.30 mg/L와 10.82 mg/L에서 OPPBR 공정 후에 각각 14.65 mg/L와 5.42 mg/L가 측정되어 39.71%와 49.91%의 낮은 제거효율을 나타내었다.
TN과 NO3-N은 COD와 비슷하게 OPPBR 공정에서 낮은 제거율을 나타내었는데 선행실험결과 질소는 미세조류의 성장에 중요한 영향인자이지만, 인과 비교하면 인이 미치는 절대적인 영향보다는 미세조류의 증식에 적은 영향을 미치는 것으로 나타났다(Shi et al., 2007). Ahn et al. (2013)은 미세조류의 증식을 위하여 C, N만을 첨가하였을 경우에는 엽록소-a 농도의 증가가 거의 없었고, P를 첨가할 경우에는 엽록소-a의 농도가 크게 증가하였다고 보고하였다. 이는 빛이 충분한 상태에서 미세조류의 생장은 대부분 P에 의하여 제한된다는 것을 나타낸다. Klaumeier et al. (2008)은 수십년에 걸친 대규모 현장실험과 사례연구의 결과로서 부영양화를 줄이기 위하여 호소 및 유역관리의 핵심은 P의 유입을 줄이는 것이라 결론을 내었다.
NO3-N의 제거율은 TN과 비교하여 약 10%정도 높았는데 이는 미세조류가 용해되지 않은 particle N 보다는 하수에 용해되어있는 NH4-N과 NOx-N를 생장에 이용하기 때문이 다. Boelee et al. (2012)는 하수에서 미세조류를 이용하여 영양염류를 제거한 결과 미세조류의 생장은 전처리가 되었거나 처리가 끝난 유출수에서는 영양성분이 적어 P제한으로 나타나고, 전처리가 되지 않았거나 부분 처리된 하수에서는 용해되지 않은 N이 많이 포함되어 있어 N의 제한이 나타난다고 보고하였다. 본 실험에서는 부유물질만 제거한 부분처리된 하수를 사용하였기 때문에 이 또한 낮은 N 제거에 영향을 미쳤다고 볼 수 있다.
TN과 NO3-N은 OPPBR 공정에서의 제거효율은 낮았지만 MBR 공정에서는 각각 초기농도 14.65 mg/L와 5.42 mg/L에서 시작하여 유출수에 1.23 mg/L와 0.97 mg/L가 남아 각각 전체 공정의 55.23%와 41.13%의 제거효율을 나타내었다. 전체 MMBR 공정에서는 각각 94.94%와 91.04%의 제거율을 나타내어 일반 생물학적 처리와 비교하여 높은 제거율을 나타내었음을 알 수 있다. 실제 하수처리장에서 사용하는 생물반응조의 효율을 보았을 때 생물반응조의 질소성분에 대한 제거율은 50 ~ 60% 정도이다(Adov et al., 2008).
3.2.3. TP and PO4-P removal
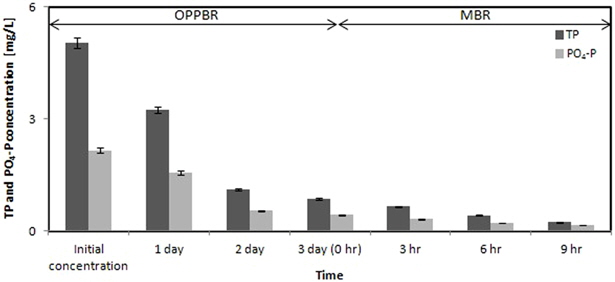
Fig. 6에 MMBR공정에서 TP와 PO4-P의 제거과정을 나타내었다. 본 실험결과 OPPBR 공정에서 TP와 PO4-P는 초기농도 5.03 mg/L 와 2.16 mg/L에서 0.86 mg/L 와 0.43 mg/L가 남아 각각 82.80%와 80.09%의 높은 제거효율을 나타내었으며, TN의 제거율과 비교하여 약 43%이상의 높은 제거율을 나타내었다. MBR 공정에서 TP는 16.74%, PO4-P는 12.97%의 제거효율을 나타내었으며 MBR 공정을 거친 유출수에 서의 TP와 PO4-P의 농도는 각각 0.23 mg/L와 0.15 mg/L가 측정되었다. 전체 MMBR에서의 TP와 PO4-P의 제거율은 각각 99.54%와 93.06%의 높은 제거효율을 나타내었다. Colak and Kaya (1988)은
본 실험결과 COD, TN, NO3-N의 OPPBR에서의 제거율은 낮았으나 후 공정인 MBR공정에서 OPPBR 공정에서 제거하지 못한 영양염류를 제거함으로써 MMBR 공정에서의 제거율은 OPPBR 공정과 MBR 공정의 단독공정과 비교하여 영양염류의 제거율이 훨씬 높았음을 알 수 있었다. 또한 OPPBR 공정에서 TN과 NO3-N의 제거율은 TP와 PO4-P의 제거율 보다 낮았다. 이는 미세조류는 종에 따라서 성장에 필요한 영양염류를 선택하게 되는데 본 실험에 사용한
OPPBR 공정과 MBR 공정을 결합한 MMBR 공정은 OPPBR 공정 단독으로 일반하수처리를 할 때와 비교하여 영양염류 제거율이 높고, 처리효율이 안정적이어서 실제 일반 하수처리장에 적용이 가능하며, 미세조류의 바이오매스 생산에도 유용하여 하수처리장에 적용할 경우 일거양득이다.
본 연구의 결과는 아래와 같다. 1) OPPBR 반응기의 미세조류는 초기농도와 비교하여 4.45배 증가하였다. 2) BOD와 COD는 OPPBR 공정에서 각각 78.45%와 37.12%,MBR에서 19.11%와 58.94%의 제거효율을 나타내어, MMBR공정에서는 각각 97.56%와 96.06%의 높은 제거효율을 나타내었다. BOD는 OPPBR 공정에서 COD는 MBR 공정에서 더 많이 제거되었음을 알 수 있었다. 3) TN, NO3-N, TP와 PO4-P는 OPPBR 공정에서 각각 39.71%,49.91%, 82.80% 그리고 80.09% MBR 공정에서 각각 55.23%,41.13%, 16.74%와 12.97%의 제거효율을 나타내어 전체 MMBR 공정에서 각각 94.94% 91.04%, 99.54%와 93.06%의 제거효율을 나타내었다. 4) 따라서 OPPBR 공정과 MBR 공정을 결합한 MMBR 공정을 이용할 경우 하수의 영양염류 제거효율을 향상시키고 미세조류의 바이오매스를 수득하여 유용하게 사용할 수있어 효율적이며, 실제 하수처리장에 적용이 가능하다.