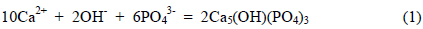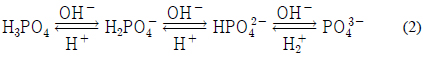This study was done to find chemicals adequate to control alkalinity and hardness in order to reduce dissolved phosphorus in water bodies like rivers and lakes. Five chemicals were selected for the study: calcite, lime, dolomite, magnesite, and gypsum. Data were obtained from the calculations with MINTEQ model as a function of dosage variations of each chemical. Findings are as follows: Three out of the five chemicals are found to be effective in reducing the dissolved phosphorus, i.e., calcite, lime, and dolomite. Calcite and dolomite are able to lower the phosphorus concentration up to one thousandth fold whereas lime does one hundred thousandths fold. In viewpoint of pH variation, both calcite and dolomite seem to be safe since the pH does not increase over 8.3 even in case of overdose. In the same circumstance, with lime the pH increases beyond 9 which is considered to be the highest pH level for the protection of water ecosystem. Nevertheless it is recommendable to use lime in case where there are some difficulties in water quality control due to algae blooms.
인과 질소는 수체의 부영양화를 일으키는 대표적인 물질이다(MPCA, 2008). 수체의 부영양화를 방지하기 위해 하폐수처리시설 방류수의 수질이 총인과 총질소 함량이 규제대상에 포함되어 탈질공정과 탈인공정이 하폐수처리공정에 추가되고 있는 것이 작금의 현실이다.
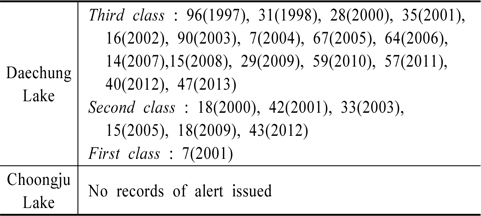
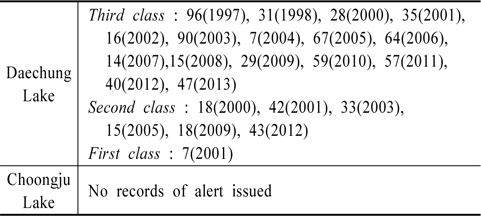
호수와 강과 같은 수체의 부영양화로 인해 조류가 번성하고 그에 따른 수질악화에 대비하고자 1997년부터 조류예보제가 실시되었고 그 기준은 Table 1과 같다(MOE, 2008). 이 같은 기준에 의한 그 동안의 대청호와 충주호의 조류예보 발령실적은 Table 2와 같다. Table 2의 내용은 그 동안 단편적으로 발표된 환경부자료를 입수하여 정리한 것이다.
[Table 1.] Criteria for the algae alert

Criteria for the algae alert
[Table 2.] Records of algae warning since 1997 days (year)
Records of algae warning since 1997 days (year)
위도상으로 큰 차이가 나지 않는 지역에 위치한 두 호수가 일사량과 같은 에너지 유입에 큰 차이가 없었을 것임에도 그 동안 조류예보제에 의한 발령실적에 큰 차이가 있음을 인지할 수 있다. 즉 1997년 이후 대청호의 경우는 조류주의보 695일, 조류경보 169일, 그리고 조류대발생이 7일간으로 총871일간 조류주의보 이상의 발령실적이 있지만 충주호에서는 단 하루도 없었다.
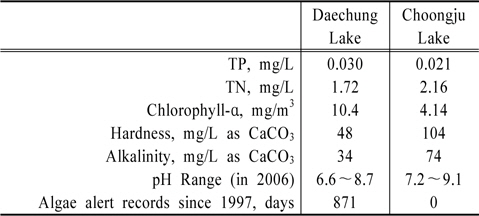
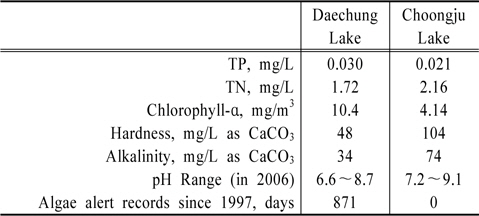
두 호수의 조류예보실적이 크게 다른 차이점을 나타내는 이유를 알아보기 위해 두 호수의 수질자료를 입수하여 비교 검토하였다. 두 호수의 수질조사는 호수의 관리주체인 한국수자원공사 대청댐관리사업소와 충주댐관리사업소에서 매월 1회 정기적으로 실시해오고 있다. 여러 가지 다양한 조사항목가운데서 조류의 생육에 직접적인 영향을 미칠 수 있는 총질소, 총인, 그리고 조류의 개체수와 비례관계에 있을 클로로필-ɑ의 함량의 지난 10년간 자료를 입수하여 정리한 것이 Table 3의 내용이다.
[Table 3.] Comparison of water quality data averaged for the last decade
Comparison of water quality data averaged for the last decade
Table 3에서 총인의 경우 대청호 0.030mg/L, 충주호 0.021 mg/L로서 대청호가 충주호에 비해 조금 높은 반면, 총질소의 경우 대청호 1.72 mg/L, 충주호 2.16 mg/L로서 대청호 보다는 충주호가 비교적 높은 것으로 나타났다. 같은 기간 클로로필-ɑ의 함량의 평균치가 대청호 10.4 mg/m3, 충주호 4.14 mg/m3로서 충주호보다는 대청호에서 월등히 높았던 것을 알 수 있다.
알칼리도와 경도는 호수수질 정기조사항목이 아니다. 따라서 대청댐 관리단과 충주권 관리단의 자료에는 없기 때문에 두 호수를 상수원으로 이용하는 청주정수장과 충주정수장의 자료를 입수하여 분석하였다. 지난 10년간 대청호의 경도와 알칼리도의 평균값은 각각 48 mg/L as CaCO3와 34 mg/L as CaCO3이고, 충주호의 경우는 각각 104 mg/L as CaCO3와 74 mg/L as CaCO3로 나타났다. 충주호의 경도와 알칼리도 모두 대청호에 비해 대략 두 배 이상의 값을 가진다. 충주호 상류지역에 해당하는 제천시와 단양군에 시멘트 공장들이 가동되고 있다는 점에서 충주호의 높은 경도와 알칼리도는 유역에 석회암 많이 분포되어 있는 지질학적 이유에서 기인하는 것으로 유추할 수 있다.
이상의 논의를 종합하면 조류예보제에 의한 경보발령은 대청호에서 활발한 반면에 충주호에서는 같은 기간 한 번도 나타나지 않았다는 것이며, 이와 같은 차이가 나타나는 원인이 두 호수 수질항목 중 두드러진 차이를 보이는 경도와 알칼리도의 차이에서 연유할 수 있다는 합리적인 의심이 가능하다. Kim and Park (2008)은 두 수질항목의 차이를 일으키는 원인물질이 석회석일 수 있다고 가정하고 혐기성 조건하에서 석회석이 인산염의 용해에 미치는 영향을 연구하였고, 그 결과 석회석의 존재는 퇴적층으로부터 인산염의 용출을 억제하는 동시에 경도와 알칼리도를 증가시켜 인산염 형성을 촉진시켜 호수에서 인의 내부부하를 감소시키는 효과가 있을 것이라고 주장하였다. 수화학평형모델인 MINTEQ를 이용하여 이 같은 주장을 이론적으로 확인하는 결과를 얻었다(Kim and Jeong, 2008). 앞의 두 연구는 대청호와 충주호의 수질만을 대상으로 연구하였기에 그 결과를 일반화하기에는 자료의 수가 부족할 수도 있다는 결점이 있다. 이를 보완하기 위해서 지난 10년간 13개의 다목적 댐과 용수전용댐에 대한 수질조사 자료를 수집정리하여 분석한 결과 클로로필-ɑ의 농도는 경도와 알칼리도를 변수로 하는 2차함수를 따르는 것으로 나타났다(Kim and Kim, 2014). 경도를 유발하는 칼슘이온은 식물의 생장에 필요한 요소로서 경도가 증가하면 식물의 일종인 조류의 생장이 촉진되지만, 반면에 경도가 매우 커지면 즉 칼슘이온의 농도가 커지면 인산이온과 침전물을 형성하여 용존인의 농도를 낮추게 되고 조류의 생장이 억제되는 결과를 초래한다. 또한 알칼리도가 증가하면 탄산종의 농도가 커지고 그에 따라 조류생장이 유리해지는 반면에 알칼리도가 매우 높으면 그에 대응하는 경도 또한 높아지고 이는 인산칼슘염의 형성을 촉진하여 용존인의 농도를 낮추어 조류의 생장을 억지하는 효과를 일으킨다. 즉 경도와 알칼리도의 증가는 어느 정도까지는 조류의 생장을 유리하게 하나 그 정도 이상이 되면 조류의 생장에 불리하게 작용할 수 있다. 따라서 경도와 알칼리도의 변화에 따른 클로로필-ɑ 농도는 극대점을 가진 포물선을 따라 변하는 것이다.
이상의 것을 종합해 보면 강과 호수와 같은 수체에서 경도와 알칼리도를 어느 정도 이상으로 높이게 되면 화학평형에 의해서 용존인의 농도를 감소시키고 이는 클로로필-ɑ의 농도를 감소를 초래할 수 있다는 것이다. 따라서 본 연구에서는 MINTEQ 모델을 이용하여 경도와 알칼리도를 동시에 증가시키기에 적합한 화학물질을 찾아내고 그에 따라 용존인의 농도가 어떻게 변화하는 가를 알아보고자 하였다.
지금까지 개발된 지구화학평형모델 중에서 MINTEQ 모델이 가장 다양한 적용이 가능하다(Allison et al., 1991). MINTEQ는 미국환경보호청(U.S.EPA)이 보급한 지구화학평형을 이루는 계의 화학종의 농도를 산출하는 모델로서 환경중에서 일어나는 용해상 물질, 흡착된 물질, 기체상 물질, 그리고 고체상 물질 상호간에 이루어지는 평형조성을 계산 할 수 있다. MINTEQ에는 계산 전에 입력화일을 생산하기 위해 연동되는 프로그램 PRODEF에 이용되는 신뢰성 높은 열역학 데이터를 포함하고 있다. MINTEQ는 사용자가 입력한 자료를 포함하여 자세한 계산결과를 제시한다. 계산결과에는 고려대상시스템 내에 존재하는 모든 화학종의 농도와 고체상들의 포화된 정도가 포함된다.
본 연구의 대상물질 중 인산염으로는 calcium hydroxyapatite를 선정하였다. Calcium hydroxyapatite의 화학식은 Ca5(OH)(PO4)3으로서 인산염들 중 열역학적으로 가장 안정한 물질로 알려져 있다(Koutsopoulst, 2001). 자연수생태계에 존재하는 인산염들은 그 주변환경의 화학적 조성에 따라 여러 가지가 있을 수 있겠으나 마치 높은 곳에 있는 물체가 낮은 곳으로 이동하여 위치에너지가 감소하듯이 화학물질들도 불안정한 상태에서 보다 안정한 상태로 옮겨가는 것이 자연의 이치이므로 다양한 인산염들 중에서 calcium hydroxyapatite를 연구대상물질로 선정하였다. Calcium hydroxyapatite의 생성반응식과 pH에 따른 용존인의 화학종 변환은 다음과 같다(Stumm and Morgan, 1996).
반응식에서 알 수 있듯이 경도의 한 성분인 Ca2+과 알칼리도에 기여하는 OH−가 calcium hydroxyapatite 생성에 영향을 미치고, OH−는 PO43−의 분율에도 영향을 미친다. 따라서 자연 수체에서 경도와 알칼리도의 증가는 가장 안정한 인산염인 calcium hydroxyapatite 생성을 촉진시킬 것으로 짐작할 수 있다.
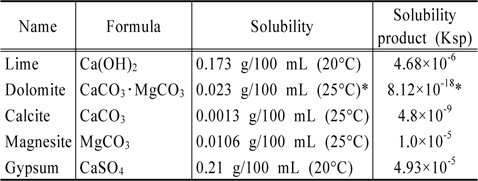
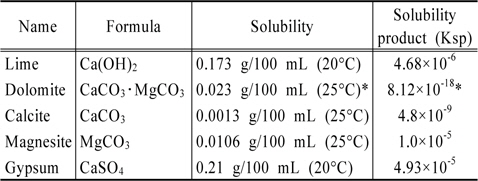
본 연구는 인산염의 용출에 미치는 경도와 알칼리도를 동시에 변화시키기에 적합한 화학물질을 선택하는 것에 초점을 맞추고 있다. 따라서 수중에서 용해시 경도와 알칼리도를 동시에 변화시킬 수 있는 lime(Ca(OH)2), dolomite (CaCO3・MgCO3), calcite(CaCO3), magnesite(MgCO3)를 선정 사용하였다. 또한 경도는 증가시키는 반면에 알칼리도는 낮추는 효과를 나타내는 물질인 gypsum(CaSO4)를 비교목적으로 사용하였다. 이 물질들의 특성으로 Table 4에 수록하였다.
[Table 4.] Materials used for this study
Materials used for this study
2.3. 연구대상물질과 calcium hydroxyapatite가 공존하는 수계에 대한 모의계산결과의 이용
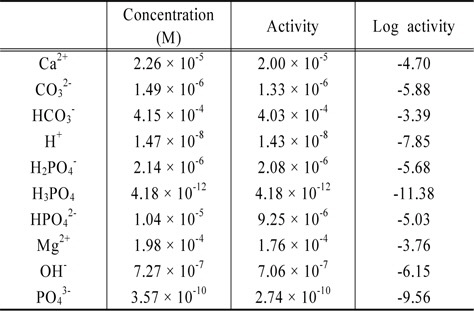
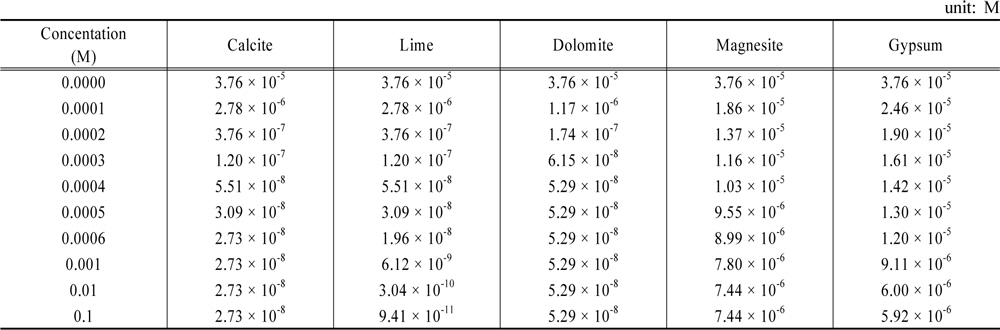
본 연구에서 MINTEQ 모델을 이용한 계산에서 calcium hydroxyapatite는 수계에 무한정 존재한다고 가정하였다. 또한 수체가 대기와 접해있다고 가정하고 대기중 CO2의 농도는 모델의 default 값 380 ppm으로 사용하여 계산하였다. 여기에 연구대상물질들의 농도를 0.0001 M부터 0.1 M로 순차적으로 증가시키며 계산하였으며, 최종 pH는 전하균형과 물질수지를 고려하여 산출하도록 설정하였다. 한 예로 마그네사이트의 농도를 0.0002 M로 입력하고 계산한 결과를 Table 5에 제시하였다.
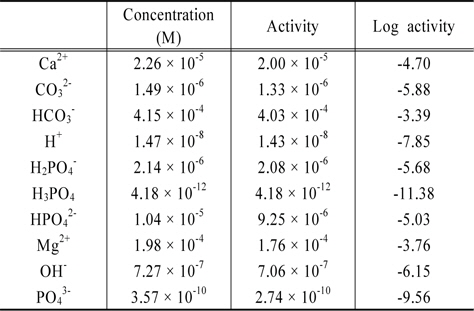
Results of MINTEQ calculation for the magnesitehydroxyapatite- water system open to the air
이로부터 magnesite-hydroxyapatite-water-air 계에서 magnesite 농도가 0.0002 M인 경우의 pH는 7.85임을 알 수 있으며, 알칼리도와 경도, 그리고 용존인의 농도를 다음과 같이 산출한다. 본 논문에서 용존인은 용존무기인(Dissolved Inorganic phosphorus, DIP)을 의미한다.
Alkalinity = [HCO3−] + 2[CO32−] + [OH−] − [H+]= 4.15 × 10−4 + 2 × 1.49 × 10−6 + 7.27 × 10−7 − 1.47 × 10−8= 4.19 × 10−4 eq/L
이를 mg/L as CaCO3로 표현하려면 환산인자 50,000 mg/eq를 곱해주면 되므로 알칼리도는 20.9 mg/L as CaCO3가 된다.
Hardness = 2([Ca2+] + [Mg2+])= 2(2.26 × 10−5 + 1.98 × 10−4)= 4.41 × 10−4 eq/L
이를 mg/L as CaCO3로 표현하려면 환산인자 50,000 mg/eq를 곱해주면 되므로 경도는 22.1 mg/L as CaCO3가 된다.
[soluble P] = [H3PO4] + [H2PO4−] + [HPO42−] + [PO43−]= 4.18 × 10−12 + 2.14 × 10−6 + 1.04 × 10−5 + 3.57 × 10−10= 1.77 × 10−5 M
3.1. 대기와 접촉한 lime-hydroxyapatite-water 계의 화학 평형 계산결과
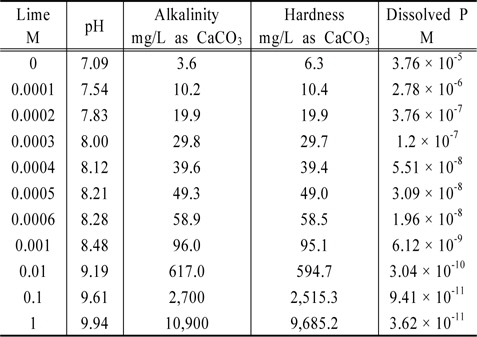
대기와 접촉시킨 lime-hydroxyapatite-water 계에서 lime 농도를 0 M에서부터 1 M 까지 변화시키면서 MINTEQ 모델을 이용하여 얻은 결과로부터 구한 알칼리도, 경도 및 용존인의 농도를 Table 6에 제시하였다. Lime의 농도가 증가함에 따라 알칼리도와 경도도 증가함을 알 수 있다. 반면에 용존인의 농도는 급격히 감소하는 것으로 나타났다. 이때 유의해야 할 점이 pH의 변화인데 lime의 농도를 1 mM 정도까지 높여도 pH가 8.48 정도로서 호수의 생태계를 보호하는데 큰 무리가 없을 것 같다. 참고로 미국환경보호국은 수생태계 보호에 적합한 호수의 pH 범위를 6~9로 제안하고 있다(U.S.EPA, 1976, 1986). Lime의 농도가 1 mM일 때 용존인의 농도는 lime의 농도가 0일 때에 비해 대략 16,000분의 1배 정도로 감소하는 것으로 나타났다. 이로부터 lime은 용존인의 농도를 감소시킬 수 있는 물질의 하나임을 알 수 있다.
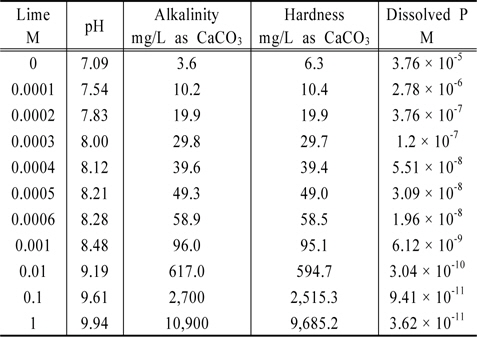
Various water qualities obtained from MINTEQ calculation for the lime-hydroxyapatite-water-air system
Lime 외에 cacite, dolomite, magnesite, 그리고 gypsum에 대해서도 동일한 과정으로 계산하였다. 그 결과를 정리하여 각각의 물질에 대하여 Table 6과 유사한 표를 제시할 수 있으나 생략하기로 한다.
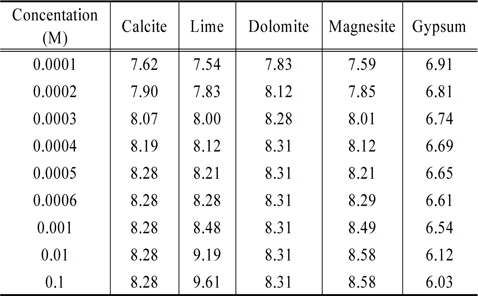
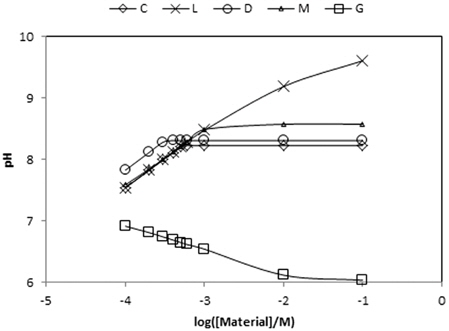
지금까지 Table 4에 제시한 5가지 물질들을 대상으로 MINTEQ 모델을 이용하여 계산한 결과로부터 각 물질들의 농도를 증가시킬 때 pH 변화를 Table 7에 정리하였다. 그리고 그 내용을 Fig. 1에 도시하였다. Fig. 1이 보여주는 바는 gypsum을 제외한 4가지 물질 모두 수용액의 pH를 증가시키는 결과를 초래한다는 것이다. 이중에서 calcite, dolomite, magnesite와 같은 탄산염들은 그들 농도의 증가에 따라 pH가 8.3~8.5 부근까지 증가하다가 더 이상 상승하지 않는 반면에 lime의 경우는 그 이상으로 상승한다는 점이다. Gypsum의 경우는 농도가 증가함에 따라 수용액의 pH를 낮추는 효과를 나타낸다. 이는 용해된 CaSO4가 가수분해하여 약염기 Ca(OH)2와 강산 H2SO4를 생성함에 기인한다. Gypsum의 경우 pH가 낮아지기는 해도 6 이상으로 유지되므로 pH 변화의 관점에서 보면 gypsum의 선택이 큰 무리는 없는것 같다. 본 논문의 graph에서 C는 calcite, L은 lime, D는 dolomite, M은 magnesite, 그리고 G는 gypsum을 나타낸다.
[Table 7.] Variations of the solution pH by various materials
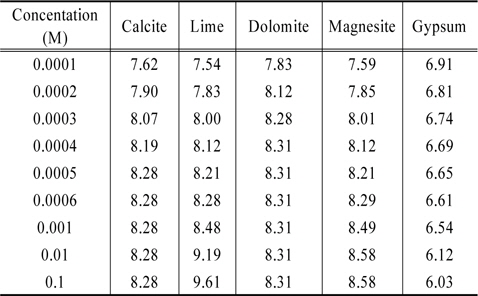
Variations of the solution pH by various materials
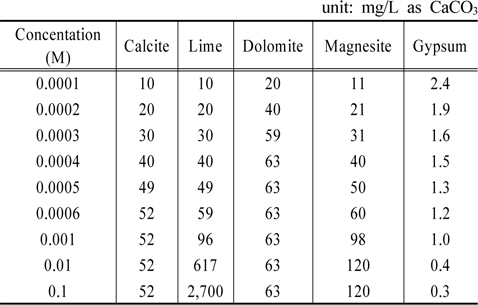
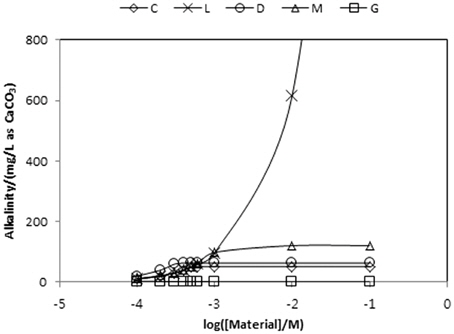
각 물질들의 농도를 증가시킬 때 알칼리도 변화를 Table 8에 정리하였다. 그리고 그 내용을 Fig. 2에 도시하였다. Fig. 2가 보여주는 바는 gypsum을 제외한 4가지 물질 모두 수용액의 알칼리도를 증가시키는 결과를 초래한다는 것이다. Calcite, dolomite, magnesite와 같은 탄산염들 농도증가에 따라 알칼리도가 각각 52, 63, 120 mg/L as CaCO3까지 증가하다가 더 이상 상승하지 않는 반면에 lime의 경우는 계속 상승하는 점이 특이하다. Gypsum의 경우 농도가 증가함에 따라 수용액의 알칼리도를 낮추는 효과를 나타낸다.
[Table 8.] Variations of alkalinity by various materials
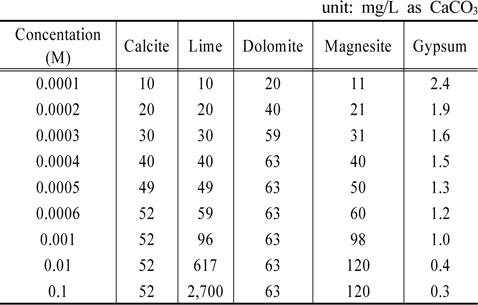
Variations of alkalinity by various materials
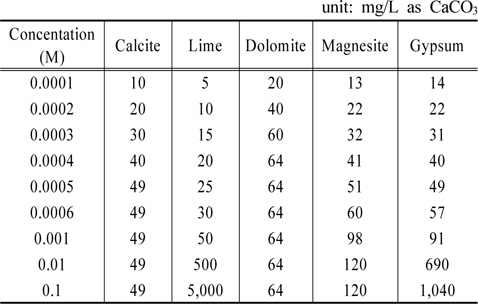
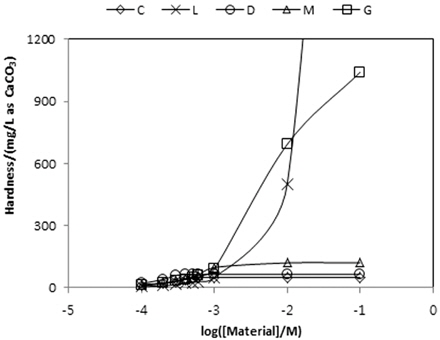
각 물질들의 농도를 증가시킬 때 경도 변화를 Table 9에 정리하였다. 그리고 그 내용을 Fig. 3에 도시하였다. Fig. 3이 보여주는 바는 calcite, dolomite, magnesite와 같은 탄산염들 농도증가에 따라 알칼리도가 각각 49, 64, 120 mg/L as CaCO3까지 증가하다가 더 이상 상승하지 않는 반면에 lime과 gypsum의 경우는 상승세가 이어진다는 점이다. 고농도 조건에서는 lime에 의한 경도의 증가가 gypsum에 의한 경도의 증가보다 더 크게 나타난다.
[Table 9.] Variations of hardness by various materials
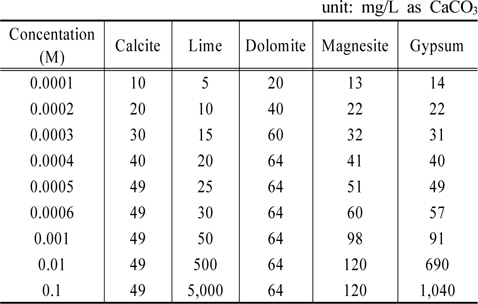
Variations of hardness by various materials
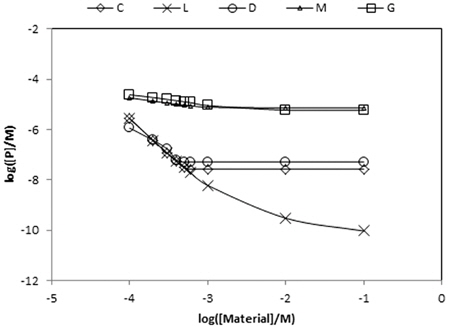
각 물질들의 농도를 증가시킬 때 용존인 농도 변화를 Table 10에 정리하였다. 그리고 그 내용을 Fig. 4에 도시하였다. Fig. 4에 따르면 5가지 물질은 세 그룹으로 나눌 수 있다. 첫째로 magnesite와 gypsum으로서 용존인의 농도를 초기농도의 십분의 1배정도로 감소시킬 수 있는 그룹이다. 둘째는 calcite와 dolomite로서 용존인의 농도를 천분의 1배정도 감소시킬 수 있는 그룹이다. 둘째 그룹의 장점은 과량이 가해져도 pH가 8.3 정도로 고정되고 용존인의 농도도 10−8 M 정도로 유지된다는 것이다. 셋째는 lime으로서 과량 가하면 용존인의 농도를 십만분의 1배인 10−10 M 정도로 낮출 수 있다는 것이다.
[Table 10.] Variations of soluble P concentration by various materials
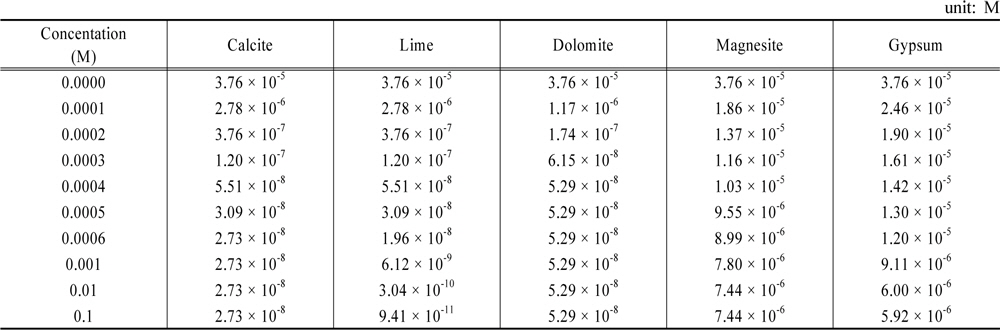
Variations of soluble P concentration by various materials
Magnesite는 경도와 알칼리도를 동시에 증가시킬 수 있는 물질이지만 경도를 나타내는 양이온이 Mg2+이어서 calcium hydroxyapatite의 평형에 큰 영향을 미치지 못하므로 용존인 농도 감소에 효과적이지 못하다. 그럼에도 불구하고 용존인의 농도를 약간 감소시키는 것은 pH가 증가하여 PO43− 이온의 분율을 높이기 때문인 것으로 풀이된다. Gypsum의 경우 Ca2+ 이온의 농도는 증가시키지만 낮은 pH로 인해 PO43− 이온의 분율이 낮아지기 때문에 용존인의 농도 감소에 그다지 효과적이지 않다.
지금까지의 논의로부터 얻은 정보를 통해 호수나 강 같은 수체에서 조류의 대량번식을 제어하기 위해 취할 수 있는 인위적 수단의 하나가 알칼리도와 경도를 동시에 높일 수 있는 물질을 선택 사용하여 용존인의 농도를 줄이는 것이 한 방법이 될 수 있다는 것이다. 이 물질들 중에서 효과를 기대할 수 있을 것으로 예견되는 것으로는 calcite, dolomite, lime 등이 있다. Calcite와 dolomite의 경우는 과량을 사용하더라도 pH를 8.3 이상 상승시키지 않으므로 수생태계에 미치는 영향이 크지 않을 것으로 기대할 수 있다. 반면에 lime을 사용할 경우에는 과량이 주입되면 pH가 9이상으로 상승하여 수생태계에 충격을 줄 수도 있어서 사전에 세심한 준비가 요구된다. 그러나 조류와 관련된 문제해결이 시간을 다투는 상황이라면 lime 사용을 고려할 수도 있을 것이다.
용존인 제어를 위해 calcite, dolomite, lime 등을 사용하고자 할 때 경제성을 고려하여 투입량을 결정해야 할 것이다. 본 연구의 추가적인 계산결과에 따르면 calcite, lime, 모두 0.0005 M (로그스케일로는 −3.30) 부근에서 그리고 dolomite는 0.0003 M (로그스케일로는 −3.52) 부근에서 불포화상태다. 그러나 0.0006 M 이상이 되면 포화상태가 되어 일부분이 그대로 침전하는 것으로 나타난다. 투입한 수처리제가 용해하지 않고 그대로 침전되는 비율이 클수록 경제성이 떨어질 것이다. 또 한 가지 주의해야 할 점은 과량사용으로 침전물량이 많아져 호수바닥을 capping 또는 코팅하는 효과가 나타나 저서생태계에 영향을 미칠 수 있다는 사실을 유의하여야 한다.
강과 호수와 같은 수체에서 용존인의 농도를 감소시킬 목적으로 경도와 알칼리도를 조절하기에 적합한 물질을 찾아내기 위해 수행한 본 연구의 결론은 다음과 같다. 연구대상으로 선정된 calcite, lime, dolomite, magnesite, 그리고 gypsum 등 5가지 물질들 중에서 magnesite와 gypsum은 용존인의 감소에 효과가 미미한 반면 calcite와 dolomite, 그리고 lime은 효과적일 것으로 보인다. Calcite와 dolomite는 용존인의 농도를 천분의 1배 정도 줄일 수 있고 lime은 십만분의 1배 정도 줄일 수 있는 것으로 나타났다. 과량사용시 calcite와 dolomite 경우 pH가 8.3에 고정되어 수생태계 보호관점에서 유리하지만, lime의 경우는 pH가 매우 높아질 수 있어서 주의가 요구된다. 그럼에도 불구하고 조류에 의한 수질관리에 어려움이 있어 시급한 해결책이 요구된다면 lime 사용을 고려할 수도 있을 것이다.