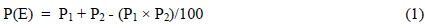The toxicity of heavy metals (Zn, Pb) and diesel, in single and binary solution was investigated using the photobacterium
최근 산업・경제 발전과 인구증가로 인한 산업화와 도시화에 따라 다양한 오염물질(중금속, 유류 등)이 환경으로 유입되고 있으며 이로 인하여 생태계 오염이 증가되고 있다. 중금속은 환경적인 요인에 의해 다양한 형태로 수계 및 토양에 존재하며, 생태학적인 진화, 영양 및 환경에 악영향을 끼치기 때문에 중금속 독성은 세계적으로 중요한 문제로 인식되고 있다. 일반적으로 중금속의 독성, 용해도 및 생체이용률은 pH, 경도, 상호작용효과 및 천연 유기물의 존재와 같은 다양한 물리화학적 변수에 의해 변화된다(Nagajyoti et al., 2010; Tsiridis et al., 2006). 또한, 중금속은 수계나 토양에 노출되어 생물체에 높은 농도로 존재하여 생분해되지 않기 때문에 생태계 내에 잔류하여 독성 영향을 미칠 수 있다. 중금속뿐만 아니라 자동차 및 항공기연료, 난방유, 폐유 등에 기인하는 총석유계탄화수소(Total Petroleum Hydrocarbons, TPH)는 환경을 오염시키는 중요한 물질 중의 하나로 환경에 유입되면 분해되지 않고 오랫동안 여러 가지 환경매체에 잔류 축적되며 인간과 생태계에 악영향을 끼친다. TPH는 휘발유, 등유, 디젤유 및 중유 등으로 분류 할 수 있으며, 그 중 디젤의 독성은 방향족화 합물의 함량에 따라 다르게 나타날 수 있으나 rat를 이용한 급성독성평가에서 치사뿐만 아니라 탈모, 무기력, 설사, 피부자극 등의 아치사(sublethal) 현상도 함께 관찰된 바 있다(Moon, 2012; Stelljes and Watkin, 1993). 다양한 독성 영향이 관찰되는 TPH의 제거에 관련된 연구도 활발히 진행되고 있다(Lee and Park, 2007).
이러한 중금속 및 유류의 생태독성 영향에 대해서는 개별 물질의 독성영향에 연구 초점이 맞춰져 있다. 하지만 이러한 오염물질들이 환경에서는 서로 혼합되어 상호작용을 일으킬 수 있기 때문에 기존의 개별 물질의 독성 영향 평가만으로는 정확한 평가가 힘들며, 오염물질의 혼합에 의한 독성영향이 상승효과(synergistic effect) 또는 길항효과(antagonistic effect)를 나타내는지에 대한 연구가 필요하다(Kungolos et al., 2004). Tsiridis et al. (2006)에 의하면, 중금속간의 혼합 독성의 결과에서, Cu와 Zn 및 Pb와 Zn의 혼합에서는 상승효과, Cu와 Pb의 혼합에서는 첨가 효과를 보인다고 보고하였다. 오염물질간의 혼합 생태독성 영향 평가는 중금속물질간의 연구는 활발한 편이나 중금속과 유류의 복합적인 독성 효과에 대한 연구는 미진한 실정이다. 따라서 환경에서 중금속 및 유류가 복합적으로 오염될 경우 생태계에 미치는 독성영향에 대한 연구가 필요하다.
오염물질이 생태계에 미치는 독성영향은 박테리아, 물벼룩, 조류, 어류, 식물종, 수서 곤충, 토양무척추동물 등 다양한 생물체의 효소 활성, 생장, 호흡량, 이동성, 치사율, 발아율 등의 평가에 근거한 생물학적 독성평가기법들이 사용되고 있으며(Oh et al., 2010; Woo et al., 2012), 그 중에서 발광박테리아인
이 연구에서는 중금속 2종(Zn, Pb)과 유류(디젤)의 단일 및 혼합 독성 영향에 대하여 Microtox 생물검정법을 이용하여 평가하였다. 특히, 혼합 독성 영향은 확률 이론에 근거한 수학적 모델을 사용하여 두 물질의 혼합에 따른 상승작용, 길항작용, 첨가작용에 대한 연구를 수행하였다.
중금속 간의 혼합 독성 및 유류와 중금속 독성 평가는 Microtox M500(Azur Environmental, USA)를 사용하였다. Microtox 독성 평가에 사용된 발광박테리아(
단일 물질(Zn, Pb, TPH)의 Microtox 발광저해도 영향은 제조사 매뉴얼인 Microtox 45% basic test 방법에 따라 분석하였다. 단일 물질 독성평가 농도는 예비실험을 통하여 최적의 농도를 설정하였으며, Zn의 경우 1.28, 2.56, 5.12, 10.23 mg/L, Pb의 경우 0.10, 0.21, 0.42, 0.84 mg/L, TPH 농도가 0.21, 0.41, 0.82, 1.64, 3.28 mg/L로 실험하였다. 모든 실험은 세 번 반복하여 수행하였다. 독성평가 방법은 Microtox용 cuvette에 희석액 0.5 mL 넣고 발광박테리아 배양액 10 μL를 넣어 초기 발광량(I0)을 측정 후, 희석한 실험용액을 0.5 mL씩 넣고 5분과 15분 후에 농도별 발광량(It)을 측정하여 발광 저해 영향(%)을 산출하였다. Microtox 실험 전 Zinc sulfate 표준용액을 사용하여
단일 물질 독성평가에서 사용한 물질들로 각각 두 종류씩의 물질을 혼합하여 Microtox 발광저해도 영향 평가를 실시하였다. 혼합 물질 독성평가에서의 Zn와 Pb의 농도를 단일 물질 독성평가와 동일한 농도를 사용하였으며, TPH 농도는 0.21, 0.82, 3.28 mg/L를 사용하였다. 혼합 조건으로 는 중금속 간의 혼합과 중금속과 유류의 혼합으로 2가지 조건으로 나눌 수 있으며, (1) Zn/Pb, (2) Zn/TPH, Pb/TPH의 조합으로 혼합 독성 영향을 관찰하였다. 각각의 실험은 모두 세 번 반복하여 수행하였다. 혼합 물질 독성평가는 Microtox 45% screening test 방법에 따라 각각의 물질을 혼합하여 준비하였다. 준비된 혼합물질의 독성평가 방법은 Microtox 45% basic test 방법과 동일하게 수행하였다. 통계적 분석은 SPSS(Statistical Package for the Social Science for windows Version 20.0, Inc)프로그램을 이용하였고 p-value 가 0.05 미만인 경우를 통계학적 유의성이 있다고 정하였다.
혼합 물질의 독성평가는 이론적으로 예상되는 복합 독성영향은 확률 이론에 근거한 간단한 수학적 모델을 사용하여 예측하였다(Kungolos et al., 1999; Tsiridis et al., 2006). 이 모델에 따르면, P1과 P2는 단일 물질 A1과 A2의 특정 농도에 따른 개별 독성 영향을 나타내며, P(E)는 이 두 물질이 혼합하였을 때 예상되는 독성 영향을 나타내는 것으로 다음의 계산식에 의해 정의된다.
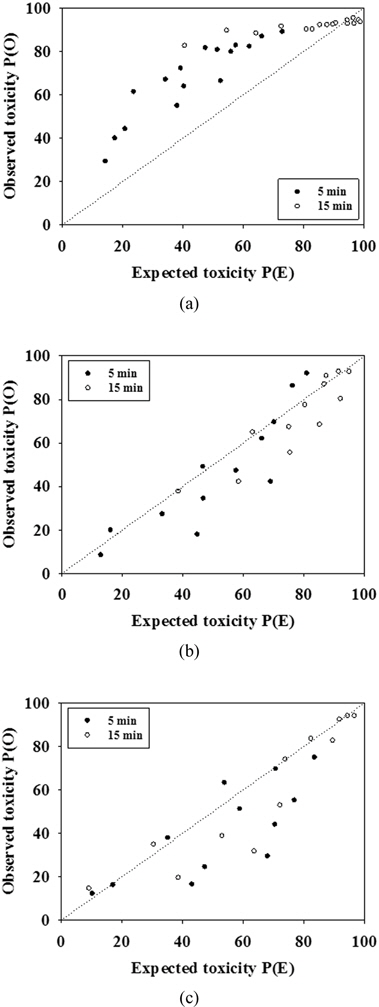
혼합 물질의 독성평가에 의하여 실제 관찰된 P(O)값과 수학적 모델에 의해 예측된 P(E)값을 비교하여, P(O)>P(E)는 혼합 물질 독성 영향이 상승효과(synergistic effect)를 나타내며, P(O)
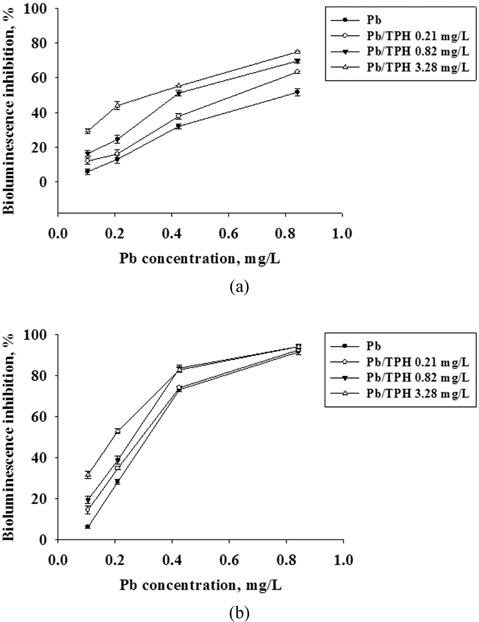
Fig. 1은 Zn, Pb, TPH 각각에 대한 발광박테리아인
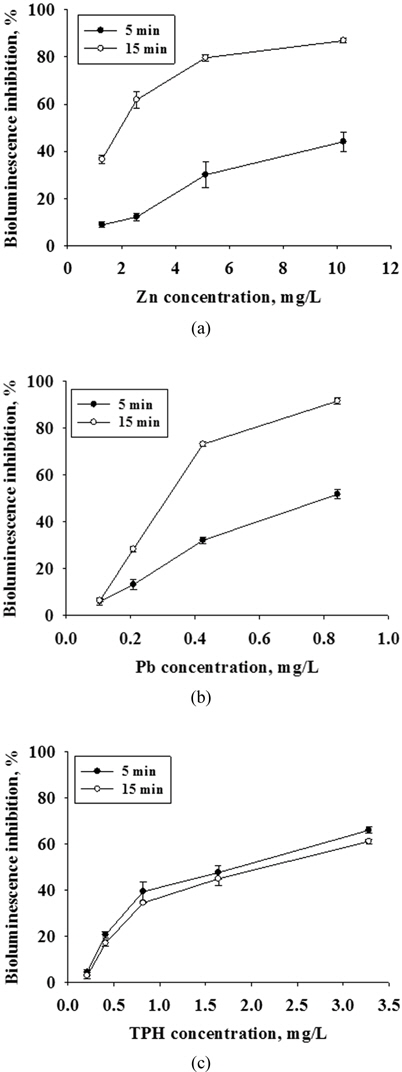
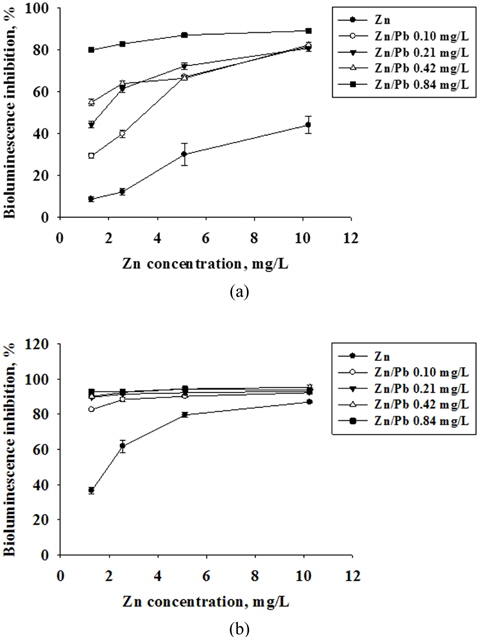
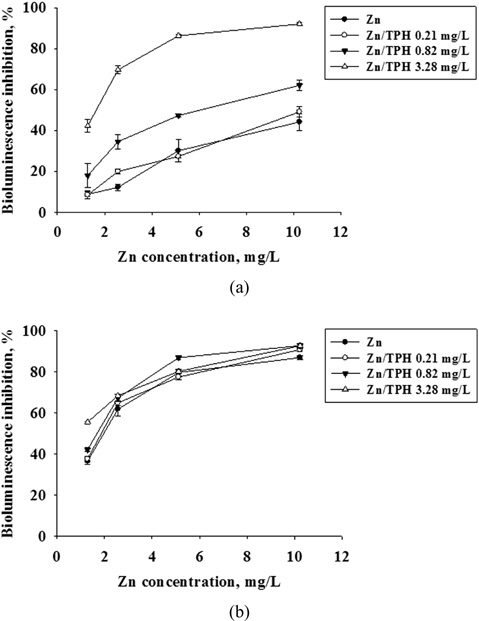
2종류 물질의 혼합 (Zn+Pb, Zn+TPH, Pb+TPH)에 의한 독성영향을 평가하기 위하여 발광박테리아의 발광저해도를 단일물질의 결과와 함께 용량 반응 곡선으로 나타내었다 (Fig. 2-4). Fig. 2에서 Zn에 대하여 Pb의 농도를 변화시키면서 독성영향을 관찰하였다. 노출시간 5분의 결과에서는 Zn이 단일 노출되었을 때보다 Pb의 농도 증가에 따라 독성 영향이 유의성 있게(P<0.05) 높아지는 경향을 보였으며, 노출시간 15분에서는 혼합 독성의 Pb 최소 농도인 0.10 mg/L에서도 80% 이상의 발광저해도가 나타나는 높은 독성영향이 관찰되었다. Tsiridis et al., (2006)의 연구결과에서 Zn와 Pb의 혼합 독성평가에서도 Zn의 농도를 0.43 mg/L으로 고정하고 Pb의 농도를 0.27과 0.67 mg/L으로 증가시키면서 독성영향을 평가한 결과, 발광저해도가 각각 41%에서 87%로 Pb의 농도 증가에 따라 독성 영향이 높아지는 것을 보고하였다. Fig. 3, 4는 중금속(Zn, Pb)과 디젤(TPH)의 혼합에 의한 독성 영향을 관찰하였다. Zn과 TPH의 혼합과 Pb와 TPH의 혼합 독성 영향에서 모두 노출시간 5분에서는 TPH의 첨가 농도에 따라 독성 영향이 증가하는 것을 볼 수 있었으며, 특히 TPH를 3.28 mg/L 농도로 첨가한 실험군에서는 TPH를 첨가하지 않은 것과 비교하여 유의성 있게 독성이 증가하는 것을 관찰하였다. 그리고 15분 노출되었을 때에는 TPH의 농도에 따른 독성 영향 증가 경향은 보이나 통계적으로 유의성이 없는 것으로 나타났다(P<0.05). 이러한 결과는 앞서 관찰한 단일 물질의 독성 영향 결과에서 나타나듯이 중금속과 TPH의 시간에 따른 독성 영향이 다르기 때문으로 판단된다.
혼합 물질의 독성 효과 평가는 단일 물질의 독성 값을 이용하여 수식 1을 통하여 계산된 예측된 값(P(E))과 두 물질을 실제 혼합하여 실험한 혼합 독성 값(P(O))의 상관 관계에 따라 3가지 형태로 나눌 수 있다. P(O)값이 P(E)값보다 크다면 상승효과(synergistic effect), P(O)값이 P(E)값보다 작다면 길항효과(antagonistic effect)를 나타내며, P(O)와 P(E) 사이의 차이가 없을 경우에는 두 물질의 혼합에 의한 단순한 첨가효과(additive effect)를 보이는 것으로 판단하였다.
Fig. 5(a)에서 보이듯이 Zn과 Pb의 혼합 물질 독성영향에서는 대부분이 실제 실험에서 나온 독성(P(O))이 예측한 독성(P(E))보다 높게 나타나며 이는 두 물질간의 상승효과가 있었다고 볼 수 있다. 이러한 결과는
본 연구에서는 중금속(Zn, Pb) 및 유류(디젤)가 생태계에 미치는 단일 및 복합 독성영향을 발광박테리아인