To examine the influences of water temperature and stocking density on feeding, growth and blind-side hypermelanosis of the starry flounder
강도다리(
한편 양성 단계에서 나타나는 무안측 착색증(blind-side hypermelanosis, 흑화)은 강도다리를 포함한 가자미류 양식에 있어서 해결해야 하는 숙제이다. 이 증상은 자연계에서 극히 드물게 나타나는 현상이지만, 대량으로 생산되는 양식 개체들에서 대부분 발현된다(Bolker and Hill, 2000). 특히 생태적 측면에서 형질 개체를 자원조성용 방류 종묘로 활용할 경우 자연계 내강도다리의 고유 형질을 변형시킬 우려가 있다. 또한 경제적 측면에서는 유통시장에서 낮은 품질 평가로 생산자에게 금전적 손실을 입히고 있으나, 그 원인이 아직 뚜렷하게 구명되어 있지 않다. 단지 부적합한 서식환경이 원인으로 추측되고 있지만, 주요 요인은 불분명하다. 그런데 최근 Kang and Kim (2013)은 사육 중 받는 스트레스가 가자미류의 무안측 흑화의 원인으로 보고하였다. 이러한 스트레스는 높은 사육밀도에서 강제적군집생활에 기인하는 것으로 보여지며(Bolasina et al., 2006), Takahashi (1994)와 Kang et al. (2011) 역시, 밀식이 가자미류의 기형적 무안측 체색발현과 관련성이 있음을 보고하였다. 실제 자연계에서 독립된 개체로 개별적인 생활하는 강도다리에게는 인공사육 중의 높은 서식밀도는 스트레스 인자로서 잠재된 무안측 색소포 발현을 촉발시킬 가능성이 있다. 그러나 이전의 다른 여러 연구자들은 가자미류의 무안측 착색증은 다른 사육환경(배경색상, 잠입기질, 영양 등)에 의한 것으로 보기 때문에(Iwata and Kikuchi, 1998; Haga et al., 2004; Amiya et al., 2005; Yamanome et al., 2005), 높은 사육밀도가 가자미류의 무안측 착색의 주요 원인이라고 정의 내리기는 어렵다.
한편 이전 연구 결과, 가자미류의 무안측 흑화 발현은 초기발달과 성장과 함께 이루어진다는 사실이 밝혀졌다(Kang and Kim, 2012). 이에 따르면 시간 경과에 따른 크기 증가는 무안측흑화 발현과 양의 상관관계가 있음을 보여준다. 이는 빠른 성장개체가 보다 심한 무안측 체색 기형을 나타낼 수 있음을 의미한다. 그러나 현재까지 군집 내 동일 성장기의 어류들 사이 개체 차이가 무안측 흑화률에 관련되어 있는지는 보고된 바 없다. 그러므로 같은 발달 단계에 있는 강도다리 치어들 사이에서 빠른 성장을 보이는 개체가 높은 흑화률을 보이는 지 여부를 추가적으로 구명해 볼 필요가 있다.
따라서 본 연구는 강도다리의 먹이섭식 및 성장에 있어 계절적 수온의 영향을 조사하고, 더불어 무안측 흑화발현에 있어 밀도, 성장 및 개체 크기의 관련성을 파악하여, 강도다리 양성 단계 사육 관리를 위한 생리학적 기초 자료로 활용하고자 한다.
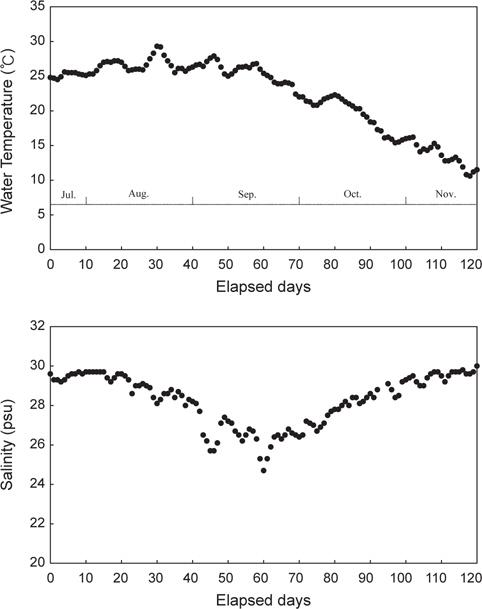
본 연구에 사용된 실험어는 전장 3.2±0.1 cm, 체중 0.6±0.1 g의 강도다리 치어 (흑화면적률 2.6±0.4%; 체표면적 15.2±0.5 cm2)를 사용하였으며, 실험 수조는 직사각형 유리수조[W61 cm×L37 cm×H41.5 cm=부피 93.7 L (면적 2,257 cm2)]를 이용하였다. 실험 밀도는 수용적 50 L를 기준으로 2마리/L (이하 저밀도구; 100 fish/tank)와 8마리/L (이하 고밀도구; 400 fish/tank)로 하였으며, 실험은 3반복으로 하절기인 7월부터 추계인 11월 까지 약 120일간 실시하였다. 실험개시 그룹별 단위면적당 점유률[percentage of covering area (PCA), %]은 저밀도구 PCA 64.4%와 고밀도구 PCA 266.0%였다.
실험기간 동안 유수식으로 사육수를 공급하였으며, 사육 수온 및 기타 환경조건은 평균 수온 22.3±5.1℃, pH 7.7±0.1, DO 6.48±1.2 mg/L 및 염분 28.2±1.3 psu로서 실험기간 동안 실험구 모두 동일하게 유지하였다(Fig. 1). 먹이는 7월~8월에는 9시와 16시에 2회/일, 9월~11월에는 9시에 1회/일 공급하였다. 1회 공급량은 어체가 만복 상태까지 섭식한 량으로 결정하였다. 실험개체의 먹이로 사용된 강도다리 사료는 상업용 EP (Love larva Co., Japan)로써 입자 크기는 1.1- 1.3 mm였다(Table 1). 사료공급 후에는 일간 사료공급량을 기록하였고, 기록된 양을 바탕으로 일간 개체당 섭식량[daily food intake; DFI (mg/fish/day)=총사료섭식량/개체수 /사육일수] 및 사료효율[feed efficiency; FE (%)=(증중량/사료섭식량)×100]을 구하였다.
[Fig. 1.] Features of blind-side of ordinary and hypermelanic starry flounder Platichthys stellatus.

[Table 1.] Proximate composition of basal diet

Proximate composition of basal diet
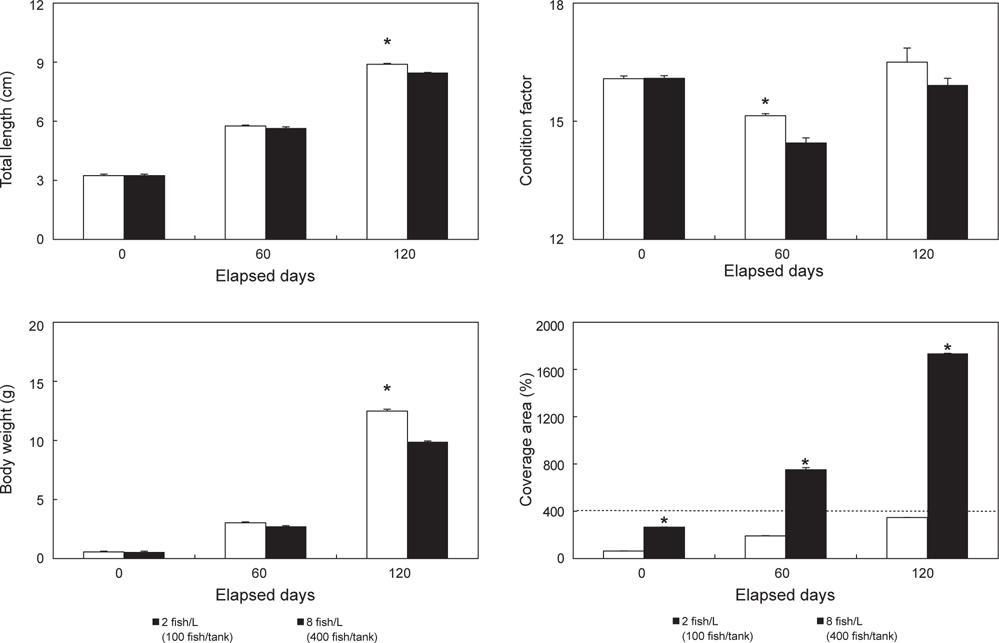
실험어의 전장(TL) 및 체장(BL) 측정은 60일 간격으로 버니아캘리퍼스를 이용하여 전량 1 mm 단위까지 계측했고, 체중(BW)은 전자저울을 이용하여 0.01 g까지 측정하였다. 이들 값을 통해 비만도[condition factor, CF=(TL)3/BW×1,000]을 산출하였으며, 그리고 매일 폐사 개체를 수집하여 계수한 뒤 생존율을 산정하였다.
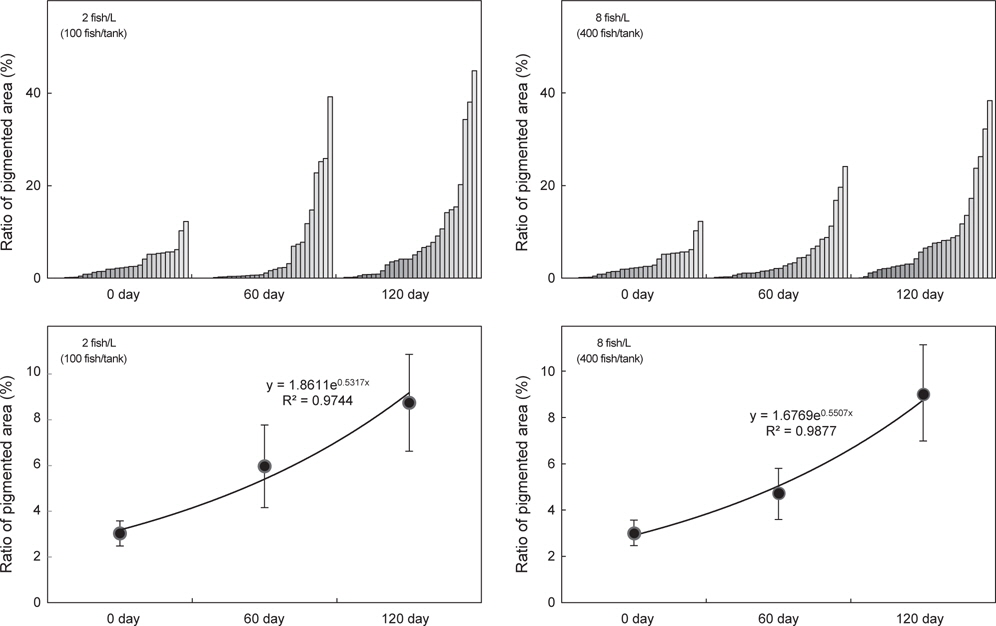
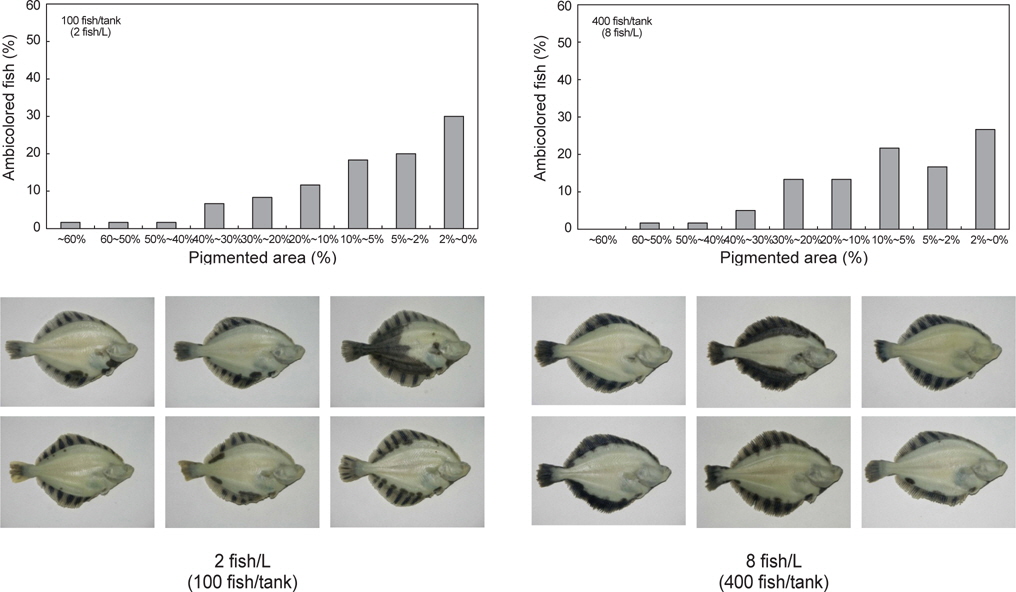
실험구별 무안측 착색률은 실험개시 후 60일 간격으로 30마리씩 2반복으로 2-phenoxyethanol로 마취 시킨 후, 무안측면을 디지털 카메라로 촬영한 뒤 컴퓨터 영상분석시스템(QWIN V3 Leica, Germany)을 통해 측정하였다. 착색반문의 면적률은 착색 표면적을 총면적으로 나눈 뒤 백분율로 환산하여 구하였다. 또한 측정된 개체별 무안측 착색 면적률을 바탕으로 1% 이상 착색률을 보인 개체를 정상으로 구분하여, 실험구별 무안측 착색 발생빈도율을 계산하였다.
실험구별 평균 값의 유의차 유무를 가리기 위해, SPSS 21.0 통계프로그램을 이용해 사료효율, 사료섭식량 및 생존율은 비모수적 방법인 Kruskall-Wallis test (n=2)를 통해 검증하였고, 성장은 모수적 방법인 Student’s t-test (n=30)를 통해 실험구간 평균치 차이 유무를 확인하였고(
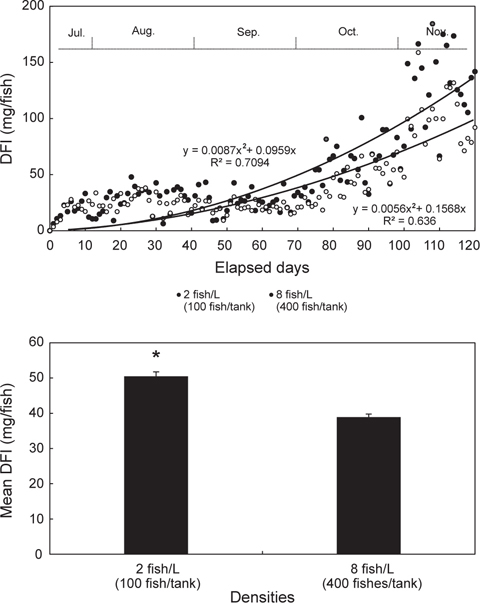
DFI는 계절적으로 수온 20℃이상을 나타내는 7월~9월까지 30 mg/fish/day 이하를 낮았지만, 수온이 20℃ 이하로 감소하기 시작하는 10월부터 급격히 증가하였으며, 이때 평균 DFI는 77.3 mg/fish/day였다(Fig. 3). 또한, 120일간 밀도구별 DFI는 저밀도구가 평균 50.5±1.23 mg/fish/day, 고밀도구가 38.9±0.87 mg/fish/day로, 저밀도구 개체들이 고밀도에 비해 보다 많은 사료를 섭식하는 것을 알 수 있었다(

Daily food intake (DFI), food efficiency (FE) and survival rates of fry starry flounders Platichthys stellatus reared in flat-bottom glass aquariums for 120 days1
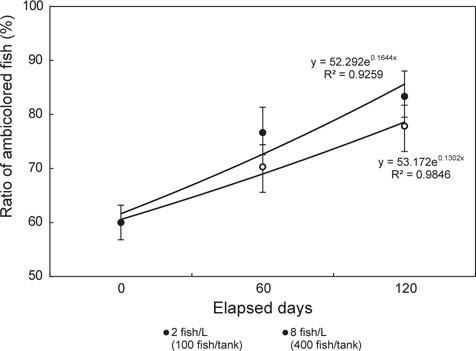
무안측 착색면적률은 개시 2.6±0.4%에서 실험 60일에 이르러 저밀도구가 7.2±0.8%로 유의하게 상승하였고(
한편 군집 내 흑화 개체비율은 개시 60.0±9.4%이던 것이, 60일에 이르러 저밀도구 70.3±4.1% 및 고밀도구 76.7±4.7%로, 두 실험구가 이전에 비해 흑화 개체수가 유의하게 늘어난 것을 확인할 수 있다(
또한 Fig. 7과 같이 흑화개체 비율과 흑화면적 비율의 군집 분포도로 비교해 본 결과, 저밀도구에서 0-2% 의 정상개체 비율이 다소 높지만, 전반적인 분포 비율에서는 큰 차이가 없었다(
어류 양식에서 사육 개체의 성장과 생존을 최적화 하기 위해 관리되어야 하는 요인은 생물학적 요인, 화학적 요인 및 물리적 요인과 같이 크게 3가지로 나누어 볼 수 있다. 생물학적 요인에 세균성 또는 바이러스성 질병, 공식현상, 군집화, 영양원 등이 있고, 화학적 요인에는 수질(암모니아, 아질산, pH농도, 산소)및 화학 약제 등이 있으며, 물리적 요인에는 수온, 염분, 밀도, 소음 등이 있다(Deane and Woo, 2009). 특히 물리적 요인은 어류 양식에 있어서 어종 별 및 성장 단계별로 적정하게 관리되어야하며, 이는 양식경영 측면에서 매우 중요한 요소 중의 하나이다. 특히 어류의 성장과 대사를 조절하는 감각계, 내분비계 및 신경 내분비계는 물리적 인자 중 수온에 매우 의존적이다(Deane and Woo, 2009; Inoue et al., 2014; Sun and Chen, 2014). 수온은 대상 동물의 섭식, 대사(Barton and Schreck, 1987), 성장(Clarke et al., 1981), 면역능력(Pickering, 1992), 성 분화(Shen and Wang, 2014) 및 번식(Carragher and Sumpter, 1990) 등을 조정하는 등 생명 현상을 유지하게 하는 가장 기본적이고 필수적인 요소이다. 특히 어류가 비정상적 수온 변화를 경험할 경우, 스트레스 반응에 의해 대사 감소, 성장 저해 및 면역력 약화 등에 의한 질병 발생과 폐사로 이어진다(Pickering, 1992; Deane and Woo, 2009; Binesh, 2014; Inoue et al., 2014). 특히 냉수성해산 어종인 강도다리의 경우, 여름철 25℃이상의 수온에 노출될 경우 그 문제는 심각하다. 적정 서식수온 범위를 벗어난 고수온은 대사 항상성을 떨어뜨리고 과도한 생체에너지의 지출을 요구하여, 성장 둔화 및 건강도 악화에 의한 생존율 감소를 유발한다(Schreck, 1982; Barton and Iwama, 1991). 이는 곧 양식 채산성을 악화시키는 요인으로 작용할 수도 있다(Pickering, 1992). 따라서 강도다리 양식 시 하절기 사양관리를 위해 고수온에 대한 대사적 생리반응 정보가 필요하며, 이를 통한 사육관리 매뉴얼이 요구된다. 이에 본 연구는 하절기(7월 중순~11월 하순) 양성 중인 강도다리 치어의 표준 사양관리 지침을 마련하기 위해, 고수온기 강도다리의 식욕 및 성장과 같은 대사반응을 조사하고, 정상 성장과 대사가 유지되는 적정 수온 범위를 구명하였다. 이를 위해, 식욕, 사료효율, 성장도 및 생존율 등을 120일간 측정하였다. 그 결과, DFI 값은 평균 수온이 20℃ 이상을 나타내는 7월에서 9월까지 50 mg/fish/day이하를 나타내었지만, 평균 수온이 20℃ 이하를 나타내는 10월 이후 급격히 증가하였다. 또한 식욕 증진에 의한 체중 증가 역시 10월 이후 급격이 증가하여, 강도다리 치어 양성을 위한 하절기 사육 수온은 20℃ 이하로 관리해 주는 것이 적절할 것으로 확인되었다.
한편 밀도는 경골어류의 골격기형(Boglione et al., 2009), 변태(Hosfeld et al., 2009), 생존(Tagawa et al., 2004), 성비(Saillant et al., 2003), 성성숙 및 산란(Claudia et al., 2004), 부화율(Peck and Holste, 2006), 공식(Baras et al., 2003)과 더불어 성장(Bolasina et al., 2006; Merino et al., 2007)에 영향을 미친다. 따라서 특정 어종의 성장단계별 적정 사육 밀도 구명은 중요하다. 본 연구 결과, 성장은 DFI가 높은 저밀도구에서 유의하게 빠른 것으로 확인되었다. 이러한 결과는 perch
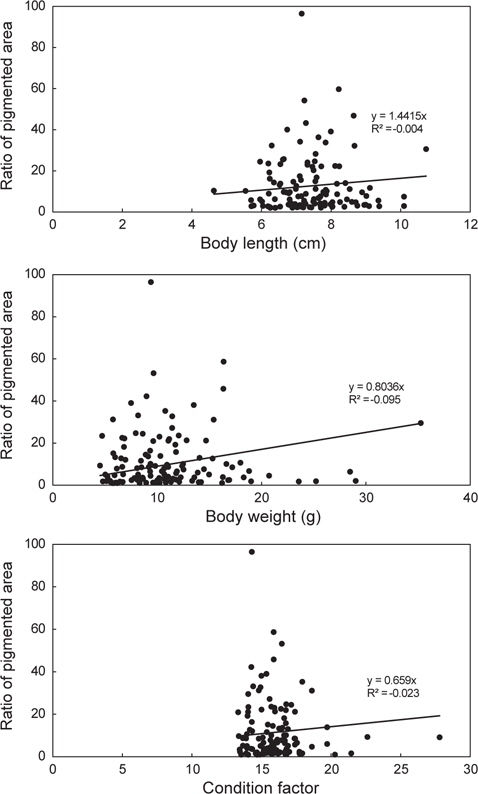
이상의 연구결과, 하절기 20℃ 이상의 수온에서 낮은 섭식량과 성장률, 20℃~10℃ 사이 수온에서 높은 섭식량과 빠른 성장을 나타내는 것을 알 수 있었다. 또한 200% PCA 이상의 높은 밀도는 먹이경쟁에 의한 섭식량을 감소시켜 성장을 저하시킬 수 있으며, 흑화 진행 속도에 영향을 미치는 것을 확인할 수 있었다. 이는 무안측 흑화 발현과 성장 사이 상호 관련성이 있음을 의미한다. 그러나 동일 성장기 개체들을 표본 조사한 결과, 크기는 흑화와는 아무런 상관관계가 없는 것을 알 수 있었다.