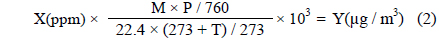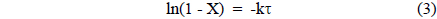Catalytic oxidation characteristics of benzene as a VOC was investigated in a fixed bed flow reactor using Cu/γ-Al2O3 catalyst. The parametric tests were conducted at the reaction temperature range of 200~500 ℃, benzene concentration of 400~650 ppm, gas flow rate of 50~100 cc/min, and space velocity range of 7,500~22,500hr−1. The property analyses by using the BET, SEM, TGA and the conversion of catalytic oxidation of benzene were examined. The experimental results showed that the conversion was increased with decreasing benzene concentration, gas flow rate and space velocity. Benzene oxidation reaction over Cu/γ-Al2O3 catalyst could be expressed as the first order homogeneous reaction of which the activation energy was 17.2 kcal/mol and frequency factor was 1.33×106sec−1.
최근 고도화된 산업발달과 인구증가로 인하여 환경오염의 피해가 늘어나고 있다. 환경오염 중 인체에 가장 직접적인 영향을 미치는 영향으로 대두되고 있는 것은 대기오염이다. 최근 자동차수의 급증이나 각종 유기용제 및 페인트의 사용량 증가로 인하여 발생되는 휘발성유기화합물(volatile organic compounds, VOCs)에 대한 관심은 사회적 문제뿐만 아니라 전 세계적으로 관심이 커지고 규제 또한 강화되고 있는 실정이다[1,2].
VOC는 질소산화물(NOx)과 강한 자외선에 의해 반응하면 오존, 알데히드 등과 같은 2차 오염물질인 광화학 산화물이 생성되는데, 이 광화학 산화물은 자체 독성뿐만 아니라 광화학스모그 발생 등으로 생물체에 지대한 영향을 주고 있다. 또한 광화학적 오존형성에 의해 인체에 간접적인 영향을 줄 뿐만 아니라 직접적으로 VOCs물질에 따라 냄새유발, 최면효과, 발암성, 유전독성 등의 다양한 형태로 영향이 나타남에 따라 연구가 이루어지면서 더욱 주목을 끌기 시작했다. 특히 합성세제원료 및 각종 첨가제나 용제로 사용되는 벤젠류는 발암물질로 규정되는 등 인체의 면역체계에 심각한 피해를 미친다는 사실이 밝혀져 있어 반드시 배출이전에 제어되어야 할 물질이다[3-5].
VOCs의 제어방법으로는 촉매산화법과 연소법, 열산화법, 응축법, 흡착법, 흡수법 등이 있다. 이 중 촉매산화는 VOC를 CO2와 H2O로 전환시키는 기술로 에너지 사용관점과 경제적면에서 가장 유용한 공정으로 평가받고 있다[6,7]. 일반적인 VOCs 촉매산화반응은 가연성가스의 연소에서 NOx의 발생을 최소화시킬 수 있고, 연소시 반응의 활성화에너지를 낮추어 화염연소보다 낮은 반응온도(200~500 ℃)에서 활성이 일어나 운전비용이 절감된다. 또한 적용범위가 넓고 간단한 시스템에 의해 설비확장이 용이하며 반응 후 폐열을 활용할 수 있는 장점이 있다. 그러나 지금까지 촉매실험에 많이 사용된 우수한 활성을 가지고 있는 귀금속계 촉매(Pt, Rh, Pd 등)는 고가일 뿐만 아니라 촉매독[8]이 존재할 경우 활성이 급감하는 영향으로 인해 경제적, 기술적 문제가 동반된다. 그러므로 귀금속계 촉매에 비하여 저가인 전이금속계 촉매의 개발이 시급한 실정이다.
전이금속촉매를 이용한 VOC 산화반응에 대한 연구로는 구리금속에 지지체를 달리하여 벤젠산화반응을 고찰한 Hong et al.[9], 크롬산화물 촉매하에 PCE (perchloroethylene) 산화반응을 고찰한 Lim et al.[10], 구리/망간 복합산화물 촉매를 사용하여 톨루엔 산화반응을 고찰한 Kim et al.[11], Ru-Sn 복합촉매를 이용한 HVOC산화반응을 고찰한 Kim et al.[12], 축열식 촉매소각장치에서 톨루엔 소각특성을 고찰한 Song et al.[13]의 연구결과를 통해 촉매산화반응의 활성도에 미치는 파라메타영향에 대한 자료가 많이 제시되었으나 아직 최적의 촉매형태나 반응조건도출을 위해서는 좀더 많은 연구가 요구되고 있다[14,15].
본 연구에서는 전이금속계열인 구리(Cu)를 바탕으로 한 촉매를 이용하여 VOCs의 산화실험을 실시하기 위하여 대표적인 VOC인 벤젠을 사용하였고, 촉매로는 공업적으로 많이 사용되며 금속의 분산성과 물리적, 기계적인 성질이 우수한 γ-Al2O3를 지지체(담체)로 하여 전이금속계열의 구리를 함침하여 촉매를 제조하였다. 제조된 촉매의 물리, 화학적 특성을 고찰하기 위하여 비표면적 측정(bruauer emmet teller, BET), 전자현미경(scanning electron microscope, SEM) 분석, X선 회절분석(XRD), 열천칭분석(thermogravimetric analyzer, TGA) 등의 다양한 분석을 실시하였으며, 벤젠농도, 가스유입량, 공간속도 등의 파라메타에 대한 촉매산화반응 특성을 고찰하였다.
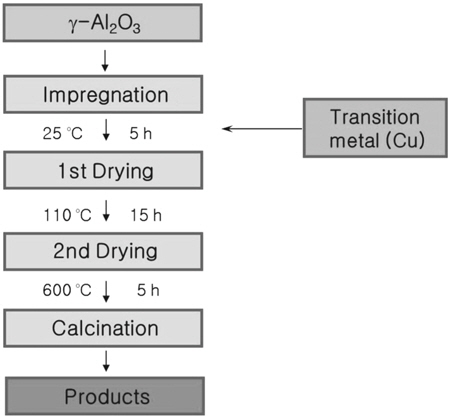
본 실험에 사용된 촉매는 초기습식함침법(incipient wetness impregnation method)[16,17]으로 제조하였으며, 제조공정은 Figure 1과 같다. 지지체로서 γ-Al2O3와 구리금속의 중량비에 따라 구리를 함침하여 구리계 촉매를 제조하였다. 촉매제조용 금속의 전구체는 Cu(NO3)2・3H2O의 시약을 사용하였다. 지지체인 γ-Al2O3는 Alfa Aesar 社의 순도 99.997%인 제품을 사용하였다. Cu 전구체 시약을 초순수에 녹인 후 지지체에 함침시키며, 이때는 전구체 시약용액이 지지체에 전체적으로 젖을 만큼 천천히 뷰렛으로 가한다. 1시간 동안 magnetic stirrer를 이용하여 충분히 교반시키고, 상온에서 5시간, 110 ℃에서 15시간 이상 건조시킨다. 마지막으로 500 ℃에서 5시간 동안 공기분위기에서 소성시켜 제조하였다.
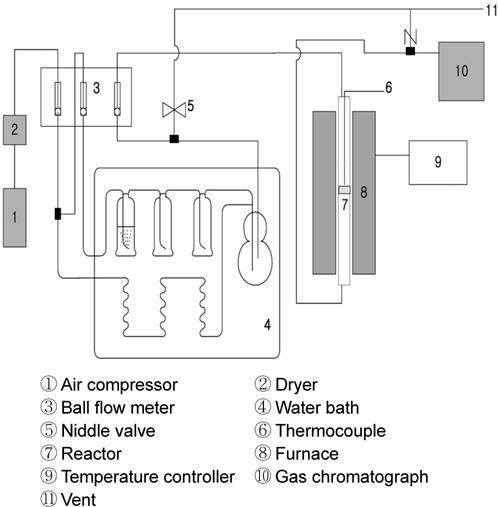
전이금속계의 구리촉매를 이용하여 산화특성을 알아보기 위한 실험장치는 Figure 2에 표지된 바와 같이 벤젠 표준가스와 촉매산화장치(reactor, furnace) 그리고 검출장치(gas chromatograph, GC)로 구성되어 있다. 벤젠 표준가스와 촉매산화시 필요한 공기를 공급하기 위해 Air compressor를 설치하였고 실험중 수분의 영향을 제거하기 위해 유입공기가 dryer를 거치게 하였으며, 반응기에 유입되는 공기의 유량은 3대의 mass flow meter (MFC)를 거치면서 조절되도록 하였다.
촉매산화장치는 fixed bed type의 길이 110 cm, 내경 1/2''의 석영관(quartz tube)을 반응기로 사용하였고, 반응기의 중간에 반응성이 없는 sintered plate를 설치하여 충전된 촉매를 지지할 수 있도록 하였다. 반응기 가열을 위해 3-zone Lindberg furnace를 사용하였고, 온도조절은 k-type thermocouple을 반응기내 촉매층의 중앙에 오도록 설치하여 반응온도를 파악하였으며, Lindberg temperature controller를 이용하여 3-zone의 온도를제어하여 균일한 실험조건을 유지하였다. 검출장치에 반응전 · 후의 시료농도측정을 위해 GC분석기를 설치하여 FID(불꽃 이온화검출기, flame ionization detecter)로 연속적으로 분석하였다.
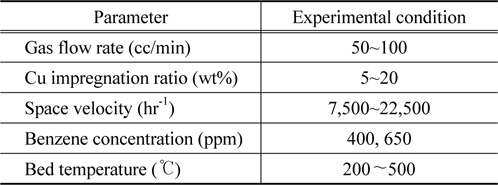
벤젠의 주입은 400~650 ppm농도 범위에서 진행하였으며, 실험이 진행되는 동안 시료가스가 이동하는 반응기 및 관속에 벤젠이 농축되지 않도록 주의하였다. 전체 가스공급유량은 50~100 cc/min, 공간속도는 7,500~22,500 hr−1, 반응온도는 200~500 ℃ 범위에서 30 ℃간격으로 온도를 상승시키며 실험하였다. 반응기의 조업이 정상상태에 도달 후, on-line으로 설치된 검출장치(GC)를 이용하여 시료가스농도를 각 온도조건마다 4~5회 측정한 다음 이를 평균하여 VOC의 전환율을 산출하였다. 측정값의 오차범위는 ± 0.5%이고 벤젠의 전환율은 식 (1)과 같이 정의하였고, 실험조건은 Table 1에 나타내었다.
[Table 1.] Experimental condition of benzene oxidation reaction
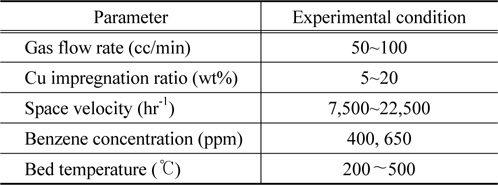
Experimental condition of benzene oxidation reaction
제조된 촉매의 비표면적 특성(BET)을 알아보기 위해 질소 흡 · 착탈력을 이용한 M-P (Multi-Point)법으로 측정하였으며, 분석기는 Micrometrics사의 The GeminiTM V Series를 사용하였고, SEM 분석을 통한 촉매의 표면구조를 알아보기 위해 Philips XL-30을 사용하였다. 아울러, 제조된 촉매의 결정구조특성은 XRD분석을 통해 살펴보았다.
또한, 초기 습식 함침된 시료를 통하여 weight loss와 적합한 소성온도를 알아보기 위해 열천칭분석을 실시하였다. 분석은 TA Instrument 사의 TGA 2050을 사용하였다. 실험은 sample pan에 시료를 놓은 후 N2 분위기 하에서 100 ℃에서 900 ℃범위로 15 ℃/min으로 승온하면서 나타나는 질량감소특성을 조사하였다.
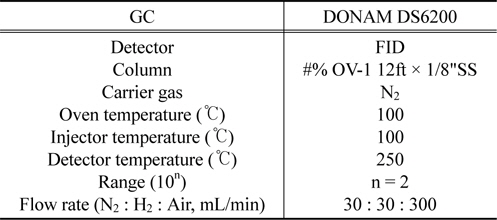
그리고, 각 실험조건에서의 벤젠의 농도분석은 표준가스에 의해 작성되는 검량선이 이용된다. 실험에 적용되는 휘발성유기화합물을 이상기체라 가정하고, 이상기체 상태방정식으로 원하는 기체농도를 만든 후에 기체 크로마토그래피(DS6200, DONAM)를 통하여 그 물질의 농도를 측정하여 검량선을 작성한다. 용제의 주입량과 그에 비례하여 생성되는 시료가스의 농도산출은 식 (2)가 이용된다. 기체 크로마토그래피의 분석조건은 Table 2에 나타내었다.
[Table 2.] Analysis condition of gas chromatograph
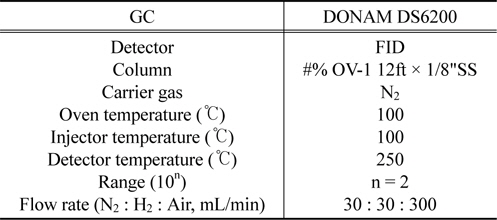
Analysis condition of gas chromatograph
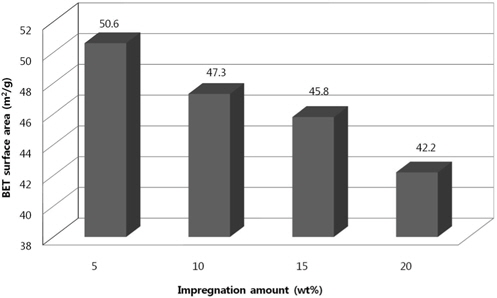
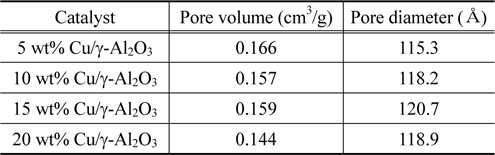
Figure 3은 Cu의 함침량을 달리하여 제조한 촉매의 비표면적 값을 나타낸 것이다. 함침량이 증가할수록 촉매의 비표면적이 감소되는 것을 알 수 있다. 이는 Cu 함침량의 증가는 촉매의 미세기공을 막거나 촉매 상의 bulk한 상태의 CuO로 남아있기 때문이다[18]. Table 3은 촉매의 구리함침량에 따른 기공부피 및 평균기공크기를 나타낸 것이다. 함침량이 증가할수록 대체로 기공부피는 감소하고 평균기공크기는 증가하는 것을 보여주고 있다. 특히, 구리함침량이 증가할수록 비표면적과 기공부피가 감소하는 것은 담지체의 몰분율이 감소하기 때문이다[19].
[Table 3.] Variation of pore volume and size as a function of copper impregnation ratio
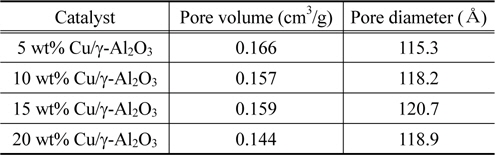
Variation of pore volume and size as a function of copper impregnation ratio
Figure 4는 구리의 함침량 차이에 따른 전자주사현미경 사진을 나타낸 것이다. 순수한 γ-Al2O3에 Cu의 함침량이 높아질수록 촉매표면에서 넓게 분산된 더 많은 양의 Cu를 관찰할 수 있으나, 15 wt%에 이르러서는 상당수의 Cu가 촉매표면에서 bulk상태로 구성되어 있는 것이 관찰되었고, 그 이상으로 함침량이 증가된 경우 Cu의 bulk화가 가속된 상태임을 알 수 있었다.
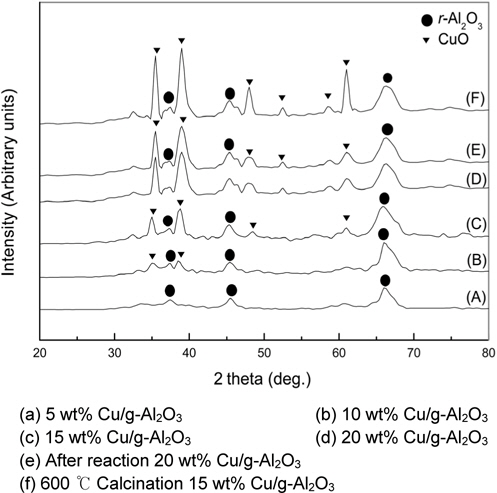
Cu/γ-Al2O3촉매의 XRD pattern을 Figure 5에 나타냈다. Friedman et al.[20]은 CuO가 XRD상에 피크로 존재하는 데는 일반적으로 지지체의 표면적과 관련이 있는데, 보통 100 m2/g의 표면적을 가진 알루미나에 담지량이 5 wt%에서부터 CuO의 대형입자화(Bulk)된 결정이 형성되며 담지량이 증가할수록 peak intensity도 일정하게 증가한다고 보고하였다. 본 실험에 쓰인 촉매의 지지체로 사용된 γ-Al2O3는 60 m2/g의 비표면적을 갖고 있으며, 5 wt%의 담지량에서도 35.6°와 38.6°에서 CuO의 결정상이 뚜렷하게 관찰되었다. 또한, CuO의 peak intensity는 Cu의 담지량이 높아질수록 커졌으며, 고온에서 관찰되는 α-Al2O3와 CuAl2O4 등의 특성 피크는 관찰되지 않았다. 반응 전후의 XRD 패턴 분석을 통해 촉매가 벤젠산화반응에 참여하여도 CuO와 γ-Al2O3의 상변이 및 결정성에 영향을 미치지 않는 것으로 나타났다.
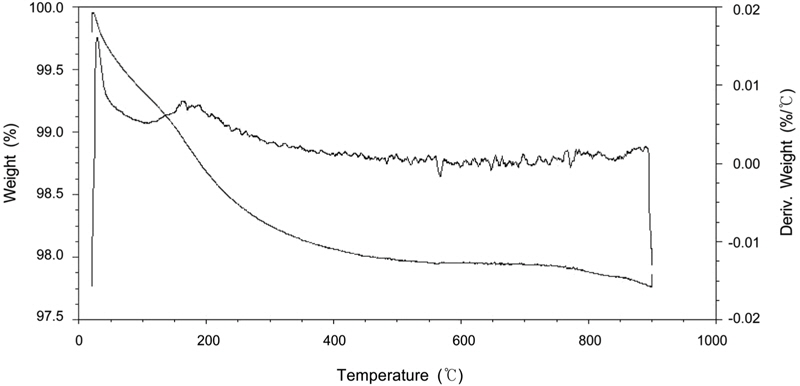
Figure 6은 초기 습식 함침된 시료의 N2 분위기에서의 TGA분석결과를 나타낸 것으로 초기 온도증가에 따라 시료내의 수분증발에 따라 무게감소가 일어나고 이후 300 ℃의 영역에서 시료에 포함된 Cu(NO3)2의 분해와 γ-Al2O3 표면에 단단히 고착되어 있는 hydroxyl기의 파괴로 인한 물의 탈착으로 인하여 완만한 무게감소가 일어나는 것으로 사료되고, 또한 800 ℃ 이상의 온도에서는 Cu산화물의 소결로 인하여 미미한 무게변화의 특성을 보여주고 있다[21].
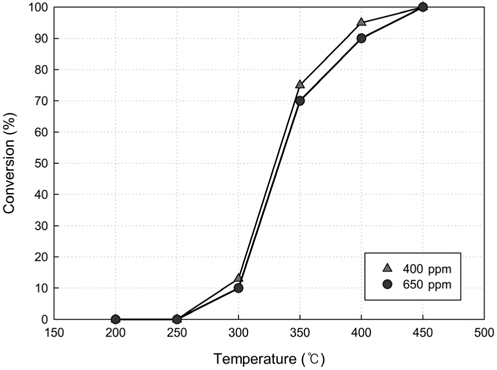
3.5.1. 벤젠농도에 따른 영향
Figure 7은 벤젠유입농도에 따른 벤젠의 전환율을 나타낸 것이다. 가스유입유량 100 cc/min에서 반응온도 200~500 ℃ 까지 온도를 상승시키며 벤젠농도는 400 ppm, 650 ppm에서 실험을 실시하였다. Figure 6에 나타난 바와 같이 벤젠농도 400 ppm인 경우에 650 ppm 보다 벤젠의 전환율이 더 높게 나타났으며, 이는 활성점에의 흡착빈도로 설명할 수 있다. 반응물의 전환은 우선적으로 활성점으로의 흡착과 표면반응에 의하여 진행되므로 동일한 조건에서 반응물의 농도가 낮을 경우, 반응물의 분자가 활성점에 흡착되는 빈도가 높아지기 때문에 저농도에서의 전환율이 더 높아지는 것으로 볼 수 있다[22].
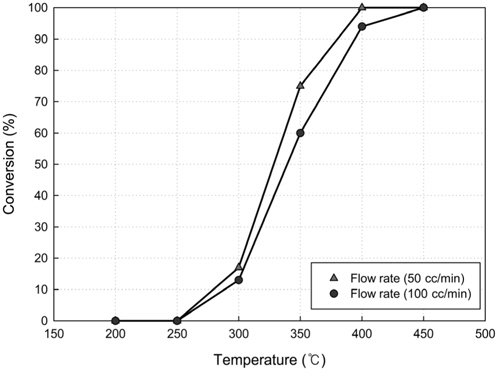
3.5.2. 가스유입량에 따른 영향
Figure 8은 반응기로 주입되는 가스유입량에 따른 벤젠의 전환율을 나타낸 것이다. 벤젠농도 650 ppm, 촉매의 충전량을 일정하게 유지한 상태에서, 벤젠유입량을 50 cc/min와 100 cc/min로 달리 적용한 결과 유입량이 낮은 경우 벤젠의 전환율은 증가하는 것으로 나타났다. 이는 주입되는 가스유입량이 증가할수록 반응기 내에서의 체류시간이 감소하게 되고, 이에 따라 반응물의 반응시간이 줄어들면서 전환율이 감소하는 것으로 볼 수 있다.
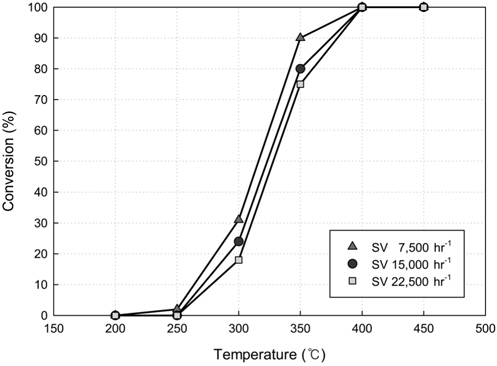
3.5.3. 공간속도에 따른 영향
Figure 9는 벤젠농도 400 ppm, 유입가스유속 50 cc/min 조건에서 촉매의 충전량을 0.4 g에서 1.2 g까지 달리하여, 유입되는 가스의 공간속도를 변화시키면서 실험한 결과를 나타낸것이다. 벤젠의 전환율은 공간속도에 반비례하는 것으로 나타났는데, 이는 촉매충전량이 늘어나 공간속도가 감소함에 따라 벤젠의 반응기내 체류시간이 증가되고, 반응하는 촉매의 표면적이 넓어지기 때문에 벤젠의 전환율이 증가하는 것으로 볼 수 있다.
3.5.4. 반응속도해석
벤젠의 산화반응을 plug flow kinetics의 1차 반응으로 가정하면 체류시간과 전환율은 다음과 같은 식 (3)으로 표시된다. 여기서 k는 반응속도상수(sec−1), τ는 체류시간(sec), X는 반응전환율이다[23].
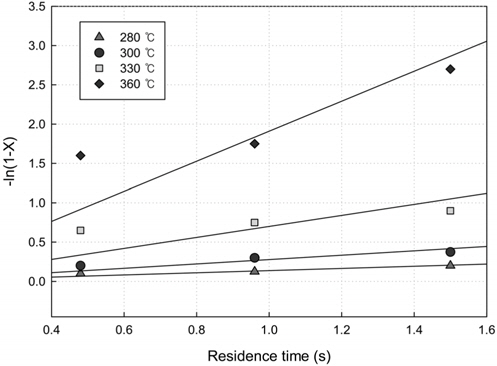
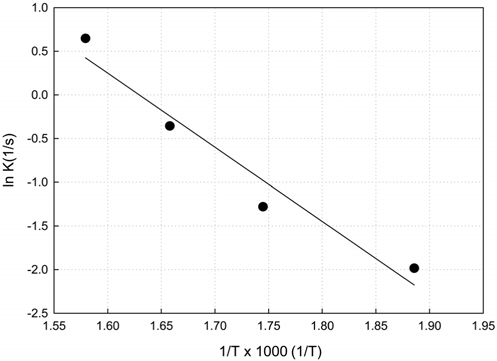
위 식으로 15 wt% Cu/γ-Al2O3 촉매를 이용하여 체류시간 대전환율에 의한 그래프를 Figure 10에 나타내었는데 반응차수 1차의 가정에 잘 맞는다는 것을 알 수 있다. 1차 반응의 속도상수(k)를 280~360 ℃의 반응온도 범위에서 Arrhenius식에 맞춰 표시하면 Figure 11과 나타낼 수 있다. 이들 결과로부터 주어지는 벤젠 산화반응의 활성화에너지(Ea)는 17.2 kcal/gmol, 빈도인자(A)는 1.33 × 106 sec−1를 얻을 수 있었다.
전이금속계통의 구리(Cu)를 γ-Al2O3 담체에 함침하여 촉매를 제조하고, 이를 적용한 벤젠의 촉매산화실험을 통해 얻어진 결론은 다음과 같다.
1) 구리를 함침시켜 제조된 촉매에 대한 물성분석을 통해 구리성분이 γ-Al2O3 표면에 CuO bulk상태로 분포되어 있는 것이 확인되었으며, 구리함침량이 증가할수록 촉매의 비표면적과 기공부피는 감소하고 평균기공크기는 증가하는 것을 알 수 있었다.
2) Cu/γ-Al2O3 촉매를 이용한 벤젠산화반응에 있어서 벤젠의 농도가 낮을수록 반응물 분자가 활성점에 흡착되는 빈도가 높아지고, 가스유입량과 공간속도가 낮아질수록 반응기내 체류시간이 증가됨에 따라 벤젠의 전환율이 증가함을 알 수 있었다.
3) 벤젠의 촉매산화반응은 1차 균일반응으로 해석될 수 있었으며, 반응의 활성화에너지(Ea)는 17.2 kcal/mol, 빈도인자(A)는 1.33 × 106 sec−1를 갖는 것으로 밝혀졌다.