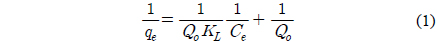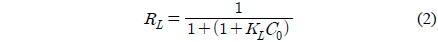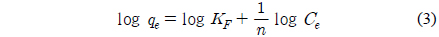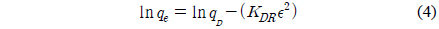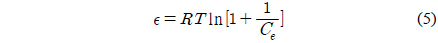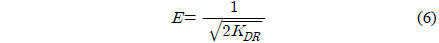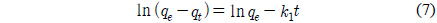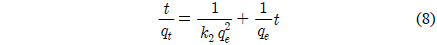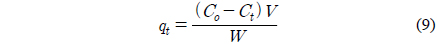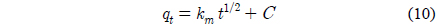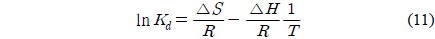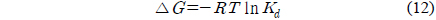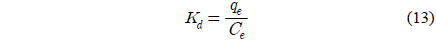Batch adsorption studies were carried out for equilibrium, kinetics and thermodynamic parameters for adsorption of coomassi brilliant blue G (CBBG) using activated carbon with varying the operating variables like initial concentration, contact time and temperature. Equilibrium adsorption data were fitted into Langmuir, Freundlich and Dubinin-Radushkevich isotherms. From estimated separation factor of Langmuir and Freundlich, this process could be employed as effective treatment for removal of CBBG. Also from Dubinin-Radushkevich isotherm model, adsorption energy (E) indicated adsorption process is physical adsorption. From kinetic experiments, the adsorption reaction was found to confirm to the pseudo second order model with good correlation. Intraparticle diffusion was rate controlling step. Thermodynamic parameters like change of free energy, enthalpy, and entropy were also calculated to predict the nature of adsorption. The change of enthalpy (406.12 kJ/mol) indicated endothermic nature of the adsorption process. The change of entropy (1.66 kJ/mol K) showed increasing disorder in process. The change of free energy found that the spontaneity of process increased with increasing adsorption temperature.
염료산업에서 배출되는 고도로 착색된 폐수는 환경오염을 일으키는 주요 원인 중의 하나이다. 염료는 화학적으로 안정한 구조를 가지고 있기 때문에 빛, 화학물질, 산화제와 열에 대한 저항성이 강하며, 생물학적 분해도도 낮기 때문에 탈색처리하는 것은 매우 어려운 일이다[1]. 염료폐수는 섬유염색 공정으로부터 폐기물로 방출되는 막대한 양의 착색된 유기물로서 수생생태계에 유해한 영향을 줄 수 있다. 인간이나 동물에게 돌연변이와 암을 비롯하여 신장과 같은 재생시스템과 간과 뇌와 같은 중추신경계에 여러 가지 손상을 줄 수가 있다[2]. 섬유산업으로부터 배출되는 염료폐수는 고농도의 유출물이면서도 고안정성의 현대적 합성염료를 포함하고 있기 때문에 응집, 정밀여과, 오존처리, 산화처리, 침강, 역삼투, 부상처리, 침전 등과 같은 전통적인 처리방법은 처리비용이 많이 들면서도 완전한 탈색과 유기물과 염료의 감소(분해)를 위해서는 비효과적이다[3]. 이에 비해 흡착공정은 기존의 방법보다 훨씬 효율적으로 물속에서 안정한 형태로 존재하는 오염물질을 제거해낼 수 있다고 알려져 있다. 흡착공정의 또 다른 이점은 광범위한 화합물을 간편한 조작방법으로 분리해 내는 능력이 있다는 것과 함께 비용이 적게 들어 경제적인 처리방법이라는 것이다. 이러한 사실 때문에 흡착기술은 폐수처리에서 광범위하게 사용되고 있다[4].
Coomassi brilliant blue G (CBBG)는 산성염료로 주로 염색약으로 많이 사용되어 왔으며, 의료용에서는 단백질 밴드확인에도 사용되고 있다. CBBG는 눈과 피부에 자극을 주고 섭취하거나 흡입하였을 경우, 소화기관과 호흡기에 자극을 주며, 쥐에 대한 경구투여치사량(LD50)은 5000 mg/kg, 무지개 송어에 대한 어류독성(LC50)은 590 mg/L인 유해한 염료이다[5]. 이와 같이 유해작용이 있는 coomassi brilliant blue 계 염료의 흡착 제거에 대한 선행연구로는 먼저 Ketelsen and Windel[6]이 soil을 사용하여 brilliant blue FCF에 대한 흡착실험을 진행하여 흡착평형은 Langmuir 식에 잘 맞으며, clay의 함량은 흡착량과 정비례 관계가 있지만 유기탄소의 함량은 반비례 관계를 나타내며, 철과 알루미늄의 산화물 또는 수산화물은 흡착과 무관하다고 발표하였다.
Gupta et al.[7]이 bottom ash와 de-oiled soya를 흡착제로 사용하여 brilliant blue FCF의 흡착특성에 미치는 pH, 흡착질의 농도, 체눈금크기, 흡착제량, 접촉시간 및 온도 등의 영향에 대해 조사하였다. 흡착평형관계는 Langmuir 식과 Freundlich식에 다 잘 맞으며, 두 흡착제 모두 흡착공정은 자발적인 흡열과정으로 진행되는데, 흡착기구는 경막확산과 입자확산이라고 보고하였다. Wu et al.[8]은 silane 계의 mesoporous hybrid xerogel을 흡착제로 사용하여 brilliant blue FCF를 흡착하는 실험을 통하여, 유사이차반응속도식에 잘 맞으며, 초기흡착 속도는 초기농도와 온도가 증가할수록 커진다고 하였다. 흡착공정의 율속단계는 내부확산이며, 평형흡착량은 초기농도, 온도, 용액의 산성도와 이온세기 등이 증가할수록 증가한다고 발표하였다. Bangash and Alam[9]은 Ailanthus altissima 목재로부터 제조한 활성탄으로 brilliant blue R 을 10~45 ℃ 범위에서 흡착한 결과, 흡착속도는 흡착온도가 높아질수록 커진다고 하였고, negative entropy 값으로부터 흡착이 일어나는 동안 고-액 계면에서 계의 무질서도가 감소한다는 것을 알아내었다. 활성탄에 대한 염료의 친화성을 나타내는 Gibbs 자유 에너지는 흡착온도가 상승할수록 증가하였고, Positive enthalpy 값으로부터 흡착공정이 흡열반응을 나타내며 온도가 올라갈수록 감소하여 반응의 수월성이 커지는 것으로 보고하였다. Xing et al.[10]은 clay와 cationic starch(CS)의 composite을 이용한 brilliant blue X-BR의 흡착거동을 조사하여, 흡착용량은 clay/CS가 0.1~0.2에서 증가하지만 0.3이 넘으면 감소한다고 하였다. 흡착등온선은 Langmir 식에 잘 맞았으며, 흡착공정은 유사이차반응속도식에 부합한다고 하였다.
그러나 이와 같은 연구에도 불구하고 아직까지 저렴한 흡착제인 활성탄을 이용하여 CBBG를 흡착 ․ 제거하는데 필요한 연구는 보고된 바가 없기 때문에 본 연구를 진행하게 되었다. 입상활성탄을 사용하여 CBBG를 흡착하는 회분식 실험을 통하여 활성탄의 물성과 흡착질의 상관관계를 검토하고, Langmuir, Freundlich 및 Dubinin-Radushkevich 식을 사용하여 등온흡착평형관계를 규명하고 CBBG의 흡착처리의 적합성을 평가하고자 하였다. 초기농도별 흡착속도실험으로부터 흡착공정에 대한 반응속도식의 일치여부를 고찰 해 보고, 온도별 흡착실험을 통하여 엔탈피, 엔트로피, 자유에너지 변화 등의 열역학 파라미터를 계산하여 흡착공정의 특성을 해석하였다.
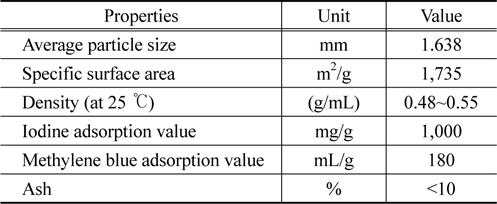
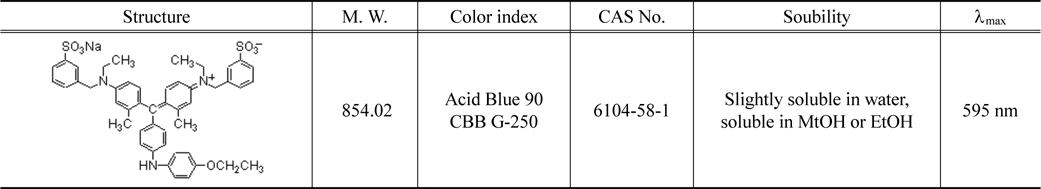
흡착제로 사용한 것은 사용된 활성탄은 역청탄을 원료로 하여 수증기활성화법으로 제조한 Clarimex 사의 8 × 35 mesh 크기의 입상활성탄(GAC)이다. 제조사로부터 제공된 시료 활성탄의 물리적 특성을 Table 1에 나타내었다. 실험에 사용하기전에 순수로 수회 세척한 후 건조기에서 105 ± 1 ℃에서 12시간 건조한 것을 필요한 양만큼 취한 후, 100 ℃의 증류수로 2시간 동안 침지시키는 전처리과정을 거쳐서 사용하였다(이하 침지활성탄). CBBG (C47H48N3NaO7S2)는 순도 99.9%의 Acros Organics 사의 특급시약을 그대로 사용하였으며, 증류수를 이용하여 1000 mg/L의 용액을 만들어 stock solution으로하고 필요한 농도에 맞게 희석하여 실험에 사용하였다. CBBG의 특성을 Table 2에 요약하였다[11].
[Table 1.] Physical properties of granular activated carbon
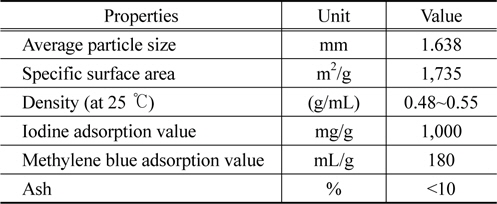
Physical properties of granular activated carbon
[Table 2.] Identification of coomassi brilliant blue G
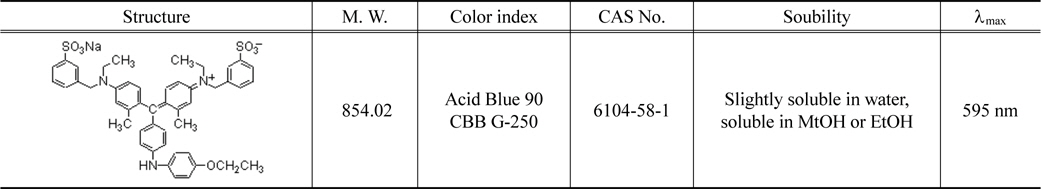
Identification of coomassi brilliant blue G
회분식 흡착실험은 흡착제의 양, pH를 변수로 먼저 실행하여 실험조건을 확정하였다. 용액의 pH는 완충용액(3~5:HAc-NaAC, 6~7:KH2PO4-K2HPO4, 8~11:NH4OH-NH4Cl)으로 조정하였으며, pH meter (DP-880, Dongwoo Medical Systems)로 측정하였다. 등온 흡착평형실험은 서로 다른 온도(298, 308, 318 K)에서 pH를 조정한 100 mg/L의 CBBG 용액 50 mL에 침지활성탄을 10~500 mg(건조기준질량) 범위에서 다르게 투입하여 100 rpm의 속도로 24시간 항온진탕한 후 UV-Vis 분광기(UV-1800, Shimadzu)에서 흡광도를 측정하여 결과를 분석하였다. 흡착동력학 실험은 서로 다른 초기농도와 흡착온도에서 흡착평형에 도달하는 흡착속도에 대해 조사하였다. 초기농도별 흡착속도실험은 흡착온도 298K에서 각각 pH를 조정한 100, 200, 300 mg/L의 CBBG 용액 50 mL에 활성탄을 넣고 항온진탕시키면서 평형에 도달할 때까지 1시간 단위로 용액 중에 남아있는 미흡착 CBBG의 농도를 분석하였다. 온도별 흡착속도실험은 298, 308 및 318 K에서 100 mg/L의 CBBG용액 50 mL에 활성탄을 넣은 다음 초기농도별 흡착속도실험과 동일한 방법으로 진행하였다.
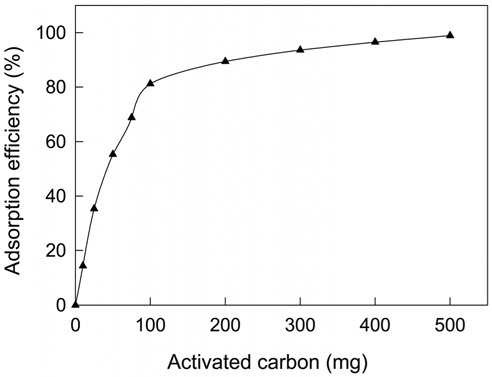
활성탄의 투입량에 따른 CBBG의 흡착 결과를 Figure 1에 나타내었다. 활성탄의 투입량 증가에 따라 CBBG의 흡착률 [=(흡착농도/초기농도) × 100)]도 높아지는데 100 mg/L의 CBBG 용액에 대한 활성탄의 투입량이 10~100 mg일 때를 보면 흡착률은 14.3~81.2%로 직선적으로 증가하고 있으며, 200~500mg에서는 89.4~98.9%로 계속 증가하지만 기울기가 현저하게 낮아져서 활성탄의 투입량 대비 흡착효과는 낮아지는 것으로 판단된다.
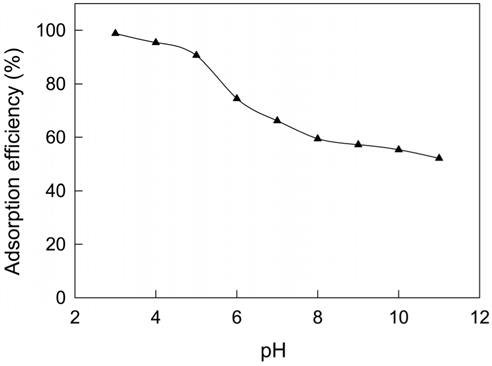
흡착제와 흡착질이 흡착공정에서 pH에 대한 의존성을 판단해 보기 위하여 활성탄에 대한 CBBG 염료용액의 pH를 완충용액으로 3~11까지 다양하게 조정한 상태에서 흡착실험을 진행하였다. 앞선 흡착제의 투입량 변화 실험에서 활성탄을 500 mg을 투입하였을 때가 98.9%로 가장 좋은 흡착률을 보였으나, 경제적인 측면을 고려하고 후속실험에서의 흡착률의 변화를 확인하기 위해 직선적인 흡착률 증가를 나타내면서 81.2%의 흡착률을 보인 100 mg을 적절한 투입량으로 결정하여 pH 변화 실험을 수행하였다. Figure 2를 보면 pH 3에서 가장 높은 97.8%의 흡착률을 나타내었으며, pH가 증가할수록 흡착량은 낮아지는 경향을 나타냈다. 이것은 SO3Na 염 상태로 있던 CBBG가 물에 녹아서 SO3- 이온을 가진 음이온 상태로 되는데 활성탄의 표면은 pH가 낮은 산성영역에서 양이온으로 되기 때문에 둘 사이에 정전기적 인력이 작용하여 pH 조절이 없을 때보다 흡착률이 크게 높아지는 것으로 판단된다[12]. 이것을 활성탄의 투입량과 비교해 보면 500 mg의 활성탄이 투입된 결과와 비슷한 흡착률로서 pH 조절의 효과가 매우 컸기 때문에 후속실험은 pH 3에서 진행하였다.
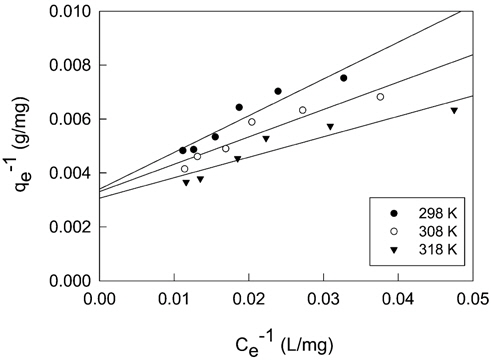
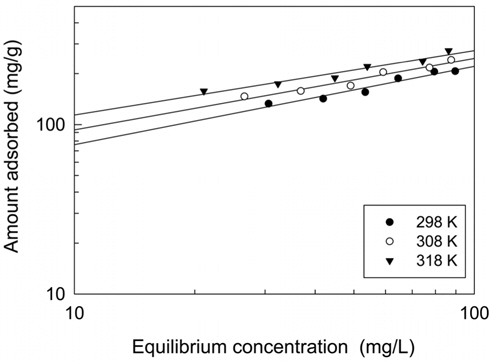
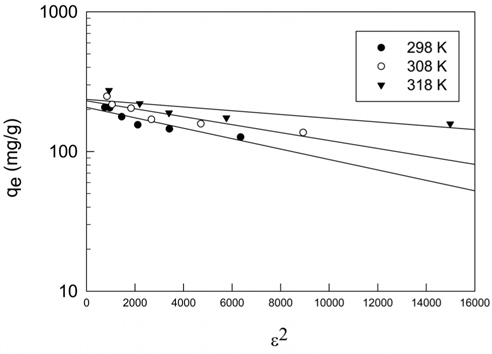
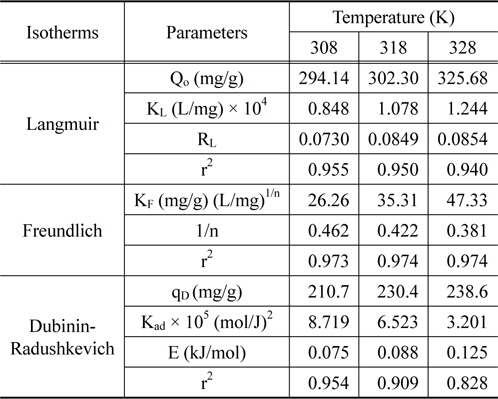
활성탄에 의한 CBBG의 흡착공정에 대한 성질과 메카니즘에 대한 정보를 얻기 위하여 등온흡착평형실험을 수행하여, 실험값들을 Langmuir, Freundlich 및 Dubinin-Radushkevich 흡착등온식에 적용하여 보았으며, 그 결과는 Figure 3~5 및 Table 3과 같다.
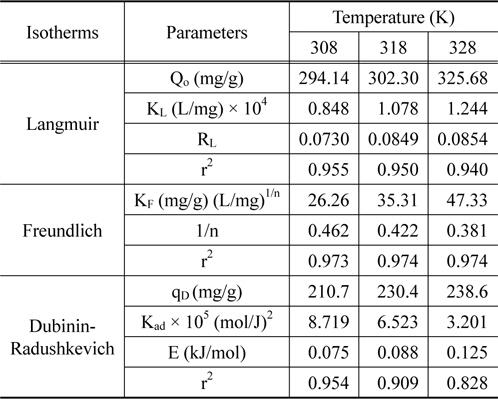
Langmuir, Freundlich, and Dubinin-Radushkevich isotherm constants for adsorption of coomassi brilliant blue G on activated Carbon
3.3.1. Langmuir 등온흡착식
Langmuir 등온흡착식은 흡착질이 균일한 흡착제 표면에 있는 한정된 흡착부위에 단분자층을 형성하는 것에 의해 흡착이 일어난다고 가정하였다.
여기서 qe는 흡착제 단위질량당 흡착된 흡착질의 양(mg/g), Ce는 흡착질의 평형농도(mg/L), Qo와 KL은 이론최대흡착용량과 흡착속도와 관련된 Langmuir 상수이다. Table 3을 보면, 온도가 증가할수록 이론최대흡착용량, Qo는 294.14 < 302.30 < 325.68 mg/g으로 증가하였고, KL은 0.848 × 10-4 < 1.078 × 10-4 < 1.244 × 10-4L/mg과 같이 커졌다. Langmuir 식에 대한 일치도를 마타내는 r2값은 0.940~0.955로 나타났다.
Langmuir 식의 특징은 다음 식으로 정의되는 분리계수 또는 평형계수로 부르는 무차원 상수 RL의 사용이다.
만약 0 < RL < 1이면 흡착처리공정이 적합하다는 것을 의미한다[13]. RL은 0.0730~0.0854로 흡착공정이 적합하다는 것을 알 수 있었다.
3.3.2. Freundlich 등온흡착식
Freundlich는 불균일한 흡착제의 표면에 다분자층으로 이루어진 흡착식을 제시하였다.
두 식에서 Ce는 흡착질의 평형농도(mg/L), qe는 흡착제의 평형흡착량(mg/g)이고 Freundlich 상수인 KF는 흡착제의 흡착용량, n은 흡착강도를 나타낸다. Table 3을 보면 먼저, 식에 대한 일치도는 r2 = 0.973~0.974로 나타났으며, 흡착용량계수 KF는 온도가 증가할수록 26.26 < 35.31 < 47.33 순으로 증가하였다. 흡착조작의 적합성을 나타내는 분리계수(1/n) 값은 0.381~0.462로 평가되어 아주 효과적인 흡착조작이 가능한 영역인 0 < 1/n < 1에 속하는 것을 알 수 있었다[14].
3.3.3. Dubinin-Radushkevich 등온흡착식
Dubinin-Radushkevich 식[18]은 흡착에너지의 불균일도와 흡착제의 기공특성을 추론하기 위해 응용한다.
여기서 qD는 이론포화용량(mg/g), KDR은 흡착질 1 몰당 평균 흡착자유에너지(mol2/J2), R은 기체상수(8.314 J/mol K), T는 절대온도(K)이다. 흡착에너지(kJ/mol)는 다음 식으로 계산할 수 있다.
Table 3에서 r2값이 0.980~0.991로 다른 등온흡착식보다 식에 대한 일치도가 좋은 것을 알 수 있고, 온도가 올라갈수록 qD가 60.33 < 68.13 < 74.64 mg/g으로 증가하는 경향을 나타내고 있다. (6) 식에 의해 흡착에너지 값은 E = 0.075~0.125 kJ/mol로 평가되었기 때문에 이 흡착 공정은 Monika et al.[15]이 앞선 연구에서 제시한 E < 8 kJ/mol 에 해당하므로 물리흡착 공정에 속하는 것으로 해석되었다.
흡착공정에 대한 효과적이고 효율적인 모델을 디자인하기 위하여 흡착공정의 동력학에 대한 세심한 이해가 필요하다. 최적조건 선정에 필요한 선행지식을 연구하기 위해 초기농도를 100, 200 및 300 mg/L로 달리하여 흡착속도실험을 진행하였다.
3.4.1. 반응속도식
유사일차반응속도식 (pseudo first order equation), 유사이차반응속도식(pseudo second order equation)은 각각 다음과 같이 주어진다.
여기서 qe와 qt는 각각 평형상태와 t시간에서 흡착된 CBBG의 양(mg/g)이며, k1은 유사일차반응속도상수(1/h), k2는 유사이차반응속도상수(g/mg h)이다. qt는 시간당 흡착량으로 다음식으로 계산할 수 있다.
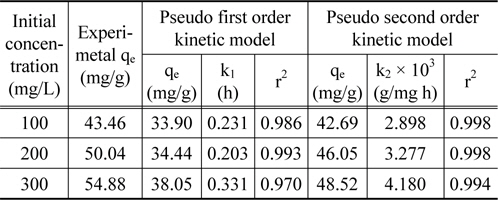
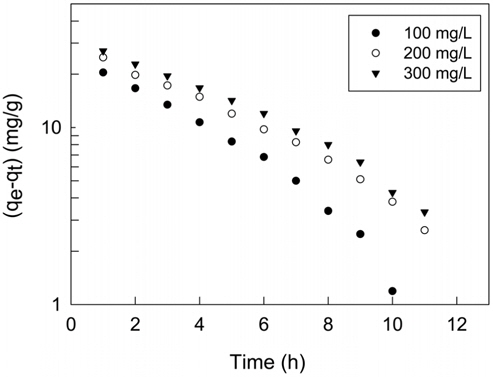
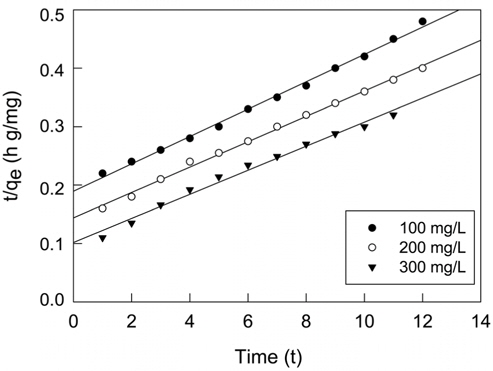
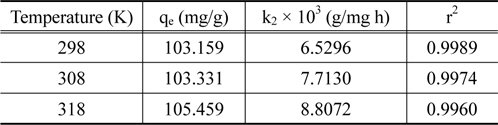
실험값을 유사일차반응속도식에 적용한 결과는 Figure 6에, 유사이차 반응속도식에 적용한 결과는 Figure 7에 각각 나타냈으며, 속도식의 파라미터 값들을 계산한 결과는 Table 4와 같다. 유사일차반응속도식과 유사이차반응속도식 모두 초기농도가 증가할수록 평형흡착량(qe)이 각각 33.90 < 34.44 < 38.05 mg/g 및 42.69 < 46.05 < 48.52 mg/g과 같이 증가하는 경향을 나타내었기 때문에 초기농도가 증가하더라도 유효한 흡착이 이루어질 수 있음을 알았다[16]. 반응속도식에 대한 일치도는 r2 값을 보면 유사일차반응속도식(0.970~0.993) ≦ 유사이차반응속도식(0.994~0.998)로 큰 차이가 나지 않았지만, 평형흡착량에 대한 결과는 실험값과 계산값의 차이가 유사일차반응속도식(9.56~16.83 mg/L) ≫유사이차반응속도식(0.77~6.36 mg/L)로 현저히 차이가 나는 것을 봤을 때 흡착공정은 유사이차반응의 형태로 진행된다고 판단되었다.
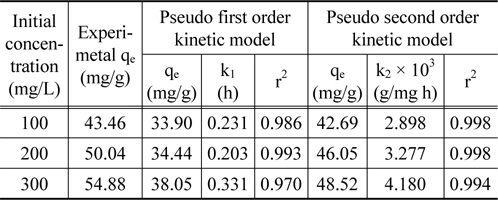
Kinetic parameters for coomassi brilliant blue G adsorption onto activated carbon at different initial concentration (T = 298 K)
3.4.2. 입자내 확산식
흡착공정의 확산기구를 해석하여 율속단계를 조사하기위해 다음과 같은 입자내 확산 모델식을 사용하였다.
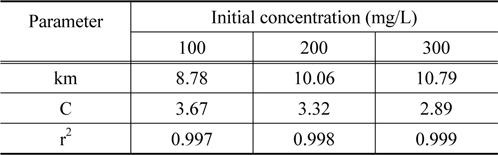
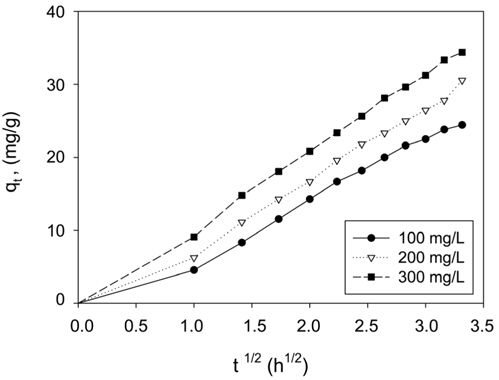
여기서 km은 입자내 확산속도상수(mg/g・min1/2)이며, C는 상수이다. Figure 8을 보면 초기농도가 100, 200, 300 mg/L에서 세 가지 모두 기울기가 1개인 직선으로 나타났다. 통상적으로 흡착공정이 기울기가 다른 3개의 직선으로 나타나는 경우에는 1. 경계층 확산 2. 세공확산 3. 표면확산의 3단계로 나누며, 2개의 직선으로 나타나는 경우는 1. 경계층 확산 2. 입자내 확산으로 구분한다. 본 실험 결과와 같이 원점을 통과하는 하나의 직선으로 나타나는 경우에는 입자내 확산이 율속인 경우로 알려져 있다[17]. 그 이유로는 흡착과정에서 미리 증류수로 침지한 활성탄을 사용하였기 때문에 경계층 확산 단계가 사라지고 입자내 확산만 진행된 결과로 판단된다[16]. Table 5를 보면 본 실험에서의 km 값은 CBBG의 초기농도가 증가할수록 8.78 < 10.06 < 10.79로 커지는데 이것은 입상활성탄의 세공도(porosity)가 크고 초기농도 증가할수록 CBBG의 운동이 활발해졌기 때문으로 해석된다[18]. 한편 C값은 경계층의 두께와 관련이 있는데, 초기농도가 커질수록 3.67 > 3.32 > 2.89 순으로 작아져서 경계층의 영향도 낮아지는 것을 알 수 있었다[19].
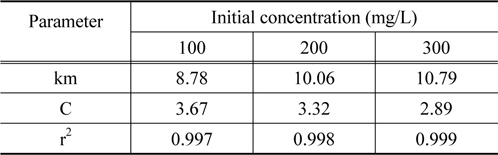
Intraparticle diffusion parameters for coomassi brilliant blue G adsorption onto activated aarbon at different initial concentration (T = 298 K)
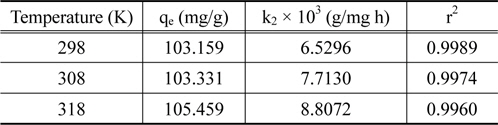
Pseudo second kinetic model parameters for coomassi brilliant blue G adsorption onto activated carbon at different temperature (Co = 100 mg/L)
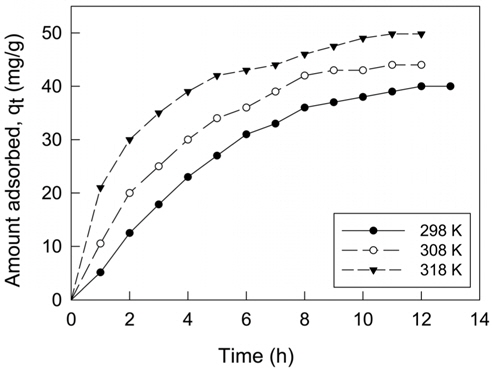
엔탈피변화(ΔH) 및 엔트로피 변화(ΔS) 자유에너지변화(ΔG)와 같은 열역학적 파라미터들은 흡착공정의 자발성을 평가하여 실제적인 공정운전에 필요한 중요한 지표로 사용될 수 있다. 열역학 파라미터들을 평가하기 위하여 298, 308, 318 K에서 흡착속도실험을 수행하였다. Van't Hoff는 흡착과정의 엔트로피와 엔탈피는 다음 식으로부터 평가하였다.
자유에너지변화는 다음 식으로 구할 수 있다.
여기서 Kd는 다음 식으로 표현되는 온도 T 에서의 분배계수이다.
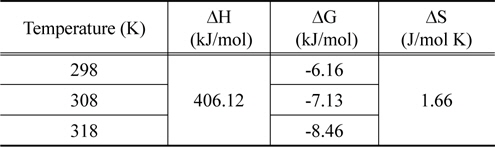
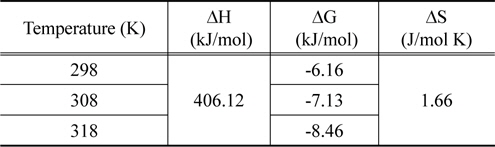
Figure 9의 실험값을 이용하여 식 (11)~(13)으로부터 구한 열역학적 파라미터 값들은 Table 7에 종합하여 나타냈다. 활성탄에 의한 CBBG의 흡착공정의 Gibbs 자유에너지변화는 온도가 303, 313, 323 K로 높아질수록 -6.16 > -7.13 > -8.46 kJ/mol 순으로 감소하였기 때문에 온도가 올라갈수록 자발성이 더 높아진다는 것을 알 수 있었다. 또한 일반적인 물리흡착의 자유에너지변화영역인 -20~0 kJ/mol 범위에 속하기 때문에 이 흡착공정이 물리흡착공정으로 진행된다는 것을 확인하였다[20].
[Table 7.] Thermodynamic parameters for coomassi brilliant blue G onto activated carbon
Thermodynamic parameters for coomassi brilliant blue G onto activated carbon
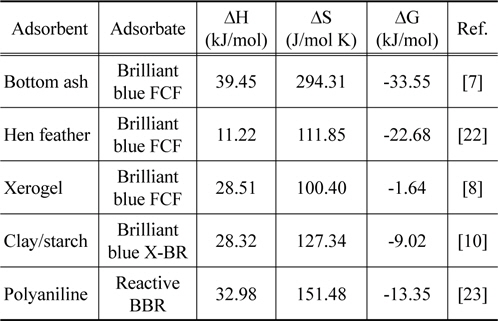
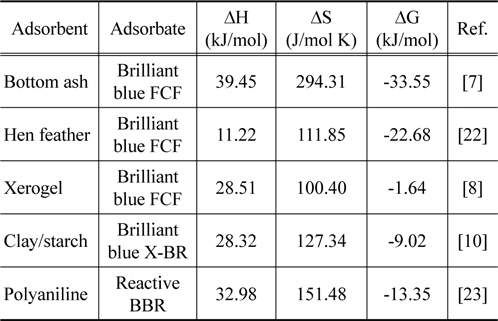
[Table 8.] Thermodynamic parameters for the of brilliant blue dyes adsorption in previous studies
Thermodynamic parameters for the of brilliant blue dyes adsorption in previous studies
Van't Hoff식으로 구한 엔탈피 변화값은 406.12 kJ/mol로 활성탄에 대한 CBBG의 흡착공정이 흡열반응으로 진행됨을 알수 있었다. 엔트로피 변화값이 1.66 kJ/mol K을 갖는 것은 활성탄에 대한 CBBG의 친화력이 좋아서 고액계면에서 무질서도가 크게 증가하였다는 것을 나타낸다[21].
여러 가지 흡착제를 사용하여 Brilliant Blue 계열 염료를 흡착한 이전의 연구결과를 나타낸 Table 7을 통해 비교해 본 결과[7,8,10,22,23], 흡착제로 활성탄을 사용하지 않았기 때문에 직접적인 비교는 어렵지만 Brilliant blue FCF, Brilliant blue X-BR 및 Reactive Brilliant blue R (Reactive BBR)에 비해 엔탈피변화, 엔트로피 변화가 커서 흡착반응에 열량이 많이 필요하고, 자유에너지변화 값은 작아서 상대적으로 반응의 수월성은 낮은 것으로 판단되었다[24].
본 연구에서는 활성탄을 사용하여 CBBG 염료를 흡착하는데 필요한 흡착평형과 흡착동역학에 대하여 조사하였다. pH가 흡착량 변화에 미치는 영향을 조사한 결과, 음이온 상태로 존재하는 CBBG는 활성탄 표면이 양전하로 되는 산성영역에서 흡착량이 크게 향상되었으며, pH 3에서 흡착량 증가가 가장 높았다. 등온흡착평형관계를 검토한 결과 Langmuir 식과 Freundlich 식으로부터 활성탄에 의한 CBBG의 흡착조작이 적절한 처리방법이 될 수 있음을 알았고, Dubinin-Radushkevich식으로부터 흡착공정이 물리흡착공정임을 알았다. 흡착공정에 대한 동력학적 해석을 통해 반응속도식의 적용결과는 유사이차반응속도식이 유사일차반응속도식에 비해 일치도가 높은 것으로 나타났으며, 입자내 확산이 흡착공정의 율속단계임을 알았다. 유사이차반응속도식을 적용한 열역학적 해석을 통해 평가된 엔탈피 변화값(406.12 kJ/mol)으로부터 흡착공정이 흡열반응으로 진행됨을 알았다. 또한 엔트로피 변화값(1.66kJ/mol K)은 흡착공정의 무질서도가 크게 증가한다는 것을 나타내었고, 자유에너지값은 온도가 올라갈수록 감소하였기 때문에 활성탄에 대한 CBBG의 흡착반응은 온도가 올라갈수록 자발성이 높아지는 것을 알았다.