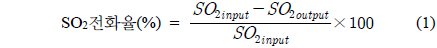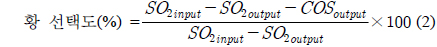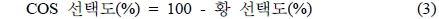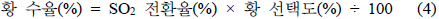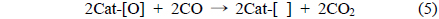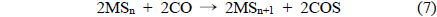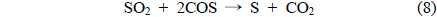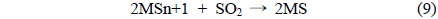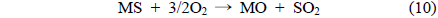In order to regenerate the sulfidated desulfurization sorbent, oxygen is used as the oxidant agent on the regeneration process. The small amount of oxygen un-reacted in regeneration process is flowed into direct sulfur recovery process. However, the reactivity for SO2 reduction can be deteriorated with the un-reacted oxygen by various reasons. In this study, the deactivation effects of un-reacted oxygen contained in the off-gas of regeneration process flowed into direct sulfur recovery process of hot gas desulfurization system were investigated. Sn-Zr based catalysts were used as the catalyst for SO2 reduction. The contents of SO2 and SO2 contained in the regenerator off-gas used as the reactants were fixed to 5.0 vol% and 4.0 vol%, respectively. The catalytic activity tests with a Sn-Zr based catalyst were for SO2 reduction performed at 300-450℃ and 1-20 atm. The un-reacted oxygen oxidized the elemental sulfur produced by SO2 catalytic reduction and the conversion of SO2 was reduced due to the production of SO2. However, the temperature for the oxidation of elemental sulfur increased with increasing pressure in the catalytic reactor. Therefore, it was concluded that the decrease of reactivity at high pressure is occurred by catalytic deactivation, which is the re-oxidation of lattice oxygen vacancy in Sn-Zr based catalyst with the un-reacted oxygen on the catalysis by redox mechanism. Meanwhile the un-reacted oxygen oxidized CO supplied as the reducing agent and the temperature in the catalyst packed bed also increased due to the combustion of CO. It was concluded that the rapidly increasing temperature in the packed bed can induce the catalytic deactivation such as the sintering of active components.
석유자원의 고갈에 따른 석탄자원의 고품위화를 위한 연구가 다양한 방식으로 이루어지고 있으며, 석탄가스화 복합발전과 석탄가스화로부터 얻어진 합성가스를 이용하여 전기, 수송연료, 화학원료 등을 생산하기 위한 실증연구들이 활발히 진행되고 있다. 중국에서는 이미 석탄가스화로부터 얻어진 합성가스를 이용하여 SNG합성, DME합성, F-T오일 합성, CTMEG(Coal to monoethylene glycol)기술을 석탄화학산업을 육성하기 위한 4대 전략기술로 선정하여 실증기술개발을 위한 프로젝트를 진행하고 있다.
이와 같은 석탄화학산업용으로 석탄가스화로부터 얻어진 합성가스를 사용하기 위해서는 반드시 생산된 가스를 정제하여야 한다. 연료가스를 원하는 형태의 에너지로 전환하기 위해서는 반드시 촉매전환공정을 거쳐야 하는데, 생산된 합성가스를 정제하지 않으면, 에너지 전환공정에 사용되는 촉매의 비활성화를 피할 수 없다. 석탄가스의 정제를 위한 탈황공정은 습식공정과 건식공정으로 구분되는데, 최근 20여 년 동안 가스정제공정의 경제성을 고려한 실증용 고온건식 탈황공정을 개발하기 위한 연구가 국내에서도 진행되어 왔다.
본 연구에서는 고온건식 탈황공정의 단위공정인 직접 황회수공정의 실증기술 개발과정에서 발생되는 몇 가지 해결해야 할 문제들 중에서 황화된 탈황제의 재생과정에서 생성되는 SO2를 원소 황으로 전환하기 위한 촉매환원반응에서 재생가스에 함유된 미량 산소에 의한 문제를 제안하고자 한다. 한등[1,2,4]은 직접 황 회수공정에 유입되는 미량 산소는 SO2의 촉매환원반응에서 SO2 전화율을 저하시킨다고 보고하였다. 본 연구에서는 미량의 산소가 SO2의 촉매환원반응에서 전화율을 감소시키는 원인을 촉매표면에서 일어나는 촉매비활성화와 그 외의 원인으로 구분하여 조사하였다.
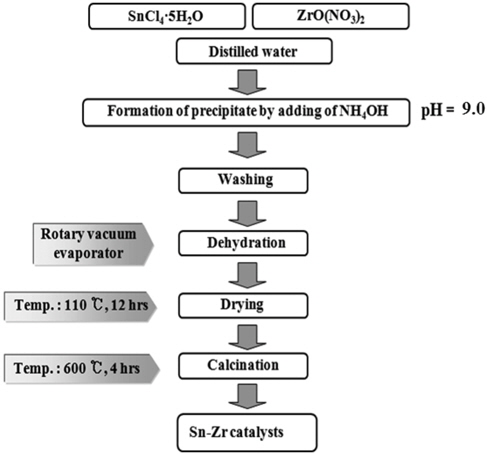
SO2 환원용 촉매로 SnO2와 ZrO2가 혼합된 Sn-Zr계 촉매는 공침법으로 제조되었다. 이들 두 성분의 전구체로 1.0 M tin chloride (SnCl4 5H2O, Aldrich)와 1.0 M zirconyl nitrate (Zr(NO3)2 6H2O, Aldrich) 용액이 사용되었으며, 침전제로 15 M의 암모니아수(NH4OH)가 첨가되었다. 암모니아수는 pH = 9가 될 때까지 첨가되었으며, 얻어진 침전물은 여과지를 이용하여 슬러리 상태로 분리하였다. 증류수를 이용하여 슬러리를 세척하였으며, 침전물 슬러리에 함유된 염소성분을 제거하기 위하여 3회 반복적으로 세척하였다. 세척된 침전물 슬러리는 110 ℃에서 12시간 동안 건조되었으며, 600 ℃에서 4시간 동안 열처리되었다. Figure 1과 같은 과정으로 제조된 촉매를 분쇄하여 200-300 μm 입자크기만 체 분리하여 반응성 실험에 사용하였다.
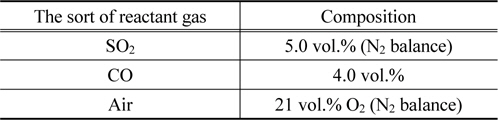
SO2 환원실험은 고정층 촉매 반응기에서 수행되었으며, 반응물로 공급되는 기체는 질량 유량조절기(mass flow controller)로 유량을 조절하였다. 반응기 내의 압력은 역압조절기(back pressure regulator)를 사용하여 20 atm 조건으로 고정하였으며, 반응온도는 300-450 ℃범위로 조절하였다. 반응물로 유입되는 기체에 함유된 성분은 SO2, CO, O2, N2이며, 이들 중 CO는 환원제로 공급되었고 나머지 성분은 고온건식 탈황공정의 재생탑에서 배출되는 기체로서 조성비는 Table 1에 나타낸 것과 같이 모사하였다. 촉매 반응기로 인코넬(Inconel 600) 재질의 1/2 inch관이 사용되었으며, 반응기의 중앙에 0.6 g정도의 촉매를 충전하고 열전대를 반응기 상부에서부터 삽입하여 촉매층의 중심에 위치시켰다. 반응기의 출구는 황 포집기를 장착하였으며, 포집기 후단에 연결된 배관은 분석장비로 사용된 기체 크로마토그래피(Shimadzu GC-8A)와 직접 연결하였다. 이때 분리관은 Hyasep Q (8 ft)와 Porapak T (2 ft)를 연결하여 사용하였으며, 운반기체는 수소가 사용되었다.
[Table 1.] Composition of regeneration off-gas
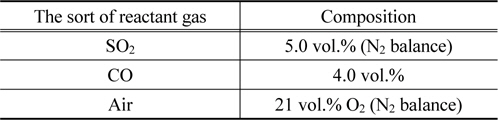
Composition of regeneration off-gas
SO2의 촉매환원은 재생가스를 유입한 상태에서 반응온도와 압력을 조절한 후 환원제를 유입하여 반응을 시작하였다. 재생가스에 함유된 산소의 양을 조절하여 이들의 영향을 조사하였으며, 다음에 나타낸 식으로 SO2 전화율, 황 선택도, COS 선택도, 황 회수율을 얻을 수 있었다.
SO2 환원으로부터 생성된 원소 황의 거동을 관찰하기 위하여 원소 황의 산화실험을 수행하였다. 반응실험에서 회수된 원소 황을 반응기에 0.1 g 충전한 후 산소를 공급하여 반응기출구로 배출되는 기체의 조성을 기체 크로마토그래피로 분석하였다. 이때 반응기의 온도를 200-450 ℃범위에서 조절하면서 SO2의 생성을 관찰하였다. 또한, 일산화탄소와 공기를 함께 반응기로 유입시키고 반응기의 온도를 100-400 ℃로 변화시키면서 반응기 출구의 일산화탄소의 함량변화를 관찰하였다. 이와 같은 실험으로부터 생성물인 원소 황 및 환원제인 일산화탄소가 재생가스에 함유된 미량 산소와의 반응거동을 관찰하였다.
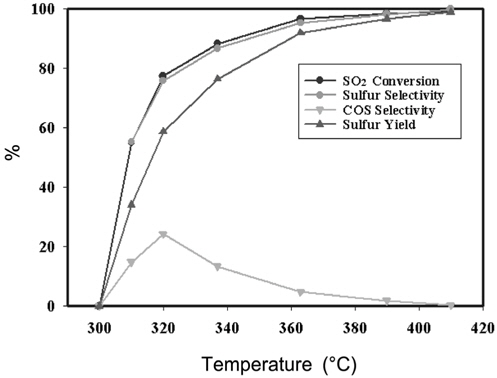
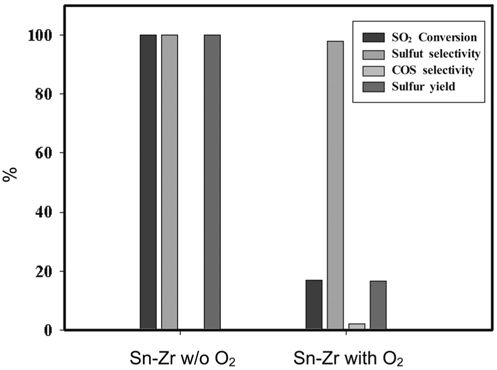
SO2를 환원하기 위한 촉매 반응에서 재생가스 내에 미량산소가 함유되지 않은 경우, Sn-Zr계 촉매의 활성은 매우 높게 유지되었다. SO2와 CO의 혼합비는 SO2 환원을 위한 화학양론비(CO/SO2 = 2)로 고정되었다. Figure 2에 나타낸 것과 같이, 약 350 ℃에서 SO2 전화율이 85% 이상으로 온도가 올라가면서 전화율은 증가되었으며, 450 ℃에서 약 98% 정도다. 또한 원소 황 수율도 높은 값으로 유지되었는데, 약 89% 정도였다. 반응기로부터 배출되는 기체 생성물 중에 COS도 관찰되었으나, 선택도가 약 1.2%정도로 낮은 것으로 확인되었다. COS의 생성은 두 가지로 설명되고 있다. 첫 번째는 생성물인 원소 황과 미 반응 CO가 반응하여 COS로 전환되는 것이며, 두 번째는 촉매의 주 활성물질인 SnO2가 SnS2로 황화된 경우에 SnS2와 CO의 기체-고체 반응에 의해서 일어난다고 보고된 바 있다[12].
재생가스 중에 미량의 산소가 함유된 경우, Figure 3에 나타낸 것과 같이 SO2의 전화율은 높은 온도에서도 거의 15%이내에 해당되는 것으로 나타났다. 한[1]의 연구에서도 재생가스 중에 함유된 미량 산소가 약 1% 정도일 때의 결과에서 SO2의 환원이 매우 낮은 것으로 보고된 바 있다. SO2 환원반응에서 산소는 산화력이 높은 기체상 물질로서 일산화탄소의 환원능력을 저하시키는 요인이 될 수 있다. 즉, 생성물인 원소황을 재 산화시켜 SO2를 다시 생성시키는 역할을 하므로 열역학 평형을 역 방향 쪽으로 이동시킬 수 있다. 그러므로 전체반응에서 SO2의 전화율은 감소되는 결과를 초래하게 된다.
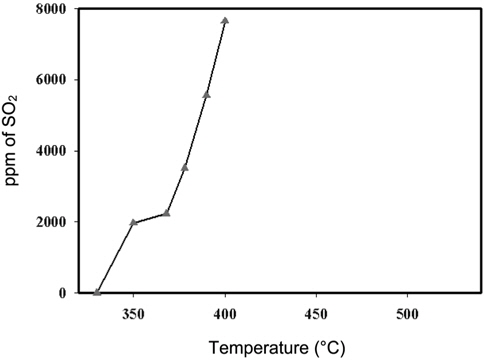
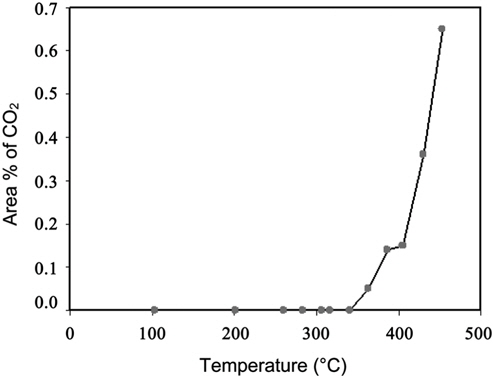
재생가스에 함유된 미량 산소에 의해서 SO2 전화율이 감소되는 것을 확인하기 위해서 SO2 환원반응에서 회수된 원소 황을 산소 분위기에서 재산화시켰다. 상압의 조건에서 반응온도를 증가시키면서 반응기 출구에서 SO2 농도변화를 관찰하였다. Figure 4에 나타낸 것과 같이, 온도가 증가할수록 SO2의 농도가 증가되는 것으로 확인되었다. 반응기의 온도가 200 ℃에서부터 SO2가 관찰되었다. 그러므로 SO2 환원반응의 운전온도가 350 ℃인 경우에는 생성물인 원소 황의 재 산화에 의한 SO2의 생성으로 전화율이 감소되는 결과를 초래할 수 있다.
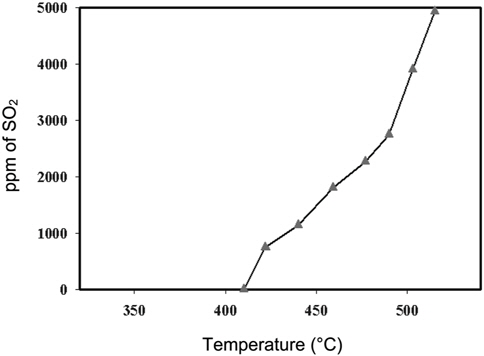
한편, 반응기 내의 압력을 10 atm으로 고정한 상태에서 동일한 실험을 수행하였다. Figure 5에 나타낸 것과 같이, SO2의 산화온도가 상당히 증가된 것을 확인할 수 있었다. 이는 압력이 증가하면서 원소 황이 응축되어 반응활성이 높은 원소 황증기의 분율이 상대적으로 낮아졌기 때문이라 할 수 있다. 그러나 본 연구에서 수행된 SO2 환원반응은 20 atm에서 운전되었기 때문에 생성물인 원소 황과 산소의 반응에 의해서 SO2가 생성되는 것이 전화율의 감소의 직접적인 요인이라 말하기에 조심스러운 면이 있다.
재생탑에서 반응에 참여하지 못하고 SO2와 함께 유출되어 직접 황 회수공정으로 공급되는 미량 산소의 거동을 촉매표면반응의 관점으로 검토하였다. 본 연구의 선행연구에서 이미 조사된 바와 같이 Sn-Zr계 촉매는 두 가지 반응기구에 의해서 촉매환원반응이 일어나는 것으로 알려져 있다[2,4]. 하나는 반응 (5)-(6)과 같이, 금속산화물 촉매의 표면 또는 격자내의 산소가 환원되어 생성된 격자산소 빈자리가 활성점으로 작용하여 SO2를 원소 황으로 환원하는 redox 반응기구이며, 다른 하나는 COS 중간체 반응기구이다. COS 중간체 반응기구는 반응 (7)-(9)에 나타낸 것과 같이, 금속산화물 촉매가 황화되어 생성된 금속 황화물과 일산화탄소의 기체-고체 반응으로부터 COS가 생성되고 COS와 SO2가 Langmuir-Hinshelwood 반응기구에 따라 원소 황과 이산화탄소로 전환되는 반응이다. 이들 반응기구에서 산소는 각각 다음과 같은 반응거동을 보일 수 있다.
첫 번째 제시된 반응기구인 Redox 반응기구로 SO2가 환원될 경우, 미량 산소는 일산화탄소에 의해서 환원되어 생성된 격자산소 빈자리를 산화시키는 작용을 할 수 있다. 그러므로 Figure 6에 나타낸 것과 같이, 반응 중에 이산화탄소의 생성과 일산화탄소의 소비는 지속되지만, SO2는 환원되지 않거나 환원에 의한 전화율이 낮게 유지되는 결과를 초래하게 된다.
반면, COS 중간체 반응기구에서 미량 산소의 영향은 다음과 같이 설명할 수 있다. 이 반응기구에서는 중간체로 COS가 생성되고 이들이 SO2와 촉매표면반응에 의해서 원소 황으로 전환되기 때문에 촉매에 함유된 황화된 금속황화물의 역할이 매우 중요하다. 금속 황화물은 미량산소와의 반응에서 반응(10)과 같이 SO2를 생성한다. 즉 SO2의 생성은 SO2환원반응에서 전화율 감소를 초래하기 된다.
그러나 이와 같은 금속황화물의 산화반응은 650 ℃ 이상의 고온에서 일어나는 것으로 잘 알려져 있다. 그러므로 400 ℃이하에서 수행되는 SO2 환원반응에서는 금속황화물의 산화에 의한 SO2 전화율 감소는 일어나지 않는다고 할 수 있다.
한 등[1,2]은 Sn-Zr계 촉매상에서 SO2환원반응은 Redox 반응기구와 COS 중간체 반응기구가 복합적으로 일어난다고 보고한 바 있다. Sn-Zr계 촉매에서 SnO2의 격자내에 존재하는 산소의 환원과 산화로부터 SO2가 환원되어 원소 황으로 전환되지만, 반응 후의 XRD로 분석된 결정구조에서 SnS2의 결정구조가 관찰되는 것으로 확인된다. 이는 COS 중간체 반응기구도 함께 일어남을 의미한다. 이들의 실험결과에서도 SO2 전화율이 50%일 때 COS의 유출농도가 가장 높은 값을 나타낸다. 이와 같은 반응 거동을 고려할 경우, 미량 산소의 유입으로 인하여 redox 반응기구로부터 원소 황이 생성되는 반응은 제한적으로 반응성이 저하되는 원인으로 작용할 것으로 판단된다.
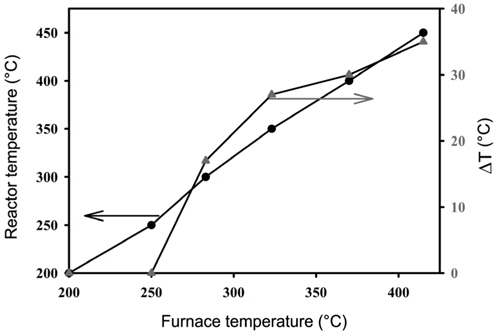
고온건식 탈황공정의 재생탑에서 배출되는 재생가스에 함유된 미량 산소는 SO2 환원반응에서 환원제로 사용된 CO를 산화시킬 수 있다. 이와 같은 반응을 연소반응이라 하며, 연소과정에서 연소열을 발생한다. 재생반응기로부터 유입되는 재생가스에는 실제로 4-6 vol% 수준의 O2가 함유되어 있다. 이는 재생반응에서 황 성분을 흡수한 탈황제를 재생하기 위하여 산화제로 21 vol% O2를 공급하여 반응에 참여하지 못하고 SO2와 함께 배출되는 산소의 농도이다. 본 연구에서는 4vol% 산소를 공급하면서 일산화탄소의 연소반응을 관찰하였다. 반응기 내부로 산소가 공급됨과 동시에 촉매층의 온도가 급격히 상승하는 것을 확인할 수 있었다. 촉매층의 온도는 350 ℃에서 최대 450 ℃까지 증가되었으며, 반응기 출구로 이산화탄소의 농도가 증가되었다. 200-250 ℃까지는 반응기 온도와 촉매 층 내부온도는 차이가 나타나지 않았지만 반응기 온도 300 ℃에서부터 촉매 층 내부온도가 CO연소 의해서 급격히 증가하는 것을 Figure 7과 같이 확인 하였다. 촉매층의 온도 상승은 SO2 환원반응의 활성을 더욱 상승시키는 효과를 얻을 수 있다. 그러나 온도의 상승으로 인하여 촉매의 비활성화가 초래될 수 있는데, 고온조건에서 Sn-Zr계 촉매에 함유된 SnO2의 소결이 일어날 수 있기 때문이다.
본 연구에서는 고온건식 탈황공정의 재생공정에서 탈황제의 재생을 위하여 사용된 산소가 완전히 소모되지 않고 재생가스에 함유되어 직접 황 회수공정으로 유입되어 SO2 환원반응에 미치는 영향이 조사되었다. 직접 황 회수공정에 유입된 산소는 SO2 환원으로부터 생성된 원소 황을 산화시켜 SO2를 생성할 수 있으나, 운전조건인 20 atm, 350 ℃에서는 황의 산화가 일어나지 않는 것으로 확인되었다. 산소의 유입으로 반응성이 저하되는 이유는 금속산화물 촉매표면과 결정격자에 존재하는 산소의 환원 후 격자산소 빈자리의 산화과정에서 SO2 분자 내 산소가 제공되지 않고 재생가스에 함유된 산소에 의해서 산화되기 때문이라 판단된다. 또한 유입된 산소는 SO2 환원을 위하여 공급되는 CO를 연소하여 촉매층의 온도를 상승시키는 결과를 초래하므로 발열에 의한 금속산화물 촉매의 소결에 의한 비활성화를 유발할 수 있다. 그러므로 재생가스에 함유된 미 반응산소의 공급을 차단 또는 억제할 수 있는 방안이 마련되어야 한다. 이와 같은 조치로부터 미 반응산소로 인한 SO2 촉매환원반응의 반응성 저하 및 비활성화를 방지할 수 있을 것이며, 더 나아가 고온건식 탈황공정을 위한 직접 황 회수공정의 실증용 기술이 확립 될 것이다.