Black seabream juveniles
우리나라 해산어류 양식생산량은 인공종묘생산, 양성 기술개발 및 수요증가로 인해 꾸준히 증가하여 왔으나, 최근 양식어장 환경 악화로 인한 성장 저하 및 질병발생 증가, 또한 고수온, 적조, 태풍과 같은 자연재해, 사료값 폭등, 수입수산물 증가 등으로 인해 그 생산량이 감소하는 실정이다. 이를 해결하기 위한 일부 방안으로 질병에 대한 예방 및 치료는 양식어류의 건강하고 안정적인 생산량 증가를 위한 효율적인 방법 중 하나이며, 양식 어류에 발생하는 기생충성 질병은 건강도 저하, 대량폐사 등을 유발함으로 기생충 구제는 반드시 필요하다.
포르말린은 대부분의 원생동물뿐만 아니라 단생 흡충류과 같은 대형 기생충 구제에 효과적이므로 어류의 아가미, 피부 및 지느러미에 있는 여러 외부 기생충을 구제하는데 오래전부터 양식어류에 사용되어져 오고 있으나(Allison, 1957; Subasinghe, 1992), 어종별 및 기생충의 종류에 따라 포르말린의 농도 및 약욕시간이 각각 다르게 나타나고 있다(Tonguthai and Chanratchakool, 1992). 포르말린은 37% 포름알데하이드를 함유한 수용액으로 파라포름알데하이드의 형성을 억제하기 위해 10-15% 메탄올을 첨가한 것을 어류에 사용한다. 어류에 대한 포르말린의 독성은 연어과 어류를 비롯한 여러 경골어류에서 주로 반수치사농도(median lethal concentration: LC50), 아가미의 조직학적 변화, 혈액성상과 관련하여 연구되어져 오고 있다(Williams and Wootten, 1981; Reardon and Harrell, 1990). 현재 우리나라의 양식어류 중에서는 넙치, 뱀장어에서만 포르말린의 LC50이 밝혀져 있는데(Park et al., 1995; Jung and Kim, 1998; Jung et al., 2007), 포르말린에 대한 내성은 어종과 처리 조건에 따라 달라지므로(Kabata, 1985), 외부기생충 구제시 이러한 어종에서 밝혀진 포르말린의 치사농도를 타 어종에 적용하여 사용하는 것은 적절하지 않다.
감성돔(
본 연구에서는 상업적으로 중요한 감성돔의 치어를 대상으로 외부기생충 구제시 사용되는 포르말린의 독성효과를 평가하고자, 다양한 포르말린 농도 및 노출 시간에 따른 폐사율 및 LC50을 조사하였으며, 또한 아가미 및 간에 대한 변화를 조직학적 방법으로 관찰하고자 하였다.
당년생인 감성돔 치어(평균 전장 6.6±0.5 cm, 체중 3.9±1.0 g) 1,000마리를 경남 통영시에 소재한 개인 종묘배양장으로 부터 구입하여 국립수산과학원 실내 사육실로 옮겨 1톤 FRP 원형수조에서 2주 동안 적응시켰다. 이 기간 동안 수온은 21.2±0.8℃, 염분은 34±0.2 ppt 였으며, 하루에 2회 상업용 배합사료를 공급하였고, 실험 48시간 전부터는 절식하였다.
포르말린에 대한 LC50을 조사하기 위하여, 6개의 아크릴 사각수조(수용적 30 L)에 해수를 채운 후, 각각 포르말린(Formaldehyde 37%: S-KillerⓇ, Chamshin Pharma Co. Ltd., Korea)농도를 0, 50, 100, 200, 300, 400 ppm으로 설정하였다. 실험어 30마리씩을 각 실험수조에 무작위로 수용한 후, 24, 48, 72 및 96시간째에 폐사율을 관찰하였으며, 3반복으로 실시하였다. 실험기간 동안 수온은 실내온도를 조절하여 20±0.2℃로 유지하였으며, DO는 6.5 ppm 이상 되도록 에어레이션을 해주었다. 포르말린 노출에 따른 조직 샘플링은 상기 동일한 조건으로 실험 수조에 실험어를 수용하였다. 0-300 ppm구는 0, 24 및 96시간째, 400 ppm구는 0 및 6시간째 각 수조로부터 4-6마리의 실험어를 채집하여 아가미와 간을 절취한 후, 10% 중성포르말린에 고정하였다. 이후 상법에 따라 파라핀으로 포매하여 5 μm 두께로 절편한 후, haematoxylin-eosin으로 염색하여 광학현미경(Axioskop 2 plus: Carl Zeiss, Jena, Germany)과 화상분석시스템(AxioVision Rel., ver 4.6, Germany)으로 관찰하였다.
>
Lethal concentration (LC) 분석
LC10, 50, 90 및 이들의 95% 신뢰구간은 PASW 통계프로그램(Ver. 18)을 사용하여 probit 분석으로 산출하였다.
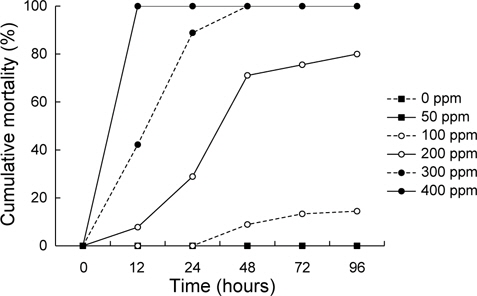
포르말린 노출에 따른 감성돔 치어의 누적 폐사율은 Fig. 1에 나타내었다. 0 ppm(대조구), 50 ppm에서는 96시간째까지 모두 생존하였다. 100 ppm에서는 48시간째에 사망한 개체가 나타나기 시작하여 96시간째에 14.4±1.1%의 폐사율을 보인 반면, 200 ppm에서는 12시간째에 폐사가 발생하여 24, 48 및 96시간째에 각각 28.9±7.8, 71.1±2.2 및 80.0±1.9%로 크게 증가하였다. 300 ppm 및 400 ppm에서는 각각 48시간과 12시간 이내에 모든 실험어가 폐사하였다.
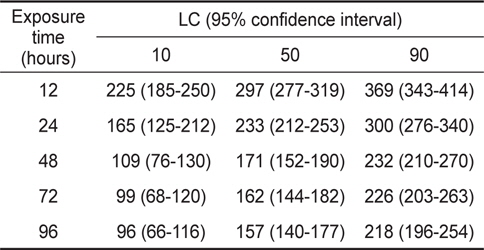
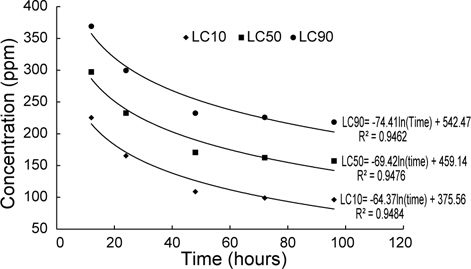
포르말린 노출에 따른 감성돔 치어의 LC10, LC50 및 LC90은 Table 1에 나타내었다. 12, 24, 48, 72 및 96시간째 LC10은 각각 225, 165, 109, 99 및 96 ppm, LC50은 각각 297, 233, 171, 162 및 157 ppm, LC90은 각각 369, 300, 232, 226 및 218 ppm이었으며, 또한 LC10, 50 및 90은 시간에 따라 로그함수식(LC10= -64.37ln(time)+375.56, R2=0.9484; LC50=69.42ln(time) +459.14, R2=0.9476; LC90=-74.41ln(time)+542.47, R2= 0.9462)으로 감소하는 것으로 나타났다(Fig. 2).
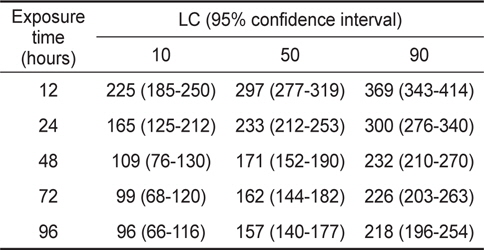
The lethal concentration (LC) of formalin to black seabream Acanthopagrus schlegelii juveniles for various exposure time
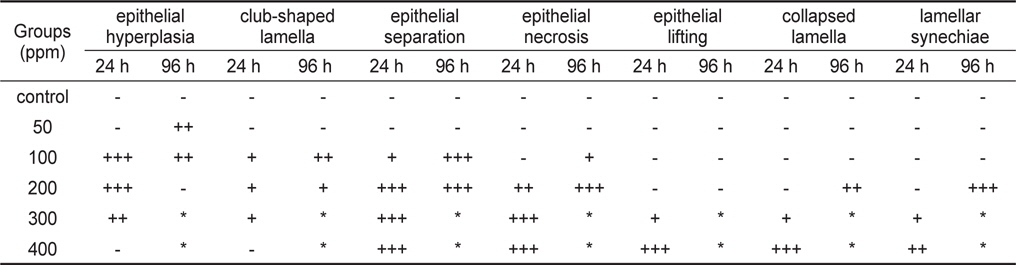
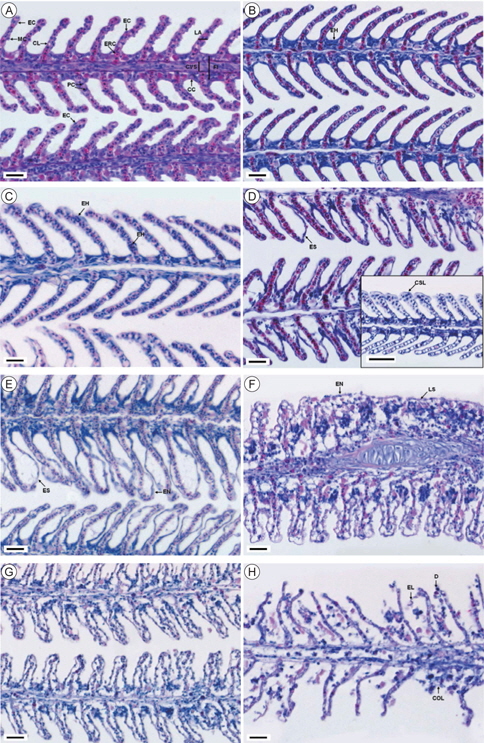
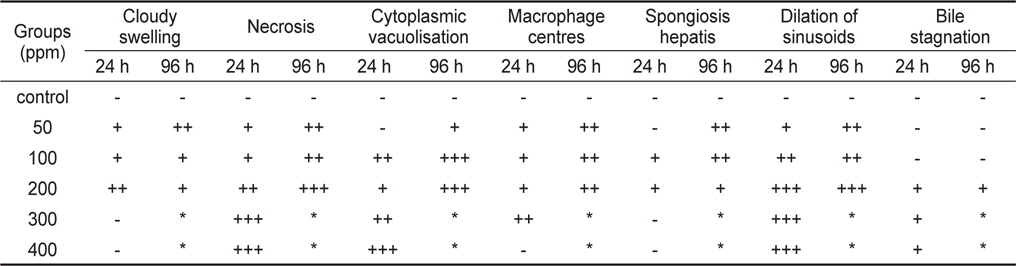
포르말린 노출에 따른 감성돔 치어의 아가미에 대한 조직학적 변화는 Table 2와 Fig. 3에 나타내었다. 50 ppm구에서는 96시간째까지 대조구와 마찬가지로 정상적인 아가미의 형태(Fig. 3A)가 유지되고 있었으나, 새변에서 상피세포의 증식이 관찰 되었다(Fig. 3B). 100 ppm에서는 24시간째 새변과 2차새변의 형태는 대조구와 큰 차이를 보이지 않았으나, 2차새변의 상피세포가 과증식(hyperplasia) 하는 현상과 2차새변이 비대해지는 현상(hypertrophy)이 주로 관찰되었으며(Fig. 3C), 96시간 째에는 일부 2차새변에서 상피세포가 분리되었으며, 2차새변의 끝이 비대해지는 곤봉화(club-shaped lamella) 현상이 나타났다(Fig. 3D). 200 ppm구에서는 24시간째에 대부분 2차새변의 상피가 분리되어 부종이 형성되었으며, 또한 괴사(necrosis)된 상피세포가 상당수 관찰되었다(Fig. 3E). 96시간째에는 상피세포의 증가와 분리가 더욱 심해져 2차새변의 유착(lamellar synechiae)이 나타났다(Fig. 3F). 300 ppm에서는 24시간째 아가미의 상피세포층이 완전히 분리(separation)되었으며(Fig. 3G), 400 ppm에서는 6시간째 역시 상피층이 분리되어 탈락(lifting)되었으며, 2차새변의 붕괴와 상피세포의 괴사가 관찰 되었다(Fig. 3H).
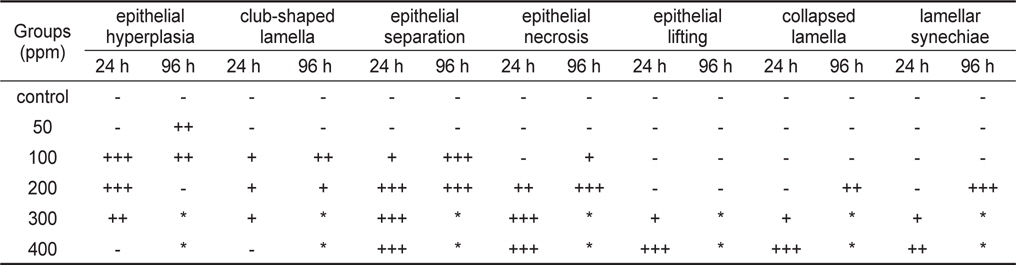
Summarized histological responses in the gills of black seabream Acanthopagrus schlegelii juveniles exposed to formalin for 24 and 96 hours
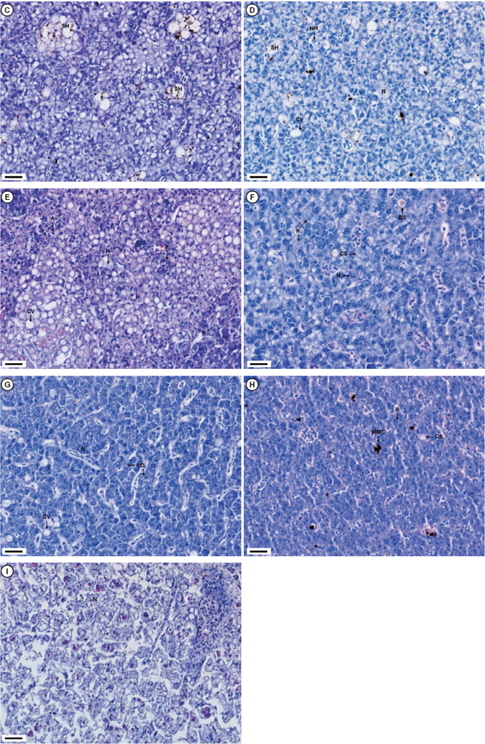
포르말린에 대한 간 조직은 Table 3과 Fig. 4에 나타내었다. 대조구의 실험어 간은 조직학적 변화가 없는 정상적인 형태로서 대체로 균질적인 세포질과 하나의 인을 포함하고 있는 구 상의 핵이 뚜렷하게 관찰되었다(Fig 4A). 50 ppm구의 24시간째에 실험구에는 동양혈관(blood sinusoid)이 팽창하였으며, 일부 간세포에서 혼탁부종(cloudy swelling), 괴사(necrosis)와 더불어 melano macrophage centres (MMC)가 관찰되었다(Fig. 4B). 96시간째에는 낭종과 유사한 구조를 띠는 낭포변성(spogiosis hepatis)의 간세포와 세포내 MMC가 나타났다(Fig. 4C). 100 ppm구의 24시간째는 낭포변성의 괴사된 간세포가 다수 출현하였으며, 이들 세포중에서는 세포질내 공포화 현상도 관찰되었으며, 또한 핵 비대증(nuclear hypertrophy)을 보이는 간세포도 확인되었다(Fig. 4D). 96시간째에는 세포질과 핵이 위축(atrophy)된 간세포 다수와 함께 거대공포성 지방증(cytoplasmic vacuolisation)이 관찰되었다(Fig. 4E). 200 ppm구에서 24시간째는 혼탁부종의 간세포와 핵융해(kartolysis)가 일어 나는 간세포가 관찰되었으며, 또한 답즙이 정체되는 현상(bile stagnation)이 나타났다(Fig. 4F). 96시간째에는 대부분 간세포가 서로 융합되어 응축된 상태로 괴사되었으며, 공포변성이 일어난 세포도 나타났다(Fig. 4G). 300 ppm에서는 24시간째 공포변성된 간세포가 다수 관찰되었으며(Fig. 4H), 400 ppm에서는 전체적으로 세포질 파괴와 핵의 소실로 보이는 괴사가 나타났다(Fig. 4I).
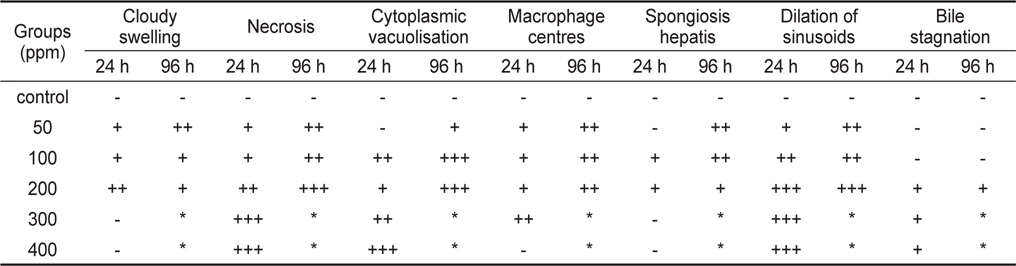
Summarized histological responses in the livers of black seabream Acanthopagrus schlegelii juveniles exposed to formalin for 24 and 96 hours
일반적으로 화학약품에 대한 독성평가 시 LC50은 중요한 지표로 사용되고 있으며(Ottoboni, 1991), 포르말린에 대한 LC50은 여러 어종에서 밝혀져 있다. 넙치는
일반적으로 아가미는 수질 지표로 고려되어지고 있으며 (Rankin et al., 1982), 환경 영향의 연구를 위한 모델로 사용되고 있다(McKim and Erickson, 1991; Wenderlaar Bonga and Lock, 1992). 또한 어류에서 아가미는 호흡, 삼투압조절 및 배출 기능을 하는 중요한 기관이다. 포르말린은 어류 아가미의 조직변화를 유도한다고 여러 어종에서 밝혀져 있다. 무지개송어,
간은 해독작용을 위한 주요 기관(Dutta et al., 1993)으로 포르말린, 농약 등의 다양한 화학약품 등에 의해 세포학적 변화를 나타내므로(Rodrigues and Fanta, 1998; Perera and Pathiratne, 2005) 환경 스트레스 요인에 대한 유용한 지표로 사용할 수 있다. 간세포의 괴사 및 공포는 독성 노출에 일반적으로 나타나는 비특이적 간 변병이다(Pierce et al., 1980). 특히, 간세포의 괴사는 독성물질에 직접적으로 영향을 받으며, 괴사된 간세포는 회복이 불가능하며, 이러한 괴사의 지속이나 진행은 간 기능의 부분 또는 전체적으로 장애를 유발한다. milkfish에서는 400 ppm 의 포르말린에 노출되었을 때 여러 형태의 간세포 괴사가 발생하는 것으로 보고(Cruz and Pitogo, 1989)된 바 있으며, 본 연구에서는 50 ppm에서 24시간째부터 간세포의 소상괴사가 관찰되었으나, 200 ppm부터는 현저하게 나타났다. 본 연구에서는 감성돔 치어의 포르말린 노출시 모든 실험구에서 MMC가 관찰되었는데, 이 MMC는 주로 퇴행성 괴사상태와 관련이 있는 유색의 대식세포가 축적된 것이다(Pacheco and Santos, 2007). 그리고 MMC는 포르말린 노출시간이 증가할 수록 현저하게 증가하는 경향을 보였는데, 이는 포르말린 독성에 의한 간세포 괴사의 증가에 따른 결과로 보여진다. 따라서 간 조직내 MMC의 분포 및 밀도는 환경오염에 대한 바이오마커로 유용하게 사용할 수 있다(Couillard and Hodson, 1996; Manera et al., 2000). 간세포가 희미한 호산성 물질로 채워지는 낭포변성(spongiosis hepatis)은 실험실에서 화학약품이나 원유의 WAF에 노출되었을 때(Agamy, 2012), 또한 오염된 지역에서의 어류로부터 보고되고 있다(Lauren et al., 1990; Couch, 1991). 본 연구에서는 이러한 증상을 50 ppm의 96시간째에 괴사된 간세포에서 낭종과 유사한 구조로 관찰되었다. 어류 간세포의 지방 침전에 의한 세포질 공포는 화학약품 노출에 따른 일반적인 반응(Marty et al., 2003; Wolfe and Wolfe, 2005)으로 200 ppm 포르말린에 노출된 무지개송어에서도 같은 현상이 나타났으며(Williams and Wootten, 1981),
본 연구에서는 100 ppm 이상 농도에서 주로 관찰되었다. 이러한 간세포의 공포화는 단백질 합성을 억제하며, 에너지 고갈, 미세소관의 분해와 연관이 있는 것으로 알려져 있다(Hinton and Lauren, 1990).
따라서 포르말린에 대한 감성돔 치어의 폐사율, LC50 및 조직학적 결과를 제시하였으며, 이는 외부 기생충 구제시 적정 포르말린 농도 및 시간을 설정하는데 효과적으로 활용할 수 있을 것으로 보인다. 그러나 앞으로는 어종의 크기, 외부환경(수온, DO 염분 등) 등의 , 염분 등) 등의 요인을 고려함과 동시에 포르말린에 대한 어체의 스트레스 및 면역반응, 삼투압조절 및 호흡 등 다양한 생리적 반응을 조사해 볼 필요가 있다.