A protease inhibitor was fractionated from fish eggs using methods based on protein solubility. Fractionation efficiency was evaluated with regard to percent recovery and total inhibitory activity (U). The fractionation of protease inhibitor (PI) from egg extracts of skipjack tuna (ST,
Protease inhibitor는 수산 및 축산 식품의 품질에 바람직하지 못한 영향을 주는 단백질 분해 효소의 촉매작용을 저해할 수 있는 단백질이나 peptides 등을 말한다. 이와 같은 protease inhibitor는 일반적으로 강장동물, 인간의 혈청, 동물, 식물, 박테리아에 널리 분포하고 있고, 의약품, 농업, 생물공학 분야에 있어 아주 중요한 물질이며, 생물체내에서 혈액응고, complement activation, 세포 이동, 호르몬 운반, 종양 억제, pro-hormone 전환, fibrynolysis, 감염성 반응 등과 관련된 아주 다양한 반응을 조절(Potempa et al. 1994; Birk, 1994; Richardson, 1990; Weder, 1985; Rawlings, 2004)하는 등으로 인해 생리적으로도 중요한 역할을 하는 물질로 알려져 있다.
이렇듯이 생체 내 다양한 반응을 조절하며, 생물체내 존재하는 protease inhibitor는 작용하는 단백질분해효소의 특이성에 따라 serine protease inhibitor와 cysteine protease inhibitor로 분류하기도 한다. Serine protease inhibitor는 모든 다세포 생물내에 널리 분포하고, 대사과정 중에 단백질 분해 효소가 관여하는 많은 생물학적 대사과정 즉, metamorphosis에 있어서 중요한 역할(Eguchi, 1993)을 하며, 주된 방어 시스템 내에는 혈액응고, pro-phenoloxidase cascade나 세포질 활성화, 다양한 병원체의 선택적 분해 등을 조절하는 결정적인 역할을 한다(Laskowski and Kato, 1980). 이와 같은 작용 능력을 가진 serine protease inhibitor는 Kazal, Kunitz, serpin 및 a-macroglobulin으로 분류된다(Kanost, 1999; Polanowski and Wilusz, 1996).
가장 잘 알려진 serine protease inhibitor로는 trypsin inhibitor이며, 동물 췌장(Kazal et al.,1948; Pubols, 1988; Zhao et al., 1996), 말미잘(Tschesche et al., 1987), 거머리(Fink et al., 1986) 등을 포함한 무척추 동물, 곤충 (Friedrich et al., 1993), 식물(Tamir et al., 1996) 등으로부터 추출, 정제 및 특성에 관한 연구가 있다. 그리고, 수산동물 유래 protease inhibitor에 관한 연구로는 연어, white croaker, Arctic charr, hake, Argentine anchovy, castaneta, rough sead, sea trout 등과 같은 어류의 혈액과 근육(Borla et al., 1998; Clereszko et al., 2000; Martone et al., 1991; Olenen et al., 2003; Sangorrin et al., 2001; Yamashita and Konagaya, 1991a), 잉어 및 연어 등과 같은 알(Oda et al., 1998; Tsai et al., 1996; Walker, 2002) 및 Atlantic salmon (Synnes, 1998; Ylonen et al., 1999), 복어외 29종 어류(Nagashima et al., 2004)의 껍질로부터 protease inhibitors를 분리 정제하여 그 특성을 검토한 바 있다. 또한, 식품산업에서 protease inhibitor를 응용한 대표적인 연구로는 수산 및 축산 식품의 선도유지, 조직감 개선 및 surimi 산업에의 응용 등을 시도한 바 있다. 이 중 surimi 산업에서 이용하는 protease inhibitor는 Pacific whiting 등과 같은 단백질 분해력이 아주 강한 내인성 효소를 함유하고 있는 어종으로 제조한 surimi에 응용되어 내인성 효소에 의한 연제품의 제조 중 자연응고시 겔 연화현상을 방지하여, 연제품의 겔 강도를 개선시켜 주는 역할을(An et al., 1996)함으로써 연제품 산업에서 없어서는 안 될 아주 중요한 식품 첨가물 중의 하나이다.
한편, 이상에서 언급한 연구에서 protease inhibitor 및 enzyme과 같은 단백질 성분의 분획이나 정제를 위해서는 단백질의 용해도 차이를 이용한 방법으로 acetone과 같은 유기용매 또는 염류로서 ammonium sulfate를 일반적으로 사용하고 있으며, 최근에는 생리적으로 중요한 단백질을 얻기 위한 방안으로 직접적이고 효율적인 방법을 개발하고자 하는 노력을 하고 있다.
어류의 가공 중에는 두부, fish frame, 내장, 껍질 및 알 등과 같은 다양한 부산물이 발생하며, 특히 알의 경우, 명태, 대구, 청어, 날치 및 철갑상어 알 등을 제외한 대부분의 어류 알은 폐기되고 있는 실정이다. 앞서의 연구(Ji et al., 2011)를 통해 8종의 어류알 모두에서 protease inhibitor의 분포가 확인되었으며, 이러한 일면에서 어류 알로부터 protease inhibitor를 추출 및 분획을 통하여 버려지는 폐자원의 up-circling 통한 고부가가치 창출과 식품산업에 기여가 가능할 것으로 판단된다.
본 연구에서는 protease inhibitor의 분포가 확인된 어류 알 중에서 가다랑어
실험에 사용한 3 종류의 어류 알 중 가다랑어(ST, Skipjack tuna
>
Target proteases, 기질 및 buffer
어류 알로부터 분획한 protease inhibitor의 저해활성을 살펴보기 위한 target protease는 serine protease인 trypsin, cysteine protease인 papain은 Sigma-Aldrich사 (St. Louis, MO, USA) 제품을, 시판 상용효소인 Alcalase 2.4 LFG, Flavourzyme 500 MG, Neutrase 0.8 L및 Protamex 1.5 MG는 Novozymes(Bagsvaerd, Denmark) 제품을 구입하여 사용하였다. 이들 단백질분해효소의 활성을 측정하기 위해 사용한 기질은 천연기질의 경우 casein을, 합성기질의 경우 Nα-benzoyl-L-arginine-pnitroanilide(BAPNA)을 Sigma-Aldrich사(St. Louis, MO, USA) 제품을, 기타 시약은 분석급으로 구입하여 사용하였다.
효소활성 측정을 위해 사용한 0.1 M sodium phosphate buffer(pH 6.0) 및 0.1 M Tris-HCl buffer (pH 9.0)는 Dawson et al.(1986)의 방법에 따라 조제하였다.
어류 알 crude extract 및 분획물의 단백질 농도는 Lowry et al.(1951)의 비색법에 따라 bovine serum albumin을 표준 단백질로 하여 구한 검량곡선으로부터 측정하였다.
어류 알 crude extract (CE)은 냉동상태의 시료를 부분해동 및 마쇄 한 다음, 마쇄한 어류 알 (100 g)에 대하여 3배(w/v)의 탈이온수를 각각 가하고, 혼합한 후, 1시간 간격으로 교반 (20℃, 6 시간)하여 추출하였다. 여기에 지방의 제거를 위하여 추출물에 대해 0.2배량 (v/v)의 사염화탄소(CCl4)를 가하고 혼합한 다음, 원심분리(12,000g, 20 min) 하여 얻어진 상층액을 CE로 하였다.
>
Target proteases 및 시판 상용효소의 활성
Serine protease trypsin 및 시판상용효소에 대한 활성은 BAPNA 및 casein 기질에 대해 저자들이 기 확립한 방법(Ji et al., 2011)에 따라 측정하였다. 즉, 일정량(30 μL)의 0.1% trypsin 용액에 0.6 mM BAPNA기질이 용해되어 있는 0.1 M Tris-HCl buffer (pH 9.0) 3 mL를 혼합 및 반응(40℃, 1 h) 시킨 다음, 반응액에 0.3 mL의 33% acetic acid를 가하여 실활 시킨 후 410nm에서 흡광도(U-2900, UV-VIS spectrophotometer, Hitachi, Tokyo, Japan)를 측정하였으며, casein 기질에 대하여는 50 μL의 0.1% trypsin 용액과 0.3% casein이 용해되어 있는 0.1 M Tris-HCl buffer (pH 7.0) 2 mL를 혼합 및 반응(40℃, 1 h) 시키고, 이어서 buffer와 동량(2 mL)의 5% trichloroacetic acid(TCA)용액을 가하여 실활 시킨 후 정치(30 min), 원심분리(146g, 20 min)한 다음, 280 nm에서 흡광도를 측정하였다.
Cysteine protease papain 및 시판 상용효소에 대한 활성은 100 μL의 0.1% papain 및 1% 시판 상용효소 용액에 0.3% casein이 용해되어 있는 0.1 M Tris-HCl buffer (pH 7.0) 2 mL를 혼합 및 반응(40℃, 1 h)시키고, 이어서 실활, 원심분리(146g, 20 min) 및 흡광도(280 nm)를 측정하였다.
이들 trypsin, papain 및 상용 proteases의 활성(U/mg)은 1분 동안 1 mg의 효소 (단백질)가 변화시키는 흡광도 0.1 digit을 1 U/mg으로 나타내었다.
Target protease (0.1% trypsin 및 papain을 각각 30 및 100 μL 씩)와 4 종의 시판 상용효소(1% Alcalase, Flavourzyme, Neutrase 및 Protamex를 각각 100 μL에 대하여)에 어류 알로부터 추출한 100 μL의 CE를 각각 가하여 전 단계 반응(40℃, 30 min)을 실시한 후, 여기에 기질의 최종농도가 일정하게 되도록 첨가(BAPNA 기질의 경우 0.6 mM 및 casein 기질의 경우 0.3%)하여, 효소 최적활성 측정조건(pH 9.0, 40℃, 1 h)에서 반응시켜 앞서 서술한 효소활성 측정 방법에 따라 흡광도를 측정하였다. 어류 알 CE의 target protease에 대한 상대 저해활성(relative inhibitory activity, RIA)은 이상에서 측정한 target protease의 어류 알 crude extracts 무첨가 대조구 활성(C) 및 첨가 활성(A)을 이용하여 다음과 같은 방법으로 산출하였다.
RIA (%) = 〔(C-A) / C〕 × 100
또한 어류 알 CE의 target protease에 대한 저해활성 (specific inhibitory activity, SIA)은 1 mg protease inhibitor가 1분 동안 1 U/mg 효소활성 (specific enzyme activity, U/mg)을 감소시키는 것으로 나타내었다.
>
어류 알 CE로부터 protease inhibitor의 acetone에 의한 분획
가다랑어(ST), 황다랑어(YT) 및 명태(AP) 알 CE로부터 protease inhibitor의 분획은 단백질 용해성(solubility) 이용한 acetone 및 ammonium sulfate 분획법에 의하여 실시하였다. 각 분획방법 별 fraction의 저해활성은 target protease인 trypsin에 대해 BAPNA 및 casein 기질을 사용하여 측정함으로써 그 효과를 검정하였다.
유기용매에 의한 어류 알 CE의 분획은 CE에 cold acetone (-20℃)을 첨가하여 최종농도가 0-20, 20-40, 40-60 및 60-80%(v/v)가 되도록 하여 순차적으로 4개의 fraction으로 분획하였다. 이어서 분획한 fraction을 원심분리(12,000g, 20 min) 한 다음 그 잔사에 대하여 최소량의 탈 이온수로 용해 및 투석하여 fraction별 특성을 조사하기 위한 시료로 사용하였다.
>
어류 알 CE로부터 protease inhibitor의 ammonium sulfate에 의한 분획
염류에 의한 어류 알 CE의 분획은 CE에 대하여 ammonium sulfate를 첨가(ammonium sulfate의 농도를 20%씩 증가시키면서 포화농도가 될 때까지 첨가)하여 순차적으로 4개의 fraction으로 분획하였다. 이어서 포화농도 별로 분획한 ammonium sulfate fractions (AS 0-20, 20-40, 40-60 및 60-80% 포화농도 fraction)들을 원심분리(12,000g, 20 min) 한 다음 그 잔사에 대하여 최소량의 탈 이온수로 용해 및 투석하여 fraction별 특성을 조사하기 위한 시료로 사용하였다.
어류 알 추출물 및 분획방법에 따른 분획효과의 검정을 위하여 native- polyacrylamide gel electrophoresis (PAGE) 시료는 각 분획시료 0.4 mL에 0.1 mL의 sample buffer (62.5 mM Tris-HCl, pH 6.8)를 혼합하여 전기영동용 시료로 사용하였다. Hedrick and Smith (1968)의 방법에 따라, 10% Mini-PROTEANⓇTGXTM Precast gel (Bio-Rad Lab., Inc., USA)을 Mni-PROTEAN Tetra cell (Bio-Rad Lab., Inc., USA)에 장착한 한 다음, 일정량 (5-10 μL)의 시료를 주입하고, gel (10 well) 당 10 mA의 전류로 전기영동을 실시하였다. 전기영동이 완료된 gel은 coomassie brilliant blue R-250 용액으로 염색한 후, acetic acid, methanol 및 탈이온수 (1:2:7, v/v/v) 혼합용액으로 탈색하였다.
>
어류 알 AS fractions과 trypsin간의 preincubation time이 저해활성에 미치는 영향
3종의 어류 알 ammonium sulfate fractions (CE, AS 0-40% 및 40-80% 포화획분)과 trypsin간의 preincubation time (15-120 min)에 따른 BAPNA 및 casein 기질에 대한 저해활성에 미치는 영향에 대하여 전술한 저해활성 측정조건에 따라 측정하였다.
>
Trypsin에 대한 Acetone fractions의 저해활성
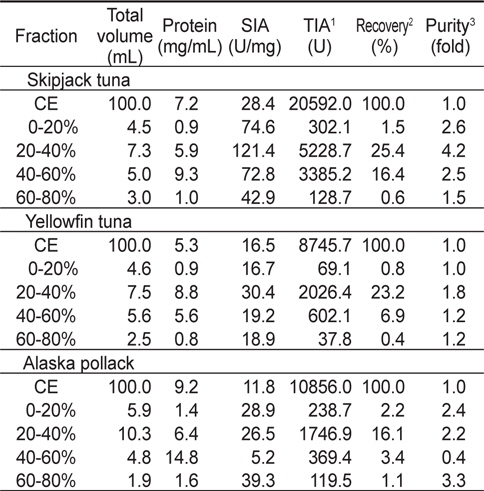
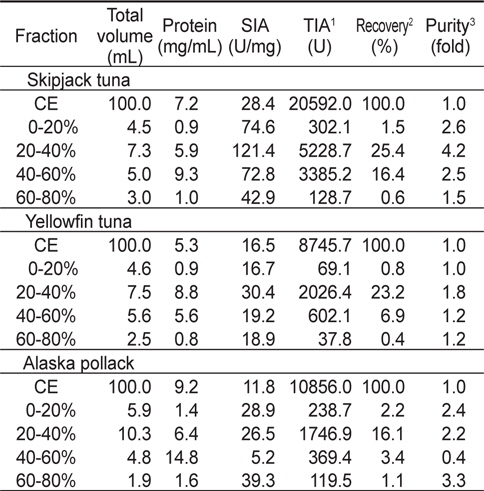
3종의 어류 알 유래 CE (100 mL)로부터 acetone으로 처리하여 분획한 4종의 fraction들의 BAPNA에 대한 저해 활성과 회수율을 측정한 결과는 Table 1과 같다. 가다랑어(ST
Trypsin inhibitory activities of fractions obtained from the crude extracts of fish eggs by the acetone fractionation toward BAPNA as a substrate
이상의 결과로 미루어 보아 어류 알 CE로부터 acetone으로 분획한 각 fraction의 BAPNA에 대한 TIA, SIA, 회수율 및 purity는 fraction 간에는 3종 어류 알이 모두 20-40% fraction이, 어종간의 비교에서는 가다랑어 알 유래 crude extract로 분획한 것이 가장 우수한 것으로 나타났다.
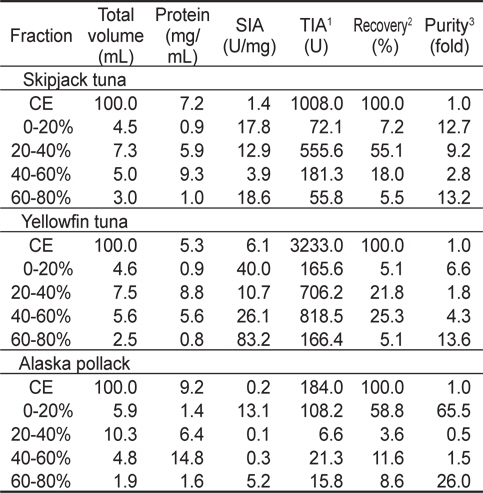
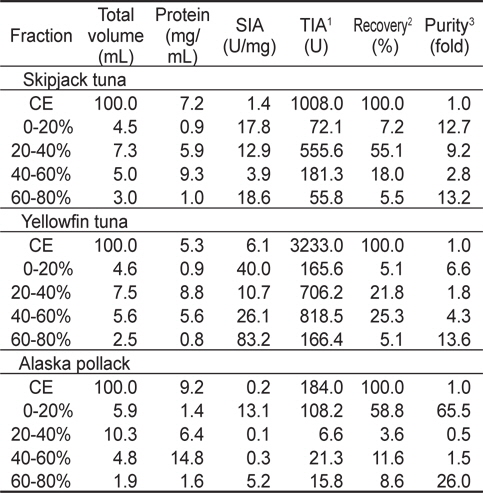
한편, 3종의 어류 알 유래 CE (100 mL)를 acetone으로 처리하여 분획한 4종의 fraction 들의 casein에 대한 저해 활성(SIA)과 회수율을 측정한 결과는 Table 2와 같다. 가다랑어 알 acetone fraction의 casein에 대한 SIA와 purity는 60-80% fraction이 각각 18.6 U/mg 및 13.2배로 가장 높았고, 다음으로 0-20% fraction(각각 17.8 U/mg 및 12.7배), 20-40% fraction (각각 12.9 U/mg 및 9.2배)의 순이었으며, 40-60% fraction이 각각 3.9 U/mg 및 2.8배로 가장 낮았다. Acetone fraction의 총 회수율은 85.8%로 CE에 대하여 약 14.2%가 감소하였고, 20-40% fraction이 55.1%로서 가장 높은 수준이었으며, 각 fraction의 TIA는 20-40% fraction이 555.6 U로 가장 높았고, 다음으로 40-60% fraction (181.3 U)이었다. 황다랑어 알 acetone fraction의 casein에 대한 SIA와 purity는 60-80% fraction이 각각 83.2 U/mg 및 13.6배로 가장 높은 반면, 20-40% fraction이 각각 10.7 U/mg 및 1.8배로 가장 낮았다. 황다랑어 알 acetone fraction의 총 회수율은 57.3%로 crude extract에 대하여 42.7%가 감소하였고, 40-60% fraction이 25.3%로 총 회수율의 44.2%를 차지하였으며, 이 fraction의 TIA는 818.5 U로 가장 높은 것으로 나타났다. 명태 알 acetone fraction의 casein에 대한 SIA와 purity는 0-20% fraction이 각각 13.1 U/mg 및 65.5배로 가장 높았고, 다음으로 60-80% fraction (각각 5.2 U/mg 및 26.0배)의 순이었다. 명태 알 acetone fraction의 총 회수율은 82.6%로 crude extract에 대하여 약 17.4%정도 감소하였으며, 0-20% fraction이 총 회수율의 71.2%를 차지하였고, 이 fraction의 TIA가 108.2 U로 가장 높은 것으로 나타났다.
Trypsin inhibitory activities of fractions obtained from the crude extracts of fish eggs by the acetone fractionation toward casein as a substrate
이상의 결과로, target protease인 trypsin에 대한 BAPNA 및 casein 기질에 대한 저해활성으로 살펴 본, 어류 알 acetone fraction의 SIA 및 purity 그리고 TIA 및 회수율을 고려한 protease inhibitor의 최적 분획농도는 3종의 어류 모두 20-40% 이었다.
일반적으로, acetone 분획은 어류 알 crude extracts로부터 1회 처리 할 수 있는 양이 비교적 많은 점, 유기용매를 사용함으로 쉽게 목적하는 분획의 최종농도를 맞출 수 있는 점, 탈수 및 탈지가 동시에 이루어지기 때문에 각 fraction의 분말화가 용이한 점, 투석과정이 필요 없다는 점 등과 같은 장점이 있어 분획방법으로서 많이 채택되고 있다. 그러나, acetone 분획법은 용해도 차이에 의한 분획방법이므로 환경 온도에 따라 분획효과가 달라지는 점, 고농도 처리 시 시료량 보다 사용되는 acetone의 양이 많아 질 수 있는 점, 분획 후 폐 acetone이 발생한다는 점, acetone에 의한 단백질의 변성을 야기 시킬 수 있다는 점 등과 같은 단점도 있다(Heu and Ahn, 1999 Kim et al., 2008a; Kim et al., 2008b). 따라서, acetone 분획방법은 폐 acetone의 발생을 최소화하는 유기용매 회수 장치를 이용하고, 저온의 일정한 조건에서 단백질의 변성을 최소화하여 실행한다면, 효과적으로 protease inhibitor를 분획하는데 이용 가능하리라 생각된다.
>
Ammonium sulfate fraction의 저해활성 비교
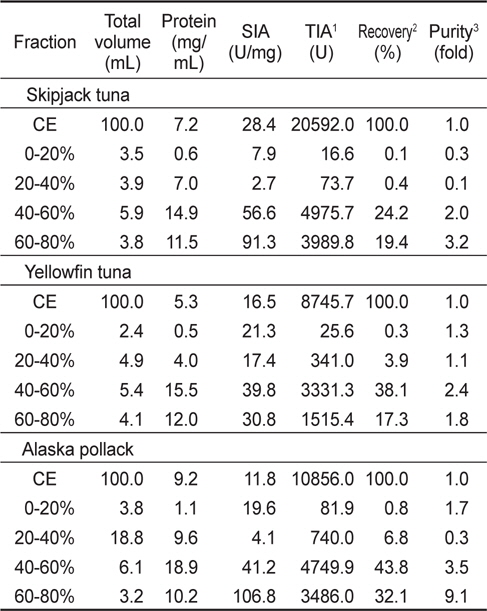
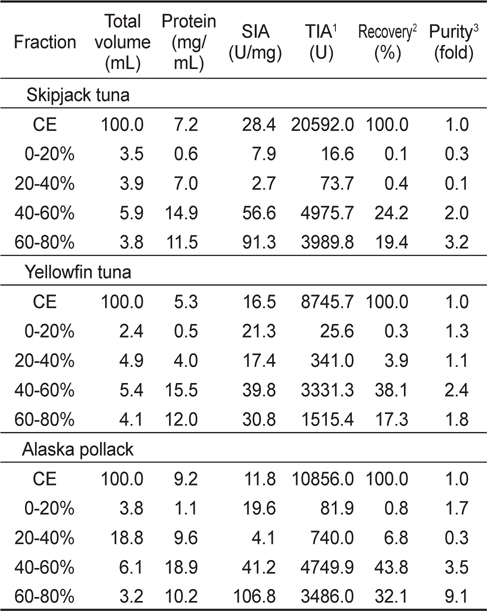
3종의 어류 알 CE (100 mL)로부터 ammonium sulfate (AS)로 처리하여 분획한 4종(AS 0-20%, 20-40%, 40-60% 및 60-80% 포화농도)의 fraction들의 BAPNA에 대한 저해 활성과 회수율을 측정한 결과는 Table 3과 같다. 가다랑어 알 AS fractions의 BAPNA에 대한 SIA와 purity는 60-80% 포화 fraction이 각각 91.3 U/mg 및 3.2배로 가장 높았고, 다음으로 40-60% 포화 fraction (각각 56.6 U/mg 및 2.0배)의 순이었다. 이들 AS fraction들의 총 회수율은 44.1 %로서 CE에 비하여 55.9%가 감소하였고, AS 40-60% 포화 fraction이 24.2%로서 전체의 54.9 %로 가장 높았다. 이들 AS fraction들의 TIA는 40-60% fraction이 4,975.7 U로 가장 높았고, 다음으로 60-80% fraction(3,989.8 U)이었다. 황다랑어 알 AS fraction의 BAPNA에 대한 SIA와 purity는 AS 40-60% fraction이 각각 39.8 U/mg 및 2.4로 가장 높은 반면, AS 20-40% fraction이 각각 17.4 U/mg 및 1.1배로 가장 낮았다. 황다랑어 알 AS fraction들의 총 회수율은 59.6%로 CE에 대하여 약 40.4%의 감소를 보였으며, AS 40-60% fraction (38.1%)이 총 회수율의 63.9%를 차지하여 가장 높았을 뿐만이 아니라 TIA 역시 회수율과 마찬가지로 3331.3 U로 가장 높았다. 명태 알 AS fraction들의 BAPNA에 대한 SIA와 purity는 AS 60-80% fraction이 각각 106.8 U/mg 및 9.1배로 가장 높았고, 다음으로 AS 40-60% fraction (각각 41.2 U/mg 및 3.5배)의 순이었다. 이때의 AS fraction의 총 회수율은 83.5%로 CE에 대하여 16.5%가 감소하였고, AS 40-60% fraction (43.8 %)이 전체의 52.4%를 차지하여 가장 높았으며, TIA 또한 회수율과 같이 AS 40-60 % fraction이 4,749.9 U로 가장 높았다.
Trypsin inhibitory activities of fractions obtained from the crude extracts of fish eggs by the ammonium sulfate fractionation toward BAPNA as a substrate
어류 알 CE로부터 ammonium sulfate로 분획한 fraction들의 BAPNA 기질에 대한 SIA 및 purity는 3종 어류 알이 모두 AS 60-80% fraction이, 그리고, 어종간 AS 60-80% fraction 중에는 명태가 가장 우수하였고, TIA 및 회수율은 3종의 어류 알이 모두 AS 40-60% fraction이, 그리고, AS 40-60% fraction 간에는 가다랑어가 가장 우수하였다.
Nagashima et al. (2004)과 Choi et al. (2002)은 각각 복어(Takifugu pardalis) 껍질 및 가다랑어 알로부터 protease inhibitor를 분획하는 연구를 시도한 결과 trypsin (BAPNA 기질)에 대한 저해활성이 각각 AS 60-80 % fraction 및 50-80% fraction에서 각각 나타났다고 보고하여, 본 연구결과와 유사한 경향을 나타내었다. 또한, Ee et al. (2008)은 Australian wattle Acacia victoriae 종자의 trypsin inhibitor 및 chymotrypsin inhibitor에 관한 연구에서 AS 25-50% fraction에서 AS 0-25% 및 50-75% fraction보다 약 1.4-3.5배 강한 저해활성을 나타내었다고 보고한 바 있다.
이와 같은 사실로 미루어 보아 다랑어류 알로부터 ammonium sulfate를 이용하여 protease inhibitor를 추출한 다음 정제공정을 거쳐 고가의 실험용으로 이용할 목적인 경우에는 가다랑어알 crude extract 유래 60-80% fraction을 이용하는 것이 적절하며, 부분 정제하여 정제품보다 저가의 식품 첨가물의 형태로 이용할 목적인 경우에는 가다랑어 알 crude extract 유래 AS 40-60% fraction을 이용하는 것이 적절하리라 판단되었다.
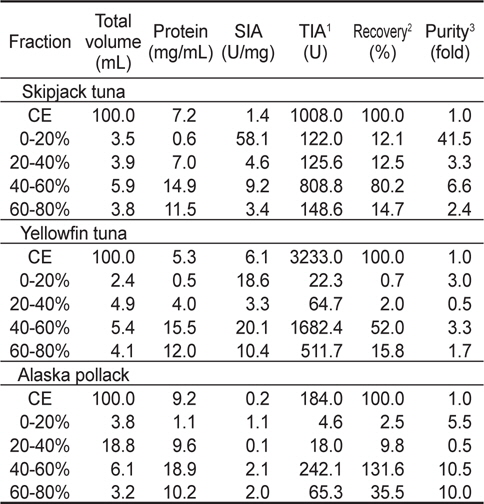
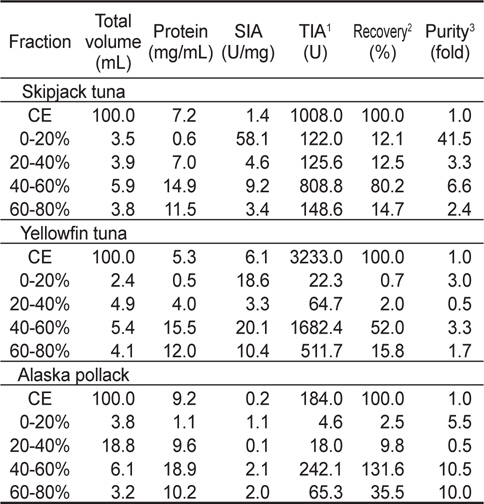
Table 4에는 3종의 어류 알 CE (100 mL)로부터 AS로 처리하여 분획한 4종의 fraction들의 casein에 대한 저해 활성과 회수율을 측정한 결과를 나타내었다. 가다랑어 알 AS fraction들의 casein에 대한 SIA와 purity는 AS 0-20% fraction이 각각 58.1 U/mg 및 41.5배로 가장 높았고, 다음으로 AS 40-60% fraction이 각각 9.2 U/mg 및 6.6배의 순이었으며, 기타 fraction이 각각 3.4-4.6 U/mg 범위 및 2.4-3.3배 범위로 AS 0-20% 및 40-60 % fraction에 비하여 낮았다. 이들 AS fraction들의 casein에 대한 총 회수율은 119.5%로 오히려 증가하였고, AS 40-60% fraction이 80.2%로서 총 회수율의 67.1%로 가장 높았으며, TIA는 회수율이 가장 높은 AS 40-60 % fraction이 808.8 U로 가장 높았고, 다음으로 AS 60-80 % fraction (148.6 U)의 순이었다. 황다랑어 알 AS fraction들의 casein에 대한 SIA와 purity는 AS 40-60% fraction이 각각 20.1 U/mg 및 3.3배로 가장 높았고, 나머지 fraction의 경우 각각 3.3-18.6 U/mg 범위 및 0.5-3.0배 범위로 낮았다. 이들 AS fraction의 총 회수율은 70.5%로 CE에 대하여 29.5% 감소하였고, AS 40-60% fraction이 52.0%로 총 회수율의 74.1%를 차지하여 가장 높았으며, 이 fraction의 TIA가 1682.4 U로 가장 높은 것으로 나타났다. 또한 명태알 AS fraction들의 casein에 대한 SIA와 purity는 AS 40-60% fraction이 각각 2.1 U/mg 및 10.5배로 가장 높았고, 다음으로 AS 60-80% fraction (각각 2.0 U/mg 및 10.0배)의 순이었다. 이들 AS fraction들의 총 회수율은 179.4%로 오히려 증가하였고, 40-60%이 131.6%로 총 회수율의 73.4%를 차지하여 가장 높았으며, 이 fraction의 TIA가 242.1 U로 가장 높았다.
Trypsin inhibitory activities of fractions obtained from the crude extracts of fish eggs by the ammonium sulfate fractionation toward casein as a substrate
이상의 결과로 미루어 보아 어류 알 crude extracts로부터 AS로 분획한 fraction의 casein에 대한 SIA 및 purity는 가다랑어의 경우 AS 0-20 % fraction이 가장 높았으나, TIU 및 회수율은 다랑어 알의 종류에 관계없이 AS 40-60 % fraction이 가장 높았다. 이와 같은 사실로 미루어 보아 다랑어류 알로부터 ammonium sulfate를 이용하여 protease inhibitor를 추출한 다음, 부분 정제하여 식품산업용 첨가물로 이용할 목적인 경우에는 황다랑어 알 crude extract 유래 AS 40-60% fraction을 이용하는 것이 적절하리라 판단되었다.
Ammonium sulfate 분획방법은 crude extract로부터 1회에 대량처리가 가능한 점, 상온(20 ℃)에서 처리가 가능한 점, 단백질의 변성 가능성이 적은 점, 비교적 분획효과가 뚜렷한 점 등과 같은 장점이 있어 분획방법으로서 많이 채택되고 있다. 그러나 ammonium sulfate 분획방법은 용해도 차이에 의한 분획방법이므로 주변 온도의 영향을 받아 분획효과에 차이를 보이는 점, 고형상의 ammonium sulfate를 사용함으로써 목적하는 포화농도로의 평형화에 시간이 다소 걸리는 점, ammonium sulfate 입자주위에 과포화가 일어날 수 있는 점, 용해 과정 중에 과도한 교반으로 단백질 변성이 야기될 수 있는 점, 염을 사용함으로써 각 fraction에 염이 함께 존재함으로써 탈염조작이 필요한 점, 분획 후 ammonium sulfate 용액이 부산물로 발생하는 점 등과 같은 단점이 있다(Heu and Ahn, 1999; Kim et al., 2008a; Kim et a;., 2008b). 따라서, ammonium sulfate에 의한 분획방법을 실제로 적용하고자 하는 경우 대량처리를 위한 분획에 이용 가능하거나, 이로 인한 폐 염류용액 처리 및 회수방법 그리고, 탈염을 위한 방안을 마련하여야 할 것으로 판단된다. 이상의 결과와 고찰을 통하여 3종의 어류 알 CE로부터 protease inhibitors의 산업적응용을 위한 방법으로는 단백질의 용해성을 이용한 acetone 및 ammonium sulfate 분획법 중에 본 연구자들은 보다 효율적인 방법으로 대용량으로 처리 가능한 AS 분획법이라고 판단하였다.
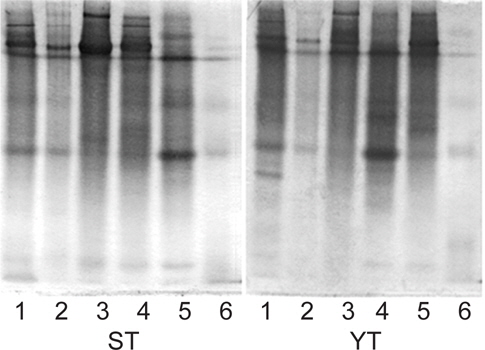
어류 알 추출물 및 AS fractions의 native-PAGE 전기영동 결과는 Fig 1과 같다. 먼저 가다랑어의 CE (lane 1)에는 gel 상단에 cationic protein band와 중간에 부분에 protein band가 확인되었으며, AS 0-60% 포화농도(lane 2-4)에 이르기 까지 gel 상단의 cationic protein band가 존재하는 반면, 60-80% 포화농도 fraction (lane 5)에서는 gel 중간부분의 protein band가 상대적으로 두드러졌다. 황다랑어의 경우도 가다랑어와 유사한 경향이었으나, AS 40-60 % fraction (lane 4)에서 gel 중간부분의 protein band가 상대적으로 두드러진 것으로 나타난 것이 가다랑어( lane 5)와 차이가 있었다. 단백질 용해도 차이에 의한 분획효과는 전기영동 결과에서도 나타났듯이 각 포화농도 별 protein band의 분포가 각기 다르게 나타남으로써 그 분획효과가 인지 되었으며, AS fraction의 저해활성 비교(Table 3과 4)에서도 AS 40-60 % 및 60-80% fraction들이 trypsin 저해활성이 강한 것으로 확인 됨에 따라 이후의 실험에서는 저농도 fraction(AS 0-40 % fraction)과 고농도 fraction (AS 40-80% fraction)으로 나누어 target protease trypsin 및 papain, 4종의 시판상용 효소와 BAPNA 및 casein 기질을 대상으로 저해활성에 대해 비교 검토하였다.
>
Ammonium sulfate fractions의 target proteases 및 상용효소에 대한 저해활성
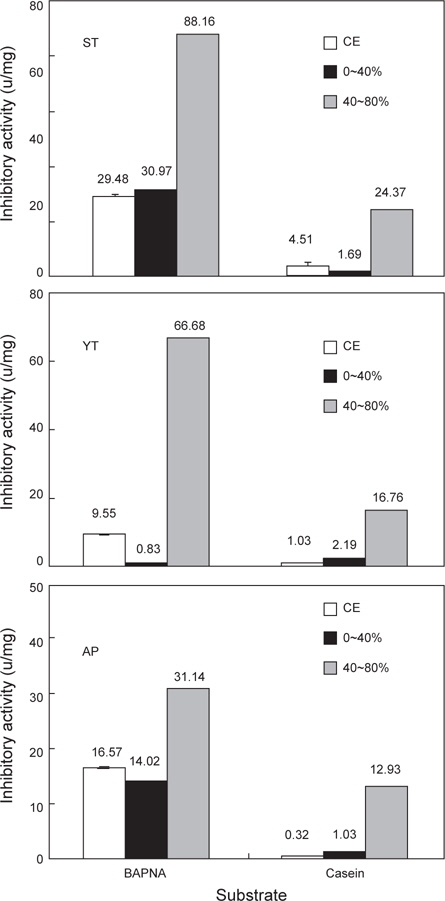
3종의 어류 알로부터 ammonium sulfate을 사용하여 저농도 fraction (AS 0-40 % fraction)과 고농도 fraction (AS 40-80% fraction)으로 분획하여, target protease trypsin의 BAPNA 및 casein 기질에 대한 저해활성의 결과는 Fig. 2와 같다.
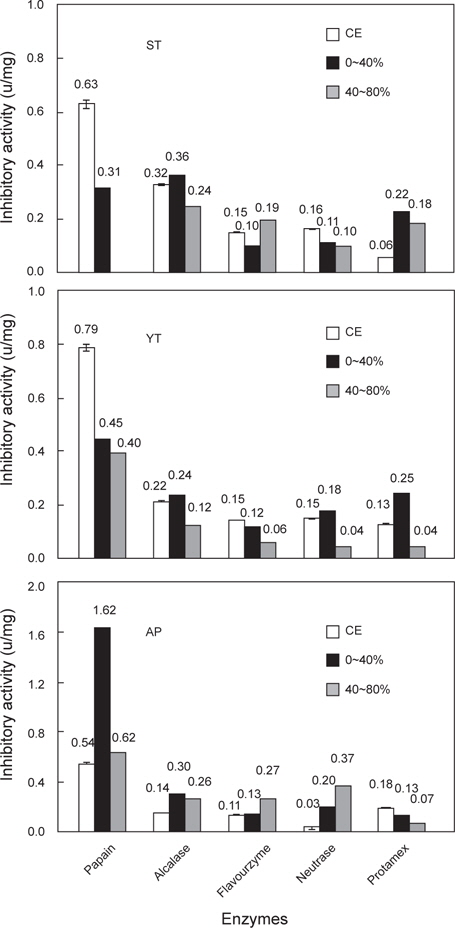
먼저, 가다랑어알 fraction의 trypsin (BAPNA 기질)에 대한 저해활성은 AS 0-40% fraction이 30.9 U/mg으로 CE의 29.5 U/mg에 비하여 차이가 인정되지 않은 반면에, AS 40-80 % fraction의 경우 88.2 U/mg으로 약 3배 증가하였다. Casein에 대한 저해활성은 AS 40-80% fraction이 24.4 U/mg으로 CE (4.2 U/mg)에 비하여 5.8배가 증가하였다. 또한, 황다랑어 알 fraction의 trypsin (BAPNA 기질)에 대한 저해활성은 AS 0-40 % fraction이 0.8 U/mg으로 CE의 9.6 U/mg에 비하여 현저히 감소한 반면, AS 40-80 % fraction의 경우 66.7 U/mg으로 약 7배가 증가하였다. 아울러 casein에 대한 저해활성은 AS 40-80% fraction이 16.8 U/mg으로 CE (1.0 U/mg)에 비하여 16.8배가 증가하였다. 명태 알 fraction의 경우, BAPNA 기질에 대한 저해활성은 AS 40-80% fraction이 31.1 U/mg로서 CE (16.6 U/mg)에 비하여 약 1.9배가 증가하였으며, casein에 대한 저해활성은 40-80 % fraction이 13.0 U/mg으로 CE (0.3 U/mg)에 비하여 약 40.1배가 증가하였다. 이상의 결과로 본 실험에서 사용한 3종의 어류 알로부터 추출 및 분획한 AS 40-80% fraction의 경우 trypsin inhibitor의 분획 효과가 인정되었다. Target protease papain 및 시판 상용효소(Alcalase, Flavourzyme, Neutrase 및 Protamex)의 casein 기질에 대한 AS fraction의 저해활성 분포를 검토한 결과는 Fig. 3에 나타내었다. 가다랑어 알 fraction들의 papain 및 시판 상용효소에 대한 저해활성은 protamex를 제외한 papain 및 3종의 시판 상용효소의 경우 fraction의 종류에 관계없이 큰 차이가 없거나 감소하는 경향을 보여 분획에 따른 차이가 인지되지 않았고, 단지 protamex의 경우 AS 0-40 %(0.22 U/mg) 및 40-80% (0.18 U/mg) fraction에서 CE에 대해 분획효과를 나타내었다. 그리고, 황다랑어 알의 경우에서도 가다랑어와 유사한 결과를 보였다. 명태 알 fraction의 저해활성은 Protamex를 제외한 papain 및 3종의 시판 상용효소에서 분획 효과가 인지(papain, Alcalase 및 Neutrase에 대하여는 모든 fraction들, Flavourzyme에 대하여는 AS 40-80% fraction)되었다. 그러나, 어류 알 CE의 종류에 관계없이 AS fraction들의 papain 및 4종의 시판 상용효소에 대한 저해활성은 0.06-1.62 U/mg 범위로, trypsin에 대한 저해활성(1.7-24.4 U/mg)에 비해 현저히 낮은 수준이었다. 한편, Ustadi et al. (2005)은 명란으로부터 ammonium sulfate의 AS 20-40% fraction이 papain 및 azocasein에 대한 저해활성을 보인다고 하였으며, CE에 대하여 회수율과 정제도가 각각 22.7%와 3.9배라고 보고한 바 있다. 이상의 결과로 미루어 보아 3종의 어류 알 AS fraction의 proteases inhibitor의 분포는 target protease인 trypsin에 대하여 주된 저해활성을 나타내었고(Ji et al. 2011), 다음으로 papain에 대한 저해활성 분포를 보인 반면, 4종의 시판효소에 대한 저해활성 분포는 미미하였을 뿐만 아니라 분획에 따른 효과도 인정되지 않았다.
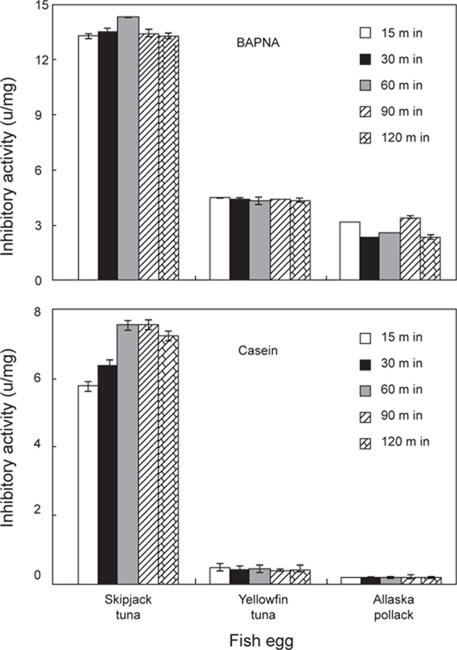
3종의 어류 알 CE로부터 저해활성에 따른 분획효과 있었던 AS 40-80% fraction을 대상으로 하여, 전 단계 반응시간(15-120 min)에 따른 target protease trypsin의 BAPNA 및 casein기질에 대한 저해활성의 결과는 Fig. 4와 같다. 전 단계 반응시간(15-120 min)에 따른 AS fraction들의 trypsin (BAPNA 기질 및 casein 기질)에 대한 저해활성은 3종의 어류 알 모두 전단계 반응시간에 관계없이 차이를 보이지 않았으며, 어종 간의 저해활성은 가다랑어, 황다랑어 및 명태 알의 순이었다. 그러나, trypsin에 대한 저해활성 강도는 어류 알의 종류에 관계없이 trypsin의 특이적 기질인 BAPNA가 casein 기질보다 강한 것으로 나타났다. 따라서, target protease와 AS 40-80% fraction과의 전 단계 반응 시간은 30분이 적절한 것으로 판단되었다.
이상의 결과로부터 어류 알의 crude extracts에서 protease inhibitor의 단백질 용해도 차이에 따른 효율적인 분획방법은 ammonium sulfate를 이용한 방법이었으며, 총 저해활성(TIA, U) 및 회수율을 고려한 최적의 fraction은 3종의 어종 모두 AS 40-80% fraction이었다. 어류 가공 중에 발생하는 가공부산물로서 어류 알은 일부 사료로 일부 이용이 될 뿐, 대부분 폐기되는 미 이용자원 자원으로부터 유용성분인 protease inhibitor의 용해도 차이에 의한 효과적인 분획 방안의 기초자료를 제시하였다. 또한 이들 최적 획분의 target protease인 trypsin에 대한 저해활성이 강한 것으로 나타나 serine protease inhibitor가 다량 분포하고 있음이 확인되었고, 본 실험조건에서 효소와 저해제 간의 상호반응도 30분 이내에 일어나는 것을 확인 할 수 있었다. 앞으로의 연구에서는 batch 또는 preparative chromatography법을 이용한 분획 방안에 대해서도 검토가 이루어져야 할 것으로 사료된다.