This study investigated the effects of water temperature, photoperiod and population density on oxygen consumption (OC) in the longtooth grouper (Epinephelus bruneus). OC rate in the longtooth grouper at 15, 20, and 25°C were 85.9±6.9, 107.5±10.1, and 164.0±19.2 mg O2 kg–1 h–1, respectively, indicating a linear increase in OC with water temperature. Photoperiod was regulated in accordance with the light (09:00-21:00 h, L) and dark (21:00-09:00 h, D) phases of the diel cycle (12L/12D), with a water temperature of 15, 20, or 25°C. OC rates during the light and dark phases were 83.8±5.4, 88.1±7.8 mg O2 kg–1 h–1, respectively, at 15°C and 111.2±12.3 and 103.7±5.7 mg O2 kg–1 h–1 at 20°C. No significant differences were observed between the light and dark phases (
전 세계적으로 자원고갈 및 이상기온 등으로 농작물의 피해가 심각해지고 있는 실정이며, 이로 인해 세계 각 국가에서는 자국의 안정적 식량 확보를 위해 많은 노력과 투자를 아끼지 않고 있다. 이에 따라 양식산업은 인간의 건강과 식품생산을 위한 중요한 수단으로 자리매김 하고 있으며, 세계 각국은 자국의 이익과 식품확보를 위해 양식생산량 확충을 위한 연구와 기술개발에 막대한 투자와 노력을 아끼지 않고 있는 실정이다. 특히 기존의 양식 대상종을 대체할 새로운 종 확보에 많은 노력을 하고 있는데, 한국의 양식관련 산업체, 학교 및 연구기관 등에서도 새로운 양식 대상종을 찾기 위하여 많은 노력을 하고 있다. 새로운 양식 대상종으로는 황복(
새로운 어종의 양식을 위해서는 양식 대상종의 생리, 생태 및 습성을 파악하는 것이 무엇보다 중요하다. 예를 들어, 대상어종이 주행성인지 야행성인지에 따라 사육실의 조도 및 사료공급 시간이 달라지며, 어종의 대사활성에 따라 사육밀도 및 산소 공급량이 결정된다. 따라서 새로운 양식 대상종의 안전하고 효과적인 양식을 위해서는 양식 대상종의 대사량을 파악하는 것이 무엇보다 중요하며, 이러한 대사량 측정은 어류의 산소소비량을 측정함으로써 직∙간접적으로 추정할 수 있다(Byun et al., 2008). 양식 어류의 산소소비는 수온(Requena et al., 1997; Byun et al., 2008), 염분(Forsberg, 1994; Lim et al., 2004; Jeong et al., 2009), 광주기(Jo and Kim, 1999; Chang et al., 2005), 어체 크기(Yager and Summerfelt, 1993; Burleson et al., 2001; Jeong et al., 2007), 사료 공급량(Forsberg, 1997; De la Gádara et al., 2002) 및 스트레스 정도(Barton and Schreck, 1987; Lund and Tufts, 2003) 등 여러 가지 요인에 의해 달라지는 것으로 알려져 있다. 특히 용존산소는 양식어류의 생산량을 결정하는 데 매우 중요한 요인 중 하나이며, 수용밀도(Kawamoto, 1977), 활어수송(Wi and Chang, 1976; Ko et al., 1995) 및 사료 요구량(Buentello et al., 2000)을 결정하는 중요한 기준으로도 작용한다.
자바리(
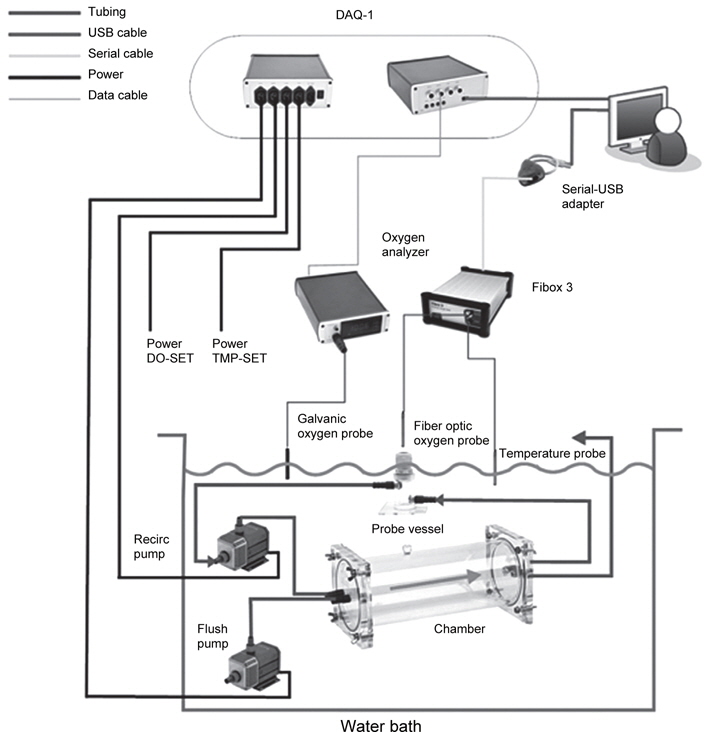
실험어는 국립수산과학원 미래양식연구센터에서 실내수조에서 사육중인 자바리를 사용하였으며, 수온 및 광조건에 따른 산소소비 실험은 평균 체중 1,170±43.8 g의 실험어를, 밀도에 따른 산소소비 실험은 평균 체중 55.8±6.5 g의 실험어를 사용하여 chamber에 각각 10, 15, 20 및 25개체씩 넣어 사육 밀도가 각각 55.4, 88.4, 118.8 및 145.1 g/L이 되도록 하였다. 실험어는 실험개시 전 24시간 동안 절식시킨 후, FRP수조(0.8 m×1.8 m×0.6 m)에 설치된 산소소비 측정장치(Fig. 1)내의 아크릴 chamber (9.3 L)에 옮겨 수온 15, 20 및 25℃에서 명기(09:00-21:00 h; L)와 암기(21:00-09:00 h; D)로 나누어 진 광조건(12L:12D)의 조건에서 산소소비를 측정하였다. 수온은 전기 히터(0.2 kw)를 이용하여 수온을 15℃부터 25℃까지 5℃씩 수온을 점차적으로 올렸으며, 광조건은 명기에는 형광등을 사용하여 조도를 500 lx로 유지하고, 암기에는 차광막을 설치하여 빛을 완전히 차단하였다. 그리고 실험어의 호흡수는 각각의 실험 수온에서 실험어의 분당 아가미 개폐 횟수를 10회 측정 후, 평균값으로 하였다. 밀도에 따른 산소소비 실험은 수온 20℃, 조도 500 lx의 명기(09:00-21:00 h) 조건에서 12시간 연속 측정하였다.
Fig. 1의 산소소비 측정장치의 구성을 보면 recirculation pump를 통해 chamber에 있는 물이 용존산소센서(Fiber optic oxygen probe)에 흐르게 하여 용존산소량을 측정하였다. 또한 PC 조정을 통해 flush pump가 작동하면 chamber와 수조의 물을 교환하며, 용존산소량을 측정하는 동안은 꺼져서 closed respirometry와 같은 기능을 하였다. 그리고 수조내에 용존산소량은 oxygen analyzer에 연결된 galvanic oxygen probe를 통하여 용존산소량을 측정하며, oxygen analyzer와 산소탱크를 solenoid valve를 이용하여 수조 내에 일정한 산소가 유지되도록 하였다.
용존산소량 측정은 Fiber-optic oxygen meter 3 (Loliogo systems, software version 5.32, Denmark)을 사용하였으며, 수조내 용존산소량은 90% 이상이 유지되도록 설정하였다. 산소소비량 계산을 위해 수온 및 광조건에 따른 산소소비 실험에서는 실험어의 중량, 부피 이외에 체고, 체폭 및 표면적 입력하였으며, 밀도에 따른 산소소비 실험에서는 실험어의 중량, 부피를 입력하였다. 실험 방법은 flush period은 300초, wait period은 60초, measure period은 240초로 설정하여 10분 간격으로 하여 단위체중당 산소소비량(mg O2 kg-1 h-1)을 자동 측정하여 1시간 간격으로 평균값을 나타냈다.
모든 측정값은 평균±표준편차로 나타냈으며, 유의차는 SPSS-통계패키지(version 10.0)를 이용하여 t-test와 one-way ANOVA-test를 실시한 후 Duncan's multiple range test를 이용하여 검정하였다(
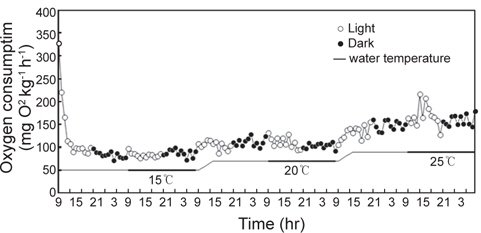
광조건 12L:12D를 설정하여 수온 15℃부터 1일 간격으로 5℃씩 상승하여 20℃와 25℃까지 연속적으로 측정한 실험어의 산소소비 리듬은 Fig. 2에서 보는 바와 같다.
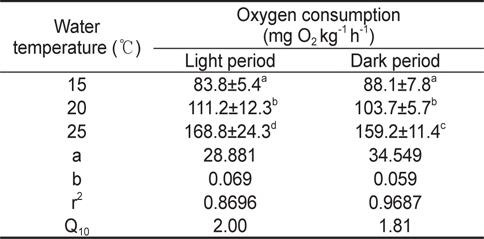
수온 및 광조건에 따른 실험어의 산소소비는 수온 15℃와 20℃에서는 명기와 암기 모두 일정한 산소소비 리듬을 보인 반면, 25℃에서는 암기에 비해 명기에 산소소비가 높고 일정하지 않은 리듬을 보였다. 또한 수온 15, 20 및 25℃ 모두 암기에서 명기로 바뀐 1시간 뒤에 산소소비가 높게 나타났다. 각각의 수온에서 실험어의 일일 평균 산소소비량은 15℃에서 85.9±6.9 mg O2 kg-1 h-1, 20℃에서 107.5±10.1 mg O2 kg-1 h-1, 25℃에서 164.0±19.2 mg O2 kg-1 h-1로 수온상승과 비례하여 산소소비량도 증가하는 경향을 보였다(
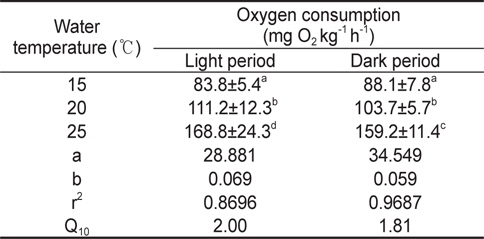
수온 15, 20 및 25℃에서 광조건에 따른 산소소비량은 Table 1에서 보는 바와 같다. 수온 15℃의 명기와 암기 조건에서 산소소비량은 각각 83.8±5.4, 88.1±7.8 mg O2 kg-1 h-1, 20℃에서 각각 111.2±12.3, 103.7±5.7 mg O2 kg-1 h-1로 명기와 암기 사이의 유의한 차이는 없었다(
Mean oxygen consumption in longtooth grouper Epinephelus bruneus under water temperature conditions of 15, 20 and 25℃ during light and dark phases
명기와 암기에서 실험어의 산소소비 증가 기울기(b) 값은 각각 0.069, 0.059로 암기보다 명기에 수온상승에 따른 산소소비증가량이 많았으며, 수온이 10℃ 상승했을 때 명기에 Q10값이 2.00으로 암기조건의 1.81 보다 높은 값을 보였다.
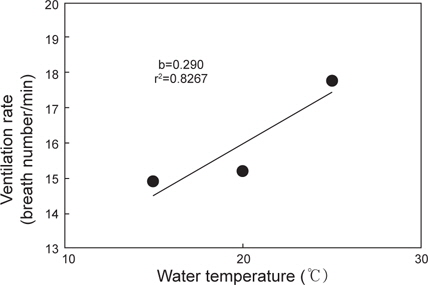
수온 15, 20 및 25℃에서 명기에 실험어의 분당 호흡수는 Fig. 3과 같다. 실험어의 호흡수는 각각의 수온에서 14.9±0.86, 15.2±1.03 및 17.8±0.92회로 수온상승과 비례하여 증가하였고(
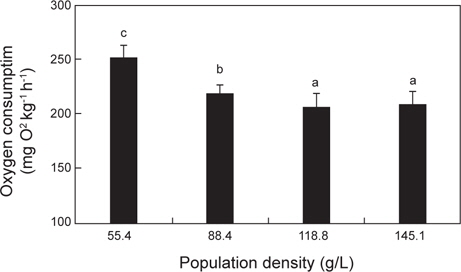
수온 20℃의 명기에서 실험어의 밀도에 따른 산소소비량은 Fig. 4에 나타내었다. 밀도 55.4, 88.4 및 118.8 g/L에서 실험어의 산소소비량은 각각 252.0±11.6, 219.0±8.7 및 206.7±11.4 mg O2 kg-1 h-1로 밀도가 증가할수록 산소소비량은 유의하게 감소하였지만(
수중에서 서식하는 어류는 수온, 염분, 광주기 등 환경변화에 매우 민감하게 반응하며, 이는 스트레스로 작용하여 생리활성을 변화시키는 것으로 알려져 있다. 또한 양식에 있어서 수중에 녹아있는 용존산소의 양은 양식동물의 생존과 밀접한 관계가 있다(Claireaux and Lagardère, 1999; Chatelier et al., 2005; Byun et al., 2008). Spencer (1939)와 Spoor (1946)는 담수어류의 활성과 산소소비 관계를 주간활동형, 야간활동형, 불규칙 활동형의 3가지 형태로 구분한 바가 있으며, 많은 연구자들은 어류의 산소소비에 결정적인 영향을 주는 요인으로 수온을 대표적인 예로 들었다(Xie and Sum, 1990; Cai and Summerfelt, 1992; Chang et al., 2005). Byun et al. (2008)은 냉수성 어류인 강도다리를 대상으로 수온에 따른 산소소비를 측정한 결과, 수온상승과 비례하여 증가하였으며, 암기에는 산소소비가 많고 명기에는 산소소비가 적은 야간활동형 어류임을 밝힌 바 있다. 또한 Jeong et al. (2009)은 강도다리의 광조건에 따른 산소소비 실험에서 수온 15, 20℃에서는 명기에 산소소비가 적고 암기에 산소소비가 많은 뚜렷한 산소소비 리듬을 보였으나, 수온이 25℃로 상승하자 명암기의 산소소비 리듬이 사라지는 경향을 보였다고 보고하였다. 본 연구에서 자바리는 수온이 15℃에서 25℃까지 단계적으로 5℃씩 상승하는 동안 산소소비량은 수온상승과 비례하여 증가하였으며, 수온이 15℃에서 25℃로 10℃ 상승했을 때 산소소비량은 각각 85.9±6.9, 164.0±19.2 mg O2 kg-1 h-1로 1.9배 증가하여 Q10 법칙에 부합되는 결과를 보였다. 또한 수온 15, 20℃에서는 광조건에 따른 산소소비량은 유의한 차이를 보이지 않았으나, 25℃에서는 명기에 산소소비가 많고, 암기에 산소소비가 적은 결과를 보였다. Horning and Pearson(1973)은 어체가 수온변화에 적응할 때 중요한 요인은 광주기와 적응온도로서, 고수온에 적응된 어류는 저수온에 약하고, 저수온에 적응된 어류는 고수온에 약하다고 보고하였다. 본 연구에서 자바리는 수온 15℃에서 산소소비량이 적고, 명암기의 산소소비량 차이가 없었다. 이에 반해, 수온 25℃에서는 산소소비량이 많고, 명암기의 산소소비량이 확연한 차이를 보였다. 따라서 자바리는 고수온에 적응된 어종이며, 수온 25℃ 이상에서 정상적인 대사활동을 하는 아열대 및 열대성 주간활동형 어종으로 판단된다.
Iwama et al. (1997)은 어류의 호흡수가 산소소비량에 유의한 영향을 미치는 것이 아니라고 하였으며, Dalla Valle et al.(2003)은 어류의 호흡수와 산소소비는 상호관계에 있어 아가미덮개의 개폐횟수와 폭의 통합적 압력 차이를 측정하면 단일 횟수에 따른 보다 정확한 산소소비량 예측이 가능하다고 하였다. 본 연구에서 자바리의 분당 호흡수는 수온 15, 20 및 25℃에서 각각 14.9±0.9, 15.2±1.0 및 17.8±0.9회로 호흡수는 수온상승과 비례하여 증가하였다. 그러나 수온 20℃를 기준으로 타 어종과 비교 했을 때, 냉수성 어류인 강도다리의 호흡수와 산소소비량은 각각 41회, 72.4±10.8 mg O2 kg-1 h-1(Byun et al., 2008), 온수성 어류인 감성돔(Acanthopagrus schlegeli)은 각각 100회 이상, 223.0±23.1 mg O2 kg-1 h-1(Jeong et al., 2007)로 자바리의 호흡수(15.2회)가 상대적으로 매우 적었다. 그러나 20℃에서 자바리의 산소소비량은 111.2±12.3 mg O2 kg-1 h-1로 호흡당 산소소비량은 가장 높은 결과를 보였다. 따라서 자바리는 다른 어종과 비교 했을 때, 한 호흡시 다량의 물을 흡입하여 그 속에서 녹아있는 산소를 최대한 흡수하는 것으로 추정된다. 그러나 이러한 결과는 아직 단정 짓기는 어려우며, 보다 다양한 조건에서 자바리의 호흡에 관한 연구를 진행해야 할 것으로 판단된다.
Chang et al. (2005)은 감성돔의 수용밀도와 수온별 호흡당 산소소비량을 비교한 결과, 밀도 14.5 g/L, 수온 20℃에서 가장 많은 호흡당 산소소비를 보였으며, 이는 밀도 14.5 g/L에서 감성돔이 가장 깊은 호흡을 한다는 것을 의미한다고 하였다. 따라서 감성돔의 인위적 사육이나 양식생산을 할 때의 적정 수용밀도는 14.5 kg/m3인 것으로 보이며, 20℃가 감성돔의 대사활성이 가장 높은 수온인 것으로 보고하였다. 본 연구에서 자바리의 호흡측정실 내 수용밀도에 따른 산소소비량을 측정한 결과, 밀도가 가장 낮은 55.4 g/L에서 산소소비량이 가장 높았다. 또한 수용밀도가 일정수준으로 높아지자 산소소비량은 유의한 차이를 보이지 않았다. 이는 호흡측정실 내에 수용할 수 있는 밀도가 한계에 이르러 산소소비량이 더 이상 증가하지 못하고 일정수준으로 유지되는 것으로 추정된다. 또한 본 연구의 최저 수용밀도 55.4 g/L에서 최고 수용밀도 145.1 g/L까지 자바리의 산소소비량은 지속적으로 감소하였기 때문에 최적으로 수용밀도가 55.4 g/L라고 하기가 어려울 것으로 판단된다. 따라서 자바리의 대사활성이 가장 높은 최적의 수용밀도를 찾기 위해서는 좀 더 다양한 밀도에서 산소소비 측정실험을 실시하여야 할 것으로 판단된다.