There have been many studies on biofilter process regarding satisfactory water quality and the operational conditions of Recirculating Aquaculture Systems (RAS). For effective nitrification processes, it is necessary to dynamically identify and apply nitrifying microorganisms. Physical, chemical and biological processes concerning biofilms can be applied and influential factors including substrate, dissolved oxygen concentrations, organic matter, temperature, pH, alkalinity, salinity and mixing velocity intensity need to be considered. Also, designing and managing the process based on the dynamic interpretation of these factors are prerequisites for engineering applications of the biofilter process. This paper draws on current literature on the kinetics of nitrification of biofilms in the biofilter process. Influential factors for nitrification are crucial during the biofilter process and are expected to be critical in informing the design and operation of recirculating aquaculture systems.
지금까지 양식장 RAS (recirculating aquaculture system) 에서는 생물학적 질산화(nitrification)에 의한 암모니아(NH3, NH4+) 제거, 물리적 여과 및 침전에 의한 입자성 고형물 제거등이 양식 수처리에 적용되었고(van Rijn, 1996), 질산화에 의한 질산염과 용존 유기물의 축적으로 인해 시스템 부피의 약 5-10% 정도의 외부 순환수를 추가하여 운영되어 왔다(Masser et al., 1999).
일반적으로 수산양식 사육수내 존재하는 암모니아는 NH3 및 NH4+ 형태로서 두 가지 모두 어류 독성으로 작용하며, 양식수내 한계 NH3 농도는 0.0125 mg/L (Colt and Armstrong, 1981; Meade, 1985)로 알려져 있고, Losordo and Westers (1994)는 RAS내 NH3의 설계 농도는 0.025 mg/L 보고하고 있다. 수중의 NH3와 NH4의 비율은 온도, pH 및 염도에 영향을 받는데 (Trussell, 1972), 낮은 pH 및 수온에서는 NH4 농도가 증가하며, NH3농도는 감소한다(Huguenin and Colt, 1989). 따라서 TAN (total ammonium nitrogen)보다 암모니아성 질소(NH4+-N)가 RAS 수질관리의 설계 및 운영에 주요인자로 작용한다 (Losordo and Westers, 1994).
RAS에서 암모니아성 질소를 제거하기 위한 생물학적 질산화과정은 유기질소가 암모니아성 질소(NH4 +-N)로 전환되는 암모니아화(ammonification), 암모니아성 질소가 질산성 질소로 산화되는 질산화(nitrification) 반응이다. 질산화 반응에 관여하는 주요 미생물은
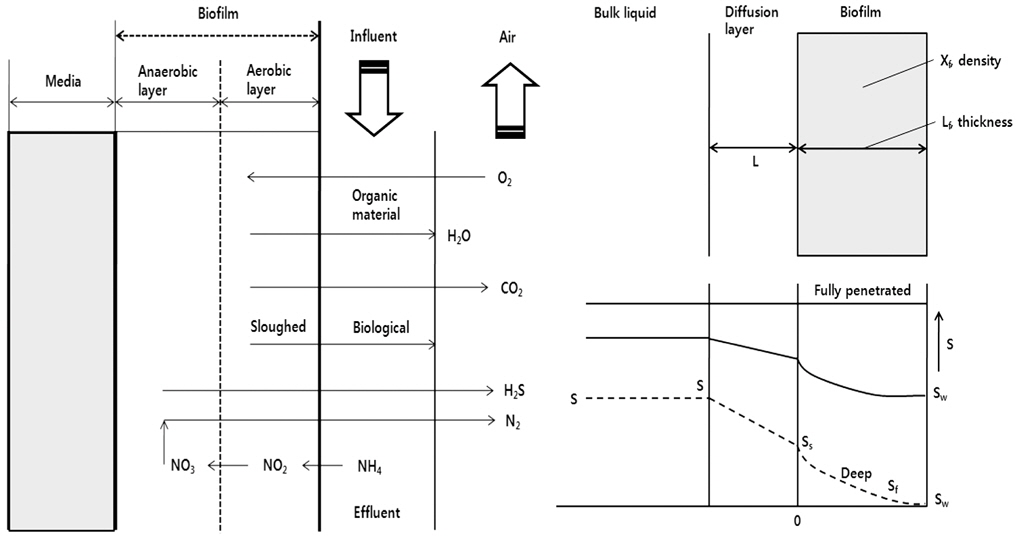
이러한 생물학적 수처리 공정에서 양호한 수준의 유출수 수질을 만족하기 위해서는 부유성장(suspended growth) 공정과 부착성장(attached growth) 공정을 이용하여 높은 미생물 농도를 유지해야 하는데, 양식수처리 공정에서는 일반적으로 부착성장 생물막(biofilter) 공정을 이용하고 있다(Fitch et al., 1998; Nogueira et al., 1998). 이는 대부분의 어종에서 유래하는 암모니아성 질소의 농도가 낮아 짧은 수리학적 체류시간에서 효과적으로 질산화를 유도하는 장점 때문인 것으로 보고되고 있다 (Chen et al., 2006). 생물막 공정은 질산화 미생물들이 소수성 (hydrophobic) 여재(media) 표면에 선택적으로 부착하는 특성이 있기 때문에 부유성장 공정보다는 생물막 공정이 질산화 미생물 축적에 유리하다고 하였다(Jung and Yun, 2003). 또한 생물막은 미생물과 고체 표면에 부착된 체외 고분자의 층형(layerlike) 응집으로 고정된 세포인 생물막은 자연 상태에서 흔히 발생하며, 살수여상(trickling filter), 회전생물접촉조(rotation biological contactors, RBC), 혐기성 여상(anaerobic filters) 등과 같이 전통적인 수처리 공정(Rittmann and McCarty, 2002과 RAS 등 양식수처리 공정(Chen et al., 2006)에서 주로 적용되고 있다.
따라서 본 연구에서는 순환양식시스템(RAS, recirculating aquaculture system)에 적용되고 있는 부착성장 미생물을 이용한 공정(AGP, attached growth process)의 운전조건 및 영향인 자를 고찰하였다.
>
생물막에서의 반응 동력학(Kinetics of biofilm)
생물막은 여재의 표면에 형성된 생물막(biofilm)과 폐수를 접촉시켜 폐수중의 오염물질을 제거하는 공정이다. 이는 원생동물, 조류, 윤충류, 세균 등의 미생물로 구성되어 있는 생물막층 (slime layer)이 하천 바닥내 존재하는 자갈, 돌 등의 표면에 형성되어 하천내 오염물질의 자정능력을 보유하게 되는데, 이 원리를 응용하여 생물막층의 정화능력을 공학적으로 고효율화하는 것이 생물접촉산화법(biological contact oxidation process)이다. 이 때 생물막이란, 매질의 표면에 형성된 미생물의 점액물질과 그 함유물로 여재(media) 매질 표면에 부착된 미생물은 호기성 조건에서 영양분인 유기물, 질소, 인 등을 섭취, 성장하여 생물막을 형성한다. 생물막이 성장을 계속하여 막이 두꺼워지면 산소가 생물막의 심층까지 도달하지 못하여 생물막내에 혐기성층이 형성되는데, 일반적으로 산소가 침투할 수 있는 생물막의 두께는 2-3 mm 정도라고 알려져 있다(Bryers and Characklis, 1982). 혐기성층에서는 미생물의 신진대사에 의해 유기산과 황화수소가 발생하며, 혐기성층이 확대되어 혐기화가 진행되면서 악취가 발생한다. 생물막 형성에 대한 메커니즘은 물리적, 화학적, 생물학적 현상들이 복합적으로 작용하는데, 먼저 생물막 형성을 위해 유체의 마찰력이 크지 않다고 가정할경우 첫째, 용존 유기물이 젖은 매질 표면에 흡착하는 단계, 둘째, 미생물 입자가 표면으로 이동하는 단계, 셋째, 미생물이 표면에 부착하는 단계, 넷째 생물막이 생성되는 단계 다섯째, 생물막이 부분적으로 탈리하는 단계로 구분된다. 이렇게 매질 표면에 형성된 생물막과 수중에 존재하는 기질간의 반응과정은 1) 기질과 산소가 액 (liquid)으로부터 액-생물막간의 경계로 확산 2) 기질과 산소가 생물막 내부로 확산 3) 생물막 내부에서 기질 소비에 따른 생화학적 반응 4) 생물막 내부로부터 대사산물이 액상으로 방출되는 단계로 구분된다. Williamson and Mc- Carty (1976)에 의해 처음으로 제안된 유체 중 기질의 제거과정을 Rittmann and McCarty (1978)는 미생물막 표면에 정체된 액막을 가상하여 미생물 막으로 이동하는 용해성 기질의 양을 Fick의 제2법칙에 따른 분자 확산에 적용하였다.
생물막 내부의 기질현상은 어떤 위치에서도 부유성장과 같은 방식이 적용된다.
(Rittmann and McCarty, 1980)
rsf : rate of substrate surface flux, g/m2·dDW: diffusion coefficient of substrate in water, m2/ddS/dx: substrate concentration gradient, g/m3·mSS: bulk liquid substrate concentration, g/ m3Sb: substrate concentration at outer layer of biofilm, g/ m3L: effective thickness of stagnant film, m
기질은 Fick의 제2법칙에 따른 분자 확산에 의해 생물막 내부로 들어오며 기질의 확산과 이용은 동시에 발생되므로 생물막의 정상상태 농도 유지를 위한 기질의 물질수지는 다음과 같다.
(Rittmann and McCarty, 1980)
rSU: rate of substrate utilization in biofilm, g/m2·dSf: substrate concentration at a point in the biofilm, g/m3
>
기질농도(substrate concentrations)
일반적으로 RAS 내에서 생물막을 이용하여 질산화를 유도하는 경우 암모니아성 질소의 농도는 중요한 설계인자로 작용한다(Wheaton et al., 1994). 이는 RAS 내 생물막에서 질산화 반응을 유도하기 위한 TAN (total ammonia nitrogen)의 최소농도와 낮은 수준의 암모니아 농도가 어류에 독성으로 작용하기 때문에 낮은 암모니아의 기질조건에서 생물막에 의한 질산화 반응이 충분히 유도되어야 한다(Chen et al., 2006).
암모니아는 수중의 pH, 온도 등에 따라 이온성과 비이온성으로 구분되는데, 비이온성 암모니아는 어류에 독성이 있는 것으로 알려져 있다(Zhu and Chen, 1999). 수생생물이 암모니아에 의해 노출되면 성장률 및 활동도 감소, 아가미 이상현상(gill abnormality)등의 현상이 나타나는 것으로 알려져 있다(Miller et al., 1990). 암모니아는 어류에 의해 배출되는 대사산물로서 사료 1 g 당 30 mg의 암모니아를 생산하는데(Miller et al., 1990), 비이온성 암모니아의 경우 무지개송어의 LC50은 0.32 mg/L이며, 메기의 LC50은 3.1 mg/L로 알려져 있다. 일반적으로 비이 온성 암모니아는 0.05-0.2 mg/L의 저농도에서도 냉수성 어류의 성장을 저해하는 것으로 보고되고 있다(Miller et al., 1990).
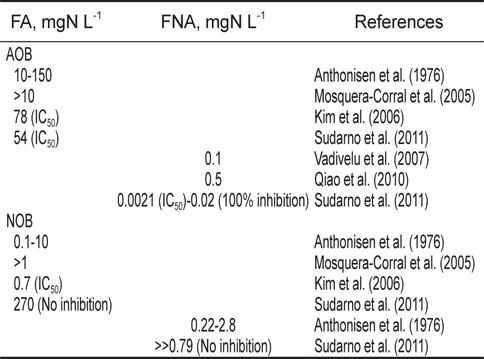
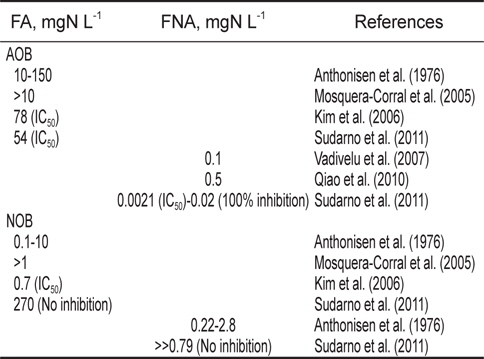
Inhibitory concentrations of FA (free ammonia) and FNA (free nitrous acid) for ammonia oxidizing bacteria (AOB) and nitrite oxidizing bacteria (NOB) (Sudarno et al., 2011)
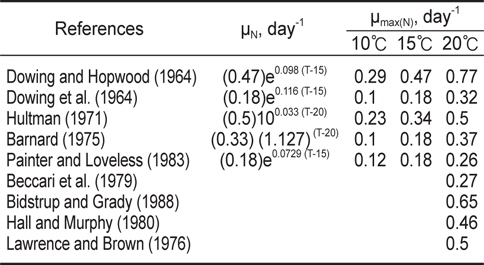
[Table 2.] The effect of temperature on nitrification maximum specific growth rate
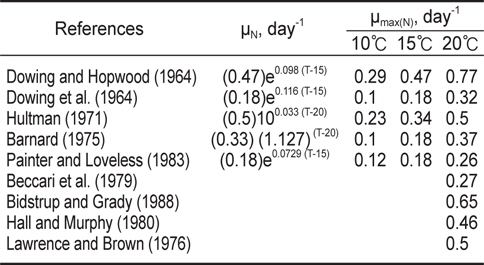
The effect of temperature on nitrification maximum specific growth rate
호기성 조건의 생물학적 반응조 내에서는 종속영양박테리아가 유기탄소원을 소모한 후, 질산화균이 질소를 산화시키기 때 문에 유입수(또는 양식사육수)내 C/N비가 낮을수록 질산화 효율을 증대시킬 수 있다(Park et al., 2010). 일반적으로 폐수처 리공정에서 유입수내 높은 암모니아성 질소 및 아질산성 질소등에 의한 기질저해가 보고되고 있으나(Sharma and Ahlert, 1977; Carrera et al., 2004), RAS의 경우 유입 기질농도(TAN)가 낮기 때문에 생물막 설계에 중요한 인자로 작용하는 것으로 보고되고 있다(Chen et al., 2006).
[Table 3.] pH effect on nitrification activity (Chen et al., 2006)
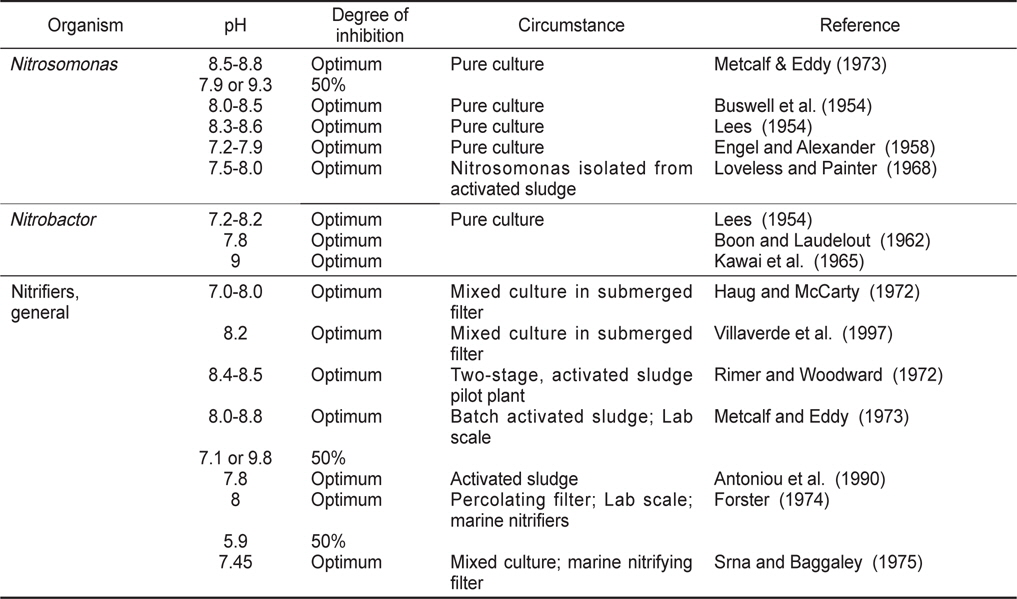
pH effect on nitrification activity (Chen et al., 2006)
또한 질산화 미생물은 질소의 형태에도 민감한 것으로 알려져 있는데, 이온화되지 않은 암모니아(Free ammonia, FA)와 이온화하지 않은 아질산염(Free nitrous acid, FNA)은 질산화 미생 물에 영향을 미치는 것으로 알려져 있다(Table 1). Anthonisen et al. (1976)는 유입 암모니아 농도가 높으면 FA (free ammonia, NH3) 및 FNA (free nitrous acid, HNO2)에 의해 AOB와 NOB가 영향을 받는다고 하였는데, AOB 및 NOB에 저해를 주는 FA농도는 각각 10-150 mg/L, 0.1-1.0 mg/L 범위이다. Mosquera- Corral et al. (2005)은 낮은 염분, 수온 35℃, 완전혼합반응조(CSTR)에서 AOB의 경우 FA 농도 10 mg/L 이하, NOB의 경우 1.0 mg/L 이하에서 저해가 나타난다고 하였다. Sudarno et al. (2011)은 FNA의 경우 0.0021 mg/L에서는 IC50이었으며, 0.02 mg/L에서 100% 저해를 주는 것으로 보고되고 있다.
>
수리학적 체류시간(HRT, hydraulic retention time)
국내 생물학적 수처리 공정에서 수리학적 체류시간이 긴 이유는 암모니아성 질소가 산화되기 위해서는 질산화 시간이 길게 소요되기 때문이다. 수리학적 체류시간을 줄이기 위해서는 질산화 미생물만을 농축, 활성도가 높은 질산화 미생물 양을 증대시켜 일반 유기물 분해 미생물의 성장을 억제하여야 한다. 이를 위해서는 질산화 반응시 유기물의 유입을 최소화하고, 여재를 이용하여 wash-out 될 수 있는 질산화 미생물을 농축해야 한다. 여재를 이용한 농축 질산화 미생물이 부착된 생물막은 부유성장 미생물보다 온도 및 독성물질의 영향이 적은 것으로 알려져있다(Weon et al., 2004). 그러나 RAS의 경우 양식 사육조내 입자성 고형물 제거를 위해 사육수 순환율을 높게 유지하기 때문에 생물막 공정내 적정 수리학적 체류시간의 유지 및 질산화 미생물의 축적이 매우 어려워 암모니아성 질소 산화를 위한 최적조건 도출에 많은 연구가 필요할 것으로 판단된다.
생물학적 질산화 반응에서 온도는 질산화 미생물의 성장률에 많은 영향을 미치며, 질산화 미생물의 최대 비성장률(μmax, maximum specific growth rate)은 온도에 크게 영향을 받은 것으로 알려져 있다. 질산화 미생물의 반응속도 역시 고온이거나 저온일 경우 반응속도가 감소하여 동력학적 반응이 제한된 범위내에서 적용되는 것이 일반적이다. Charey et al. (1979)은 질산화 반응은 15-30℃에서 Michaelis-Menten 모델에 적용되며, 암모니아성 질소 산화의 최적온도는 약 15℃라고 보고하였다. 질산화 반응은 약 4-45℃에서 잘 일어나며, 최적수온은 약 30℃라고 알려져 있다(Hitdlebaugh and Miller, 1981). USEPA (1975)는 5-30℃에서는
일반적으로 생물반응조 내에서 물리적 인자인 온도는 두 가지 경로로 미생물에 영향을 미친다. 즉, 효소가 촉매역할을 하는 미생물 세포내의 생화학 반응의 속도에 영향을 주며, 외부 기질이 미생물 세포 내로 흡수되는 기질 전달률에 영향을 준다. 대부분 미생물 반응에 있어 고온이거나 저온일 경우 반응속도가 감소하는데, 이는 미생물 세포내의 생화학 반응에 관여하는 촉매효 소가 저해를 받기 때문이다(Landelout and Van Tichelen, 1960; Boon and Landelout, 1962).
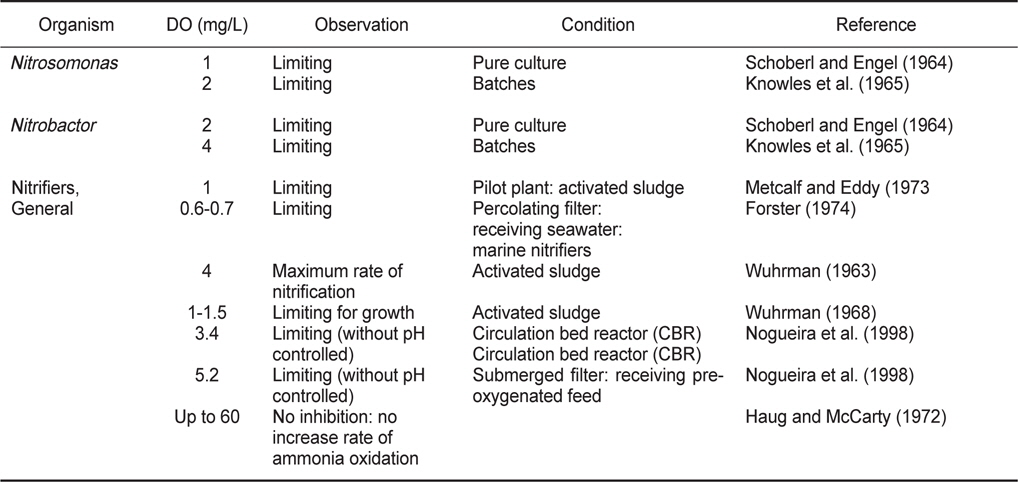
[Table 4.] Effect of DO on nitrification activity (Chen et al., 2006)
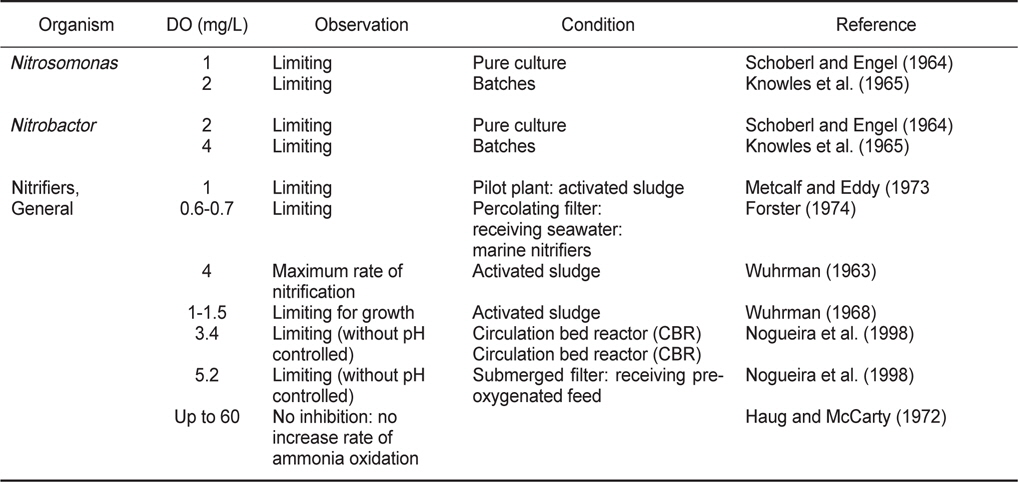
Effect of DO on nitrification activity (Chen et al., 2006)
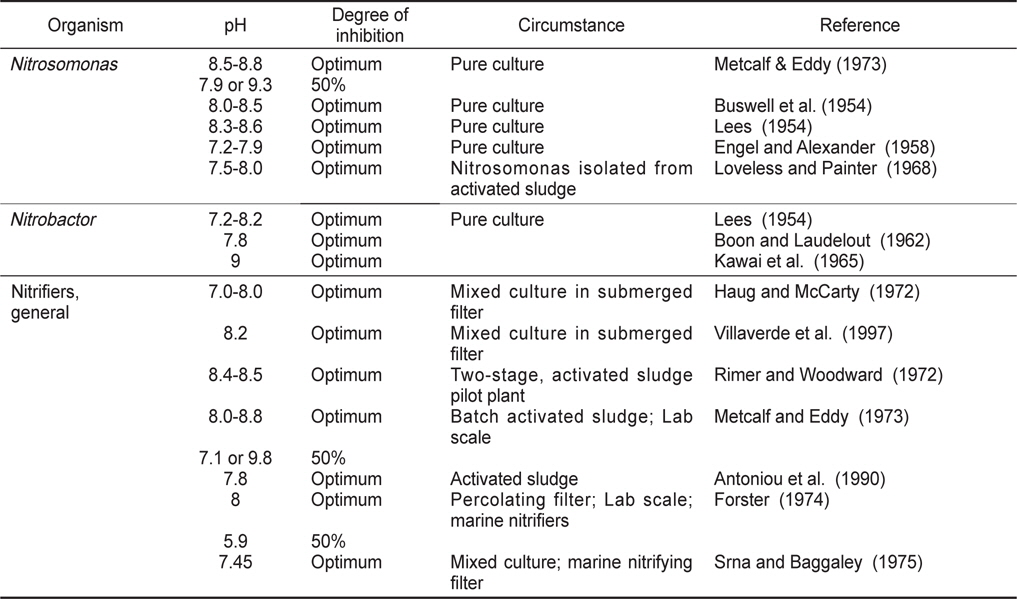
양식 사육수의 pH는 어류양식에 있어 중요한 인자로, 질산화 반응에 미치는 pH의 영향에 관해서 많은 연구가 수행된 바 있다. 일반적으로 질산화 미생물의 최적 성장 pH는 7.2-8.0으로 pH 7에서 질산화 미생물의 최대 비성장율은 pH 8보다 약 50% 감소하는 것으로 알려져 있으며, pH 5.8 이하에서는 질산화 반응이 저해를 받는 것으로 알려져 있다(Princic et al., 1998). 질산화 미생물의 초기 운전조건에서는 중성범위가 적정하며, 정상상태(steady state)에서는 낮은 pH에도 질산화 미생물은 최대 성장률을 나타내며, 미생물의 축적이 가능한 것으로 보고되고 있다(Haug and McCarty, 1972). 또한 일반적으로 질산화 반응에서 1 mg의 암모니아성 질소가 산화하는데 약 7.14 mg (as CaCO3)의 알칼리도가 소모된다. Gujer and Boller (1986)는 50 mg·CaCO3/L 이하의 농도에서는 질산화 반응이 저해된다고 보고하였다. 따라서 유입수의 암모니아성 질소의 농도가 높고 알칼리도가 낮게 존재하면 질산화 반응 후 pH가 감소하기 때문에 반응조내 추가적인 알칼리도의 투입이 요구된다.
용존산소는 질산화 미생물의 성장과 질산화 반응에 중요한 영향인자이다. 생물학적 처리공정에서 용존산소가 질산화 반응에 미치는 영향이 상이한 이유는 SRT, 플럭(floc)의 크기, 교반강도 및 용존산소 주입 방식 등의 운영조건에 따라 용존산소의 전달률에서 차이를 나타내는 것으로 판단된다(Park et al., 2010). 부착성장 및 부유성장 질산화 공정에서 유기물 부하가클 경우 질산화 미생물의 플럭 내부로 갈수록 용존산소가 고갈되기 때문에 전체적으로 질산화율이 낮아지는데, 용존산소 농도가 낮거나 미생물 floc 내부로 확산저항이 클 경우 SRT를 길게 조절하여 운전하는 것이 효과적인 것으로 보고되고 있다 (Hagopian and Riley, 1998). Table 4는 반응조의 종류 및 운전 조건에 따라 질산화 반응에 미치는 용존산소 영향을 정리하였는데, 전체적으로 용존산소 4.0 mg/L 이상에서는 질산화의 영 향은 없는 것으로 나타났다.
RAS (recirculating aquaculture system)는 양식생물 유래 암모니아의 농도가 어류 독성으로 작용하기 때문에 반응속도가 빠른 부착성장 미생물을 이용한 생물막 공정이 대부분 적용된다. 생물막 공정에서 효율적인 생물학적 질산화를 위한 반응속 도 인자는 기질의 확산과 이용의 최적 조건 도출 및 발현이 매우 중요한 요소로 작용된다. 따라서 성공적인 RAS를 구현하 기 위해서는 생물막의 동력학적 특성을 이해하고 기질농도, 온도, pH, 용존산소 등 환경인자에 대한 이해 및 연구가 요구된다.