The black seabream Acanthopagrus schlegelii is an important species for aquaculture in Korea. There are, however, no reports on the physiological responses to hypoxia in this species. The objective of this study was to evaluate the effects of acute hypoxia on the physiological stress responses (plasma cortisol as the primary response, and plasma glucose, hematocrit (Ht), hemoglobin (Hb), sodium, chloride, osmolality, AST, ALT and total protein as the secondary responses) of the fish. The experimental fish were exposed to 0.5 ppm dissolved oxygen (DO) in the seawater via two methods (progressive stepwise decline (Exp.Ⅰ), and direct decline (Exp.Ⅱ)). A highly significant increase was detected in plasma cortisol levels due to the hypoxia treatments, and fish in Exp.Ⅰ had hormone levels that were significantly higher than the fish in Exp.Ⅱ. For plasma glucose, there was no significant difference between the Exp.Ⅰ fish and the control fish, whereas Exp.Ⅱ fish showed significantly higher plasma glucose levels than Exp.Ⅰ fish and control fish. Ht values increased in both hypoxia treatments; however, Hb concentrations increased only in Exp.Ⅰ. Although plasma chloride levels were unaffected by acute hypoxia, plasma sodium and osmolality levels increased in Exp.Ⅰ. Progressive hypoxia (Exp.Ⅰ fish) increased plasma AST, ALT and total protein. These results suggest that the value and direction of changes to the investigated parameters can be used to determine the resistance of black seabream to acute hypoxia.
빈산소는 정상적인 산소보다 현저하게 낮은 산소를 포함하는 있는 경우를 말하는 것으로, 빈산소의 수괴 형성은 조류소통이 원활하지 못하고, 연안이 부영양화되어 수중에 축적된 유기물이 많은 곳에서 여름철 수온이 상승할 때 발생할 수 있다(NFRDI, 2009). 자연 환경에서는 유영생물이 이러한 빈산소 수괴로부터 도피할 수 있으나, 가두리 및 수하식 양식방법에 따른 양식생물은 빈산소 수괴에 대한 피해가 불가피하다. 또한 어류의 육상 수조식 양식시 공급수 펌핑 및 산소공급장치에 문제가 발생될 경우 급격한 저산소 현상이 나타나며, 이는 양식 어류의 뇌, 간, 근육의 에너지 대사에 장애를 유발함으로써 어류폐사에 직접적으로 영향을 미친다(van Raaij et al., 1994; Lays et al., 2009). 급격한 저산소 노출에 따른 다양한 생리학적 변화는 여러 어종에서 밝혀져 있다(Caldwell and Hinshaw, 1994; Lays et al., 2009; Sun et al., 2012). 또한 저산소는 혈중 CO2, 글루코스, hematocrit (Ht), hemoglobin (Hb)의 상승(Smit and Hattingh, 1978)과, 나아가 먹이섭식, 성장, 사료효율의 감소를 초래한다(Chabot and Dutil, 1999).
감성돔(
본 연구의 목적은 상업적으로 중요한 감성돔을 대상으로 저산소 노출에 따른 스트레스의 1·2차 반응을 내분비학적, 생화학적 및 혈액학적 측면에서 조사하고자 하였다.
본 실험에 사용된 감성돔은 경남 거제시에 소재한 가두리 양식장으로부터 300마리(평균 전장 17.0±1.7 cm, 체중 78.7±17.9g)를 구입하여 국립수산과학원(부산 기장군) 실내 사육실로 수송한 후 1톤 유수식 원형 FRP 수조에서 14일간 적응시켰다. 이 기간동안 수온은 21.2±0.8℃였으며, 염분은 34.0±0.2 psu였으며, DO는 7.8±0.4 mg/L 하루에 2회 상업용 배합사료를 공급하였고, 실험 24시간 전부터는 절식하였다. 실험 전까지 실험어의 폐사율은 5% 이하였다.
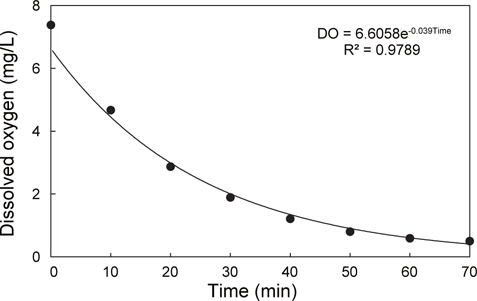
1톤 수조에 적응시킨 실험어를 3개의 500 L 원형 FRP 수조(수용적 200 L)에 15마리를 즉시 옮겨 실험을 하였으며, 모든 수조의 수온은 19.8℃, 염분은 33.8 psu였다. 각 수조의 조건 및 실험방법은 다음과 같다. 첫 번째 수조는 대조구로, DO는 7.6 mg/ L였으며, 실험어 수조 이동 10분후에 모든 개체로부터 채혈하였다(Con.) 두 번째 수조는 실험어 수조 이동 10분후에 질소가스(N2)를 수중에 주입하여 DO를 감소시켰으며, 그 변화를 수질측정기(YSI-556NPS, USA)로 모니터링하였다. N2를 실험어가 비정상적인 유영(횡와)과 자의적인 유영이 불가능해질 때까지 일정하게 주입하였으며(1.2 L/min., 70분), 이때의 DO 농도는 0.55 mg/L로, N2주입에 따라 DO는 지수함수적으로 감소하였다(Fig. 1). N2주입이 완료되었을 때 이 수조의 실험어로부터 채혈하였다(Exp.Ⅰ: 점차적인 DO 감소). 세 번째 수조는 N2를 주입하여 DO의 농도가 0.55 mg/L로 설정한 다음, 실험어를 옮겨 10분후에 채혈하였다(Exp.Ⅱ: 급격한 DO 감소).
혈액 채취전 각 수조에 tricaine methan sulphonate (MS-222, Sigma, USA)를 150 ppm의 농도가 되도록 첨가하여 실험어를 마취하였다. heparin sodium 처리된 주사기(3 mL)를 사용하여 실험어의 미부혈관으로부터 혈액을 채취하여, 일부는 Ht 및 Hb을 측정에 사용하였으며, 나머지는 원심분리(4℃, 10,000 rpm, 15분)하여 혈장을 분리하여 분석전까지 -80℃의 초저온 냉동고에 보관하였다.
Ht는 혈액을 모세유리관에 넣어 원심분리(10,000 rpm, 10분)하여 Ht 측정판(MICRO-HAEMATOCRIT READER, Hawksley Co, UK)으로, Hb은 Hb 자동생화학분석기(Fuji dry-chem 4000, Fujifilm Co., Japan)로 측정하였다. MCHt 및 Hb의 측정값을 바탕으로 평균적혈구혈색소농도(mean corpuscular Hb concentation, MCHC)를 다음과 같이 계산하였다.
·MCHC (%) = Hb (g/100 mL)/Ht (%) × 100
혈장 코티졸은 cortisol EIA kit (Oxford, USA)를 사용하여 효소면역분석(enzyme immunoassay, EIA)로 측정하였으며, 간략히 설명하자면 다음과 같다: ethyl ether를 사용하여 혈장 100 μL로부터 cortisol을 추출한 후, 유기상(organic phase)을 분리하여 이를 N2 가스로 증발시켰다. 잔여물을 100 μL의 추출 buffer에 녹인뒤, 이중 10 μL를 다시 990 μL의 추출 buffer 에 더하여 100배로 희석시켜 이를 샘플로 사용하였다. 샘플 또는 표준용액 50 μL를 microplate에 2반복으로 넣은 후, 동량의 Cor-tisol-HRP Conjugate를 첨가하여 1시간 동안 상온에서 두었다. Microplate를 세척한 후, 150 μL TMB 기질을 각 well에 넣은후 30분 동안 반응시켜, microplate reader (ThermoScientific MultiskanSpectrum, Thermo, Finlan)로 650 nm에서 값을 측정하였다. 코티졸의 분석시 Inter-assay coefficients of variation(CV) 및 Intra-assay CV는 각각 2.8% (n=66) 및 10.5% (n=8)이었다. 혈장의 글루코스 및 AST (aspartate aminotransferase), ALT (alanine aminotransferase), 총단백질, Na+, Cl-은 자동생화학분석기로, 삼투질농도는 삼투압측정기(Vapro 5520, WESCOR Co., USA)로 측정하였다.
실험결과의 자료값은 평균±표준오차로 나타내었으며, SPSS 통계프로그램(ver. 17.0)을 사용하여 one way-ANOVA 및 Duncan’s multiple range test 유의성을 검정하였다(
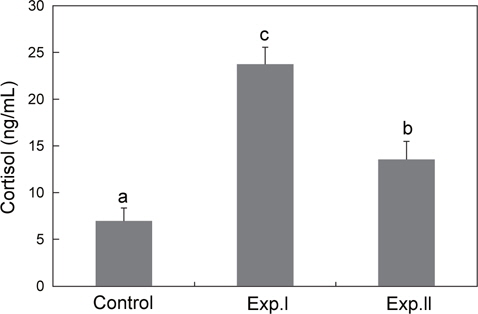
혈장의 코티졸 농도는 대조구의 경우 6.9±1.4 ng/mL였으며, 저산소 노출은 코티졸의 농도를 유의하게 상승시켰다. 특히 점차적으로 DO를 감소한 Exp.Ⅰ은 23.7±1.8 ng/mL로 단계적으로 DO를 감소한 Exp.Ⅱ의 13±1.9 ng/mL보다 높았다(Fig. 2).
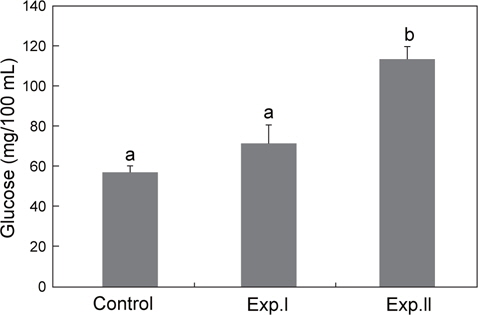
글루코스 농도는 대조구의 경우 57.2±3.2 mg/100 mL였으며, Exp.Ⅰ 및 Ⅱ는 각각 71.5 mg/100 mL, 및 113.6 mg/100 mL로 Exp.Ⅰ은 대조구와 차이를 보이지 않았으나, Exp.Ⅱ은 대조구보다 유의하게 높았다(Fig. 3).
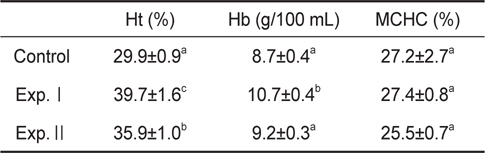
감성돔의 저산소 노출에 따른 Ht의 변화는 Table 1에 나타내었다. 대조구의 Ht는 29.9±0.9%였으나 Exp.Ⅰ및 Ⅱ는 각각 39.7±1.6% 및 35.9±1.0%로 대조구보다 유의하게 높았으며, 또한 Exp.Ⅰ은 Exp.Ⅱ보다 높았다. Exp.Ⅰ의 Hb의 농도는 10.7±0.4 g/100 mL로 대조구의 8.7±0.4 g/100 mL로 높았으나, Exp.Ⅱ는 9.2±0.3 g/100 mL로 대조구와 차이를 보이지 않았다. 모든 실험구의 MCHC는 25.5±0.7-27.4±0.8로 그룹간 통계적인 차이가 없었다.
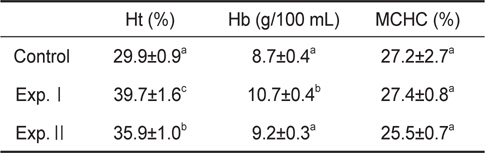
Levels of haematocrit (Ht), blood haemoglobin concentration (Hb) and mean corpuscular haemoglobin concentration (MCHC) in black seabram Acanthopagrus schlegelii in hypoxia
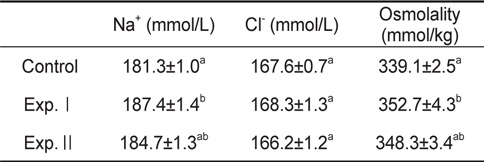
저산소 노출에 따른 Exp.Ⅰ의 Na+는 187.4±1.4 mmol/L로 대조구의 181.3±1.0 mmol/L보다 유의하게 높았으나, Exp.Ⅱ은 184.7±1.3 mmol/L로 대조구와 차이가 없었다. 모든 실험구의 Cl-은 166.2±1.2-168.3±1.3 mmol/L 범위로 그룹간 유 의한 차이가 없었다. 삼투질농도는 Exp.Ⅰ만 대조구보다 높아 혈장 Na+와 같은 경향의 변화를 보였다(Table 2).
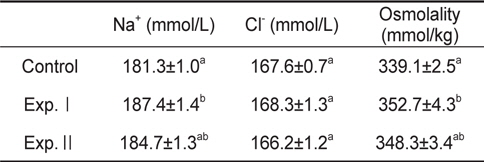
Levels of plasma Na+, Cl- and osmolality in black seabram Acanthopagrus schlegelii in hypoxia
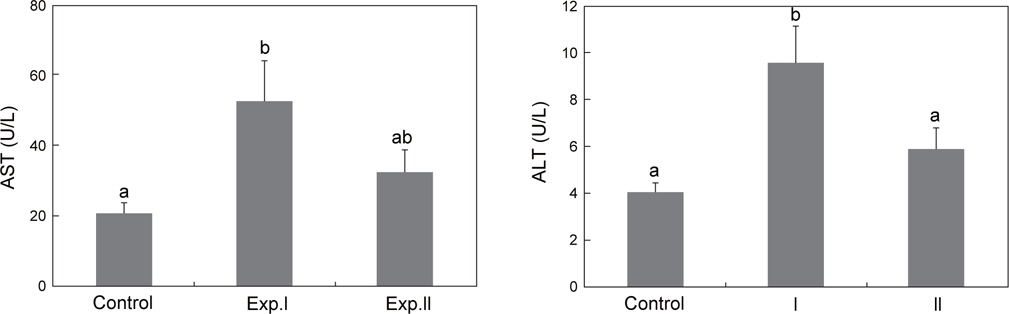
저산소 노출에 따른 Exp.Ⅰ의 AST는 53.1±11.6 U/L로 대조구의 20.9±3.0 U/L보다 유의하게 높았지만, Exp.Ⅱ는 32.7±6.4 U/L로 대조구와 통계적인 차이는 보이지 않았다(Fig. 4A).
Exp.Ⅰ의 ALT는 9.6±1.6 U/L로 대조구의 4.1±0.4 U/L와 Exp.Ⅱ의 5.9±0.9 U/L보다 유의하게 높았으나, Exp.Ⅱ는 대조구와 차이가 없었다(Fig. 4B).
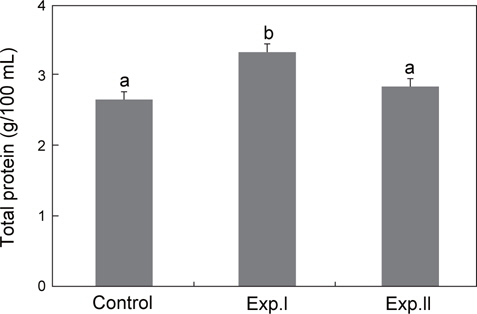
대조구의 총단백질 농도는 2.7±0.1 g/100 mL였으며, Exp.Ⅰ은 3.4±0.1 g/100 mL로 대조구보다 높았으나, Exp.Ⅱ는 2.9±0.1 g/100 mL로 대조구와 차이가 없었다(Fig. 5).
경골어류에서 코티졸은 주요 corticosteriod로 스트레스를 받는 동안 혈장의 코티졸 농도가 뚜렷하게 상승하므로, 코티졸은 주로 스트레스 지표로 이용된다(Mommsen et al., 1999). 일반적으로 안정시 또는 스트레스를 받지 않는 어류의 일반적인 코티졸 농도는 30-40 ng/mL 이지만(Wedemeyer et al., 1990), 이상적인 코티졸 농도는 5 ng/mL 이하로 나타나고 있다(Pickering and Pottinger, 1989). 감성돔의 경우, 안정시의 코티졸 농도가 10 ng/mL 이하로 밝혀져 있으며(Min et al., 2005; Chang et al., 2007; Choi et al., 2007, Park et al., 2012) 본 연구에서도 이와 비슷한 결과(대조구: 6.9 ng/mL)가 나타났다. 그러나 이러한 안정시 코티졸의 농도는 어종, 크기, 수온, 영양상태, 시간 등 많은 환경적 요인과 발달 단계에 따라 달라진다고 알려져 있다(Barton and Iwama, 1991). 본 연구에서는 저산소 노출이 실험어의 HPI 축을 활성화시켜 혈중 코티졸을 상승시킨 것으로 났으며, 특히 점차적으로 DO를 낮춘 Exp.Ⅰ에서는 23.7 ng/mL, 그리고 즉시 DO를 낮춘 Exp.Ⅱ에서는 13.5 ng/mL로 Exp.Ⅰ이 1.8배 정도 높았다. 이러한 이유는 Exp.Ⅱ는 저산소 (DO=0.55 mg/L, 포화도 7.4%) 노출후 10분 동안만 스트레스를 받았지만, Exp.Ⅰ은 DO의 어느 농도인지는 알 수가 없었나 채혈 시점 이전부터 계속해서 저산소에 따른 스트레스를 받아왔기 때문인 것으로 여겨진다. 저산소 노출에 따른 어체의 코티졸 상승은 많은 어종에서 보고되고 있다(Herbert and Steffensen, 2005; Lays et al., 2009; O'Connor et al., 2011). Lays et al. (2009)에 따르면 spotted wolffish (Anarhichas minor)의 코티졸의 농도가 저산소 노출전 5 ng/mL 정도였으며, 산소의 포화도가 40%까지는 유의한 차이를 보이지 않았으나 그 포화도가 20%에서는 약 35 ng/mL로 7배정도 증가한 반면, 본 연구의 Exp.Ⅰ에서는 산소 포화도가 7.4%일 때 코티졸 농도가 3배정도 증가한 것으로 나타난 것으로 볼 때 저산소 스트레스 유발요인에 대한 코티졸 반응이 어종에 따라 다르게 나타남을 알 수 있다. 스트레스 반응은 일반적으로 스트레스 유발요인의 종류 및 강도에 따라 다른데, 감성돔의 경우 담수로 이동하였을 때 코티졸의 농도가 약 30 ng/mL (Chang et al., 2007)였던 반면, 수온 상승시(20→30℃)에는 약 106 ng/mL (Choi et al., 2006)로 나타나 본 연구에서보다 높은 것으로 나타났다. 또한 스트레스 반응은 어종에 따라 다르며 이들의 생태형과 생활방식에 좌우된 다고 알려져 있다(Silkin and Silkina, 2005). 연안 정착성 어종인 감성돔은 본 연구를 비롯하여 여러 스트레스 유발요인 노출에 따른 코티졸 상승(Min, 2006)이 연어와 어류와 같은 유영성 어류보다 낮은 경향을 보이는데(Barton and Iwama, 1991), 정착성 어류에서 스트레스 유발요인에 대한 코티졸의 낮은 반응은 스트레스 유발요인 인지에 대하여 HPI축 내의 신경내분비 조절 때문인 것으로 보여진다(Vijayan and Moon, 1994).
글루코스는 화학적 에너지(ATP)로 전환되어 최종적으로 기계적 에너지가 되므로 동물의 생체에너지 대사에서 주요한 역할을 한다(Lucas, 1996). 경골어류의 안정시 혈장 글루코스 농도는 어종에 따라 다양한데, 잉어, 대구 및 연어과 어류와 같이 활동성이 강한 어종에서는 54-180 mg/100 mL (West et al.,1994; Blasco et al., 2001)로 활동성이 거의 없는 rock perch (
일반적으로 혈액학적 parameters (Ht, Hb 및 백혈구수 등)의 변화는 스트레스의 2차적 반응으로 나타난다(Barton and Iwama, 1991). Ht는 혈중의 적혈구 용적을 나타내며 어종에 따라 매우 다르게 나타나는데, 글루코스와 마찬가지로 활동성이 강한 어종(sea carp,
또한 생리학적 스트레스의 2차 반응으로 물-미네랄 균형에 변화가 나타난다(Barton and Iwama, 1991). 일반적으로 척추 동물은 체내에 일정한 염분을 유지함으로써 세포 내외의 이온경사를 유지한다. 이러한 이유로 어류는 끊임없이 삼투압 조절작용을 하는데, 어류는 해수와 담수에서 그 차이를 보인다. 해수어류의 경우 체내의 일정한 삼투질 농도를 유지하기 위하여 이온은 방출하고, 물은 흡수하는 저삼투압조절 능력을 가진다(Min et al., 2009). 따라서 어류에 있어 수온상승, 감금 등 스트레스 유발요인 노출은 이러한 삼투압조절에 혼란을 야기 시켜 혈장의 Na+, Cl- 및 삼투질농도의 변화를 초래한다(Nolan et al., 1999; Choi et al., 2007). 본 연구에서 Exp.Ⅰ은 혈장 Cl-에는 영향을 미치지 않았으나 혈장 Na+ 및 삼투질농도를 상승시켜 지속적인 저산소 노출은 어체의 삼투압조절 장애를 유발하였다. 척추동물에서 AST 및 ALT는 아미노전이효소로 이들의 혈중농도는 일반적으로 간기능 지수이며, 또한 수온변화, 저산소, pH, 암모니아, 중금속에 의한 스트레스 반응으로도 사용된다(Pan et al., 2003). 본 연구의 Exp.Ⅰ에서는 AST 및 ALT의 상승은 간세포에 손상이 나타났음을 의미하나, Exp.Ⅱ에서는 대조구와 비교해 변화가 없었다. 이것은 Exp.Ⅰ이 Exp.Ⅱ보다 간세포 손상에 영향을 미칠 만큼 저산소 노출이 길었으며, 또한 Exp.Ⅱ에서 같이 급격한 저산소 노출후 적어도 10분 이내에는 간세포 손상에 변화가 없다는 것을 의미한다.
혈장의 총단백질 농도는 육상 및 수서생물의 건강, 스트레스 및 웰빙을 나타내는 광범위한 임상 지표로 이용되며(Riche, 2007), 스트레스 반응에 따른 혈장 단백질의 상승은 단백질 대사에 코티졸의 영향으로 나타난다(Van der Boon et al., 1991). 본 연구에서 지속적인 저산소 노출은 혈장 단백질 상승을 초래한 반면, 급격한 노출에서는 변화가 없었는데, 이 같은 결과는 AST 및 ALT의 변화와 같은 맥락으로 해석이 된다.
이상의 결과를 종합해 보면, 감성돔의 급격한 저산소 노출은 스트레스의 1차적 반응으로 혈장 코티졸 상승을, 2차적 반응으로 글루코스, Ht, 이온, 삼투질 농도, AST, ALT 및 총단백질의 상승을 유발하였다. 본 연구와 관련하여 앞으로는 저산소 노출시 DO 농도에 따른 어체의 스트레스 반응을 어체의 크기를 비롯하여 다양한 환경조건(수온, 염분 등)에 따라 조사해야 할 것 으로 보인다.