The effects of temperature on spore release, growth and photosynthetic efficiency of
각상형(encrusting) 홍조류인 무절산호조류는 극지역에서 열대해역까지 광이 존재하는 모든 수심에서 관찰되며, 온대 해역에서는 중요한 석회화 생물중의 하나로서 연안에 서식하는 다양한 무척추동물의 정착(settlement)과 가입(recruitment)을 유도하고 관련 생물의 다양성을 높이는 서식처로서 생태학적 중요성을 가진다(Morse and Morse, 1984; Dethier, 1994; Martin and Gattuso, 2009). 또한, 해양생태계에서 무절산호조류는 탄산염을 축적하여 생장하거나 사멸 후 분해되어 무척추동물의 생명유지에 필요한 패각의 구성물질로 이용된다(Bosence, 1983; Leclercq et al., 2000). 이외에도 이들은 전 세계적인 분포를 보이고 조하대에서 번무하며, 다양한 크기와 형태로서 다른 해조류와 동물의 부착기질로서 연안생물의 중요한 서식처 역할을 한다(Johansen, 1981; Johnson and Mann, 1986; Foster, 2001). 각상형의 무절산호조류는 일년에 수 밀리미터의 느린연변부 생장(lateral growth)을 보이지만, 수온이나 광, 염분 등과 같은 무생물적 환경요인의 영향을 받기 쉬운 직립형 해조류에 비해 환경적응이 용이하여 교란이 심한 지역에서 우점하며 (Dethier, 1994), 탄산칼슘으로 구성된 엽체는 포식자의 섭식에 높은 저항성을 나타냄으로써(Fujita et al., 1992; Gherardi and Bosense, 2001), 열대에서 극지방에 이르는 광범위한 수온 및 광합성이 가능한 모든 수심에서 우점하여 서식하는 것으로 알려져 있다(Littler et al., 1985; Steneck, 1986).
최근에, 우리나라와 일본의 조간대 및 조하대에서는 무절산호조류가 번무하는 갯녹음(Isoyake) 현상으로 기초생산자인 해조류의 다양성과 생물량이 감소하고(Chung et al., 1998; Wilson et al., 2004), 이들을 먹이원으로 사용하는 수산동물의 자원감소를 초래하여 연안생태계가 황폐화되고 있다(Noro et al., 1983; Chung et al., 1998; Ichiki et al., 2000; Kim et al., 2011). 이처럼 무절산호조류는 패각을 형성하는 생물의 탄산칼슘의 근원으로서 긍정적인 측면과 해조류의 종다양성과 풍도의 감소를 가져오는 부정적인 측면이 있기 때문에 해양생태계 변화에 중요한 영향을 미친다. 이외에도 대기 중 이산화탄소(CO2)의 농도가 증가하는 지구온난화로 인한 해양산성화(ocean acidification) 는 각상형 무절산호조류의 석회화 억제와 분해 촉진을 초래하는 것으로 확인되어(Martin and Gattuso, 2009), 무절산호조류의 생리·생태적 연구는 해양생태계의 변화를 모니터링하고 관리하기 위해 반드시 필요하다(Noro, 1976; Noro et al., 1983; Hwang et al., 2002). 그럼에도 불구하고 무절산호조류에 대한 국내 연구는 분류학적 위치 및 분포에 대한 연구(Kang, 1966; Kim, 2000)와 납작돌잎의 포자방출과 생장에 대한 연구만 수행되어 보다 폭넓은 연구가 절실한 실정이다(Hwang et al., 2002). 해조류는 다양한 환경요인과 종에 따라서 생장과 성숙이 변화하므로 실내배양을 통한 각 종별 정확한 생리정보를 확인하는 연구가 필요하다(Wilson et al., 2004; Steller et al., 2007).
무절산호조류의 생존과 생장은 초식동물의 섭식압 및 각상형 동·식물간의 경쟁과 같은 생물적요인과 인간활동에 의한 부유물질 유입과 수질오염 등의 무생물적 환경요인에 의해 제한되거나 번무하는 것으로 알려져 있다(Johnson and Mann, 1986; Suzuki et al., 1998; Terawaki et al., 2001; Wilson et al., 2004). 일반적으로 무절산호조류는 고온인 여름철에 생장과 생식력이 좋은 것으로 알려져 있으며(Johansen, 1981; Potin et al., 1990; Choi et al., 2002), 배아단계에서도 고온에서 생장이 빠른 것으로 확인되었다(Ichiki et al., 2000). 각상형 산호조류인
본 연구는 우리나라 연안의 갯녹음 현상과 관련된 각상형 홍조류 2종, 동해안에 우점하는 납작돌잎(
본 연구에 사용된 각상형 산호조류인 납작돌잎은 강원도 속초시 갈남에서, 진분홍딱지는 전북 부안군 격포에서 채집되었다 (Fig. 1). 무절산호조류가 피복된 작은 돌은 실험실로 운반하여 부착해조류를 메스로 제거하고 여과해수(0.45 μm)와 brush로 표면에 부착된 미세조류를 수회 세척한 후 실험에 사용하였다.
포자방출에 미치는 온도의 영향을 확인하기 위하여, 납작돌잎은 갈남에서 2011년 5월에, 진분홍딱지는 격포에서 2011년 3월에 채집하였다. 무절산호조류가 피복된 돌의 표면을 디지털 카메라(Canon IXUS 860IS)로 촬영한 후 Image J 프로그램을 이용하여 각 종의 피복면적을 측정하였다. 두 종의 표면을 여과해수와 칫솔로 세척하고 절단된 슬라이드글라스 조각(2.5×2.5 cm)이 바닥에 깔린 Petri dish (직경 12 cm)에 각 종이 피복된 돌을 올리고 멸균해수가 들어있는 2 L 수조에 넣어 배양기에서 포자방출을 유도하였다. 배양기의 온도는 10, 15와 20℃로 각기 다르게 조절하였고 염분(34 psu)과 조도(50 μmol photon m−2 s−1), 광주기(12:12h LD)는 동일하게 유지시켰다. 48시간 후 슬라이드 조각에 부착된 포자를 광학현미경(Olympus BH-2, Japan) 하에서 계수하여 각 종의 피복 면적당 방출된 포자의 수를 계산하였다. 포자방출 실험은 2회 반복하였다.
납작돌잎과 진분홍딱지를 갈남과 격포에서 2011년 5월과 3월에 각각 채집하였으며, 생장실험에 필요한 다량의 포자를 확보하기 위하여 상기 실험에서 확인된 포자방출의 적온인 10℃(납작돌잎)와 20℃(진분홍딱지)에서 3-4개의 대형 플라스틱 수조(2 L)를 이용하여 포자를 방출시켰으며 배양기의 다른 조건은 위에서 언급한 포자방출실험과 동일하였다.
두 종의 포자가 부착된 슬라이드 조각 3-4개를 PES 배양 해수(Provasoli, 1968)가 30 mL씩 담긴 Petri dish (직경 10 cm)에 넣었다. 규조류의 번식을 억제하기 위해 배양액에 산화게르마늄 5 mgL−1을 첨가하였으며(Shea and Chopin, 2006), 2일 간격으로 유화용 붓으로 배아를 제외한 오염물질을 제거하고 배양액을 전량 교체하였다. 배아가 들어있는 Petri dish는 서로 다른 5개의 온도(10, 15, 20, 25, 30℃)에서 14일간 배양하였으 며, 이때 염분(34 psu), 조도(50 μmol photon m−2 s−1)와 광주기 (12:12h LD)는 모든 배양기에서 동일하였다. 각상형 홍조류의 배아는 연변부 생장(marginal growth)을 하기 때문에 배아 생장은 7일 간격으로 광학현미경 하에서 사진을 촬영하여 Image J 프로그램(1.40s, National Institute of Health, Bethesda, USA)으로 배아별 면적을 측정하고, 상대생장률을 아래의 식으로 계산하였다(Rueness and Tananger, 1984). 실험구 별로 배아 30개체의 면적을 측정하였으며 3개의 반복구를 두었다.
RGR=(lnL2-lnL1)/t2-t1, L1, 실험 개시 때 배아면적; L2는 측정시 배아면적, t1, t2 는 배양 일수
생장에 대한 실험 데이터는 Levene의 등분산검정(test of homogeneity of variances)을 실시하여 동질성을 확인한 후에 각종에 대해서 One-way ANOVA로 유의차를 검정하였으며, 자료에 대한 유의차가 확인되면 Tukey’s test로 사후검정을 실시하였다. 모든 자료 분석은 STATISTICA version 7.0을 사용하여 수행되었다.
각상형 산호조류 두 종의 광합성에 온도가 미치는 영향을 파악하기 위해, 갈남과 격포에서 2011년 9월에 납작돌잎과 진분홍딱지를 채집하였다. 무절산호조류가 피복된 작은 돌의 표면을 여과된 해수로 씻어내고 Diving PAM (Walz, Effecltrich, Germany)을 사용하여 최소형광(Fo) 값을 측정한 후, 멸균해수가 담긴 비이커(250 mL)에 넣었다. 염분(34 psu), 조도(50 μmol photon m−2 s−1), 광주기(12:12h LD)는 동일하지만, 온도가 10, 15, 20, 25℃로 다르게 설정된 배양기에 넣고 시간별(3, 6, 9, 15 h)로 적응 시킨 다음 광합성효율(Fv/Fm)을 측정하고 적응시간별 변화를 확인하였다. 광합성 효율은 아래와 같은 식으 로 계산하였으며 3회 반복 측정하였다. 최소형광(Fo)과 최대형광(Fm) 값은 5분간 암적응 시킨 후 암조건 상태에서 Fiber-optic probe를 무절산호조류가 피복된 표면에 밀착시켜 측정하였으며, 형광변수(Fv)는 암적응 후 최대형광과 최소형광의 차이를 나타낸다(Jesus et al., 2006).Fv/Fm (광합성효율) = (Fm-Fo)/Fm
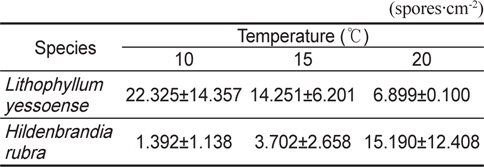
납작돌잎과 진분홍딱지의 포자방출은 10-20℃의 범위에서 가능하였으며, 납작돌잎의 방출된 포자수는 10℃에서 22.33±14.36 spores/cm2으로 가장 많았고 20℃에서 6.90±0.10 spores/cm2로 가장 적었다. 진분홍딱지는 20℃에서 15.19±12.41 spores/cm2 로 방출된 포자수가 가장 많았으며 10℃에서 가장 적었다 (Table 1). 무절산호조류의 포자 방출을 위한 최적 온도는 납작돌잎은 10℃이고 진분홍딱지는 20℃로서 종에 따라 다른 것으로 확인되었다.

Effects of water temperature on the spore release of Lithophyllum yessoense and Hildenbrandia rubra. Culture conditions were 34 psu, 50 μmol photon m?2 s?1, 12:12h LD (mean ± SE, n=2 replicate)
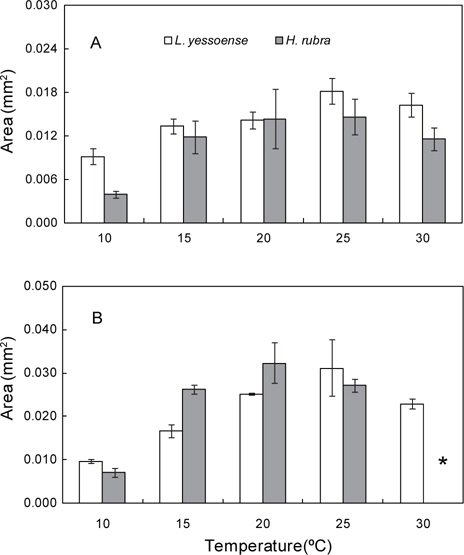
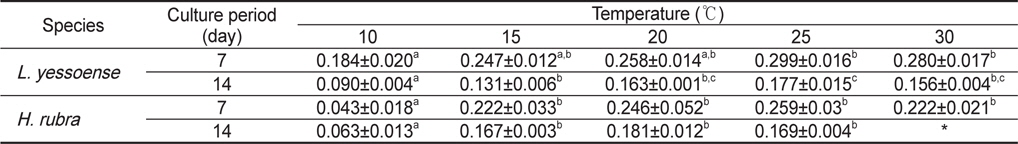
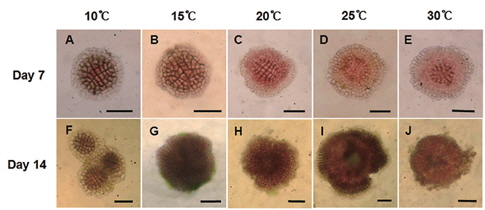
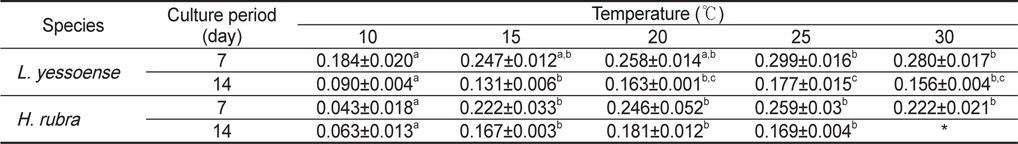
납작돌잎은 배양 7일 후 배아의 면적이 0.009-0.018 mm2로 10℃에서 최소, 25℃에서 최대였으며 모든 온도에서 초기 배아(0.003 mm2)에 비하여 3-6배 이상 생장하였다. 30℃에서는 배아의 면적이 0.016 mm2으로 25℃와 유사하였다(Fig. 2A). 배양 14일 후, 배아의 면적은10℃에서 0.010 mm2으로 7일 이후 생장이 거의 이루어지지 않았으나, 25℃에서는 7일에 비해 약 2배(0.031 mm2)로 생장하였다(Fig. 2B). 배아는 30℃에서 7일 이후부터 하얗게 탈색되기 시작하여 14일 이후엔 대부분 사멸하고 소수만이 생존하였다. 납작돌잎의 상대생장률은 배양 7일에 0.184-0.299 day−1였으며 10-20℃에서는 유의차가 없었으나 25와 30℃에서는 10℃에 비해 통계적으로 유의차를 보이는 빠른 생장을 보였다(Table 2). 배양 14일 경과 후 0.090-0.177 day−1로 배양 기간에 25℃에서 가장 높았고 모든 실험 온도에서 배양 초기에 빠르게 생장하다가 7일 이후부터 생장속도가 지연되었으며 고온에서 높은 생장률을 나타냈다(Table 2).
Average relative growth rate (day?1) of sporelings of Lithophyllum yessoense and Hildenbrandia rubra grown at various temperature for 7 and 14 days. Culture conditions were 34 psu, 50 μmol photon m?2 s?1 and 12:12h LD.
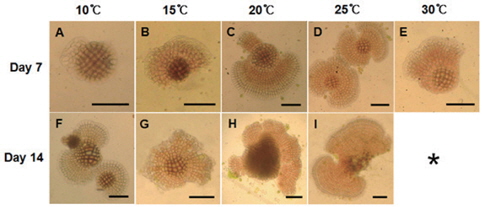
진분홍딱지의 배아 면적은 배양 7일 후에 20℃와 25℃에서 0.014 mm2와 0.015 mm2로 초기 배아(0.003 mm2)에 비해 약 5배 생장하였으나 10℃ (0.004 mm2)에서는 생장이 이루어지지 않았다(Fig. 2A). 배양 14일 후, 20℃에서 배아의 면적은 0.032 mm2로 최대였고, 10℃에서는 배양 7일에 비해 약 2배(0.007 mm2)로 생장하였으나, 다른 온도에 비해 배아의 생장은 지연되었다. 30℃에서는 배양 7일 이후에 배아가 하얗게 고사되기 시 작하여 14일에는 대부분의 배아가 사멸하여 배아의 면적을 측정할 수 없었다(Fig. 2B). 진분홍딱지의 상대생장률은 배양 7일에 0.043-0.259 day−1으로 10℃에 비해 20℃와 25℃에서 약 6배 빠른 생장을 보였으며 배양 14일에는 0.063-0.181 day−1으로 배양기간 동안 생장률은 20℃에서 최대였으나 15-25℃의 온도에서는 생장률에서 통계적 유의차는 없었다(Table 2). 따라서 진분홍딱지 배아의 최대 생장이 일어나는 수온은 20℃였으며, 30℃에서 배양한 배아는 7일 이후 대부분 사멸되어 납작돌잎에 비해 온도의 영향을 크게 받는 것으로 확인되었다.
두 종의 무절산호조류 포자의 형태는 동일하였으나, 배양 온도조건에 따라 배아의 분열 형태에서 구분되었다. 납작돌잎의 배아는 배양기간에 모든 온도조건에서 둥근 형태를 보였으며, 배양 7일 후는 10℃와 15℃에서는 중앙 부위에서 분열되어 퍼지는 정도가 적었으며 20℃이상의 온도에서는 많이 분열하여 둥근 형태를 유지하며 주변으로 확장되었다. 14일에는 10℃를 제외한 나머지 온도에서 직경 150 μm 이상까지 분열하였다(Fig. 3).
진분홍딱지는 초기 배아는 둥근 형태였지만 분열하면서 불규칙적인 형태를 보였으며 붉은색의 포자가 생장하면서 분열하는 연변부는 점차 연한 분홍색으로 바뀌었다. 배양 7일 후에 10℃에서는 생장이 지연되어 중앙부분에서 가장자리로 생장되는 부분이 적었고 빠른 생장이 일어난 15℃이상에서는 배아가 부채꼴 형태를 보였다. 배양 14일에는 2개 이상의 배아가 서로 결합하여 넓게 퍼진 형태가 많이 관찰되었다(Fig. 4).
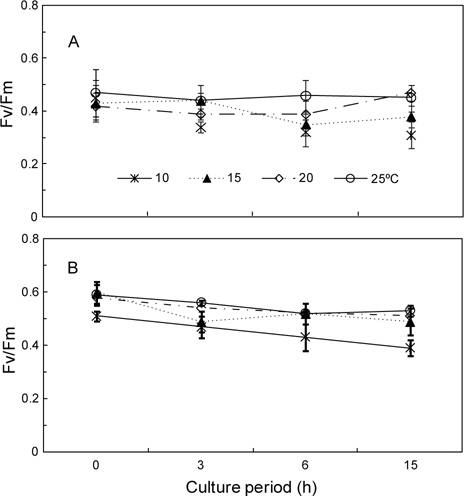
두 각상형 홍조류 성체의 광합성 효율(Fv/Fm)은 배양개시 전에 납작돌잎이 0.42-0.47이고 진분홍딱지가 0.51-0.60으로 진분홍딱지가 약간 높게 나타났다. 두 종은 모두 20-25℃ 범위에서 광합성 효율이 높았으나, 10℃에서는 배양 개시 전에 측정한 값에 비해 현저하게 감소되었다. 납작돌잎의 광합성 효율은 10℃에서 배양 개시 전에 0.45였으나 3시간 후에 0.34로서 초기값(100%)에 비하여 23%가 감소한 77%였으며 15시간 후에는 69%였다. 한편, 20℃와 25℃에서는 시간이 경과하여도 광합성 효율은 초기값과 유사하였다(Fig. 5A).
진분홍딱지의 광합성 효율은 10℃에서 측정이 시작된 시점(0.51)부터 꾸준히 감소하여 15시간 후에는 0.39로서 초기값에 비하여 76%정도였으며, 납작돌잎에 비하여 수치가 서서히 감소하였다. 진분홍딱지의 광합성 효율은 납작돌잎에서와 마찬가지로 저온(10, 15℃)에 비해 20℃와 25℃에서 높게 나타났으며, 15시간 후에는 0.51과 0.53으로 실험 개시 때의 90%를 나타내었다(Fig. 5B).
각상형 홍조류, 납작돌잎과 진분홍딱지의 포자는 10-20℃에서 방출되었으며, 적온은 납작돌잎은 10℃, 진분홍딱지는 20℃로 종별로 차이를 보였으며, 적온이 아닌 조건에서도 포자가 방출되어 무절산호조류 두 종의 포자방출은 연중 일어나는 것으로 사료된다. Hwang et al. (2002)은 납작돌잎의 포자방출은 여름-초겨울(6월-12월)에 주로 발생하며 9월에 최대 방출량을 보였고 1-3월에 포자방출이 일어나지 않았다고 하여 포자방출에 계절성이 있음을 확인하였다. 무절산호조류의 포자에 의한 가입(recruitment)은 성체의 풍도 및 군집구조와 관련이 있기 때문에 포자방출시기(혹은 적온)은 공급측면(supply-side)에서 매우 중요한 정보이다. Masaki et al. (1984)는 대부분의 무절산호조류는 표피세포(epithallial cells)가 박리(sloughing)되어 방오(antifouling)작용을 하므로, 납작돌잎(
본 연구에서 납작돌잎과 진분홍딱지의 최적 생장온도는 납작돌잎(25℃)과 진분홍딱지(20℃)에서 차이를 보였으며, 2종 모두 10℃에서는 배아의 면적이 최소였고 30℃에서는 7일 이후부터는 하얗게 고사되기 시작하였다. 본 연구의 결과는 40일간의 실내배양에서 납작돌잎 배아의 최적 생장온도가 20℃라는 Ichiki et al. (2000)과 Hwang et al. (2002)의 결과와 약간의 차이를 보였고 저온에서 납작돌잎의 생장이 지연된다는 선행연구 결과와 유사하였다(Ichiki et al., 2000; Hwang et al., 2002). Ichiki et al. (2000)은 납작돌잎의 생장은 5-25℃의 범위에서 일어났으며 20-25℃에서 최대였고 25℃ 이상의 고온에서는 생장이 저하된다고 하였다. 이러한 연구결과는 납작돌잎이 광온에서 서식하는 온대종으로(Fujita, 1989), 수온은 납작돌잎의 생장에 영향을 주는 중요한 환경인자이며, 서식하는 환경에 따라 최적 생장 적온이 약간씩 다르다는 것을 확인하였다. 진분홍딱지는 선행연구가 없어 납작돌잎의 결과와 비교해 보면, 진분홍딱지 배아는 20℃에서 최대생장을 보였고 30℃에서 배양7일이 경과한 후에 배아의 대부분이 고사하여, 최적생장 온도가 25℃이고 30℃에서도 생존한 납작돌잎과는 다른 생리적인 특성을 보였다. 즉, 진분홍딱지의 배아는 납작돌잎에 비해 생장이 가능한 온도의 범위가 좁았으며, 종에 따라 생장 및 성숙의 최적 조건이 다르다는 것이 확인되었다.
본 연구에서 납작돌잎의 최대 생장률은 25℃에서 배양 7일에 0.269 day−1, 14일에 0.171 day−1이었으며, 진분홍딱지는 20℃에서 배양 7일에 0.201 day−1, 14일에는 0.156 day−1로 배아 초기에 빠른 생장을 보였으며 종별 차이를 보였다. Dethier (1994)는 야외 실험에서 진분홍딱지는 수평생장이 거의 없었으며, 4년후 최대 1.5 mm의 생장을 보여 다른 무절산호조류에 비해 더딘 생장을 보였는데, 본 연구의 실내배양에서도 납작돌잎에 비해 느린 생장을 보였다.
본 연구에서 각상형 홍조류 2종의 생장은 사진촬영 후 Image J 프로그램을 이용한 면적을 측정하는 방법을 이용하였다. 느린 생장을 하는 각상형 산호조류는 2차원적인 평면 생장을 하므로 부착기질 표면에 공간 경쟁을 하며, 포복성이고 원반형의 가장자리에서 가장 활발한 생장을 보인다(Dethier, 1994; Dethier and Steneck, 2001). 현재까지 무절산호조류의 생장을 측정하는 방법은 격자를 이용한 면적 측정 방법(Dethier, 1994), 가장 긴 축을 측정하는 방법(Matsuda, 1989), 직각으로 2개의 직경을 측정하여 평균값을 사용하는 방법(Edyvean and Ford, 1987), 직경 측정방법(Hwang et al., 2002), 직경 측정 후 타원형으로 면적 환산하는 방법(Ichiki et al., 2000) 등으로 수평생장을 측정하였고 두께로서 수직생장을 측정하는 연구자도 있었다(Matsuda, 1989; Edyvean and Ford, 1987; Dethier and Steneck, 2001). Hwang et al. (2002)의 납작돌잎 배아는 초기생장에서 원반(disk) 형태를 보이지 않았으며, Dethier and Steneck (2001)는 각상형 홍조류인 무절산호조류의 종별로 생장패턴이 다르고 동일한 개체에서도 태양광에 직접 노출된 부분과 가려진(shade) 부분에 따라 생장이 다르다고 하였다. 본 연구에서도 납작돌잎과 진분홍딱지 배아의 생장패턴이 온도에 따라 다르게 나타났으며(Fig. 3, 4), 진분홍딱지의 배아 면적은 직경, 혹은 장축 등을 측정하여 환산할수 없다. 따라서, 각상형 무절산호조류의 배아의 생장은 사진촬영 후 면적을 측정하는 프로그램을 이용하는 것이 가장 적절할 것으로 사료된다.
본 연구에서 두 종의 최대 광합성효율을 나타낸 온도는 20- 25℃였으며 저온인 10℃에서는 광합성효율이 실험 초기에 비해 지속적인 감소를 보였다. 이러한 연구 결과는 Steller et al. (2007)이 보고한 납작돌잎과 같은 군에 속하는
한국산 무절산호조류 2종의 배아생장, 외형 및 성체의 광합성 효율은 모두 수온에 의해 영향을 받는다는 것과 낮은 수온에서는 배아생장과 광합성효율이 감소한다는 것을 확인할 수 있었다. 다른 해조류와 마찬가지로 무절산호조류도 섭식과 경쟁과 같은 생물학적 환경과 본 연구에서 수행되지 않은 조도, 염분 등과 같은 무생물적 환경요인도 광합성과 생장에 영향을 미칠 것으로 사료된다. 따라서, 무절산호조류의 번무로 인하여 파괴된 해중림을 복원하기 위해서는 우리나라 연안에 서식하는 다양한 무절산호조류의 종별 생리적인 연구가 활발하게 수행되어야 할 것으로 판단된다.