To secure the biological safety of live fish and shellfish for raw consumption, the germicidal effects of electrolyzed seawater were evaluated. Upon direct exposure to electrolyzed seawater, coliform group bacteria were killed and decreased to undetectable levels after 1 day. The physicochemical characteristics of the seawater were stable during the test period. A byproduct of chlorine disinfection, trihalomethane, was not generated by the electrolysis of seawater.
매년 여름철을 중심으로 오염된 어패류의 생식에 의해 식중독이 발생하고 있어 국민 건강에 영향을 미칠 뿐만 아니라 수산물의 소비위축을 야기하고 있다(Elliot et al., 1992; WHO, 1980; Oliver, 1989). 어패류의 생식을 즐기는 식습관을 가진 우리 나라에서는 식중독 예방을 위해 어획, 유통 및 가공 단계에서 활어패류 위생처리가 중요하나, 활어패류 저장에 연안 해수를 직접 사용하는 일이 관행적으로 이루어지고 있으며 해수의 수질관리는 단순여과에 의존하는 경우가 많다(Chang, 1998). 부분적으로 염소 처리, 오존 처리, 자외선 처리 등이 이용되고 있으나 그 적용에는 모두 한계점을 가지고 있다(Kang, 2005). 염소는 유기물이 존재하는 경우 살균효과가 급감되며 유해한 부산물을 형성할 수 있다. 강한 산화력을 가진 오존은 살균력이 높으나 고가의 장치가 필요하고 기화된 오존이 생물체에 악영향을 미칠 수 있다. 그리고 자외선의 살균력은 매질의 탁도에 큰 영향을 받으며, 장치의 램프 교체와 석영관 표면 이물질 제거가 지속적으로 이루어져야 한다(Jeong, 2003; Chang, 1998; Graham, 1997; Ong et al., 1995).
이러한 기존 살균법에 대한 대안으로 저 농도의 유효염소로 살균력을 나타내고 부산물 생성이 적은 전기분해수를 살균매체로 활용하고자 많은 연구가 이루어졌다(Mattick et al., 2003; Sharma et al., 2003; Park et al., 2004; Kim et al., 2000a; Kim et al., 2000b; Jϕgensen et al., 2002; Venkitanarayanan et al., 1999). 전기분해수는 병원성 세균 및 바이러스에 탁월한 살균효과를 나타내어 광범위한 응용이 가능할 것으로 기대되고 있다(Ozer and Demici, 2006; Kasai et al., 2000; Nakajima et al., 2004).
이 연구에서는 생식을 주로 하는 활어패류의 안전확보를 위한 위생처리 방법으로 해수 전기분해 장치를 개발하고 전기분해해수의 살균처리 능력과 안전성을 검토하였다.
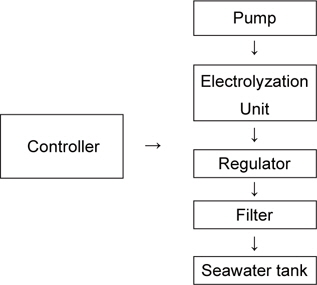
전기분해 장치는 국립수산과학원에서 개발하여 특허등록(특허 제0491985호, 2005. 05. 19, 무격막 전해조를 이용한 활어 패류 수조의 위생처리 방법 및 장치)한 전기분해 장치를 이용하였다. 1시간에 1 A 전류를 1 m2 극판에 흘릴 경우 1.323 g/ Ah의 염소가 발생되는 점과 염분농도 32-35 psu 조건에서 전기분해 효율이 90%가 된다는 점에 근거하여 전극판을 13×14 cm의 백금 도금판으로 제작하고 해수에 5 V/5 A의 전기를 흘려 최종 발생되는 염소량을 0-25 mg/kg으로 제어할 수 있도록 고안하였다.
200 L수조에 해수를 채우고 전동펌프를 사용하여 분당 30 L의 유량으로 순환되도록 하였으며, 전기분해 장치를 펌프의 출구에 장착하여 분당 5 L의 해수가 전기분해되어 수조로 유입되도록 하였다(수온 20-25℃). 이 때 분해되지 않은 잉여 해수는 보조 관로를 통하여 여과용 스펀지(25×50×10 cm)를 거쳐 수조로 반송되도록 설계하였다. 조절부에서 생성된 차아염소산나트륨(NaOCl)의 농도를 조절하며, 활성탄이 포함된 여과부는 생물체에 영향을 미칠 수 있는 부산물을 흡착하도록 하였다(Fig. 1).
시험에 사용한 어류는 주로 횟감용으로 소비되는 어종인 조피볼락(black rock fish,
해수의 수온은 봉상 온도계를 사용하여 측정하였으며, pH는 pH meter (Fisher Scientific, Model 815MP)로 측정하였 고, 염분은 Salinometer (Beckman, Model RS-10)로 측정하여 Practical Salinity Unit (PSU)로 나타내었으며, 탁도는 Turbidimeter(HACH, Model 2100-A)로 측정하여 Nephelometric Turbidity Units (NTU)로 나타내었다. 잔류염소의 농도는 σ-tolidine (Junsei Chem. Co.)용액을 이용한 비색법으로 RC meter (DKK-TOA Corp., RC-24P)를 사용하여 측정하였다.
분변계대장균으로
해수 및 어류 중 대장균군 및 분변계대장균 정량은 Recommended Procedures for the Examination of Seawater and Shellfish (APHA, 1970)의 방법에 따라 실시하였다. 어류는 시험 부위인 내장, 육, 표피를 시료로 30 g을 무균적으로 취하여 멸균 희석수로 1:10의 비율이 되도록 희석한 후 균질화하여 시료 원액으로 사용하였고, 패류는 가식 부위인 육을 50 g씩 취하여 동일한 방법으로 처리하여 시료원액으로 사용하였다. 어류 중 비브리오균의 정량은 Bacteriological Analytical Method (Elliot et al., 1992)의 방법에 따라 실시하였다.
해수 전기분해에 의한 trihalomethane 성분의 발생여부를 파악하기 위해 US EPA method 524.2 (US Environmental Protection Agency, 1979) 방법으로 분석하였다. 해수 시료 10 mL와 5 mL pentane 그리고 무수 sodium sulfate (Na2SO4) 20 g을 분액깔때기에 담은 후 10분 동안 격렬하게 흔들어 추출하고, pentane층을 autosampler vial에 옮긴 후 Gas chromatography/ electron capture detector (GC/ECD)를 사용하여 정량하였다. 기기분석 조건은 Table 1과 같다.
[Table 1.] Gas chromatography conditions for trihalomethane analysis

Gas chromatography conditions for trihalomethane analysis
>
전기분해에 따른 해수의 미생물학적 및 이화학적 변화
어패류에 대한 살균 효과 시험을 실시하기 전 해수에 대한 직접 살균 효과를 시험하기 위하여 대장균군 및 분변계대장균을 해수에 현탁하여 인위적으로 오염시킨 후 전기분해를 실시하면서 경시적으로 세균수의 변화를 측정하였다. 이와 동시에 수온, 염분 및 pH 등과 같은 해수의 물리화학적 변화도 측정하였다.
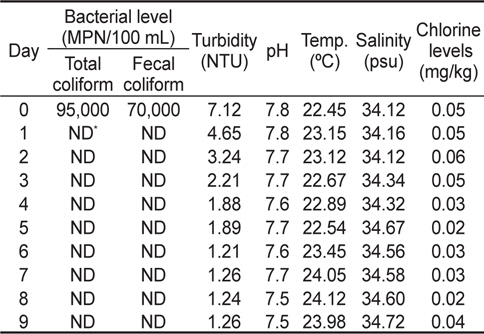
해수 중 대장균군 및 분변계대장균의 초기농도가 각각 95,000 MPN/100 mL, 70,000 MPN/100 mL이었던 것이 1일 후에는 검출한계 이하로 낮아져 강력한 살균효과가 확인되었다(Table 2). 이는 염소수를 이용한 단발성 처리의 경우 초기 염소농도가 서서히 낮아져 살균효과가 경시적으로 감소하는 반면, 전해분해수 장치를 이용하는 경우 염소의 농도가 일정하게 유지되어(0.02-0.06 mg/kg) 해수 중 대장균군이 살균성분에 지속적으로 노출되기 때문에 그 효과가 상대적으로 높았다고 사료된다. 해수의 물리화학적 성상의 변화를 조사한 결과, 탁도는 초기 7.12 NTU에서 1일 및 7일 후 각각 4.65 NTU와 1.21 NTU로 각각 감소하였는데, 이것은 여과장치에 의해 부유물이 제거되었기 때문으로 사료된다. 이 시험에서는 무격막 전해조를 사용하였기 때문에 중성의 전해수가 생성되어 해수의 pH가 거의 일정하게 유지되었다. 또한, 염분 농도도 변화가 없어 해수 고유의 성질이 유지되는 것으로 확인되었다(Table 2).
[Table 2.] Bacteriological and physic-chemical water quality of electrolyzed water system
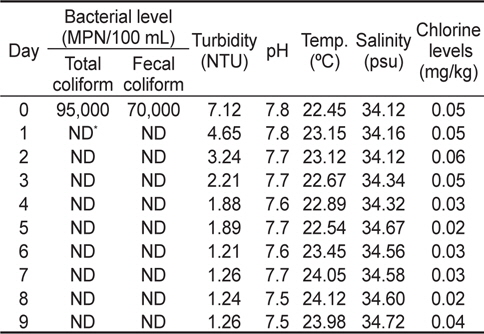
Bacteriological and physic-chemical water quality of electrolyzed water system
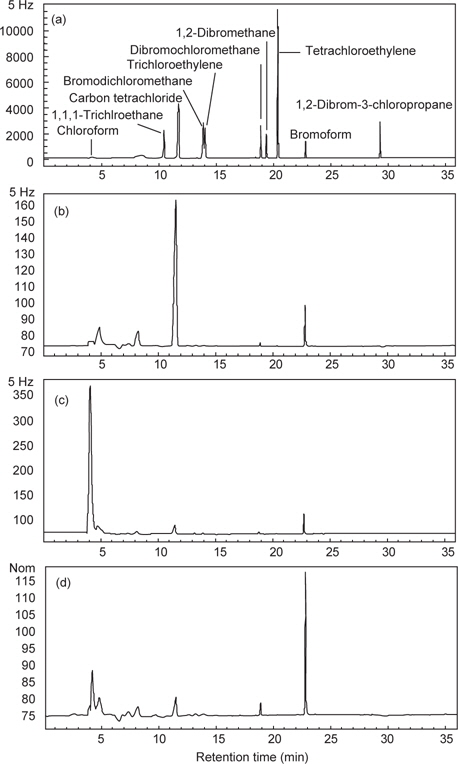
살균을 목적으로 염소를 사용하는 경우 발암성의 trihalomethane이 생성되고 이러한 유해물질이 인체에 부정적인 영 향을 미칠 수 있다는 연구 결과가 보고되고 있다(Sapers, 1998; Graham, 1997; Yoon and Song, 1996; Jeong, 2003). 전기분해해수의 살균 유효성분 역시 염소 화합물이므로 유해 부산물인 trihalomethane발생여부를 조사하였다. 이를 위해 수조에 활어를 수용한 후 전기분해 해수로 사육하면서 염소농도 0.7 mg/kg, 2 mg/kg 및 5 mg/kg의 해수를 채취하여 분석하였다. 분석을 위해 사용한 표준물질(Drinking Water VOA MegaMix Standard 524.2 Rev. 4.1, Restek, Bellefonte, USA)은 chloroform, 1,1,1-trichloroethane, carbon tetrachloride, trichloroethylene, bromodichloromethane, tetrachloroethylene, dibromo- chloromethane, 1,2-dibromomethane, bromoform, 1,2-dibromo- 3-chloropropane이며 그 크로마토그램은 Fig. 2(a)와 같다. 분석 결과 전기분해 해수에서 chloroform, bromo-dichloromethan, dibromo-chloromethane류는 전혀 검출이 되지 않았으나 bromoform의 존재가 의심되었다[Fig. 2(b), 2(c), 2(d)]. 그러나 검출된 bromoform 의심물질의 농도가 50 μg/kg 정도로 나타나 trihalomethane 류라고 할지라도 우리 나라 먹는 물 수질기준인 100 μg/kg (ME, 2013)의 절반 수준이라서 안전에는 문제가 없을 것으로 추정되었다.
전기분해 해수의 어류에 대한 살균 효과를 확인하기 위하여 활어수조에 어류를 혼합 수용하고 사육용수에
전기분해수의 살균기작에 대해서는 완전히 밝혀져 있지 않지만 차아염소산(HOCl)과 차아염소산 이온(OCl-)과 같은 유효염소가 주된 역할을 하는 것으로 보고되어 있다 (Rhaman et al., 2010). 이 연구에서 사용한 해수 전기분해장치는 pH를 비롯한 해수 고유의 물성을 변화시키지 않아 산성 전기분해수의 부식작용과 피부자극 등(Abadias et al., 2008)은 관찰되지 않았으나, 염소농도가 증가하는 경우에는 염소 소독처리 후 수생생물에서 나타나는 표피 탈색 및 스트레스 반응 유도와 같은 생물자극이 관찰되었다. 특히 어류를 염소농도 0.1 mg/kg 이상의 조건에 7일간 이상 노출시키는 경우 대부분 시험 어류의 표피에서 탈색현상이 관찰되며 80% 이상이 폐사하는 것으로 나타났다. 그러나 이 연구의 시험조건인 0.07-0.09 mg/kg의 염소농도에 일주일간 어류를 노출시킨 경우에는 폐사 개체가 없었고 표피, 아가미 그리고 내장에서 특이할 만한 생물자극 현상은 관찰되지 않았다.
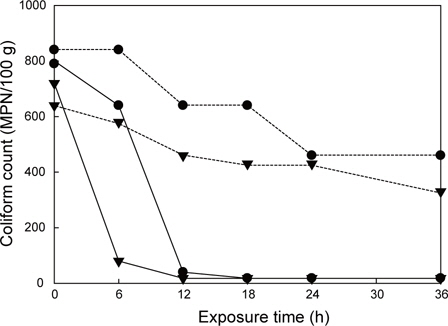
시험구와 대조구에 굴 5 kg을 각각 넣고 해수를 공급하고 1일간 순치한 후 시험균주를 접종하여 패육 중의 대장균군과 분변계대장균 농도가 각각 790-840 MPN/100 g및 640-720 MPM/100 g이 되도록 감염시켰다. 시험구에는 염소 농도가 0.07-0.09 mg/kg이 되도록 전기분해를 실시하면서 해수를 순환시키고 대조구에는 무처리 해수를 순환시키면서 수용된 굴 중의 대장균군 및 분변계대장균 농도 변화를 경시적으로 관찰하였다.
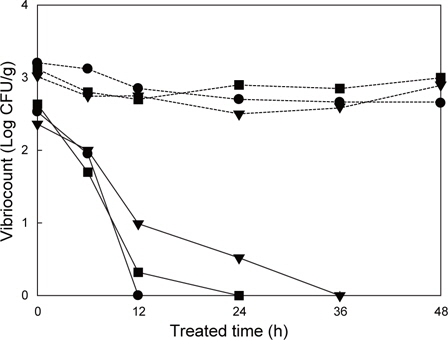
시험구에 수용된 굴 중의 대장균군 농도는 초기 790 MPN/100 g에서 12시간 만에 40 MPN/100 g으로 급격히 감소한 후 18시간 후에는 검출한계 이하로 농도가 낮아졌다(Fig. 4). 분변계대장균의 경우에는 12시간 만에 검출한계 이하로 농도가 감소하였다. 이러한 결과는 패류의 호흡에 의해서 소화관 내에 축적된 세균이 수중으로 유출되고 전기분해 해수에 의해 사멸되므로 2차 오염이 이루어지지 않아 패류 중 세균 농도가 급격히 감소하기 때문으로 추정되었다. Dore and Lees (1995)에 의하면 오염해역에서 일정기간 오염시킨 굴과 진주담치를 자외선으로 살균한 해수로 정화(depuration)한 경우 진주담치는 12시간 만에 굴의 경우는 48시간 만에 거의 98% 이상이 정화되었다고 보고한 것과 유사한 결과를 나타내었다. 반면 대조구에 수용될 굴 중의 대장균군과 분변계대장균의 농도는 해수의 자정능력에 의해 다소 감소하였으나 36시간까지 330-460 MPN/100 g으로 높게 유지되었다(Fig. 4). 이때 시험구와 대조구에 수용된 굴의 폐사율은 일주일 후 확인 시 5% 미만으로 나타났다.
이상의 결과는 전기분해 해수를 사용하여 낮은 염소농도 하에서도 단시간에 활어 및 활패류 중의 세균을 살균할 수 있음을 보여주고 있다. 특히 활어와 활패류를 고밀도로 혼합 수용하는 소매단계에서 위생안전을 확보하는 수단으로 활용하기에 적합할 것으로 판단되었으며 여름철 수산물 생식으로 인한 비브리오균 감염증 등의 식중독 사고 발생을 줄이는데 도움이 될 것으로 사료되었다.