In this study, we investigated about cell toxicity and oxidative stress of HepG2 cell by treatment of sodium fluoride (NaF) and fluoride extracts from krill
남극은 수많은 생명체들이 서식하는 생태계의 보고로 세계 각국이 앞 다투어 미래의 식량 자원 확보를 위한 연구개발을 수행 하고 있다. 그 중 큰 잠재력을 지니고 있는 식량자원 중의 하나인 크릴은 최근 학계와 식품업계 등을 중심으로 식량자원으로 서 응용에 관한 연구가 활발히 진행되고 있다(Tou et al., 2007). 하지만 크릴의 활용에 있어서 가장 큰 걸림돌은 크릴에 함유되어 있는 불소이다.
크릴의 불소함량은 크릴의 shell을 포함하는 whole body와 shell에 각각 330 ppm과 1,200 ppm이 함유되어 있다고 보고되고 있다(Sherlock, 1984). 따라서 크릴을 식품 소재로 활용하기 위하여 크릴에 함유된 불소를 제거하기 위한 다양한 방법들이 연구되고 있다(Park et al., 1998; Kim et al., 1990).
불소는 소량으로 존재할 때는 충치예방 등의 장점이 있지만 10년 이상 하루 10 mg 초과하여 섭취한 결과 관절이 뻣뻣해지고 골반과 척추의 골경화증과 같은 증후가 나타날 수 있다 고 보고하였다(Park et al., 1988; Son et al., 2008; Underwood, 1977; Christians, 1983).
불소는 일반적으로 음용수, 식품 또는 치약 등을 통해 사람들에게 섭취된다. 식품 중 불소는 우유 및 유제품에서 0.01-0.8 mg/kg, 어류에서는 0.21-4.47 mg/kg, 야채에는 0.28-1.34 mg/ kg이 포함되어 있으며(Dabeka and Mckenzie, 1995), 특히 중국 가정에서 음용하고 있는 차에 다량의 불소가 함유되어 있는 것으로 알려져 있다(Chen et al., 1996).
불소는 동물과 사람의 간세포에 프리 라디칼을 형성하고 항산화 시스템의 활성을 억제하여 간 독성을 유발한다고 알려져 있다(Son et al., 2008). 또한 인체가 불소에 노출되었을 때 소병소성 괴사(focal necrosis), 쿠퍼 세포의 팽창, 거대한 세포 내 고포 (vacuole) 생성 및 간세포 구조변화와 같은 간 조직의 조직병리학적 변화를 일으키는 것으로 알려져 있다(Shivarajashankara, 2001).
본 연구에서는 크릴로부터 추출한 불소 추출물을 간세포에 처리하여 이들 추출물이 간세포 독성과 산화적 스트레스에 미치는 영향에 대하여 알아보고자 하였다.
본 실험에 사용된 크릴은 남극 크릴(
세포 실험에 사용된 시약은 Modified Eagle's Medium (MEM) 및 fetal bovine serum (FBS)은 Hyclone Co. (Logan, UT, USA)의 제품을 사용하였고, 그 외에 실험에 사용된 분석용 시약은 Sigma Aldrich Co. (St. Louis, MO, USA)에서 구입하였다. 배양에 관련된 기기는 NUNC Co. (Langenselbold, Germany)의 제품을 사용하였다.
각 시료에 함유된 불소를 추출하기 위하여 불소 추출 최적조건으로 알려져 있는 구연산 추출법을 이용하였다(Xie et al., 2012). 시료건물(dry basis) 당 50배의 10 mM 구연산을 가한후 homogenizer로 800 rpm에서 5분간 마쇄하였다. 이것을 실 온에서 stirrer를 이용하여 30분간 추출하였다. 추출물은 5,000 rpm에서 20분간 원심분리하고 상등액을 여과한 후 여과액을 동결 건조하여 크릴 불소 추출물(KFE, krill fluoride extracts)로 사용하였다. 불소함량은 불소이온전극(9609BNWP and 960900 fluoride combination electrode, thermo scientific, Bellefonte, PA, USA)을 장착한 pH/mV 메타(Orion dual star, pH/ISE benchtop, thermo scientific, Bellefonte, PA, USA)로 표준물질과 시료의 이온 강도를 측정하여 표준물질의 표준 검량식을 통해 시료 중의 불소 함량을 산출하였다. 본 실험에 사용된 KFE의 농도는 세포에 처리시 최종 불소함량으로 처리하였다.
실험에 사용한 간암 세포주(HepG2 cell line)는 한국세포주은행(KCLB, Seoul, Korea)에서 분양 받아 사용하였다. 세포주는 10% FBS 배지를 함유한 MEM 배지로 배양하였으며, 1주일에 2-3회 계대 배양하였다. 세포는 습도 95%, 5% CO2 및 온 도는 37℃의 배양기에서 배양하였으며, 배지는 2-3일에 한 번씩 교환하였다.
세포 배양용 플라스크에 배양한 HepG2 세포를 1×104 cells/ well의 농도로 96 well plate에 분주하고, 24시간 동안 배양하였다. 새로운 배지에 최종농도가 50, 100, 300 및 500 μg/mL이 되도록 제조하여 세포에 처리하고 24시간 동안 배양하였다. 세포생존률은 Promega (Madison, WI, USA)사에서 구입한 CellTiter 96 well Aqueous One Solution Cell Proliferation Assay를 이용하여 microplate reader (Perkin Elmer 1420, VICTORTM X Multilabel Plate Readers, Waltham, MA, USA)로 490 nm에서 흡광도를 측정하였다. 세포의 생존율은 시료를 처리하지 않은 대조군에 대비한 시료 처리군의 흡광도로 나타내었다.
프리 라디칼 생성량 및 항산화 효소의 활성 측정을 위하여 HepG2 cell을 6 well에 분주하여 24시간 배양한 후, 농도를 달리 한 NaF와 각 부위별KFE를 새로운 배지에 녹여 세포에 처리 하고 2시간 동안 배양하였다. 배양된 세포의 프리 라디칼 생성량과 항산화 효소의 활성을 측정하기 위하여 배양된 세포를 다음과 같은 방법으로 회수하였다. 먼저 배지를 제거하고 PBS 1 mL로 2회 세척한 다음, lysis buffer 300 μL를 넣고 scrapper로 세포를 떼어 내어 EP 튜브에 옮겼다. 얼음 위에서 30분간 방치하고 4℃, 12,000 rpm에서 20분간 원심 분리한 후 그 상등액을 취하여, 프리 라디칼 생성량 및 항산화 효소의 활성을 측정하였으며, 세포 추출액의 단백질함량은 BCA 법으로 측정하였다.
NaF 와 KFE 처리 세포 추출액의 수퍼옥시드 라디칼의 생성량은 McCord 와 Fridovch의 방법에 따라 측정하였다(McCord and Frichvch, 1969). 세포 추출액 300 μL에 0.1 mM EDTA를 함유하는 0.3 M potassium phosphate (pH 7.4) 36 mL와 3 mM potassium cyanide 680 μL, 0.1 mM cytochrome C 4 mL를 혼합한 용액 2 mL를 가한 후, 550 nm에서 2분간 흡광도의 차이를 측정하였다. 이 때 cytochrome C의 변화량은 분자흡광계수 19,500 mol/l -1·mm -1 로 계산하였다. 이 모든 과정은 얼음 위에서 실시하였다.
히드록시 라디칼 생성능은 Halliwell과 Gutteridge의 방법(1981)에 따라 측정하였다. NaF 및 KFE 처리 세포 추출액 50μL와 D.W의 양이 200 μL가 되도록 한 후, 0.1 M potassium phosphate buffer (pH 7.4), 10 mM sodium azide, 7 mM deoxyribose, 5 mM ferrous ammonium sulfate를 각각 33.3 μL씩 혼합한 시약을 가하였다. 혼합액을 37℃에서 15분간 항온 시킨후, 미리 혼합하여 항온한 시료 67 μL, 8.1% SDS 75 μL, 20% acetic acid 500 μL와 증류수 25 μL를 넣고 333 μL의 1.2% TBA를 가하여 잘 혼합한 후, 3,000 rpm에서 5분간 원심분리하였다. 532 nm에서 흡광도를 측정하여 표준검량 곡선에 따라 생성량을 계산하였다.
>
Superoxide dismutase (SOD)의 활성 측정
항산화 효소인 SOD의 활성은 Oyanagui의 방법(1984)에 따라 측정하였다. NaF 및 KFE 처리 세포 추출액 100 μL, 증류수 500 μL, 기질용액인 3 mM hydroxylamine-hypoxanthine 200 μL와 0.1 mM EDTA가 함유된 phosphate buffer (pH 8.2)로 제조한 7.5 mU xanthine oxidase 효소용액을 200 μL 가하여 37℃에서 40분간 반응시켰다. 16.7% acetic acid에 용해시킨 3.5 mM sulfanilic-N-1-naphthylethylene diamine 2 mL를 넣어 반응을 중지시키고 실온에서 20분간 방치한 후 550 nm에서 흡광도를 측정하였다. 표준 검량선에 따라 SOD 활성(unit/mg protein)을 측정하였다.
CAT 활성은 Rigo등의 방법(1977)에 따라 측정하였다. NaF 및 KFE 처리 세포 추출액 을 5배 희석한 후 희석액 20 μL에 130 mM sodium phosphate buffer (pH 7.0) 250 μL, 탈이온수 330 μL, 15 mM hydrogen peroxide 900 μL를 가하여 2분 동안 240 nm에서 흡광도를 측정하여, 분당 hydrogen peroxide 감소율을 측정하여 효소의 활성을 구하였다.
>
Glutathione peroxidase (GSH-Px)의 활성 측정
GSH-Px 활성은 Lawrence와 Burk (1978)의 방법에 따라 실시하였다. 4 mM EDTA를 함유하는 0.3 M phosphate buffer (pH 7.2) 1 mL, 26.56 mM sodium azide 0.5 mL, 탈이온수 1.295 mL, 294.37 mM glutathione 60 μL , 8.4 mM NADPH 110 μL와 glutathione reductase 5 μL를 넣고 혼합하였다. 혼합액에 NaF 및 KFE 처리 세포 추출액 30 μL와 1 mM hydroperoxide 320 μL 넣고 5초 동안 혼합한 뒤, 2분 동안 340 nm에서 흡광도를 측정하여 1분당 hydroperoxide의 감소율을 측정하여 GSH-Px의 활성을 구하였다.
본 연구의 모든 실험 결과는 3회 이상 반복으로 평균값으로 나타내었다. 통계분석은 Student's t-test를 이용하였으며, 각각의 시료에 대해 평균±표준편차로 나타내었다. 각 시료군에 대한 유의성 검증은 분산분석을 한 후
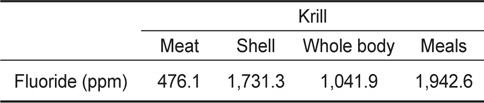
Table 1은 krill meat, shell, whole body 및 krill meals 동결건조물의 불소함량을 측정한 결과이다. Krill meat는 건물당(dry basis) 476.1 ppm, shell 은 1,731.3 ppm, whole body는 1,041.9 ppm이었으며, meals은 1,942.6 ppm으로 shell과 meals에서 가장 높은 불소 함량을 나타내었다.
[Table 1.] Fluoride contents of krill Euphausia superba fluoride extracts
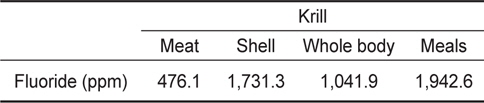
Fluoride contents of krill Euphausia superba fluoride extracts
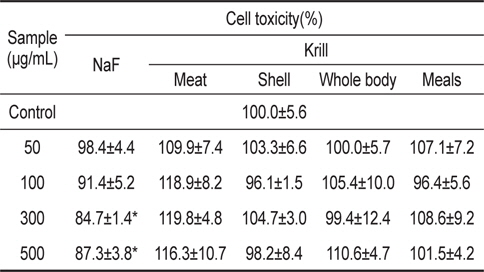
KFE의 독성은 NaF와 동일한 불소 함량의 KFE가 들어가도록 세포 처리시 최종 불소 함량으로 시험하였다. 시료를 24시간 동안 배양하였을 때 시료 미처리 대조군의 세포 생존율에 비해 300 μg/mL에서는 세포생존율이 84.7±1.4%, 500 μg/mL 에서는 87.3±3.8%의 생존율을 나타내었으며, 300 μg/mL 이상 의 농도에서 독성을 나타내었다(Table 2). 그러나 KFE로 처리한 시험군에서는 세포독성을 나타내지 않았다.
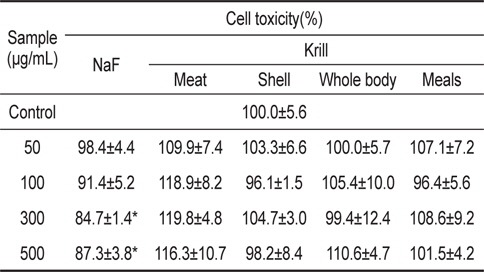
Cell toxicity against HepG2 cell line with treatment of NaF and krill Euphausia superba fluoride extracts
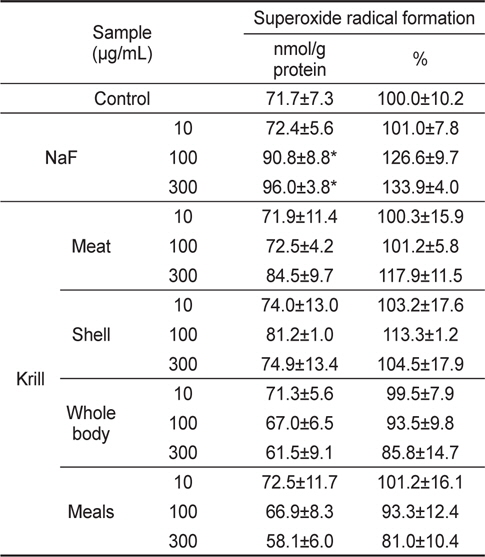
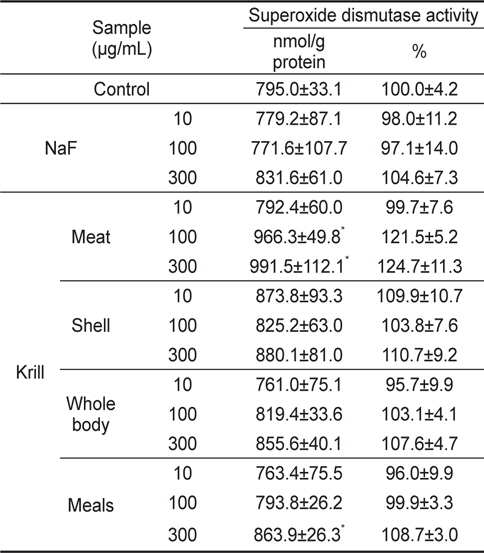
수퍼옥시드 라디칼은 프리 라디칼 반응에서 초기단계에서 가장 강력한 프리 라디칼로 NaF와 KFE 처리시 간세포의 수퍼옥시드 라디칼의 생성량은 Table 3과 같다. NaF 처리군의 경우 100 μg/mL에서 90.8±8.8 nmol/g protein였고, 300 μg/mL에서는 96.0±3.8 nmol/g protein으로 농도가 증가함에 따라 유의적으로 수퍼옥시드 라디칼 생성이 증가되었다. 그러나 KFE 처리군에서는 수퍼옥시드 라디칼 생성량은 증가하지 않았다.
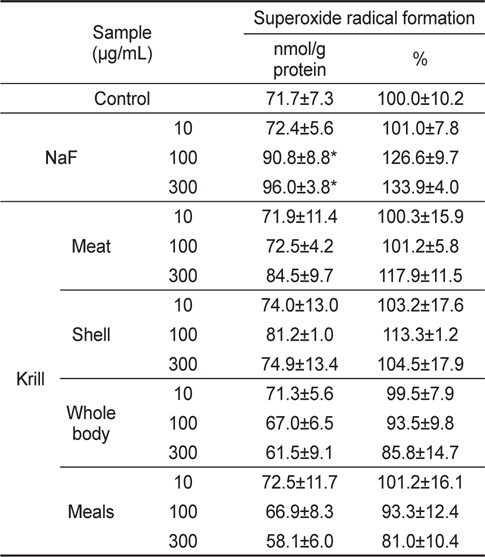
Superoxide radical formation of NaF and krill Euphausia superba fluoride extracts in HepG2 cells
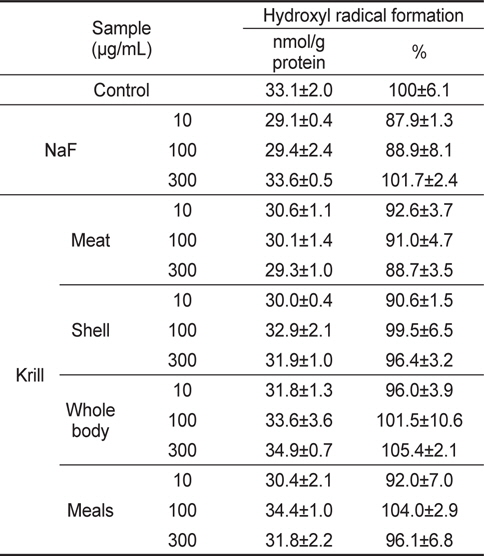
NaF와 KFE처리군의 히드록시 라디칼 생성량을 비교한 결과, 히드록시 라디칼 생성량은 수퍼옥시드 라디칼 생성량과 달리 NaF 처리군 뿐만 아니라 모든 KFE 처리군에서 농도간에 히드록시 라디칼 생성량의 유의적인 차이는 나타나지 않았다 (Table 4)
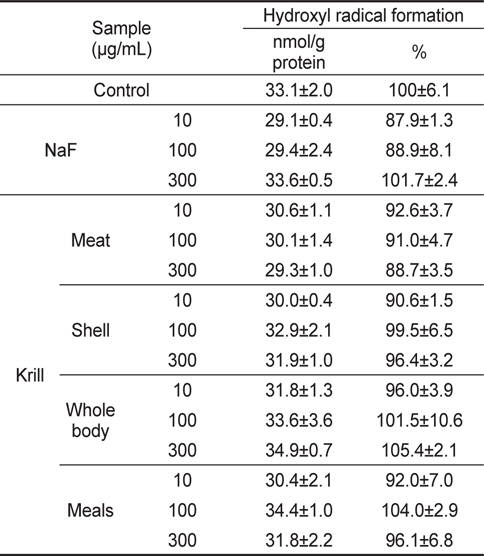
Hydroxyl radical formation effect of NaF and krill Euphausia superba fluoride extracts in HepG2 cells
>
Superoxide dismutase (SOD) 활성
NaF와 KFE 처리군의SOD 활성은 Table 5에 나타내었다. NaF 처리군은 모든 농도에서 대조군과 비교하였을 때, SOD 활성의 유의적인 증가는 나타나지 않았다. 그러나 krill meat 불소추출물 처리군은 100 μg/mL 농도에서 약 21.5%, 300 μg/mL 농도에서 활성이 약 24.7% 증가되었다. Krill meals불소 추출물 처리군의 경우에는 300 μg/mL농도에서 약 8.7%로 활성이 증가하는 것으로 나타났다. 그러나 krill shell과 whole body에서는 유의적인 활성 증가는 나타나지 않았다.
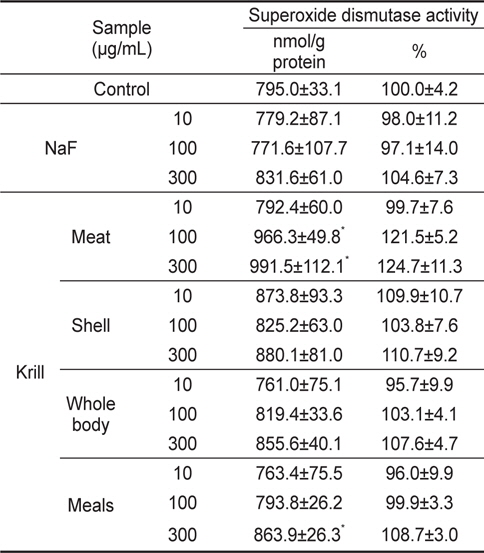
Superoxide dismutase activity of NaF and krill Euphausia superba fluoride extracts in HepG2 cells
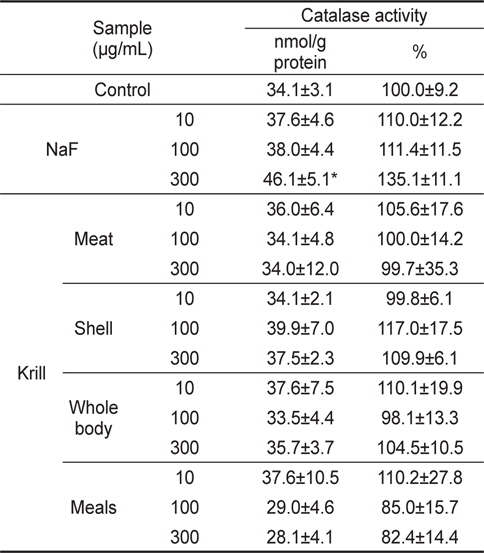
CAT는 지방의 자동산화 및 유기물의 산화로 생성된 H2O2를 물과 산소로 분해하여 지질 산화에 의한 세포손상을 방어하는데 작용하는 효소로서, CAT 활성 결과는 Table 6과 같다. CAT 활성은 NaF 처리군 300 μg/mL의 농도에서 유의적으로 활성이 증가되었다. 그러나 모든 KFE 처리군에서는 통계적으로 유의적인 활성 변화는 나타나지 않았다.
[Table 6.] Catalase activity of NaF and krill Euphausia superba fluoride extracts in HepG2 cells
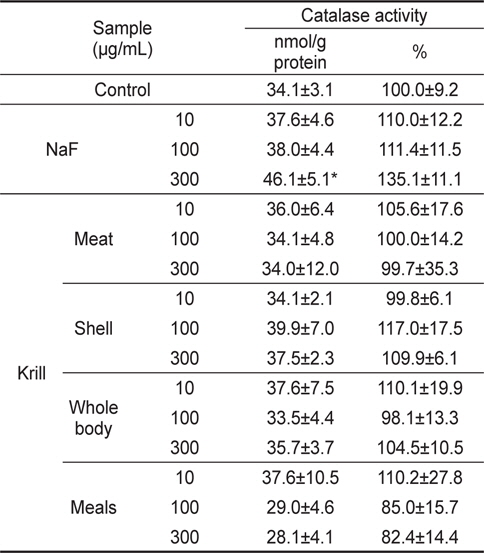
Catalase activity of NaF and krill Euphausia superba fluoride extracts in HepG2 cells
>
Glutathione peroxidase (GSH-Px) 활성
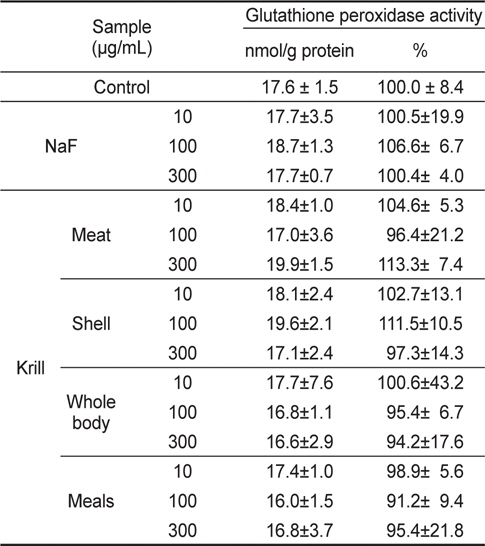
NaF와 KFE 처리군에 대한 GSH-Px의 활성을 측정한 결과 (Table 7), NaF 처리군은 대조군과 비교했을 때 활성 변화는 나타나지 않았으며, KFE의 모든 농도에서도 유의적인 활성 변화는 나타나지 않았다.
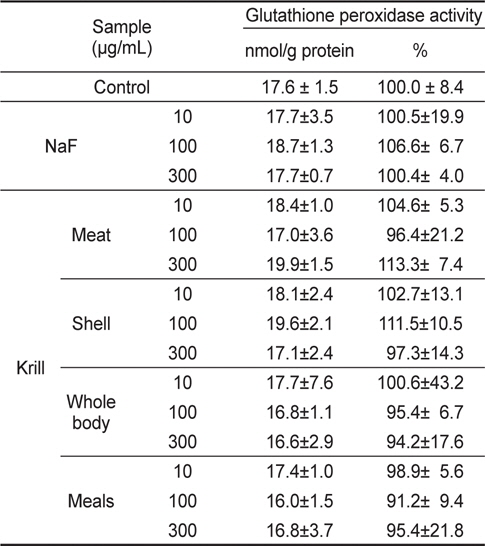
Glutathione peroxidase activity of NaF and krill Euphausia superba fluoride extracts in HepG2 cells
불소는 인체내에 흡수되어 혈액을 통해 체내로 이동을 하게되며, 간에서는 이러한 약물이나 독성물질을 무독화시키는 일련의 반응이 일어난다.(Whitford, 1996) 불소는 산화적 스트레스를 일으키는 활성 산소종과 항산화 효소계의 불균형을 초래하고, 관련 효소의 활성을 저해하여 생화학적 스트레스를 일으킨다(Basha and Sujitha, 2012). 그리고
본 연구 결과의 크릴 불소함량은 이미 보고된 크릴 불소 함량 (whole body 1,058±108 ppm, shell 2,594±661 ppm)과 유사한 결과를 나타내었으나,
본 연구 결과에서는 NaF는 고농도에서 세포독성을 나타내었으나, KFE 처리군에서는 NaF와 동일한 양의 불소로 처리하였음에도 불구하고, 독성은 나타나지 않았다. 수퍼옥시드 라디칼생성량은 NaF 처리군에서 100 μg/mL 이상의 고농도에서 유의적인 생성량 증가를 확인할 수 있었으나, KFE처리 모든 군에서는 수퍼옥시드 라디칼 생성이 증가되지 않았다. 히드록시라디칼 생성량은 NaF 처리군 뿐만 아니라 KFE 처리 모든 군에서 유의적인 증가는 없었다. 또한 SOD 활성에서는 NaF처리군의 경우 SOD 활성의 유의적 변화는 없었으나, krill meat와 krill meals 불소 추출물 처리군 중 일부 농도에서 효소 활성이 더 증가되는 것으로 나타났다. SOD의 활성은 불소가 길항적 저해제로 작용하여 활성을 저해한다고 알려져 있으며(Zhang et al., 2000), NaF에 노출된 랫트의 이하선에서는 SOD 활성, CAT 활성 및 지질과산화물 생성에 어떠한 영향도 미치지 않았으나, 악하선에서는 SOD 활성이 증가하다가 시간이 지남에 따라 감소하였으며 지질과산화물은 모두 증가한 것으로 나타났다 (Yamaguti, 2013). 악하선에서의 SOD 활성이 일시적으로 증가한 것과 같이, 본 실험에서도 SOD 활성이 증가하였는데 이것은 불소 독성을 제거하기 위한 적응의 일시적인 효과로 추정된다(Yamaguti, 2013).
SOD는 수퍼옥시드 라디칼을 H2O2와 O2로 전환시키는 작용을 하여, 산화적 스트레스에 대한 1차 방어 효소이며, CAT와 GSH-Px는 H2O2를 물로 전환되어 인체 내의 산화적 스트레스를 방어한다(Chinoy and Memon, 2001). 이러한 효소 활성 저 하는 산화적 스트레스를 유발하여 체내 조직의 손상을 일으키고, 각종 질병이 발생하게 되는데, KFE는 CAT와 GSH-Px 활성에 영향을 주지 않는 것으로 나타났다. 이러한 결과로부터 NaF는 단시간 처리에도 산화적 스트레스를 일으켜 수퍼옥시드 라디칼의 생성을 유도함으로써 세포독성을 유발하고 세포사멸을 일으키나, KFE는 NaF와 동량의 불소를 처리해도 세포 생존률이나 활성산소 생성량 및 항산화 효소 활성에 큰 영향을 미치지 않았고, 일부 추출물에서 SOD의 활성은 증가하였다. 또한 NaF를 투여한 쥐의 혈청내에서 지방산이 쥐 혈청내에서 NaF와 항산화제에 대한 말론디알데히드의 농도의 변화에 대한 연구(Ewa et al., 2009)에서 쥐에게 NaF를 함유한 용액을 투여하였을 때, 투여군의 지방산 산화는 미투여 대조군에 비해 1.57배 증가하는 것으로 나타났다. 그러나 항산화제인 비타민 C와E를 함께 투여하였을 때는 지방산 산화는 대조군과 거의 비슷하게 나타나, 산화적 스트레스가 억제되었음을 확인하였다. 한편 Guo 등도 비슷한 결과를 보고하고 있다(Guo et al., 2002). 이외에도 흑차 추출물이 NaF로 인해 생성된 지질 과산화에 미치는 영향을 연구한 결과, NaF를 투여했을 때 농도가 높을수록 뇌에서 지질 과산화물이 더 많이 생성되었으며, 항산화 효소인 CAT, SOD 및 GSH-Px의 효소활성은 감소하였다(Trivedi,a et al., 2011). 그리고 흑차 추출물을 동시에 투여했을 때 NaF를 투여하지 않은 대조군과 거의 비슷한 항산화 효소 활성을 보여주었다.
즉 간세포에 단시간 처리시 NaF는 간세포에 산화적 스트레스를 주지만, 크릴에서 추출한 불소 추출물의 경우 산화적 스트레스에 영향을 주지 않았다. 이러한 결과로 미루어 크릴 불소 추출물이 간세포의 산화적 스트레스에 큰 영향을 미치지 못하는 것은 크릴 불소 추출물에 함유된 다른 화합물들의 작용하는 것으로 판단된다. 크릴 불소 수용성 추출물의 성분에 대한 연구로 mycosporine-like amino acid의 항산화 효능에 관한 보고와 중성지방의 축적을 저해한다는 보고 외에 수용성 성분에 관한 연 구는 거의 없으나(Stuart et al., and Yamada et al.,2011), 크릴불소 구연산 추출물 내에 이러한 활성에 관여하는 물질로는 수 용성 비타민 및 아미노산이나 아미노산 유사물질들이 관여하는 것으로 여겨진다.