An ethanolic extract of
체내의 염증 반응은 외부로부터 침입한 병원성 물질이나 조직의 손상에 대한 방어작용으로 나타나는데, 이는 정상적인 조직의 구조와 기능을 회복하기 위해 필수적으로 일어나는 반응이다. 정상적인 염증반응은 시간이 지남에 따라 염증촉진성 매개체(pro-inflammatory mediators)의 생성은 감소되고, 항염증성 매개체(anti-inflammatory mediators)는 증가됨으로써 스스로 염증반응이 제한되는 조절과정을 가지고 있다(Lawrence et al., 2002). 그러나 이러한 염증반응 조절과정에 이상이 생기거나 최초 염증반응 유발원인이 완전히 제거되지 못하였을 경우 염증촉진성 매개체들은 과잉으로 지속적으로 생성되게 되고, 이 경우 만성적인 염증상태가 유지됨으로써 조직손상을 유발하는데 작용을 할 수 있다(Kaplanski et al., 2003). 동맥경화, 염증성 관절염 및 암, 그리고 노화 및 알쯔하이머병(Alzheimer’s disease, AD)를 포함하는 퇴행성 신경질환과 같은 질환들의 발병에 이러한 만성적인 염증반응이 관련되어 있는 것으로 알려져 있다(Libby, 2006; Packard and Libby, 2008; Schwab and McGeer, 2008; Solinas et al., 2010).
체내의 면역반응에 관여하는 세포 중 하나인 대식세포(macrophages)는 이러한 염증반응에 중요한 역할을 하고 있다. 대식세포는 interferon-γ (IFN-γ), interleukin (IL)-1β, IL-6, tumor necrosis factor-α (TNF-α)와 같은 염증촉진성 cytokines, 그리고 세균 세포막성분인 lipopolysaccharides (LPS) 등의 자극에 노출됨으로써 활성화된다(Xie et al., 1993). 활성화된 대식세포는 염증촉진성 cytokines 이외에 inducible nitric oxide synthase (iNOS) 및 cyclooxygenase-2 (COX-2)와 같은 효소의 발현을 통해 nitric oxide (NO) 및 prostaglandin E2 (PGE2)와 같은 다양한 염증매개체들을 생성하게 되고(Nathan, 1992; Zhang and Ghosh, 2000), 이들 매개체들의 과도하고도 지속적인 생성은 다양한 만성염증성 질환의 발병에 기여하고 있는 것으로 알려져 있다.
대식세포에 있어 염증성 cytokines 및 COX-2, iNOS와 같은 매개체들의 발현은 전사수준에서 주요 전사인자인 nuclear factor kappa-B (NF-κB)에 의해 조절된다(Baeuerle and Henkel, 1994). NF-κB는 dimer를 이루는 두 개의 subunit로 이루어져 있고 포유류에서 가장 일반적인 형태는 p50/65의 heterodimer이다. 자극이 없는 상태에서 NF-κB는 inhibitor of kappa B (IκB)와 결합한 상태로 불활성 형태로 세포질에 격리되어 있다(D’Acquisto et al., 1997; Makarov, 2001). 그러나 LPS와 같은 자극이 주어지는 경우 IκB는 IκB kinase에 의해 인산화되면서 떨어져 나와 분해되고, 유리된 NF-κB는 핵으로 이동하여 다양한 염증성 매개체와 같은 표적유전자의 발현을 유도하게 된다(Chen et al., 1995). 이러한 과정에 있어 IκB kinase의 활성화에는 extracellular signal-regulated kinase (ERK), c-Jun N-terminal kinase (JNK), p38 kinase를 포함하는 mitogen-activated protein kinases (MAPKs) 그리고 Akt와 같은 kinase에 의해 조절되는 것으로 알려져 있다(Marks-Konczalik et al., 1998; Zhang and Ghosh, 2000).
바다에 널리 자생하는 해조류는 비타민과 무기질이 다량 함유되어 있으며 식이섬유가 풍부하다. 그 중 갈조류는 엽록소와 갈색을 띄는 크산토필계 카로티노이드의 일종인 fucoxanthin과 fucoidan, alginic acid, laminarin 등의 다당류, fucosterol, polyphenol과 같은 다양한 생리활성 물질들을 가지고 있는 것으로 보고되었다(Hosokawa et al., 2004; Kim et al., 2012; Kim et al., 2013; Lee et al., 2003; Lee et al., 2004; Maeda et al., 2006; Park et al., 2010; Sachindra et al., 2007; Yan et al., 1999; Yoo et al., 2012; Zhang et al., 2013). 갈조류의 하나인 미역(
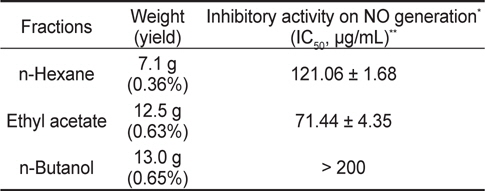
Inhibitory activity of various solvent fractions of Undaria pinnatifida ethanolic extract on nitric oxide (NO) generation in RAW 264.7 cells
부산 기장에서 채취한 미역의 건조분말 2 kg을 환류냉각기가 부착된 집기병에 담고 95% ethanol (EtOH, v/v) 4 L를 넣어 가열, 추출하고(50°C, 3시간) 추출액을 여과하여 rotary vacuum evaporator를 사용하여 농축하였다. 이를 3회 반복하여 총 178 g의 EtOH extract를 얻었다. 이를 H2O:EtOH (9:1, v/v)의 혼합 용매로 녹인 후 동량의 n-hexane을 넣어 분액깔대기에 평형화시켜 상층액의 n-hexane 가용부를 모아 sodium sulfate anhydrous로 처리한 다음 여과, 농축과정을 거쳐 n-hexane fraction을 얻었다. 이를 동일한 방법으로 ethyl acetate (EtOAc)로 추출하여 EtOAc extract (UPE) 12.5 g을 얻었다.
RAW 164.7 macrophage cells (ATCC, Rockville, MD, USA)는 10% fetal bovine serum (FBS)와 penicillin (100 units/ml), streptomycin sulfate (100 μg/mL)을 첨가한 Dulbecco’s modified Eagle’s medium (DMEM)을 사용하였고, 5% CO2, 37°C 배양기에서 배양하였다. Cell culture plate에 RAW 264.7 cell이 70-80% 정도 채워지면 phosphate-buffered saline (PBS)로 한번 씻어낸 후, 계대 배양하였다. UPE는 100% dimethyl sulfoxide (DMSO)에 녹여 사용하였고, 배양세포 처리 전에 배지에 희석하여 처리하였다.
RAW 264.7 cell을 96-well plate에 5×105 cells/well로 분주하고 37°C에서 24시간 동안 배양하였다. 이후에 UPE가 0, 25, 50, 100, 200 μg/mL 농도로 희석된 DMEM 배지로 교체하여 1시간 배양하였고, 이후에 LPS (1 μg/mL)를 함유한 DMEM 배지에 다시 24시간 배양하였다. 이후 CellTiter96ⓇAqueous 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium (MTS) 시험 키트(Promega, Madison, WI, USA)를 사용하여 제조사의 방법에 따라 세포 생존율을 분석하였다. MTS 용액은 FBS-free DMEM에 5% (v/v)의 농도로 섞어 100 μL씩 처리하였다. 1시간 후에 microplate reader (Glomax Multi Detection System, Promega, Madison, WI, USA)를 이용하여 490 nm의 파장에서 흡광도를 측정하였다.
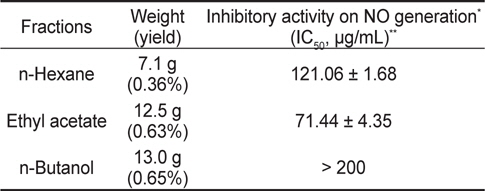
분리한 각 분획물들의 항염증효과 비교를 위해 RAW 264.7 세포에서의 NO 생성에 대한 억제효과를 분석하였다. 세포를 분획물들로 1시간동안 전처리 한 다음 LPS (1 μg/mL)로 24시간동안 자극하고, 그 배지를 원심분리(2,000×g, 4°C, 10분)하여 회수하였다. NO의 농도는 배지(100 μL)와 Griess 시약(0.1% naphthylethylene diamine dihydrochloride + 1% sulfanilamide + 5% phosphoric acid)을 동일한 비율로 반응시켜 microplate reader로 540 nm의 파장에서 흡광도를 측정하였다(Kim et al., 2009). 그 결과(Table 1), NO 생성에 대한 저해효능(IC50, ug/mL)이 가장 뛰어난 EtOAc 추출물(UPE)을 이후 연구에 사용하였다.
NO 생성 억제에 대한 농도별 UPE의 효과는 상기와 동일한 방법으로 분석하였다. 배지 중의 IL-1β, IL-6, TNF-α의 양은 enzyme-linked immunosorbent assay kit (ELISA, R&D Systems, Minneapolis, MN, USA)를 이용하여 제조사의 방법에 따라 측정하였다.
RAW 264.7 세포(1×106 cells/well)를 0, 25, 50, 100 μg/mL의 농도로 UPE를 1시간 동안 처리한 후, LPS 1 μg/mL의 농도로 6시간 동안 자극시켰다. 이후 Quiazol 시약(Quiagen Science, Valencia, CA, USA)을 이용하여 total RNA를 분리하였다(Kim et al., 2009). Total RNA로부터 reverse transcription-polymerase chain reaction (RT-PCR) 분석에 의한 iNOS mRNA 발현양의 분석은 이전의 보고(Kim et al., 2009)에서 사용한 방법을 이용하였고, 유전자 발현양의 상대적인 비교를 위해서 housekeeping gene인 glyceraldehye-3-phosphate dehydrogenase (GAPDH)를 함께 분석하였다. PCR 반응에 이용된 각각의 primer는 다음과 같다: iNOS sense, 5’-GCC TTC AAC ACC AAG GTT GTC TGC A-3’; iNOS antisense, 5’-GTC ATT GTA CTC TGA CTC TGA GGG CTG ACA C-3’; GAPDH sense, 5’-GAC CCC TTC ATT GAC CTC AA-3’; GAPDH antisense, 5’-CTT CTC CAT GGT GGT GAA GA-3’. 전기영동 상 band의 정량 분석은 cooled CCD camera system EZ-Capture Ⅱ (ATTO & Rise Co., Tokyo, Japan)과 CS analyzer ver. 3.00 software (ATTO)를 이용하여 최소 3번의 반복 실험을 통해 얻었다.
NF-κB의 활성화 정도를 분석하기 위해 UPE 및 LPS를 각각 처리한 RAW 264.7 세포로부터 세포질 및 핵 단백질 추출물을 각각 분리 제조하였다(Kim et al., 2009). 간략하게, 처리한 세포(2×106 cells/dish)를 PBS로 세척하여 회수하고, 180 μL의 hypotonic buffer [10 mM Tris-HCl, 10 mM NaCl, 3 mM MgCl2, 0.02% NaN3, 0.5 mM dithiothreitol (DTT), 1mM phenylmethanesulfonyl fluoride (PMSF), pH 7.4]를 넣고, 20 μL의 5% nonidet NP-40을 첨가하여 5분 동안 반응시켰다. 이후 원심분리(1,800×g, 4°C, 5분)한 후 상층액을 세포질 추출물로 이용하였다. 침전물은 hypotonic buffer로 한번 세척하고, hypertonic buffer [20 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid, 25% glycerol, 420 mM NaCl, 1.5 mM MgCl2, 0.2 mM ethylenediaminetetraacetic acid, 0.02% NaN3, 0.5 mM DTT, 1 mM PMSF, pH 7.4]를 넣고 1시간 동안 얼음 위에서 반응시킨 다음 원심분리(13,000×g, 4°C, 10분)하여 상층액을 회수하여 핵단백질 추출물로 이용하였다.
>
Western Blot 분석에 의한 단백질 양 분석
iNOS 단백질의 발현양, MAPK 및 Akt의 양과 인산화 정도는 세포를 UPE 및 LPS로 처리한 이후 whole cell lysate를 제조하여 시료로, NF-κB 및 IκB의 활성화 및 인산화 정도는 상기의 핵 및 세포질 추출물을 시료로 이용하였고, 단백질의 양은 이전의 보고(Kim et al., 2009)와 마찬가지로 sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) 이후 nitrocellulose membrane에 전이시켜 Western blot 방법으로 조사하였다. 검출된 band의 정량 분석은 mRNA 분석과 마찬가지로 cooled CCD camera system EZ-Capture Ⅱ와 CS analyzer ver. 3.00 software를 이용하여 최소 3번의 반복 실험을 통해 얻었고, 그 결과를 각 blot의 하단에 수치로 표기하였다. 그리고, Western blot 사용된 각각의 1차 항체들은 다음과 같다: iNOS (sc-650), β-actin (sc-47778), phospho-Akt (sc-4060), Akt (sc-1618), phospho-ERK (sc-7883), ERK (sc-94), phospho-JNK (sc-6254), JNK (sc-7345), NF-κB/p65 subunit (sc-8008), Poly(ADP-ribose) polymerase (PARP, sc-7150)는 Santa Cruz Biotechnology (Santa Cruz, CA, USA)에서 구입하였고, phospho-IκB-α (4814), IκB-α (9246), phospho-p38 (4511), p38 (9212)는 Cell Signaling Technology (Danvers, MD, USA)에서 각각 구입하였다. Horseradish peroxidase (HRP)가 conjugate되어 있는 각각의 2차 항체들[rabbit anti-goat IgG (LF-SA5004), goat anti-mouse IgG (LF-SA5001), goat anti-rabbit IgG (LF-SA5002)]은 AbFrontier (Seoul, Korea)에서 구입하였고, Enhanced chemiluminescence (ECL) detection kit은 GE Healthcare Bio-Science (Piscataway, NJ, USA)를 사용하였다. β-actin과 PARP는 각각 세포질과 핵의 control 단백질로서 분석에 포함시켰다.
RAW 264.7 세포를 glass coverslips (SPL Lifesciences Co., Gyeonggi-do, Korea) 위에 24시간 배양한 뒤, UPE로 1시간 전처리 하고, LPS (1 μg/mL)로 30분 자극시켰다. 세포를 4.0% paraformaldehyde가 첨가된 PBS로 실온에서 15분 동안 반응시켜 고정시키고, 0.5% Triton X-100이 첨가된 PBS를 넣어 10분 동안 반응시켰다. PBS로 세척한 뒤에 3% BSA/PBS를 넣고 30분 동안 blocking시킨 후, anti-NF-κB polyclonal antibody가 희석된 3% BSA/PBS를 넣어 2시간 동안 반응시켰다. 그 다음, Alexa FluorⓇ 488-conjugated secondary antibody (Invitrogen, Carlsbad, CA, USA)가 희석된 3% BSA/PBS를 넣고 1시간 동안 반응시킨 뒤, 2 μg/mL의 4,6-diamidino-2-phenylindole (DAPI)로 핵을 염색하고 LSM700 laser scanning confocal microscope (Carl Zeiss, Oberkochen, Germany)로 관찰하였다.
>
NF-κB Promoter/Luciferase assay
RAW 264.7 세포(2×105 cells/well)가 들어있는 24-well plate의 각 well에 1 μg의 pNF-κB firefly luciferase DNA와 20 ng의 pRL-TK renilla luciferase DNA를 lipofectamine/plus reagent Invitrogen, Carlsbad, CA, USA)와 함께 처리하여 40시간 동안 transfection시켰다. 그 다음, UPE를 1시간 전처리하고, LPS (1 μg/mL)로 6시간 자극시켰다. 이후 PBS로 세척하고 100 μL의 lysis buffer (0.5 mM HEPES, pH 7.8, 1% Triton N-101, 1 mM CaCl2, and 1 mM MgCl2)로 lysate를 만들고, luciferase assay kit를 사용하여 firefly luciferase activity와 renilla luciferase activity를 측정하였다. Renilla luciferase의 발현은 지속적으로 일어나는 반면, firefly luciferase는 NF-κB에 의해서만 발현이 되므로 세포 수에 의한 오차를 보정할 수 있다.
본 연구의 모든 실험은 세 번 이상 반복하였으며, 얻어진 결과들을 평균값과 표준편차(mean±SD)를 계산하여 나타내었다. 실험군 간의 유의성 검증은 Student’s t-test로 검증하였다.
>
LPS로 유도되는 NO 생성 및 iNOS 발현에 대한 UPE의 억제 효과
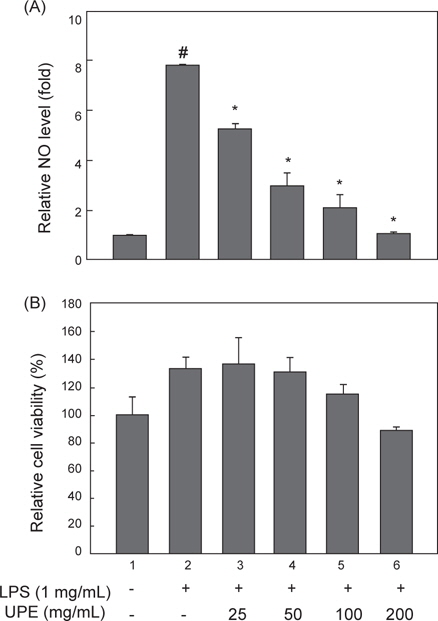
LPS로 자극된 RAW 2645.7 대식세포에서 생성되는 NO에 대한 UPE의 억제효과를 알아보기 위해서 세포를 다양한 농도 (0-200 μg/mL)의 UPE로 1시간 전처리하고, LPS로 24시간 자극하여 상층의 배지로 방출되는 nitrite 생성량을 측정하여 NO 생성량을 분석하였다. LPS 처리에 의해 NO 생성량이 무처리군과 비교하여 7.6배로 급격하게 증가하는 것을 알 수 있고 (Fig. 1A,
이러한 NO 생성의 억제효과는 UPE에 의한 세포독성으로 RAW 264.7 세포가 사멸되는 것에 의해서도 나타날 수 있으므로, 이러한 가능성을 배제하고자 동일한 UPE 처리 조건하에서 세포생존율의 변화를 MTS assay로 분석하였다. Fig. 1B에 나타내었듯이 세포의 생존율은 UPE 처리에 의해 뚜렷한 변화가 없었다. 이러한 세포독성 실험결과에서 UPE처리에 의한 NO 생성의 억제효과는 세포독성에 의한 것이 아니라는 것을 확인할 수 있었다.
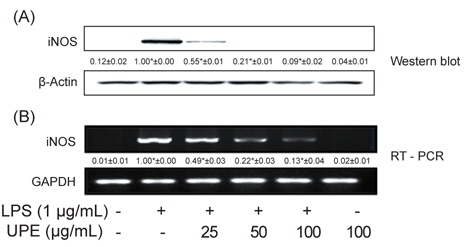
다음은 NO를 생성하는 효소인 iNOS의 발현에 대한 UPE의 효과를 알아보고자 하였다. 전술과 같이 RAW 264.7 세포에 UPE를 0-100 μg/mL의 농도로 전처리한 이후 LPS로 자극하였고, 이후 total RNA 및 cell lysate를 분리하여 각각 iNOS의 유전자 및 단백질을 발현수준을 분석하였다. 그림 2B에 나타내었듯이 iNOS mRNA 발현양은 LPS 처리에 의해 현저하게 높게 유도되는 것을 알 수 있었고(
NO는 NOS에 의해 L-arginine으로부터 생성된다. iNOS는 세균의 endotoxin 및 염증성 cytokines에 의해 강하게 유도된다(Guha and Mackman, 2001). 병리학적인 조건 하에서 iNOS에 의한 NO의 현저한 증가는 다른 염증성 매개체들과 함께 과도한 염증을 유발하게 되고 조직의 손상을 유발하는 것으로 알려져 있어 염증성 손상의 주요 매개체이다(Nathan, 1992; Pan et al., 2011). 따라서 이러한 NO의 생성과 iNOS의 발현 및 활성을 억제할 수 있는 화합물은 항염증 물질로 이용될 수 있을 것이다. 본 결과에서 UPE에 의한 NO 생성의 억제는 iNOS의 발현이 낮아지는 것에 의한 것임을 나타낸다.
>
LPS로 유도되는 염증성 Cytokines의 생성에 대한 UPE의 억제효과
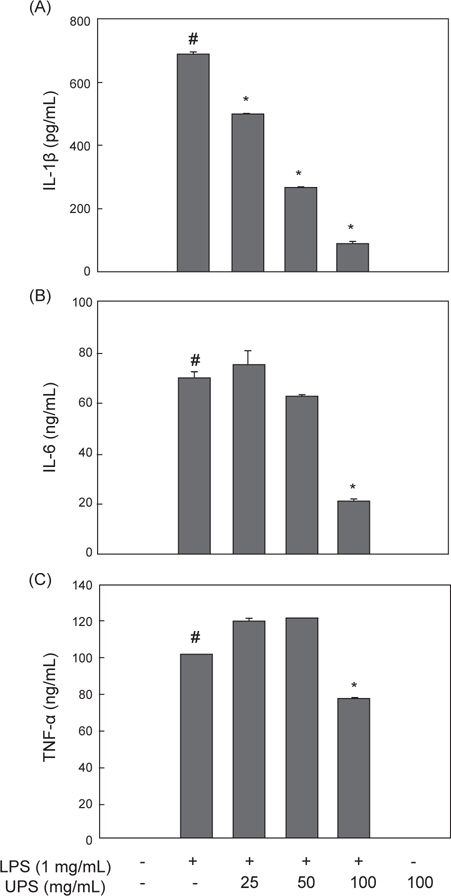
LPS로 자극된 RAW 2645.7 세포에서 생성되는 염증촉진성 cytokines의 생성에 대한 UPE의 효과를 ELISA 방법으로 분석하였다. LPS 자극에 의해 IL-1β, IL-6, TNF-α와 같은 cytokines의 생성량은 크게 증가하는 것으로 나타났고(Fig. 3A, B, and C,
이들의 염증촉진성 cytokines들은 체내에서 다양한 면역 및 염증반응을 조절하는 역할을 한다. 세균의 LPS에 의해 자극된 대식되는 TNF-α를 생성하고 분비된 TNF-α 및 LPS는 IL-1β와 IL-6의 생성을 유도하게 된다(Beutler and Ceramin, 1989). TNF-α는 패혈성 쇼크, 염증, 세포상해성 등의 다양한 생리학적 과정에 관여하고 있다(Dinarello, 1999). IL-1β는 대식세포에서 생성되는 주요 염증촉진성 cytokine으로서, 세균 감염에 대한 염증성 응답의 개시 및 강화에 중요한 cytokine이다(Lebovic et al., 2000). IL-6도 대식세포에서 생성되는 중요한 염증촉진성 cytokine으로서 급성 면역응답에 작용한다(Yoshimura, 2006). 본 연구에서 관찰된 결과는 UPE가 LPS-자극에 의해 유도되는 IL-1β, IL-6, TNF-α의 생성을 억제시키는 것으로 나타났고, 이는 UPE가 LPS-자극에 의한 염증성 응답의 초기 단계를 억제하고 있음을 의미한다.
>
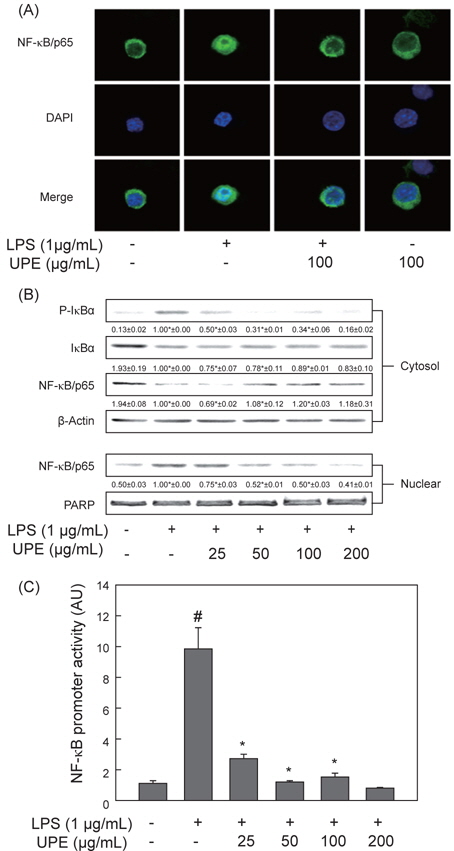
LPS로 유도되는 NF-κB의 활성화에 대한 UPE의 억제 효과
앞에서 서술하였듯이 여러 염증촉진성 cytokines 및 iNOS의 발현은 전사수준에 주요 전사인자인 NF-κB에 의해 조절된다(Baeuerle and Henkel, 1994). 따라서 LPS로 자극한 RAW 264.7 세포에서 NF-κB의 활성화 변화에 이에 대한 UPE의 처리 효과를 분석하였다. 먼저 면역형광법으로 염색을 하고 confocal microscopy로 분석한 결과를 Fig. 4A에 나타내었다. 아무런 자극이 가해지지 않은 상태에서 NF-κB/p65 subunit (녹색)는 DAPI로 염색된 핵(청색) 주변에 대부분 분포하는 것이 관찰되지만, LPS로 자극한 경우 녹색인 NF-κB p65의 대부분은 청색인 핵과 함께 분포하는 것으로 나타났고 이는 NF-κB가 활성화되어 핵으로 이동했음을 보여주는 결과이다. 이러한 세포에 UPE (100 μg/mL)를 전처리한 경우 NF-κB p65는 다시 핵 주변의 세포질에 대부분 분포하는 것으로 관찰되었고, 이는 UPE에 의해 NF-κB의 활성화가 현저하게 억제되고 있음을 보여주는 결과이다(Fig. 4A).
NF-κB의 활성화에 따른 핵으로의 이동은 이를 억제하는 단백질인 IκB-α의 인산화에 의한 분해에 의한 것이다(Chen et al., 1995). 따라서 세포질 및 핵 추출물에서 NF-κB 및 IκB-α의 양 및 인산화 정도를 항체를 이용한 Western blot 방법으로 분석하였다. Fig. 4B에 나타낸 것과 같이, 세포질 내에 존재하는 NF-κB의 양은 LPS 자극에 의해 현저하게 줄어드는 반면, 핵 추출물에서는 그 양이 증가하는 것으로 관찰되었다(
다음은 LPS로 자극된 대식세포주에 있어 NF-κB의 promoter activity에 대한 UPE의 효과를 분석하고자 하였다. 이를 위해 RAW 264.7 세포에 NF-κB promoter를 가진 luciferase construct를 일시적으로 transfection하고, 이 세포를 다양한 농도의 UPE로 2시간 전처리 하고 이어서 LPS로 6시간동안 자극하였다. Fig. 4C에 나타내었듯이 luciferase 활성은 LPS 자극에 의해 현저하게 증가하였으며, 이는 LPS 자극에 의해 활성화된 NF-κB가 NF-κB의 promoter를 가진 luciferase의 발현을 크게 증가시켰음을 의미한다. 이에 대한 UPE의 억제효과는 25 μg/mL의 낮은 농도뿐만 아니라 50-100 μg/mL 농도에 이르기까지 유의적인 것으로 나타났다. 이들 결과는 대식세포주에서 LPS 자극에 의해 유도되는 NF-κB의 활성화가 UPE에 의해 효과적으로 억제되고 있음을 보여주고 있고, 이는 UPE에 의한 상기의 염증성 cytokines 및 iNOS의 발현 억제는 NF-κB 활성화 경로에 의해 조절되고 있음을 의미하는 것이다.
>
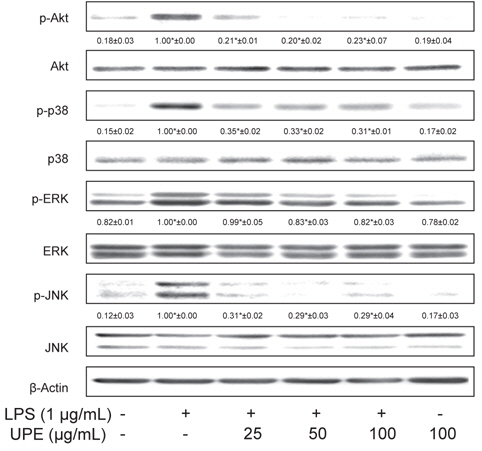
LPS로 유도되는 MAPKs와 Akt의 활성화에 대한 UPE의 억제 효과
LPS 자극에 의해 IκB-α는 IκB-α kinase에 의해 인산화되어 분해되고 결과적으로 NF-κB는 핵으로 이동하여 염증성 매개체와 같은 표적유전자의 발현을 유도하게 된다(Chen et al., 1995). 이러한 IκB-α kinase의 활성화에 관여하는 MAPKs와 Akt의 인산화 정도를 Western blot 방법으로 조사하였고 그 양을 인산화되지 않은 형태의 양과 비교하여 정량분석하였다. Fig. 5에 나타내었듯이 각 kinase들의 활성화된 형태인 p-Akt, p-p38, p-ERK, p-JNK는 LPS 자극에 의해 모두 현저하게 그 양이 증가하는 것으로 관찰되었고(
NF-κB의 활성은 MAPKs나 Akt와 같은 다양한 세포내의 kinase들에 의해 조절되고(Chen et al., 1995). MAPKs는 다양한 세포 신호 전달 과정에 관여한다. 많은 연구들에서 p38, JNK, ERK와 같은 MAPKs가 설치류의 대식세포에서 LPS에 인한 NF-κB의 활성화에 중요한 역할을 한다고 밝히고 있다(Guha and Mackman, 2001). 그리고 Akt 또한 NF-κB의 활성화를 포함하여 여러 염증 유전자의 발현을 조절하는 것으로 알려져 있다(Sizemore et al., 1999). 본 연구의 결과에서 LPS 자극에 의해 유도되는 NF-κB의 활성화에 대한 UPE의 억제효과는 MAPKs 및 Akt와 같은 kinase의 인산화 과정과 관련되어 있음을 나타낸다.
앞서 설명한 것처럼 갈조류에서 분리한 fucoxanthin이나 fucoidan, fucosterol과 같은 화합물들의 생리활성에 대해 활발한 연구가 진행되고 있다. Fucoxanthin의 경우 항산화 효능(Sachindra et al., 2007; Yan et al., 1999)과 항암 효능(Hosokawa et al., 2004), 항비만 효능(Maeda et al., 2006)과 같은 생리활성 기능을 갖는 것으로 알려져 있다. 다당류인 fucoidan은 항암 효능(Zhang et al., 2013), 항비만 효능(Kim et al., 2013)을 가지는 것으로 알려져 있고, fucosterol은 항산화 효능(Lee et al., 2003), 항당뇨 효능(Lee et al., 2004)이 보고되어 있다. 특히 미역의 에탄올추출물에서 항당뇨 효능(Park et al., 2010)이 보고되었고, 메탄올추출물(Khan et al., 2008) 및 미역에서 분리한 fucoidan (Kim et al., 2012)과 fucosterol (Yoo et al., 2012)의 경우 항염증 효능이 있는 것으로 확인되었다. 본 실험에 사용한 UPE에 이들 화합물이 유효성분으로 포함되어 있는지, 또는 이외의 화합물에 의해 항염증활성이 나타나는가에 대해서는 이후의 연구가 필요하다.
이상의 결과에서, LPS로 자극한 RAW 264.7 세포에 있어 NO와 같은 염증성 매개체뿐만 아니라 염증촉진성 cytokines의 생성 및 발현이 UPE에 의해 억제된다는 것을 증명하였다. 이러한 UPE의 억제효과는 IκB의 분해를 저해함으로써 NF-κB 경로를 불활성화시키는 것과 연관되어 있는 것으로 나타났다. 또한 UPE는 NF-κB 활성화의 상위 신호전달 경로인 MAPKs 및 Akt에도 영향을 미치는 것으로 확인되었다. 여러 만성염증성 질환에 과도한 염증성 매개체들의 발현 및 생성이 중요한 병인적 역할을 하고 있음을 고려했을 때, 우리들의 결과는 UPE가 항염증 효능을 가진 기능성식품의 소재로 이용될 수 있다는 가능성을 제시하고 있다. 향후 UPE의 항염증 효과를 나타내는 유효화합물의 분리.동정 및 활성분석에 대한 향후 연구가 진행되어야 할 것으로 판단된다.