To prevent paralytic shellfish poisoning (PSP) due to the consumption of shellfish contaminated with PSP toxins, the quantitative analysis of these toxins is very crucial. The AOAC International mouse bioassay (MBA) has been used widely for the routine monitoring of PSP toxins for more than 50 years. However, this method has low sensitivity and high limit of quantification (LOQ) and interferences from other components in the extract, and it cannot determine toxic profiles. Ethical problems also exist with the continued use of this live mouse assay. To establish an alternative method to the MBA used for PSP toxins analysis, we attempted to optimize the analysis conditions of a precolumn high-performance liquid chromatography (HPLC) oxidation method and succeeded in validating its accuracy and precision in quantifying PSP toxins. A clear peak and the isolation of PSP toxins were obtained by injecting the working standards of Certified Reference Materials using HPLC. The LOQ of the precolumn HPLC oxidation method for PSP toxins was about 0.1002 μg/g, which represented an approximately fourfold improvement in detection capability versus the AOAC MBA. The intra-accuracy and precision for PSP toxins in oysters were 77.0-103.3% and 2.0-5.7%, respectively, while the respective inter-accuracy and precision were 77.3-100.7% and 2.4-6.0%. The mean recoveries of PSP toxins from oysters were 75.2-112.1%. The results of a comparison study showed good correlation between the results of the precolumn HPLC oxidation method and those of MBA, with a correlation factor of 0.9291 for mussels. The precolumn HPLC oxidation method may be used as an alternative to, or supplementary method with, MBA to monitor the occurrence of PSP toxins and to analyze the profiles of these toxins in shellfish.
패류는 지역에 따라 특정한 시기에 식중독을 유발하는 패류독소를 함유하는 경우가 있으며, 이들 패류독소 중에는 중독시 마비를 유발하는 마비성패류독소(paralytic shellfish poison, PSP), 설사를 유발하는 설사성패류독소(diarrhetic shellfish poison, DSP) 및 아자스피르산(azaspir acid), 신경계 장해를 유발하는 기억상실성패류독소(amnesic shellfish poison, ASP) 및 신경성패류독소(neurotoxic shellfish poison, NSP) 등이 대표적이며, 이 외에도 다수의 유독성분이 알려지고 있다(Mons et al., 1998; Noguchi, 2003; Silvert and Rao, 1992; Toyofuku, 2006).
마비성패류독소는 Alexandrium sp., Gymnodinium sp., Pyrodinium sp. 등 편모조류에 속하는 식물성 플랑크톤이 생산하는 독소이며, 독소가 축적된 패류를 사람이 섭취하여 중독되면 마비를 유발하게 된다(Hall et al., 1990; Kim et al., 1996). 패류독소라는 명칭이 붙여진 것은 독소를 생성하는 원인생물이 밝혀지기 전에 이매패류에서 주로 검출되었기 때문이다. 그리고, 마비성패류독소는 단일 성분으로 되어 있는 것이 아니라 약 20종의 유독성분의 복합체로 구성되어 있다(Oshima, 1995; Thomas et al., 2006).
최근 마비성패류독소는 세계 여러 나라에서 발생하고 있고, 우리나라에서도 마비성패류독소에 의한 식중독 사고가 보고된 바 있으며(Chang et al., 1987; Lee et al., 1997), 남해안의 진해만 연안에서는 매년 주기적으로 마비성패류독소가 검출되고 있다(Chang et al., 1989; Park et al., 2000; Shon et al., 2009).
이에 따라 우리나라는 미국, 일본, 캐나다 및 유럽 등 세계 여러 나라와 더불어 마비성패류독소로 인한 식중독 예방을 위하여 마비성패류독소의 허용기준치를 80 μg /100 g으로 설정하여 관리하고 있다(Chang et al., 1987; Determan, 2003; Noguchi, 2003; Rourke et al., 2008; Toyofuku, 2006; Wekell et al., 2004). 또한 세계 여러 나라에서는 연안 패류 중의 마비성패류 독소 농도 및 해수 중의 원인플랑크톤을 주기적으로 모니터링하여 마비성패류독소 관리에 활용하고 있다(Rodríguez et al., 1990; Takata et al., 2008; Sayfritz et al., 2008; Wekell et al., 2004).
마비성패류독소 분석법은 전세계적으로 마우스를 사용한 동물시험법을 채택하여 사용하고 있으며, 이는 AOAC방법(AOAC, 2005)에 기초하여 패류에서 0.1 N HCl로 독소를 추출하여 마우스로 정량하는 방법이다. 이 시험법의 검출한계는 약 40 μg STX eq/100 g으로 알려져 있으며(Hall, 1991), 높은 검출한계에도 불구하고 시료 중 총 독소량 분석에는 신뢰성 있는 방법으로 약 50 년간 지속적으로 이용되어 오고 있다(Park et al., 1986). 그러나 최근 시험동물의 사용을 억제하거나 금지하고자 하는 여론이 확산되고 있으며, 독성 프로파일에 대한 정보를 얻을 수 없는 단점이 부각되고 있다(Balls et al., 1995; Hess et al., 2006; Mons et al., 1998). 이에 동물시험법의 사용범위 축소나 배제를 위한 대체 기기분석법 개발이 필요한 실정이다.
지금까지 동물시험법을 대체하기 위하여 bioassay (Louzao et al., 2003; Manger et al., 2003), electrophoresis (Thibault et al., 1991), chemosensor (Gawley et al., 2002) 및 immunoassay(Usleber et al., 2001; Jellet et al., 2002)를 포함한 다양한 분석법들이 검토되었으며, HPLC를 이용한 기기분석법은 상당히 연구가 진척되어 동물시험법을 대체할 가장 합리적인 방법으로 인식되고 있다(Asp et al., 2004; Franco and Fernández-Vila, 1993; Lawrence and Niedzwiadek, 2001; Lawrence et al., 2005; Oshima, 1995; Thomas et al., 2006).
본 연구에서는 우리나라 시료특성에 적합한 마비성패류독소 동물시험법의 대체 기기분석법을 확립하기 위하여 HPLC를 이용한 precolumn oxidation 시험방법의 선행연구를 검토하여 최적의 분석조건을 확립하였다. 또한 동 HPLC 시험법에 대한 유효성 확인 및 동물시험법과의 비교를 실시하여 실제 현장에서 마비성패류독소 모니터링을 위하여 사용될 수 있는지 그 타당성을 검토하고자 하였다.
HPLC에 의한 마비성패류독소 분석을 위한 표준물질은 인증표준물질(Certified Reference Material, CRM)인 STX, dc-STX, NEO, GTX 1&&4, GTX 2&3, GTX 5 (B-1), dcGTX 2&3 및 C 1&2 등을 NRC (National Reference Council, Halifax, Canada)에서 구입하여 사용하였고, 동물시험을 위한 표준물질인 saxitoxin (STX)은 미국 FDA에서 직접 분양을 받아 사용하였다.
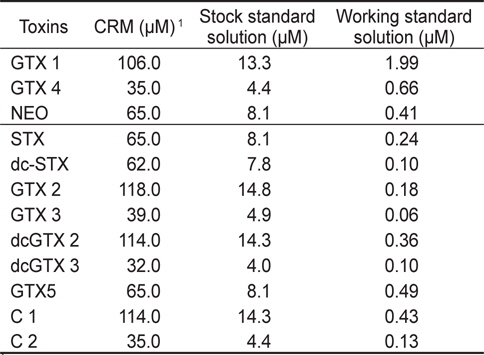
HPLC법 유효성 검정을 위해서는 인증표준물질을 사용하여 stock solution과 working solution을 조제하여 사용하였다. 즉, stock solution은 표준용액 0.5 mL를 탈이온수로 8배로 희석하여 최종 4 mL가 되도록 희석하여 제조하였다. 그리고 working solution은 stock solution을 저장하면서 분석할 때 Table 1과 같이 희석하여 사용하였다. 이때, 혼합 표준용액은 oxidation반응에 따라 두 그룹으로 나누어서 사용하였으며, 첫 번째 그룹(Mix 1, periodate oxidation)은 GTX 1&4, NEO로 구성되며, 두 번째 그룹(Mix 2, peroxide oxidation)은 STX, dcSTX, GTX 2&3, dcGTX 2&3, GTX 5 (B-1), C 1&2로 구성되었다.
[Table 1.] Concentrations of stock and working standard solutions
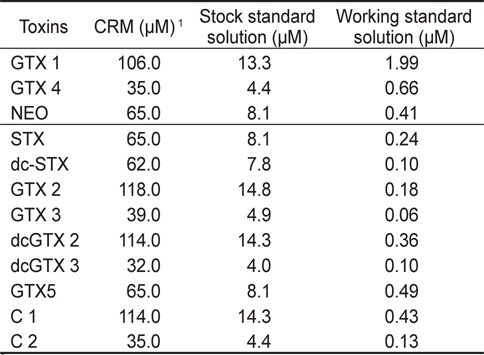
Concentrations of stock and working standard solutions
시험에 사용된 모든 시약은 analytical 또는 LC grade를 사용하였으며, 마비성패류독소 추출용매로는 hydrochloric acid(Merck, Darmstadt, Germany) 및 sodium hydroxide(Sigma, St. Louis, MO, USA)을 사용하였다. Oxidation 반응 및 SPE C18 cartridge (3 mL, Supelco, USA) 정제에 사용된 시약인 ammonium formate는 Fluka (Buchs, Germany) 제품, sodium hydroxide와 periodic acid는 Sigma (St. Louis, MO, USA) 제품, 그리고 sodium phosphate, hydrogen peroxide, acetic acid 및 methanol 은 Merck (Darmstadt, Germany) 제품을 각각 사용하였다. 이때, Oxidation 반응에 사용된 periodate oxidant는 0.03 M periodic acid, 0.3 M ammonium formate 및 0.3 M sodium phosphate (Na2HPO4)를 각각 5 mL씩 첨가하여 혼합한 다음 0.2 M sodium hydroxide (NaOH)로 pH 8.2로 조정하여 사용하였다. 이동상 제조에는 ammonium formate (Fluka, Buchs, Germany), acetonitrile (Merck, Darmstadt, Germany) 및 acetic acid (Merck, Darmstadt, Germany)를 사용하였으며, 탈이온수는 Milli-Q system (Millipore, Bedford, MA, USA)에서 18Ω resistance 또는 동등 순도로 정제하여 사용하였다.
실험에 사용된 패류시료는 경남 진해만 연안에서 생산되는 진주담치(Mytilus edulis) 및 굴(Crassostrea gigas)를 직접 채취하여 사용하였다. 채취한 패류시료는 패각의 외부를 수도수로 깨끗이 세척하고, 패각을 탈각한 후 물기를 제거한 패육을 균질화하여 사용하였다.
패류 시료로부터 마비성패류독소 추출시 추출물에 존재하는 염소이온의 양을 감소시키기 위하여 동물시험법(Mouse bioassay, AOAC, 2005)을 조금 수정하였다. 즉, 50 mL 비이커에 균질화한 패류시료 10 g을 넣고, 0.1 N HCl을 10 mL 첨가하여 10분간 가열 추출한 후 냉장고에 5분 동안 냉각하였다. 추출액을 4,500 rpm (3,600g)에서 10분간 원심분리하여 상층액을 50mL 메스실린더에 넣는다. 비어커를 7 mL 증류수로 씻어 고형물이 남아있는 원심관에 붓고 혼합한 후 재차 동일한 방법으로 원심분리하였다. 그리고 상층액은 같은 메스실린더에 붓고, 증류수로 정확히 20 mL가 되도록 정용한 것을 시료 추출액으로 하였다.
SPE C18 cartridge (3 mL, Supelco, USA)를 미리 6 mL 메탄올과 6 mL 증류수로 활성화시킨 다음, 시료 추출액 1 mL를 첨가하여 2-3 mL/min로 흘려 5 mL conical tube에 받았다. 그리고 2 mL 증류수로 씻어 동일 conical tube에 받아 1 M NaOH로 pH 6.5로 조정한 후 4 mL가 되도록 증류수로 정용하였다. 이 용출액은 periodate 및 peroxide oxidation한 후에 HPLC로 분석하였다. 또한 용출액 중에 잔존하고 있는 현광물질 등 유사물질의 유무를 알아보기 위하여 용출액에 periodate oxidant 대신에 증류수를 첨가하여 대조구로서 HPLC로 분석하였다.
Periodate oxidation (Mix 1)은 1.5 mL vial에 matrix modifier 용액(마비성패류독소가 없는 굴 시료를 동일한 전처리로 처리한 용액)을 100 μL 넣고 표준용액(working solution) 또는 SPE C18로 정제한 용액을 각각 100 μL를 첨가하였다. 또한 미리 준비한 500 μL periodate oxidant를 첨가하여 잘 혼합하고, 실온에서 1분간 반응시켰다. 그리고 5 μL acetic acid를 넣어 혼합하고, 실온에서 10분간 방치한 후 50 μL를 HPLC에 주입하였다.
Peroxide oxidation (Mix 2)은 1.5 mL vial에 1 M NaOH 용액 250 μL를 넣고, 10% H2O2를 25 μL 첨가하여 혼합하였다. 그리고 표준용액(working solution) 또는 SPE C18 정제한 용액을 각각 100 μL를 첨가하고, 실온에서 2분간 반응시켰다. 그리고 20 μL acetic acid를 첨가하여 혼합한 후 25 μL 를 HPLC에 주입하였다.
HPLC를 이용한 마비성패류독소 동시분석을 위한 최적 HPLC 분석조건은 Table 2와 같다. 분석장비는 Themo Electron사(San Jose, CA, USA )의 HPLC system (Finnigan Surveyor Plus)과 Fluorescence detector (Finnigan Surveyor FL Plus Detector)를 사용하였고, 칼럼은 Supelcosil C-18 (15 cm×4.6 mm id, 5 μm, Supelco, USA)를 사용하였다. 이동상으로 A 용액은 0.1 M ammonium formate를, B 용액은 A 용액에 acetonitrile (MeCN)를 5% 되도록 첨가하여 사용하였으며, 두 이동상 모두 0.1 M acetic acid 6 mL를 가하여 pH 6으로 조정하여 0.2 μm membrane filter (Nylon, Millipore, USA)로 여과하여 사용하였다. 그리고 A 용액과 B 용액을 gradient하여 분석하였으며, 즉 B 용액을 0 → 10% 되도록 5분간, 10 → 70%되도록 6분간, 70 → 0% 되도록 2분간 흘린 후 다음 시료 주입까지 3분간 유지하였다. 이때, 칼럼오븐 온도는 35℃로 조정하였으며, 유속은 1.3 mL/min으로 하였다.
[Table 2.] HPLC conditions for analysis of PSP toxins

HPLC conditions for analysis of PSP toxins
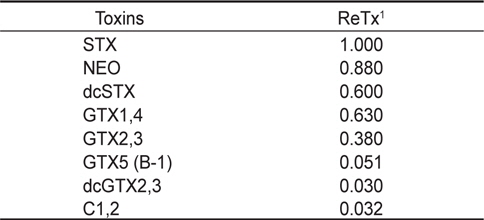
HPLC 분석에 의한 독력계산은 single point calibration을 사용하여 peak 면적을 측정하였으며 Table 3에 제시된 독소 성분 별 saxitoxin 상대독성을 고려하여 개별 독소성분의 기여도를 합하여 시료 중 총 독소농도를 계산하고 μg STX eq/g으로 표시하였다.
[Table 3.] Relative toxicity of paralytic shellfish toxins for Precolumn oxidation using HPLC
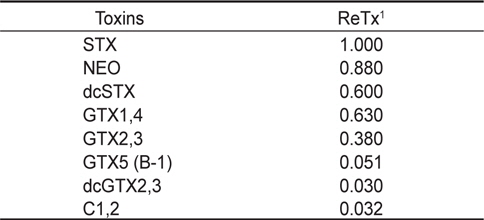
Relative toxicity of paralytic shellfish toxins for Precolumn oxidation using HPLC
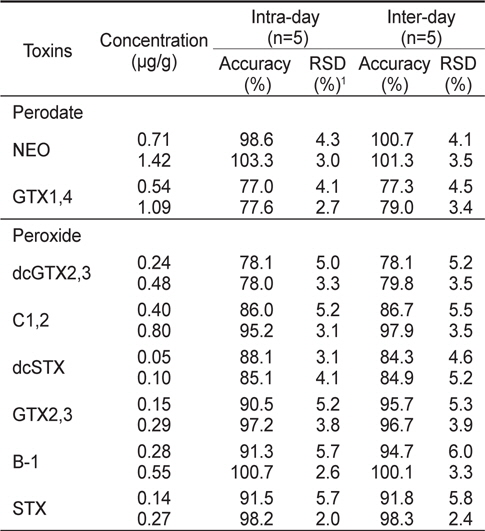
HPLC 분석법의 유효성 시험을 위하여 최적의 분석조건에서 직선성, 검출한계, 정량한계, 정확성, 정밀성, 회수율 등을 검토하였다. 우선 마비성패류독소 표준물질들의 직선성을 알아보기 위하여 표준물질을 Mix 1과 2로 나누어, 각 Mix를 5개의 농도범위로 제조하여 oxidation시킨 후 HPLC로 분석하였다. 패류(굴) 중에서의 마비성패류독소 표준물질의 검출한계(LOD; limit of detection)는 신호대 잡음비(S/N)가 > 3으로 하였으며, 정량한계(LOQ; limit of quantification)는 LOD×3일 때의 농도로 구하였다. 본 분석법의 정확성(accuracy)와 정밀성(precision)을 확인하기 위하여 패류(굴) 중 표준물질을 각 2가지 농도로 첨가하여 제조한 것을 사용하여 일내(intra-day) 및 일간(inter-day) 반복시험을 1일 5회 및 3일간(1일 5회) 반복 측정하여 평가하였다.
동물시험법을 이용한 패류의 마비성패류독소 함량은 AOAC 방법 준하여 정량하였다(AOAC, 2005). 패육 약 100-150 g을 취하여 2분간 균질화한 다음 균질화된 시료 100 g에 0.1 N HCl 100 mL 첨가하여 5분간 가열한 후 실온으로 냉각하였다. 추출액을 pH 2.0-4.0가 되도록 조정하여 200 mL로 정용한 후 3,000rpm에서 5분간 원심분리하여 상층액을 시료 추출액으로 사용하였다. 그리고 시료 추출액을 3 마리의 mouse 복강에 각각 1mL 주입하고 사망여부를 확인하여 독력을 계산하였다. 이때 실험동물은 체중 18-21 g의 ICR (Institute Cancer Research)계 mouse 수컷을 사용하였다.
>
HPLC에 의한 Precolumn oxidation 법의 유효성 검정
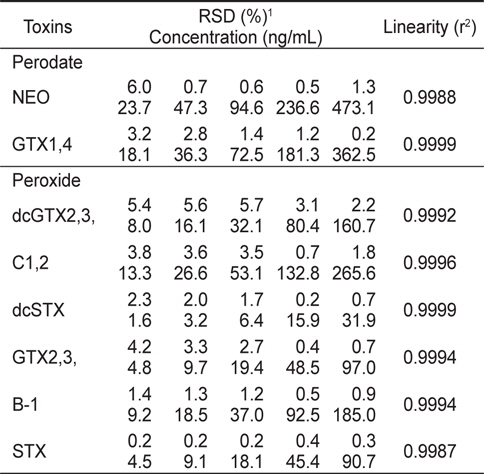
확립된 HPLC 분석법의 검정하고자 우선 마비성패류독소 표준물질들의 직선성을 알아보기 위하여 표준물질을 Mix 1과 2로 나누어, 각 Mix를 5개의 농도범위로 제조하여 oxidation시킨 후 HPLC로 분석하였다. 각 표준물질당 3개씩 반복 분석한 결과 모든 표준물질은 각 농도범위에서 PSP 독소성분을 용이하게 검출할 수 있었고, 상관관계(r2)가 0.99이상으로 각 농도범위에서 매우 양호한 직선성을 나타내었다(Table 4).
[Table 4.] Linearity for the working standard of PSP toxins by Precolumn oxidation using HPLC
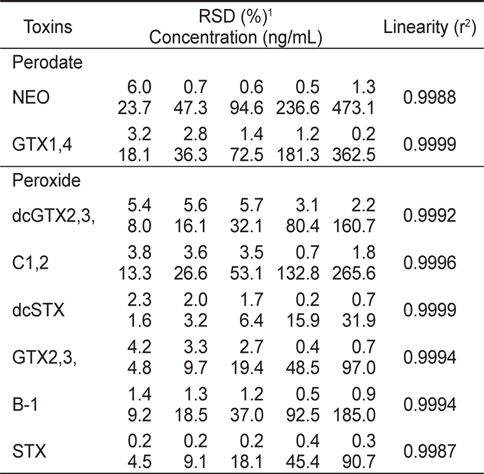
Linearity for the working standard of PSP toxins by Precolumn oxidation using HPLC
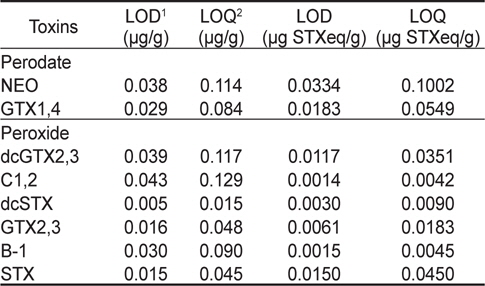
패류(굴) 중에서 마비성패류독소 성분의 검출한계(LOD)와 정량한계(LOQ)의 경우 NEO는 0.038과 0.114 μg/g, GTX 1&4는 0.029와 0.084 μg/g, dcGTX 2&3은 0.039와 0.117 μg/g, C 1&2는 0.043과 0.129 μg/g, dcSTX는 0.005와 0.015 μg/g, GTX 2&3은 0.016과 0.048 μg/g, B-1은 0.030과 0.090 μg/g, STX는 0.015와 0.045 μg/g 이었다(Table 5). 또한, PSP 개별 독소의 비독성을 고려하여 보정한 검출한계와 정량한계는 μg STX eq/g으로 표기하였다(Table 5). 실제 마비성패류독소가 발생하는 시기에 채취된 현장시료에서는 다양한 독소성분이 검출되며, 발생 시기 및 장소에 따라 각 성분의 함량 및 구성비도 차이가 있다(Lawrence et al., 1995; Park et al., 2000; Shon et al., 2009). 이에 실제 현장시료의 독력분석에 있어서는 독소구성성분 중 가장 높은 정량한계치(비독성 보정치)가 총독소량 검출에 있어서 정량한계가 된다. 굴을 매트릭스로 이용한 시험에서 나타난 정량한계 최고치는 NEO의 0.1002 μg STX eq/g이다. 즉 정량한계가 더 낮은 다른 독소성분이 검출되더라도 이독소가 정량한계 이하로 존재하는 경우 검출되지 않아 총 독소량이 과소평가될 수 있다. 이를 감안하여 이 시험에서 얻어진 실제 검출한계와 정량한계는 각각 약 0.0334 및 0.1002 μg STX eq/g이라고 할 수 있다. 이는 동물시험법의 분석능력을 기준으로 정량한계를 약 4배 정도 향상시킨 것에 해당된다.
[Table 5.] LOD and LOQ of PSP toxins in oyster (n=5) by precolumn oxidation using HPLC
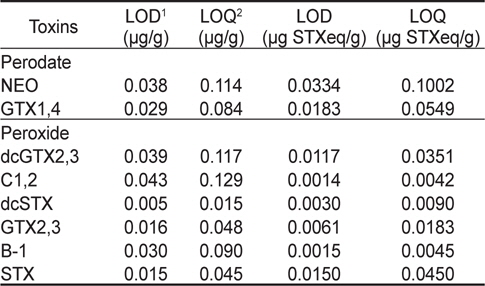
LOD and LOQ of PSP toxins in oyster (n=5) by precolumn oxidation using HPLC
패류(굴) 중에서의 본 분석법의 일내 및 일간 정확성과 정밀성를 알아보기 위하여 표준물질을 Mix 1과 2로 나누어 제조하여 oxidation시킨 후 HPLC로 분석하였다. 분석법의 일내(intraday) 정확성 및 정밀성은 각각 77.0-103.3%의 정확성과 2.0-5.7%의 정밀성을 나타내었다(Table 6). 일간(inter-day) 정확성 및 정밀성의 경우는 3일간 반복하여 구하였으며, 각각 77.3-100.7%의 정확성과 2.4-6.0%의 정밀성을 나타내었다(Table 6). AOAC 시험법 검증 가이드라인(AOAC, 2002)에서는 시료에 첨가한 표준물질의 농도가 0.01 μg/g에서는 70-120%, 1.0 μg /g에서는 75-120% 및 10 μg/g에서는 80-115%의 정확성을 요구하고 있으며, 본 시험 방법은 이에 부합되는 것으로 확인되었다. 또한 AOAC (2002)에서는 반복 시험에서 나타난 정밀성(RSD)은 시료에 첨가한 표준물질의 농도가 0.01 μg/g에서는 15%, 1.0 μg /g에서는 8% 및 10 μg/g에서는 6%보다 낮은 정밀성을 요구하고 있으며, 본 시험에서는 이에 부합하여 정밀성은 양호한 것을 알 수 있었다.
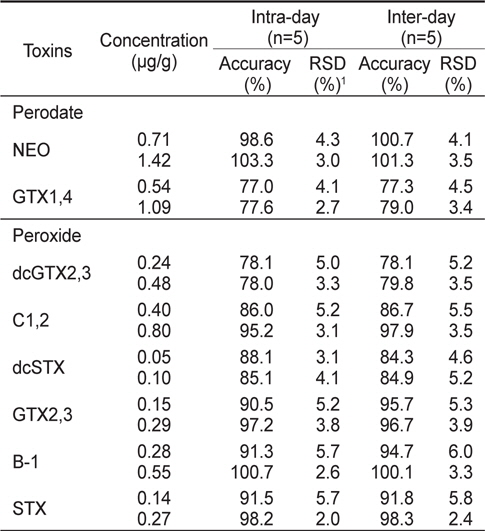
Intra-day and inter-day accuracy and precision for PSP toxins by precolumn oxidation using HPLC
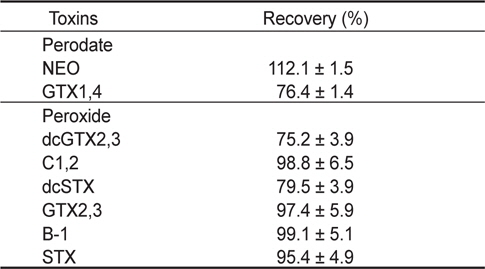
패류(굴) 중에서의 PSP 표준물질의 회수율을 알아보기 위하여 표준물질을 Mix 1과 2로 나누어, 각 Mix를 0.10-1.42 μg/g가 되도록 제조하여 oxidation시킨 후 HPLC로 분석하였다. 굴 중에서 모든 표준물질의 회수율은 75.2-112.1%로 나타났으며(Table 7), 이 결과는 Rourke et al. (2008)의 HPLC에 의한 precolumn oxidation법을 이용한 진주담치 중에서 회수율(76-112%)과 유사하였다. AOAC (2002)에서는 시료에 첨가한 표준물질의 농도가 0.01 μg/g에서는 70-120%, 1.0 μg/g에서는 75-120% 및 10 μg/g에서는 80-115%의 회수율을 요구하고 있으며, 본 시험 방법은 이에 부합되는 것으로 확인되었다.
[Table 7.] Recovery of PSP toxins in oyster (n=5) by precolumn oxidation using HPLC
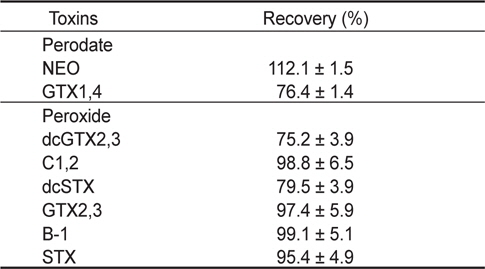
Recovery of PSP toxins in oyster (n=5) by precolumn oxidation using HPLC
따라서 최적분석 조건에서 HPLC 분석법의 유효성 확인을 위하여 실시한 선택성, 직선성, 정확성, 정밀성 및 회수율 등은 모두 양호한 결과를 나타내어 패류 중에서 마비성패류독소 검출을 위하여 유용할 것으로 판단된다.
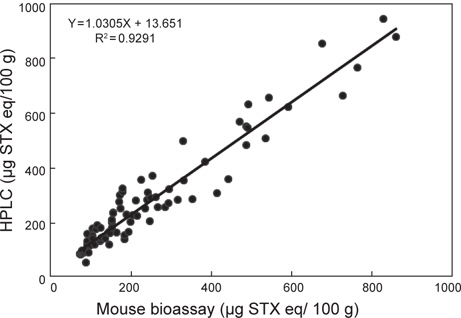
본 연구에서 확립된 HPLC 분석법과 동물시험법의 동등성을 확인하여 대체 시험법으로 활용가능성을 타진하기 위하여 두시험법 간의 비교시험을 수행하였다. 2009년 3월부터 6월까지 경남 진해만 연안에서 채취한 진주담치 중의 동물시험법에서 마비성패류독소가 허용기준치(80 μg/100 g)를 초과한 시료 96점에 대하여 실시하였다. 두 시험법을 사용하여 비교시험 실시한 결과, Y = 1.0305X + 13.651 (R2 = 0.9291)로 높은 상관관계를 나타내었다(Fig. 1). 이 결과는 Lawrence et al. (1995)의 바닷가재에서 두 시험법 간의 상관계수(0.90) 및 Rourke et al.(2008)의 패류에서 post-column oxidation법과 동물시험법의 상관계수(0.86) 보다는 다소 높았다.
인간에 대한 잠재적 위해를 고려할 때 패류 중 마비성패류독소 검출을 위해서는 신속하고 감도와 특이성이 높은 분석법이 요구된다. 현재 국제적으로 사용되고 있는 마비성패류독소 모니터링 프로그램의 근간은 마우스를 사용한 동물시험법(mouse bioassy)이다. 동물시험법은 시료의 총 독소함량을 측정하는데 매우 합리적인 시험법이라는 것은 공인된 사실이나(Park et al., 1986), 낮은 검출한계와 독 조성을 알 수 없다는 단점은 물론 동물을 분석시험에 사용하지 못하도록 하자는 국제적 압력이 높아지고 있어 대체 기기분석 시험법이 요구된다(Balls et al., 1995; Hall, 1991; Hess et al., 2006; Mons et al., 1998). HPLC 분석법과 같은 기기분석법은 동물시험법에서 방해물질로 작용하는 carbamate와 같은 신경독소, 유기인계 살충제 및 시료 중의 높은 염 농도 등에 영향을 받지 않아 false positive 결과를 배제할 수 있는 특이성을 가지고 있다(Schantz et al., 1958; Van de Riet et al., 2009). 본 연구에서 확립된 HPLC를 이용한 마비성패류독소 분석법은 국제적으로 제기되고 있는 실험동물 사용억제 노력에 부응할 수 있을 뿐만 아니라 시료 중에서 동물시험법으로 알 수 없는 마비성패류독소 구성성분을 밝힐 수 있는 장점을 가지고 있다. 또한, 마비성패류독소의 원인 플랑크톤과 패류 중 독소 구성성분의 비교하여 패류 종류별 독소축적 양상과 독성 프로파일을 밝히고, 나아가 우리나라 마비성패류독소 관리 및 평가를 위한 분석법으로 활용될 수 있을 것이라 판단된다.