This paper reviews current status of weed control practices in herbicide-resistant crops to examine weed management strategies in cope with cropping herbicide-resistant crops in the near future. Herbicide-resistant crops were rapidly adopted weed management technologies due to broad-spectrum weed control without crop injury. Transgenic glyphosate-resistant cultivars in soybean, corn, canola, and cotton were adopted to manage weeds at lower cost in a simplified weed management system. Dual stack crops with glyphosate and glufosinate resistance were developed to control glyphosate resistant weeds in corn, soybean and cotton. New multiple herbicide-resistant crops with resistance to glyphosate and glufosinate, acetolactate synthase (ALS) inhibitors, synthetic auxin herbicides, 4-hydroxyphenyl pyruvate dioxygenase (HPPD) inhibitors or acetyl Coenzyme A carboxylase (ACCase) inhibitors will expended the utility of existing herbicide technologies to manage the evolution of resistant weeds. However, herbicide resistant crops alone cannot solve weed problems and thus studies on diverse weed managements using an array of alternating herbicides of mode of action, mechanical, and cultural practices are needed for integrated weed management systems in the future.
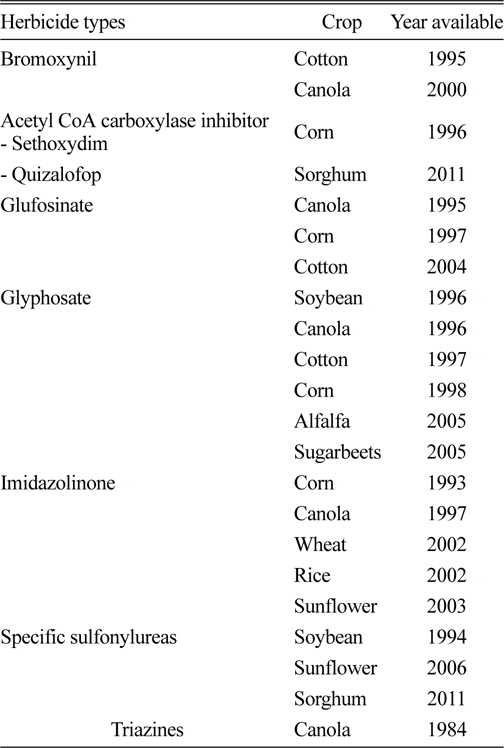
제초제 저항성작물은 Table 1에서 보는 바와 같이 bromoxynil이 1995년에 개발된 이래 ACCase 저해형 제초제, glufosinate, glyphosate, imidazolinones, sulfonylureas 및 triazine 제초제에 대한 저항성을 나타내는 작물들이 상업적으로 개발되었다(Duke, 2005).
[Table 1.] Commercial herbicide-resistant crops in North America (Duke, 2005).
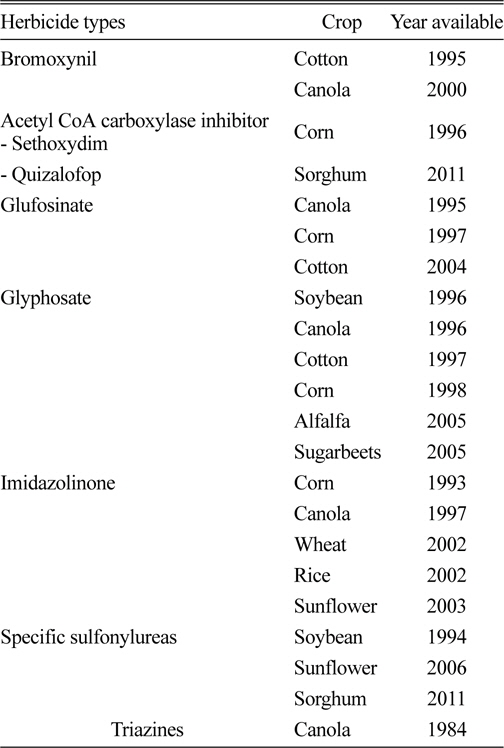
Commercial herbicide-resistant crops in North America (Duke, 2005).
제초제 저항성작물을 개발하는 방법은 첫 번째로 목표 효소의 민감도를 변형하여 제초제에 대한 식물의 민감도를 저해하는 방법과 두 번째는 제초제 무독성화 경로를 식물에 도입하는 방법이다(Simoens and Van Montagu, 1995). 첫 번째 시도는 glyphosate와 acifluorfen 저항성이다. Glyphosate 제초제는 광범위한 살초스펙트럼을 갖는 비선택성 제초제로서 5-enol pyruvyl shikimate-3-phosphate(EPSP) synthase를 저해하여 살초작용을 나타내지만 작물을 고사시키기 때문에 작물의 안전성을 증대하는 방향으로 개발되었다. Glyphosate 저항성 콩은 glyphosate 저항성 클론 cp4 EPSPS를 콩에 삽입시켜 개발되었으며, 면화, 옥수수, 캐놀라, 알팔파, 벤트그라스(
두 번째 시도는 glufosinate와 bromoxynil 저항성으로, 이들의 제초활성 물질이 작물에서 무독성인 물질로 전환하는 제초제 대사를 증진하는 유전자의 도입에 의하여 이루어졌다(Haumann, 1997). 제초제 Ignite/Basta의 경우, glufosinate 저항성작물은 phosphinothricin N-acetyltransferase (PAT)에 의한 glufosinate의 불활성화 반응을 이용하여 개발되었으며,
Glufosinate 저항성 캐놀라는 31%를 차지하여 제초제 저항성작물 시장에서 적은 이익을 얻었지만 glufosinate 저항성 면화에서 glufosinate는 glyphosate 저항성잡초의 발생으로 인하여 glyphosate보다 잡초방제 효과가 높기 때문에 미국 텍사스에서는 높은 비율로 채택되어 사용되고 있다(Sankula, 2006). Glufosinate는 잡초방제 효과가 뛰어나며, 저항성잡초의 출현빈도가 현저히 낮기 때문에 glufosinate 저항성작물의 재배면적이 증가되어 왔으며, 앞으로 그 중요성이 더욱 높아질 것으로 판단된다.
광엽잡초에 대한 방제효과가 있는 합성옥신 제초제인 dicamba는 dicamba monooxygenase(DMO)에 의해 불활성화된다. 이 효소를 암호화하는 유전자는 토양세균의 크로닝으로부터 얻었으며, dicamba 저항성 콩을 육성하는데 사용되었다(Herman et al., 2005). 2,4-D와 기타 옥신형 제초제 저항성작물은 세균의 aryloxyalkanenoate dioxygenase(AAD) 유전자에 의하여 개발되었으며, 화본과잡초에 방제효과를 나타내는 triclopyr와 fluroxypyr 저항성작물은 AAD-12 유전자에 의하여 개발되었다(Wright et al., 2010).
효소 4-hydroxyphenyl pyruvate dioxygenase (HPPD) 저해형 제초제는 triketones, isoxazoles, callistemones 등이며, Syngenta와 Bayer CropScience는 2011년에 HPPD 저항성콩을 공동 개발하였으며, 이 형질전환 콩은 곧 상업화될 것이다(Syngenta, 2012).
Protoporphrinogen oxidase (PPO) 저해형 제초제 저항성 옥수수는 애기장대로부터 PPO 유전자와 PPO-1에서 점 돌연변이를 이용하여 얻었으며, 벼에서
제초제 목표 단백질의 암호화 내생 유전자에서 돌연변이 유도물질로 유도된 돌연변이로부터 비형질전환방법으로 제초제 저항성작물을 개발할 수 있었으며, imidazolinone 저항성작물은 ALS효소에서 돌연변이 유발물질 유도변이의 선발을 통하여 개발되었다(Tan et al., 2005).
Imidazolinone 저항성 밀은 1992년에 돌연변이 유발에 의하여 품종(Clearfield)이 처음으로 육성되었고(Newhouse, 1992), 2007년에는 단일유전자를 가진 AGS CL7 품종이 육성되었다(Johnson, 2010). Imidazolinone 저항성 벼는 1993년에 종자돌연변이 유발에 의하여 비형질전환방법으로 개발되었으며(Croughan, 1994), imazethapyr는 벼에서 파종전 혹은 발아 전 토양처리제와 경엽처리제로 개발되어 사용되고 있다.
Triazine 저항성 유채는 triazine 감수성 유채에 triazine 저항성잡초 생태형의 세포질을 이입하여 개발되었다(Beversdorf and Kott, 1987). Acetyl CoA carboxylase(ACCase) 저해형 제초제 저항성작물은 조직배양 선발을 이용하여 생성된 변형 ACCase로부터 sethoxydim 저항성 옥수수를 처음 개발하였으며(Somers, 1996), 두 번째로 수수는 상업화의 최종단계에 있다.
Glyphosate 제초제는 높은 효능으로 다양한 잡초를 쉽고, 간단하며, 저렴하게 방제할 수 있었지만 다양한 잡초 관리체계에서도 영원히 지속되지 못하였다. Glyphosate 저항성작물의 재배 확대는 glyphosate 사용이 증가됨에 따라 잡초군락의 변화와 잡초의 저항성을 유도하여 농가 포장에서 glyphosate 저항성잡초인 망초(
광범위한 면적에 glyphosate를 반복적으로 처리함에 따라 잡초에 전례가 없는 선발압이 부여되었고, 결국 glyphosate 저항성잡초가 광범하게 발현되게 유도하였다. Glyphosate 저항성 콩이 도입된 후 3년 만에 망초에서 저항성이 발견되었으며, 이후
최근에
미국 농민의 조사결과, 잡초군락의 변화는 인지하고 있지만 잡초군락에 대한 선발압과 제초제저항성 발현에 대한 이해가 부족하였다(Owen, 2008). 그 결과로 농민들은 과거 10년간 glyphosate 저항성작물에서 glyphosate 이외의 잡초방제법을 선택을 하지 않았기 때문에 glyphosate 저항성잡초는 급격하게 증가하였다. 오늘날 23종의 잡초에서 glyphosate 저항성이 발견되었으며, 우려는 점점 높아지고 있다(Heap, 2012).
Glufosinate는 주요한 glyphosate 저항성잡초를 포함하여 많은 광엽잡초와 화본과 잡초에 제초효과를 나타내며, 아직까지 glufosinate 저항성잡초는 발견된 바 없다.
현재 작물생산체계의 지속성에서 가장 큰 위험성은 제초제 다중저항성잡초, 특히 glyphosate와 다른 작용기작 제초제에 저항성을 나타내는 잡초의 빠른 증가를 들 수 있다. 현재 50 초종 이상의 잡초가 여러 제초제 작용기작에 다중저항성을 나타내며, 적어도 8 초종의 glyphosate 저항성잡초는 4종 혹은 그 이상의 제초제에 저항성을 나타내고 있다(Tranel et al., 2012).
미국에서 glyphosate 저항성 콩과 캐놀라가 1996년, 면화는 1997년, 그리고 옥수수는 1999년에 도입되기 시작하면서 glyphosate 사용방법은 변경되었는데, glyphosate 작물에 약해를 입히지 않으면서 발생된 잡초방제를 가능하게 하였다. Glyphosate 저항성작물의 재배로 glyphosate는 새로운 제초제 사용방법으로 사용되었고, 대부분 농민은 glyphosate 저항성 콩을 광범한 지역에 매년 사용하여 2009년에 재배된 경작면적은 91%이고, glyphosate 저항성 옥수수 경작면적은 68%이었다(Reddy and Norsworthy, 2010). Glyphosate 제초제는 현재 glyphosate 저항성 콩, 면화, 캐놀라, 옥수수에서 선택성 경엽처리제로 잡초방제에 사용되고 있다.
Glyphosate 저항성품종이 도입되기 전에는 농가 포장에서 다양한 잡초를 방제하기 위하여 여러 제초제를 혼합하여 사용하여왔다. 그러나 glyphosate가 대부분의 화본과잡초와 광엽잡초를 방제할 수 있고, 농민은 단지 하나의 제초제에만 의존하여 사용하는 단순성과 저렴한 제초비용때문에 glyphosate 저항성 품종이 콩, 캐놀라, 면화 제초제 시장으로 급속하게 침투된 이후 콩밭에서의 잡초방제는 단순하게 수행되었다(Russnogle, 1998).
Glyphosate 저항성 콩 재배에서 농민은 콩 파종 전에 경운 혹은 glyphosate를 처리하여 잡초를 제거하며 이 후 잡초가 30 cm까지 생장하기 전에 1-2회 경엽처리에 의하여 고랑에 있는 잡초를 방제하는 것으로 토양처리용 제초제의 사용을 권장하지 않았다(Monsanto, 1999). Glyphosate 처리시기를 콩 파종 후 4-6주까지 지연하여 처리하면 작물과의 경합에 의해 잡초발생이 억제되기 때문에 glyphosate의 잔효성 부족을 보상할 수 있으며, glyphosate 저항성 콩에서 잡초방제의 30% 효과는 작물경합에 기인한다(Shaner, 2000). 그러나 glyphosate를 너무 일찍 처리하면 제초제 처리 후 추가적인 잡초의 발생으로 수량 감소가 초래된다.
제초제저항성 콩에서 일반적인 제초제 처리 추천방법은 파종 전 기존에 발생된 잡초를 제거하기 위하여 glyphosate를 경엽처리한 다음 glyphosate를 1회 혹은 2회 살포하는 방법이며(Sartorato et al., 2011), 1회 처리는 비용이 적게들고, 선발압 경감효과가 있다. 그러나 glyphosate 저항성 콩재배에서 방제가 잘 안 되는 잡초를 대상으로 할 경우에는 cloransulam + flumioxazin 혹은 metolachlor + fomesafen 토양처리 후 glyphosate를 체계처리(sequential application)함으로써 돼지풀을 96% 방제하였고, 명아주와
Dicamba 저항성 콩에서 glyphosate + dicamba를 토양처리한 후 glyphosate + dicamba 제초제를 1회 처리한 체계처리는 glyphosate 저항성잡초인 돼지풀류(
한편, glyphosate 저항성 콩에서 ALS 저해형 제초제는 광범위한 제초효과 때문에 가장 많이 사용되었으나 처리면적은 급격하게 감소하여 1993년에 86%에서 1998년에 43%로 줄어들었으며, dinitroanilines, acetyl CoA carboxylase 저해형 제초제 및 protoporphyrinogen oxidase 저해형 제초제의 사용량도 감소하였다(Shaner, 2000). 이런 결과로 미국 콩 재배면적의 10%에서 사용된 제초제 유효성분의 수는 1995년에 11종에서 2002년에는 glyphosate 한 종류로 감소하였다(USDA, 2004). 단기간적으로는 이와 같은 제초제 사용방식의 변화는 계속되겠지만 장기적인 면에서는 glyphosate 저항성작물의 연작 혹은 윤작의 경우 잡초를 방제하기 위하여 주로 glyphosate에 의존하기 때문에 저항성잡초가 우점하는 방향으로 잡초군락이 변화될 것이다(Shaner, 2000). 따라서 이와 같은 군락변화의 결과, 다른 제초제가 이들 잡초를 방제하는데 필요하게 될 것이다.
Glyphosate 저항성 옥수수가 glyphosate 저항성 콩과 같 이 광범하게 수용된다면 glyphosate는 미국의 광대한 지역에 여러 해 동안 처리될 수 있는 주된 제초제가 될 것이다. Glyphosate 저항성 옥수수 밭에 발생하는 잡초의 방제방법은 glyphosate 경엽처리와 함께 acetochlor 혹은 acetochlor + atrazine을 체계처리하는 방법을 추천하였다(Anon, 1998). Glyphosate와 acetochlor 혹은 acetochlor + atrazine 체계처리는 glyphosate에 대한 저항성 발현을 지연시키는데 도움이 되겠지만 이 체계처리는 어저귀(
면화에서는 glyphosate 사용량은 크게 증가되었으나, 카로티노이드 생합성과 광합성 저해 제초제 사용량은 감소되었고 dinitroanilines 제초제는 약간 감소하였다. 면화 재배 농민은 잔효성이 있는 pendimethalin과 fluometuron을 선택하였다(Riar et al., 2011).
Imidazolinone 저항성 벼에서 사용되는 제초제인 imazethapyr는 토양 및 경엽처리에서 넓은 살초효과가 있는 ALS 저해형 제초제이다(Croughan, 1994). Imazethapyr 저항성 벼에서 발생하는 잡초성 벼, 피,
밀 재배에서 이탈리안라이그라스(
또한 glyphosate 저항성작물 재배는 glyphosate를 선택성 제초제로 사용할 수 있게 함으로써 조기 파종, 무경운과 같은 재배적 장점과 함께 잡초방제를 쉽고, 경제적이며, 효과적으로 만들었다.
Glufosinate 저항성작물은 상업적으로 개발되었지만 glufosinate의 높은 가격과 처리시기의 제한 때문에 성공적으로 재배되지는 못하였다. 그러나
한편, 제초제의 다양성이 적고, glyphosate 선발압이 매우 강한 지역에서는 glyphosate 저항성잡초 군락이 형성되므로 glyphosate 저항성작물이 재배된 지역에서 glyphosate 저항성잡초는 중대한 위협이 되고 있다. 이런 지역에서 현행 방제법이 지속된다면 glyphosate 저항성잡초는 가장 큰 문제가 될 것이다. Gardner et al. (1998)은 제초제 저항성 잡초의 발현을 지연시키는 전략으로 제초제 처리수준의 고농도와 저농도의 교호처리, 다른 작용기작을 가진 제초제의 교호사용 혹은 제초제 혼합사용을 제시하였다.
따라서 glyphosate를 지속적으로 사용하려면 이들 농업 생태계에서 다양성의 재도입 혹은 유지가 중요하다. 제초제의 교호사용, 체계처리, 여러 작용기작 제초제와 비선택성 제초제와 같은 잡초방제 수단은 다양성과 관련이 있다(Neve et al., 2004). Sammons et al.(2007) 보고에 의하면 glyphosate와 여러 다른 제초제의 이상적인 처리농도와의 혼합처리는 매우 효과적이며, 추가적으로 제초제저항성 유전자들을 가진 복합형질 변형작물의 개발은 glyphosate 저항성잡초의 방제에 매우 중요한 역할을 할 것이다(Green, 2007).
잡초관리 전략은 제초제, 경운, 유전자변형 형질 등을 종합적으로 활용할 수 있고, 작용기작이 다른 대체 제초제 사용과 경운은 glyphosate 저항성 옥수수와 면화에서 대규모로 사용되고 있다. Glyphosate 저항성 콩에서는 작용기작이 다른 제초제 사용 또는 무경운 재배가 포함되며, 대부분의 면적은 옥수수와 윤작하면 잡초관리 다양성이 확보될 것이다.
현재 개발전략 추세는 glyphosate 저항성 콩, 옥수수와 면화에서 작용기작이 다른 제초제 사용을 포함시키고 있다. 왜냐하면 잡초관리체계에서 다른 작용기작 제초제는 잡초군락 변화와 잡초의 저항성에 가장 효과적인 수단이며, 또한 옥수수에서 발아 전 처리 제초제는 glyphosate와 함께 사용될 때 많은 농민은 glyphosate 저항성작물에 대한 만족도가 높기 때문이다(Dill et al., 2008).
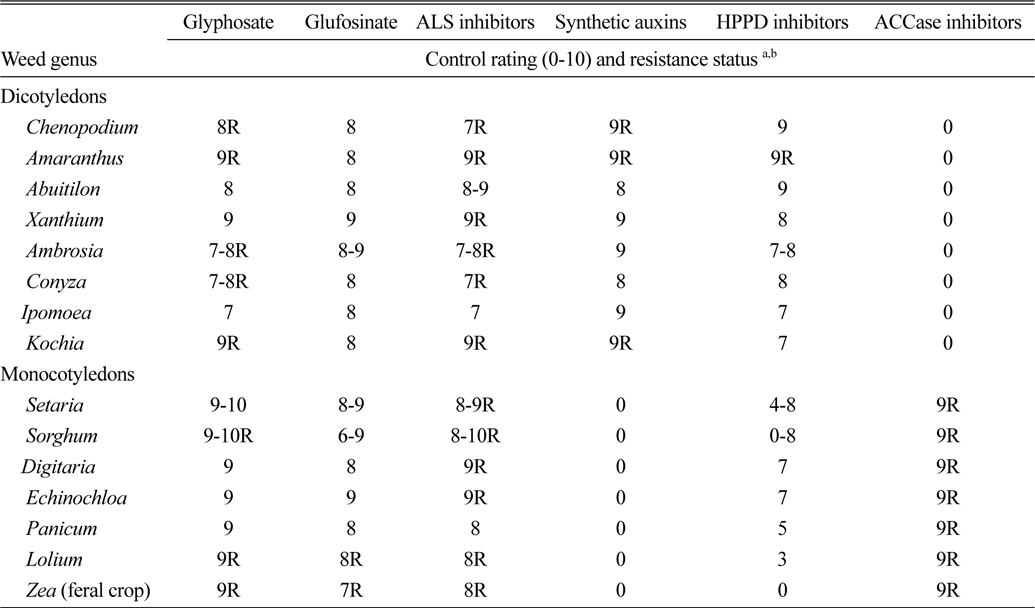
한편, glyphosate 저항성잡초는 방제하기 매우 어렵고, 방제할 제초제가 매우 제한적이기 때문에 농민은 경운작업을 강화하고, 일부 지역에서는 비싼 손 제초를 하고 있는 실정이다(CAST, 2012). 따라서 저항성 잡초를 관리하고 다른 잡초에서 저항성 발현을 지연시킬 전략은 윤작과 다양한 재배방법이 포함되며, Table 2에 제시한 여러 다른 작용기작 제초제를 사용하는 방법도 매우 효과가 높을 것이므로 적극 검토되어야 할 것이다(Dill et al, 2008; Green and Owen, 2011).
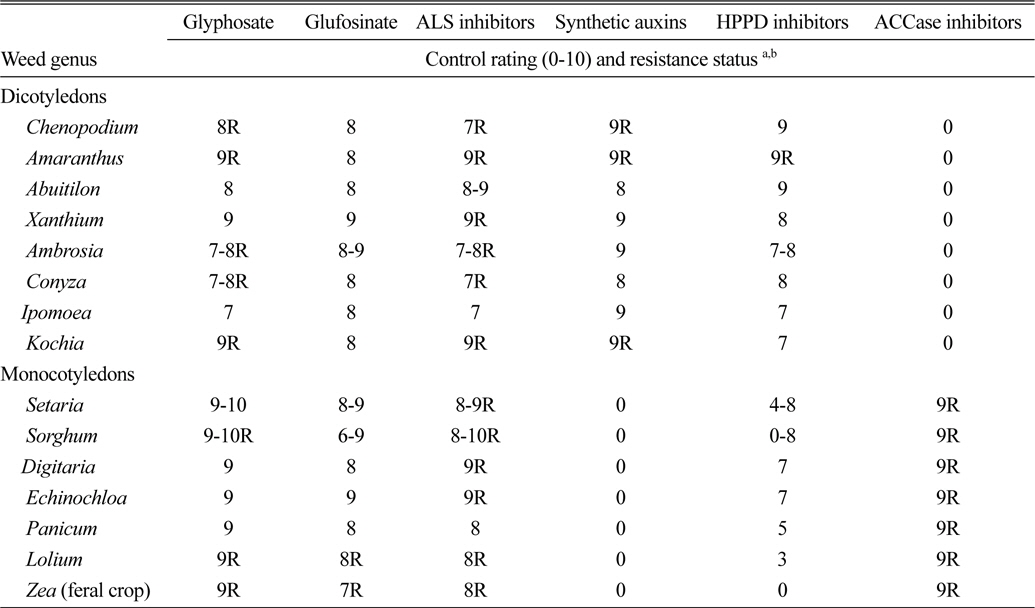
Weed efficacy and resistance status for key herbicide modes of action to be used with existing and future herbicideresistant crops (Green and Owen, 2011).
잡초군락 변화와 저항성잡초와 같은 잡초관리 문제를 해결하기 위하여 미국 몬산토 회사에서 콩과 면화에서 제초제 저항성 형질들을 복합하는 연구가 진행되고 있다. 그리고 저항성을 다른 제초제 저항성과 결합하는 방법으로 콩에 glyphosate 저항성과 sulfonylurea 저항성(STS)을 복합한 이중저항성 콩을 개발하였으며(Green et al., 2008), 여러 해 동안 판매되었다. Sulfonylurea 저항성 콩은 생명공학에서 유래한 형질이 아니고 전통적 육종에 의하여 개발되었다. 이와 같은 복합저항성작물은 콩을 밀과 이모작 재배하는 지역에서 제초제 잔류 피해를 막기 위하여 밀생산에서 sulfonylurea 제초제를 사용할 수 있게 되었다.
이들 제초제 복합저항성작물은 glyphosate 한가지 제초제에 대한 의존성을 줄일 수 있는 차세대기술로서 glyphosate 이외 많은 종류의 제초제 선택을 가능하게 할 수 있다. 또한 제초제 저항성작물을 개발하기 위하여 제초제를 최상의 종합적 형질을 갖게 하는 연구가 많이 이루어 지고 있다. 예를 들면 glufosinate는 저항성잡초가 적고 살초 범위가 넓은 제초제이므로 glyphosate와 glufosinate 저항성을 갖는 이중저항성 품종은 옥수수, 콩, 면화에서 개발되어 glyphosate 저항성잡초를 방제하는데 사용되고 있으며, 제초제 다중저항성잡초의 종류가 증가함에 따라 glyphosate와 glufosinate 이중저항성작물의 가치는 높아질 것이다(Legleiter and Bradley, 2008).
또한, Table 3에서 제시한 바와 같이 앞으로 glyphosate 혹은 glufosinate와 ALS 저해제, 합성옥신 제초제(2,4-D, dicamba), HPPD 저해제, ACCase 저해제의 제초제 복합저항성작물은 개발될 수 있을 것으로 기대된다(Green, 2012). 기타 다른 제초제 저항성 형질과의 복합저항성작물 개발은 주요 작물에서 잡초관리 선택에 활용될 수 있을 것으로 생각된다.
[Table 3.] Transgenic multiple herbicide-resistant crops (Green, 2012).

Transgenic multiple herbicide-resistant crops (Green, 2012).
그리고 새로운 제초제 복합저항성 형질 이용과 함께 작용기작이 다른 제초제의 사용과 윤작, 경운과 같은 재배적 방법은 잡초관리체계에 유효한 추가수단이 되고, 제초제 저항성작물의 장점을 더 오래 지속되도록 도움을 줄 것이며, 아울러 기존 제초제 기술의 새로운 이용을 가능하게 할 것이므로 향후 종합잡초관리 방안의 중요한 요인이 될 것이다.