Exopeptidase active fractions from the hepatopancreas of the Argentina shortfin squid
단백질 분해효소는 단백질의 peptide 결합을 분해하는 가수분해효소(EC 3.4. peptide hydrolase)로서 전체 효소 산업의 약 60%로 대부분을 차지하고 있으며(Haard, 1994), 식품가공에서 저분자 물질의 생산을 위해 아주 유용하게 사용되고 있다. 하지만, 이들 효소의 대부분은 endoprotease이어서 식품산업에서 응용하는 경우 숙성 및 가수분해 중 쓴맛 peptide에 기인한 풍미의 저하로 인하여 제품의 질이 저하하는 단점이 있다(Liu and Yasuda, 2005; Ishibashi et al., 1987a; 1987b). 이로 인하여 최근에는 exopeptidase인 aminopeptidase를 산업적으로 이용하려는 시도가 많이 이루어지고 있다. 그러나, exopeptidase는 단백질 가수분해물의 쓴맛 개선 효과(Izawa et al., 1997; Capiralla et al., 2002; Nishiwaki et al., 2002; Umetsu and Ichishima, 1988; Saha and Hayashi, 2001)가 있으나, endoprotease에 비하여 가격 면에서 상당히 고가이어서 실제로 식품제조에 거의 이용되지 못하고 있다.
한편, 우리나라 대표적인 수산물의 하나인 오징어는 한국인의 식미에 맞음으로 인하여 마른 오징어, 조미 오징어, 조미 냉동식품 및 젓갈 등과 같이 다양한 형태로 가공되거나, 조리될 뿐만 아니라 횟감으로 즐겨 식용함으로 인하여 그 수요가 증대되어 국내산의 어획량만으로는 부족하여 매년 다량 수입되고 있다. 이와 같이 식품 용도로 우리나라에 수입되고 있는 오징어는 아르헨티나 짧은 지느러미 오징어, 웰링톤 오징어(뉴질랜드), 빨강 오징어 및 아메리카 대왕 오징어 등이 대부분을 차지하고 있다(Ministry of Oceans and Fisheries, 2013). 그리고, 오징어는 우리의 식미에 맞게 가공 및 조리하는 경우에 반드시 내장, 껍질, 자숙수 및 먹물 등과 같은 부산물이 다량 발생하고 있다. 이와 같은 연체류 가공 부산물 중 내장에는 다양한 효소(Raksakulthai and Haard, 1999; Raksakulthai and Haard, 2001; Hameed and Haard, 1985; Gildberg, 1987)가 존재하고 있으며, endoprotease가 대부분을 차지하는 다른 수산동물의 내장(Heu and Ahn, 1999)과는 달리 exopeptidase가 다량 함유되어 있다(Kim et al., 2007; Kim et al., 2012a). 이러한 일면에서, 본 연구자 등은 원양산 오징어 내장으로부터 endoprotease (Kim et al., 2008a) 및 exopeptidase (Kim et al., 2008b)를, 갑오징어 간췌장(Kim et al., 2012b)으로부터 추출 최적조건 및 다양한 단백질 분획방법을 적용하여 각각 분획하여 그 특성에 대하여 보고하였다. 따라서 exopeptidase active fraction의 특성 및 단백질 가수분해물의 쓴맛 개선을 위한 적용 조건에 대하여 구명하는 경우, 오징어 내장 유래 exopeptidase의 산업적 응용이 가능하리라 판단된다.
그러나, 오징어 내장으로부터 exopeptidase를 이용하고자 하는 연구로는 분포(Kim et al., 2007) 및 대부분이 정제 및 특성 (Raksakulthai and Harrd, 1999, 2001)에 관한 연구이고, 오징어 내장으로부터 exopeptidase를 추출 및 분획하여 이의 쓴맛개선제로 응용하기 위한 적용 조건에 대한 연구는 전무한 실정이다.
본 연구에서는 원양산 오징어(Argentina shortfin squid
실험에 사용한 원양산 오징어 내장은 포클랜드 근해에서 어획된 아르헨티나 짧은 지느러미 오징어(ASS, Argentine shortfin squid
효소활성 측정을 위한 기질은 endoprotease의 기질로서 azocasein과 exopeptidase의 기질로서 LeuPNA (L-Leucine-pnitroanilide), 쓴맛 가수분해물 제조를 위한 trypsin 및 casein는 Sigma-Aldrich Co. (St. Louis, MO) 제품 구입하여 사용하였고, 기타 시약은 분석급으로 구입하여 사용하였다.
본 실험에서 사용한 모든 buffer는 Dawson et al. (1986)의 방법에 따라 조제하여 사용하였다.
>
쓴맛 tryptic casein hydrolysate의 제조
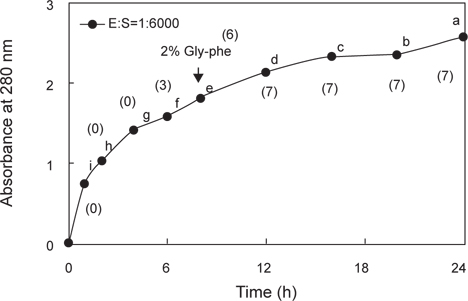
Trypsin 처리 casein hydrolysate은 가수분해정도에 따라 쓴맛이 강한 것으로 알려져 있어(Matoba et al., 1970a, 1970b; Bumberger and Belitz, 1993; Tan et al., 1993), 쓴맛의 강도가 2% glycylphenylalanine (Gly-phe)과 유사한 trypsin 처리 casein hydrolysate를 오징어 간췌장 조추출물로부터 분획한 active fraction의 쓴맛 개선 효과를 검토하기 위한 기질로 사용하고자 하였다. 쓴맛 casein hydrolysate의 조제는 Nishiwaki et al. (2002)의 방법을 다소 수정하여, 0.2% (w/v) trypsin과 2% (w/v) casein용액[0.1 M sodium phosphate buffer (pH 7.5)]을 1/6,000 (단백질 함량 기준)의 비율로 효소반응 혼합액을 조제하고, 50℃에서 일정시간(1, 2, 4, 6, 8, 12, 16, 20 및 24 h) 동안 반응시켰다. 이후 효소의 실활(100℃, 20 min), 냉각(5 min) 및 원심분리(1,460×
Argentine shortfin squid (
단백질 농도는 Lowry et al., (1951)의 비색법에 따라 bovine serum albumin을 표준 단백질로 하여 구한 검량곡선으로부터 측정하였다.
>
AssHP의 조추출물로부터 endoprotease 및 exopeptidase의 분획
AssHP의 조추출물로부터 endoprotease의 분획은 Kim et al. (2008a)의 방법, 그리고 exopeptidase의 분획은 Kim et al. (2008b)의 방법에 따라 분획하였다.
먼저 acetone (AC)에 의한 분획은 조추출물에 대하여 cold acetone (-20℃)을 최종농도가 0-30, 30-40, 40-50, 50-60 및 60-70% (v/v)이 되도록 각각 단계별로 가한 다음, 각 농도단계별 fraction에 대하여 원심분리(12,000×
Ammonium sulfate (AS)에 의한 분획은 조추출물에 대하여 ammonium sulfate의 농도를 10%씩 농도를 증가시키면서 해당 포화농도가 될 때까지 첨가하여 염석하는 방법으로 분획하였다. 이어서 각 fraction(0-20, 20-30, 30-40, 40-50, 50-60, 60-70 및 70-80% 포화농도의 fraction)을 원심분리(12,000×
단백질 하전(net charge) 차이에 의한 분획은 조추출물(50 mL)를 DEAE-Sepharose CL-6B column (i.d. 2.6×15 cm)에 주입하고, 탈 이온수(200 mL)로 용출하면서 단백질을 흡착시킨 다음, 이어서 이온강도가 다른 100 mL의 용출액(0.1, 0.2, 0.3, 0.4, 0.6 및 1.0 M의 NaCl)을 stepwise식으로 일정한 유속 (25 mL/h)으로 분취(25 mL) 하여 1개의 비흡착 fraction (UF, unabsorbed fraction)과 이온강도가 다른 6개의 흡착 fraction을 얻었고, 이를 농축 및 투석하여 7개의 fraction으로 분획하였다.
단백질 분자량의 크기에 따른 분획은 조추출물(5 mL)를 Sephadex G-50 column (i.d. 1.6×95 cm)에 주입하고, 0.1 M NaCl을 함유하는 sodium phosphate buffer (pH 7.0)를 이용하여 일정한 유속(40 mL/h)으로 용출(3 mL/tube) 시켜 이를 10회 반복 실시하였다. Chromatogram 상의 단백질 농도곡선(파장 280 nm)과 LeuPNA기질에 대한 효소활성 분포를 측정하여 활성 fraction을 분획하였다.
이상의 분획 방법별로 분획한 fraction들은 효소의 specific activity (U/mg) 및 회수율을 고려하여 본 실험에서는 endoprotease active fractions은 acetone 분획법으로 AC 40-50% (v/v) fraction, ammonium sulfate 분획법으로 AS 50-60% saturated fraction, anion exchange chromatography로 AE-UF (unabsorbed fraction) 및 gel filtration 법으로 GF-II (15-24 kDa) fraction을 사용하였으며, exopeptidase active fractions는 AC 30-40% (v/v) fraction, AS 60-70% saturated fraction, AE 0.2 M NaCl fraction 및 GF-I (30-50 kDa) fraction을 각각 사용하였다.
Endoprotease의 활성은 azocasein을 기질로 사용하는 Starky (1977)의 방법을 다소 수정한 Kim et al. (2008a)의 방법에 따라 측정하였다. 즉, 10-20 μL의 조효소와 2 mL의 1% azocasein 기질이 용해되어 있는 0.1 M sodium phosphate buffer (pH 6.0)를 혼합 및 반응(50℃, 1 h)시키고, 이 반응액에 동량(2 mL)의 5% trichloroacetic acid (TCA) 용액을 가하여 실활 시킨 후 정치(30 min) 및 원심분리(1,460×
Exopeptidase의 활성은 LeuPNA를 기질로 사용하여 Kim et al. (2008b)의 방법으로 측정하였다. 즉, 10-20 μL의 효소 용액과 1 mL의 0.2 mM 기질이 용해되어 있는 0.1 M sodium phosphate buffer (pH 7.5)를 혼합 및 반응(50℃, 1 h) 시킨 다음, 반응혼액에 0.3 mL의 33% acetic acid를 가하여 실활 시킨 후 정치(30 min) 및 원심분리(1,460×
이들 endoprotease 및 exopeptidase의 활성은 1시간 동안 1 mg의 효소(단백질)가 변화시키는 흡광도 0.1 digit을 1 U/mg으로 나타내었다.
분획 방법별로 분획한 endoprotease와 exopeptidase active fraction 처리 가수분해물은 각 endoprotease와 exopeptidase active fraction과 쓴맛 casein 가수분해물을 1/500 (단백질 함량기준)으로 혼합하고, 50℃에서 0, 8, 16 및 24 시간동안 각각 반응시킨 다음 실활(100℃, 20 min), 냉각(5 min) 및 원심분리 (1,460×
그리고, 분획방법 별로 분획한 이들 active fraction들의 쓴맛 개선 효과는 위에서 조제한 hydrolysates을 대상으로 하여 다음에서 언급하는 관능검사에 의한 쓴맛의 정도와 HPLC 분석에 의한 소수성 peptide의 area %로 검토하였다.
관능검사에 의한 쓴맛 개선의 정도는 1% glycylphenylalanine (Gly-phe) 용액의 쓴맛을 기준점인 3점으로 하고, 조제 가수분해물의 쓴맛이 이보다 약할수록 1-2점으로, 이보다 강할수록 4-5점으로 하는 5점 평점법으로 실시하여 평가하였다.
HPLC 분석에 의한 쓴맛 개선의 정도를 평가하기 위한 가수분해물의 HPLC 분석은 5C18-AR column (i.d. 4.6×250 mm, 5 μm, Waters Co., Massachusetts, USA)이 장착된 HPLC (L-2000, Hitachi Co., Japan)를 이용하여 이동상을 0.1% (v/v) trifluoroacetic acid (TFA)가 함유된 acetonitrile 용액으로 하고, linear gradient(0-45% 범위)로 실시하였으며, 이 때 유속을 0.7 mL/min, 용출시간을 60 min, UV detector (L-2400, Hitachi Co., Tokyo, Japan)의 파장을 214 nm로 하였다.
데이터의 통계처리는 SPSS 통계 프로그램(Version 12.0K, SPSS Inc., Chicago, Illinois, USA)을 사용하여 ANOVA test로 분산 분석한 후, Duncan의 다중위 검정으로 5% 유의수준에서 실시하였다.
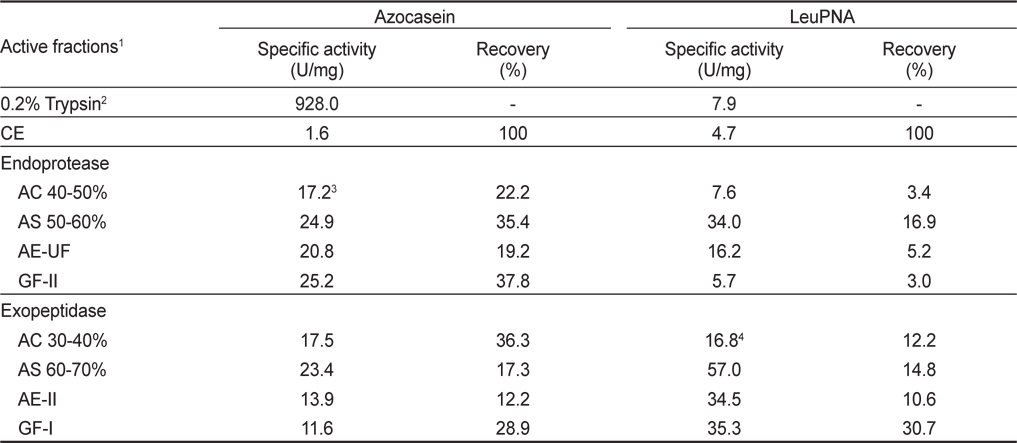
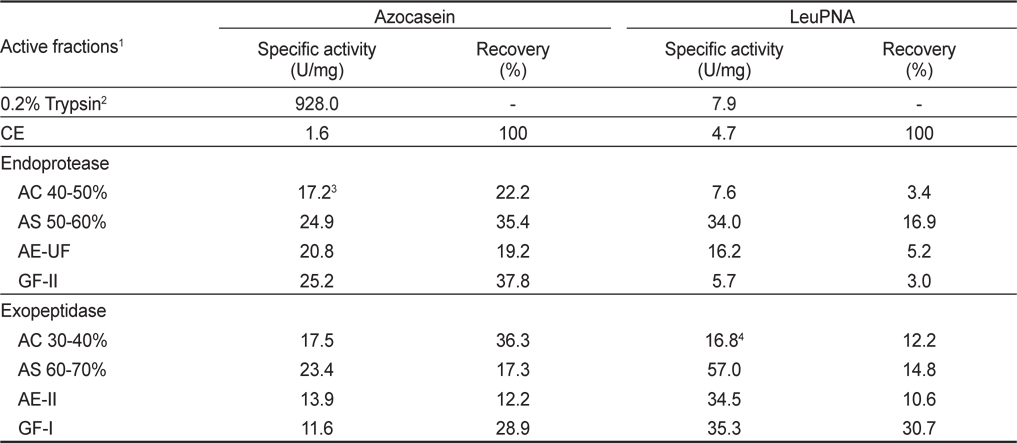
오징어 간췌장 조추출물로부터 acetone, ammonium sulfate, anion exchange 및 gel filtration chromatography로 분획한 endoprotease 및 exopeptidase active fraction을 대상으로 이들의 azocasein 및 LeuPNA에 대한 specific activity 및 회수율을 살펴 본 결과는 Table 1과 같다. 일반적으로 오징어 간췌장 조추출물로부터 효소를 정제하고자 하는 경우 specific activity가 높은 fraction을 이용하는 것이 적절하나, 적절히 분획하여 그 fraction 자체를 이용하고자 하는 경우 total activity가 고려된 회수율이 높은 fraction을 이용하는 것이 적절하리라 판단된다.
Endoprotease and exopeptidase activities of the active fractions obtained from the crude extract of squid Illex argentinus hepatopancreas by different fractionation methods
분획방법 별 endoprotease active fraction의 azocasein에 대한 specific activity 및 회수율은 조추출물(1.6 U/mg 및 100%)에 대하여 AC 40-50% fraction 의 경우 각각 17.2 U/mg 및 22.2%, AS 50-60% fraction의 경우 각각 24.9 U/mg 및 35.4%, AE-UF의 경우 각각 20.8 U/mg 및 19.2%, 그리고, GF-II fraction의 경우 각각 25.2 U/mg 및 37.8%이었다(Kim et al., 2008a). 또한 이들 endoprotease active fraction들의 LeuPNA에 대한 specific activity 및 회수율은 조추출물 (4.7 U/mg 및 100%)에 대하여 AS 50-60 fraction이 각각 34.0 U/mg 및 16.9%로 가장 높은 활성과 회수율을 나타내었으며, 그 외의 fraction들에서는 각각 5.7-16.2 U/mg의 활성과 3.0-5.2%정도만의 회수율을 나타내었다. 이와 같은 결과로부터 오징어 간췌장 조추출물로부터 endoprotease를 분획 및 정제 소재로 활용하고자 하는 경우 gel filtration에 의하여 15-24 kDa이 주로 함유되어 있는 GF-II를 분획하는 것이 가장 적절하리라 판단되었고, 이 경우 peptide의 말단에 존재하는 leucine의 분해능은 거의 기대할 수 없으리라 추정되었다.
한편, exopeptidase active fraction들의 azocasein에 대한 specific activity 및 회수율은 조추출물에 대하여 specific activity는 AS 60-70% fraction (23.4 U/mg)이 그리고 회수율은 AC 30-40% fraction (36.7%)이 가장 높은 것으로 나타났으며, 다음으로는 GF-I fraction이 28.9%의 회수율을 나타내었다. 반면에 LeuPNA에 대한 specific activity 및 회수율은 AC 30-40% fraction이 각각 16.8 U/mg 및 12.2%, AS 60-70% fraction의 경우 각각 57.0 U/mg 및 14.8%, AE-II fraction의 경우 각각 34.5 U/mg 및 10.6%, 그리고 GF-I의 경우 각각 35.3 U/mg 및 30.7%이었다(Kim et al., 2008b). 이와 같은 결과로부터 오징어 간췌장 조추출물로부터 exopeptidase를 분획하여 쓴맛 개선제와 같이 이용하고자 하는 경우 gel filtration chromatography에 의하여 30-50 kDa이 주로 함유되어 있는 fraction (GF-I)을 분획하는 것이 가장 적절하리라 판단되었고, 이 경우 peptide의 소수성 아미노산 부위를 절단하여 쓴맛을 야기하는 상대적으로 endoprotease 활성은 낮아, 쓴맛 개선과 동시에 쓴맛의 발생정도는 상당히 낮으리라 판단되었다. 또한, 오징어 간췌장 조추출물로부터 쓴맛 개선에 관여하는 exopeptidase계 효소를 정제하기 위하여는 ammonium sulfate로 60-70% 포화용액이 되도록 하여 분획한 specific activity가 높은 fraction (AS 60-70%, 57.0 U/mg)을 이용하는 것이 적절하리라 판단되었다.
>
쓴맛 casein hydrolysates에 대한 active fractions의 쓴맛개선 평가
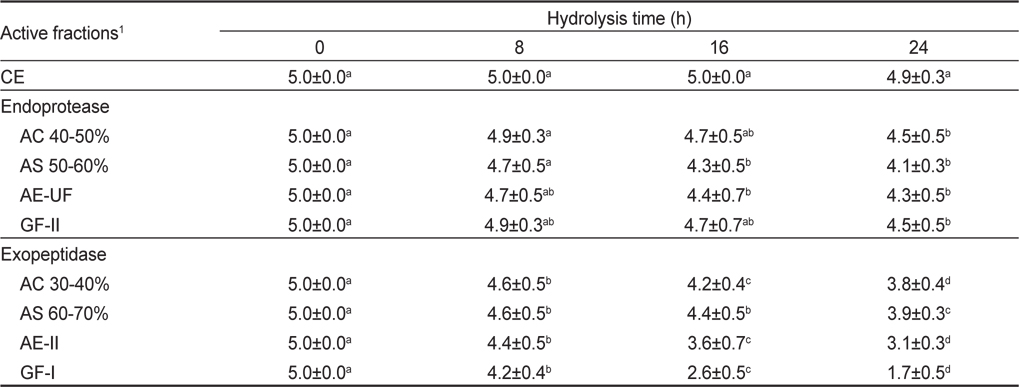
오징어 간췌장 조추출물로부터 acetone, ammonium sulfate, anion exchange chromatography 및 gel filtration chromatography로 분획한 endoprotease 및 exopeptidase active fraction들의 쓴맛 개선 효과를 검토하기 위하여 이들 fraction을 2% Gly-phe의 쓴맛에 준하게 제조한 trypsin 처리 casein hydrolysate에 각각 가하여 가수분해 시킨 다음(Fig. 1), 관능검사를 실시(1% Gly-phe의 쓴맛을 기준점인 3점으로 하고, hydrolysate의 쓴맛 강도가 이보다 강한 경우 4-5점으로, 가수분해물의 쓴맛 강도 이보다 약한 경우 1-2점으로 하여 실시 한 결과는 Table 2와 같다. Endoprotease active fractions 처리 casein hydrolysates의 쓴맛 개선 효과는 분획방법에 따른 fraction의 종류에 관계없이 16-24시간(4.1-4.7점)을 적용하여야 유의적인 쓴맛의 감소가 인지되나, 쓴맛의 강도는 1% Gly-phe (3점)의 쓴맛보다 아주 강하게 쓴맛이 인지되어 산업적으로 적용하기에는 적절하지 않을 것으로 추정되었다. Exopeptidase active fraction에 의한 casein hydrolysates의 쓴맛 개선 효과는 분획방법에 따른 fraction의 종류에 관계없이 대체로 적용시간이 경과할수록 5% 유의수준에서 쓴맛의 감소가 인지되었다. 쓴맛의 강도가 1% Gly-phe의 쓴맛보다 미약하게 인지되는 것은 GF-I fraction을 16시간 및 24시간 적용시킨 hydrolysates이었고, 이들의 관능평점은 각각 2.6점 및 1.7점으로 쓴맛이 확연히 개선된 것을 알 수 있었다.
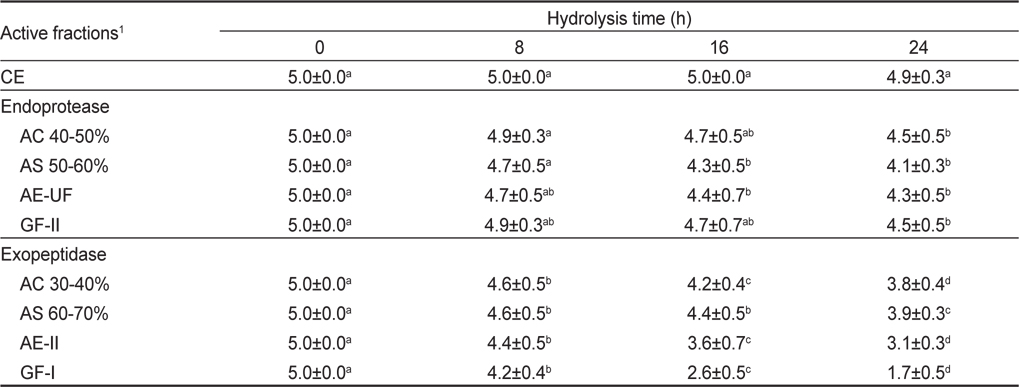
Results of sensory evaluation on the bitterness of tryptic casein hydrolysates treated with the active fractions obtained from the crude extracts of squid Illex argentinus hepatopancreas by different fractionation methods for different hydrolysis times
이상의 결과로 미루어 보아 오징어 간췌장 조추출물로부터 분획한 endoprotease 및 exopeptidase active fraction들 중 쓴맛 개선 효과가 우수한 fraction은 gel filtration chromatography의 GF-I fraction (30-50 kDa)이었다.
한편, exopeptidase의 protein hydrolysate에 대한 쓴맛 개선 효과에 관한 연구로는 Raksakulthai et al. (2002)은 오징어(
이상의 결과와 연구보고로 미루어 보아, exopeptidase active fraction은 쓴맛 단백질(casein 및 soybean) hydrolysate에 대하여 관능평가에 따른 쓴맛 개선 효과가 있는 것으로 판단되었다.
>
쓴맛 casein hydrolysate에 대한 active fractions의 분해활성
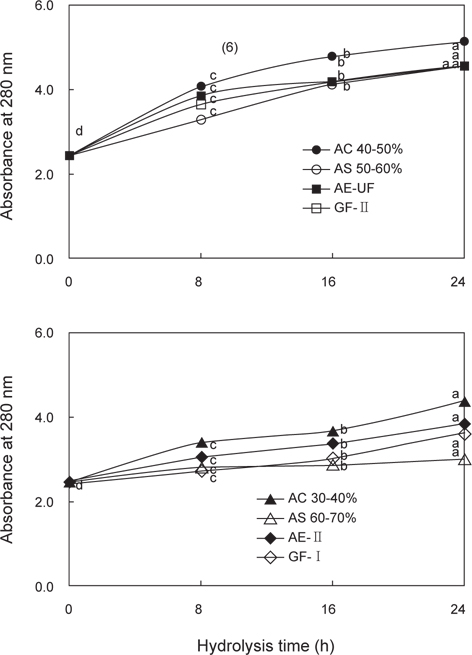
쓴맛 casein hydrolysate에 대한 오징어 간췌장 조추출물로부터 endoprotease 및 exopeptidase active fractions의 분해활성을 흡광도(280 nm)로 나타낸 결과는 Fig. 2와 같다. Endoprotease 최적 활성 fraction의 분해활성은 0시간 처리한 것이 분획방법에 관계없이 모두 2.44로 차이가 없었으나, 8시간 이상 처리한 것의 경우 AC 40-50% fraction이 4.06-5.13 범위로 가장 높았으나, AE-UF (3.85-4.55), GF-II fraction (3.66-4.57) 및 AS 50-60% fraction은 3.26-4.55 범위의 분해활성을 나타내었다. Endoprotease active fractions의 처리시간이 경과할수록 유의적으로 활성이 증가하는 경향을 나타내었다(
이상의 결과에서 쓴맛 casein hydrolysate에 대한 오징어 간췌장 조추출물로부터 active fraction의 분해활성(Fig. 2)은 exopeptidase active fractions이 endoprotease active fractions에 비하여 낮은 것으로 나타나 Table 1의 단백질기질인 azocasein에 대한 분해활성 결과와 유사하였으나, 쓴맛 개선효과(Table 2)에서는 exopeptidase active fraction이 endoprotease active fraction에 비하여 우수한 것으로 나타났다. 따라서 active fractions의 효소활성 강도가 쓴맛 casein hydrolysate에 대한 쓴맛 개선 효과 간에는 절대적인 상관관계가 없는 것으로 판단되었다.
>
쓴맛 casein hydrolysate에 대한 GF-I fraction의 가수분해 pattern
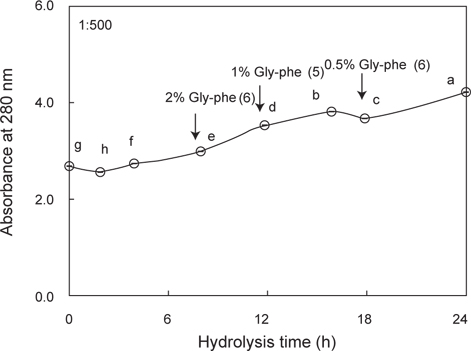
쓴맛 개선 효과(Table 2)가 가장 우수한 exopeptidase active fractions는 gel filtration chromatography 법으로 분획한 GF-I (30-50 kDa 범위) 이었으며, 이러한 결과를 토대로 쓴맛 casein hydrolysate에 GF-I fraction을 가한 다음, 가수분해 시간에 따른 casein hydrolysate의 peptide 패턴과 이의 쓴맛 정도를 Gly-Phe 쓴맛 표준용액과 비교하여 나타낸 결과는 Fig. 3과 같다. GF-I fraction의 적용 시간에 따른 쓴맛의 정도는 가수분해 8시간의 경우 2% Gly-phe 용액에 준하는 쓴맛을 나타내었고, 가수분해 12시간의 경우 1% Gly-phe 용액에 준하는 쓴맛을 나타내었으며, 가수분해 18시간의 경우 아주 미미한 정도의 쓴맛이 인지되는 0.5% Gly-phe 용액의 맛에 준하는 맛을 나타내어 가수분해 18시간 이후에는 쓴맛 개선효과가 확연히 인정되었다.
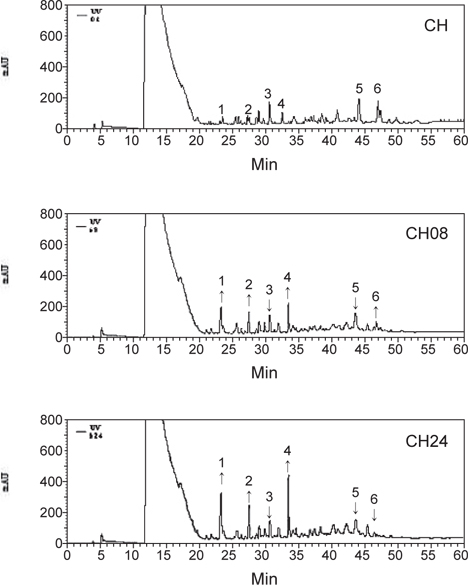
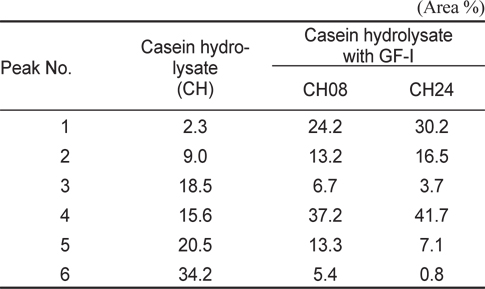
쓴맛 casein hyofrolysate에 대하여 GF-I fraction 처리 시간별 hydrolysates (CH, CH08, 및 CH24)의 HPLC profile은 Fig. 4와 같으며, HPLC chromatogram상에 두드러진 peak area (%)의 변화가 큰 이들 중 맛에 다소 영향을 미치리라 판단되는 6개의 peak의 area %는 Table 3과 같다. 오징어 간췌장 유래 GF-I fraction을 적용하여 조제한 casein hydrolysate의 HPLC profile은 가수분해 시간에 관계없이 peptide peak가 retention time 20분에서 나타나기 시작하였다. 각각의 HPLC profile은 총 60분간의 분석에서 가수분해시간의 경과에 따라 두드러진 변화를 보인 peak는 24분대의 peak 1, 27분대의 peak 2, 31분대의 peak 3, 33분대의 peak 4, 44분대의 peak 5 그리고 47분대의 peak 6과 같은 6종이었다. 이들 peak의 area %는 대조구(CH)의 area%에 비해 소수성이 가장 강한 peptide로 추정(Lin et al., 1997) 되는 peak 6 (대조구가 34.2%, 가수분해 8시간이 5.4% 및 24시간이 0.8%)의 감소가 두드러졌으며, 다음으로 peak 3 (대조구가 18.5%, 가수분해 8시간이 6.7% 및 24시간이 3.7%) 및 peak 5 (대조구가 20.5%, 가수분해 8시간이 13.3% 및 24시간이 7.1%)의 순으로 감소하는 경향을 보인 반면에, 소수성이 상대적으로 약한 peptide로 추정되는 peak 1, peak 2 및 peak 4는 가수분해 시간의 경과와 더불어 증가하였다. 이상의 결과와 Table 3의 결과로 미루어 보아 오징어 간췌장 유래 GF-I fraction의 적용으로 쓴맛 casein hydrolysate의 쓴맛 개선 효과는 casein 가수분해물 중의 peptide 말단에 소수성 아미노산이 노출되어 쓴맛을 야기하는 peptide로부터 소수성 아미노산을 분해함으로써 상대적으로 친수성의 peptide로 전환되었기 때문이라 판단되었다.
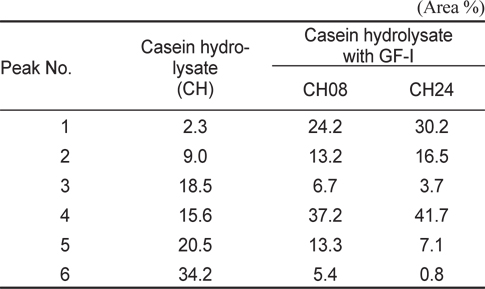
The major peptide distribution of tryptic casein hydrolysates treated with GF-I fraction Illex argentinus for different hydrolysis times
한편, Bumberger and Belitz (1993), Park and Lee (1996), Lin et al. (1997), 및 Nishiwaki et al. (2002)도 exopeptidase를 이용하여 casein 가수분해물의 쓴맛 개선을 시도하였고, 그 효과를 C18-RP HPLC profile로 검토한 결과 retention time 30분대 이후의 소수성이 강한 peak들이 감소한 반면 30분대 이전의 친수성이 강한 peak들이 증가하였다고 보고 한 바 있다.
이상의 연구결과와 보고에서 원양산 오징어 간췌장의 조추출물로부터 여러 가지 분획방법으로 분획한 endoprotease 및 exopeptidase active fractions에 대한 분해 활성과 이들 fractions의 쓴맛 casein 가수분해물의 쓴맛 제거 효과는 gel filtration chromatography에 의하여 분획된 GF-I fraction이 가장 효과적이었다. 오징어 간췌장 유래 쓴맛 개선효과를 가지는 exopeptidase의 산업적 이용을 위하여는 앞으로의 연구에서는 단백질 분자량 크기에 따른 연속 분획공정의 개발이 이루어져야 할 것으로 사료된다.