Both docosahexaenoic acid (DHA, 22:6n-3) and eicosapentaenoic acid (EPA, 20:5n-3) have attracted increasing attention since the first epidemiological report on the importance of n-3 essential fatty acids. Lipids in microbial cells play various biological roles and, consequently, much research has been carried out on their role in cell physiology. The lipid composition of microorganisms can exhibit considerable variations depending on environment. The effects of culture conditions, temperature (15, 20, 24, 28, 32 and 36 ℃), salinity (10, 20, 30, 40 and 50 psu), pH (pH5, 6, 7, 8 and 9), rotation speeds (50, 100, 150 and 200 rpm), carbon sources, nitrogen sources and C/N ratio on the production of docosahexaenoic acid, fatty-acid profiles, and acids secreted to the broth culture by the oleaginous microorganism,
Docosahexaenoic acid (DHA)는 eicosapentaenoic acid (EPA), α-linolenic acid와 함께 오메가-3계 지방산에 속하며, serum triacylglycerides 및 LDL-cholesterol의 함량을 낮추고 HDL-cholesterol 수치를 높임으로써 동맥경화 및 혈전증 등과 같은 심혈관계 질환의 예방에 효과가 있는 것으로 보고되고 있다(Lee and Kim, 2001; Ohr, 2003). 또한 두뇌, 신경계 및 안구조직의 필수지방산으로 특히, 유아의 시력 및 운동능력 개발 등에 중요한 요소이며 뇌의 구조적 지질에 가장 풍부한 구성요소중의 하나이다(Horrocks and Yeo, 1999). 이러한 DHA의 중요성이 제기됨과 동시에 그것을 무엇으로부터 어떻게 확보하느냐 하는 것도 중요한 과제가 되었다. DHA는 특이하게도 화학 합성이 용이하지 못하여 천연물에서 얻어져야 되는데, 지금까지 산업적으로 DHA의 주요 공급원은 고등어, 꽁치, 참치, 전갱이, 정어리, 청어 등과 같은 등 푸른 생선의 기름에서 추출되어 왔다(Haglund et al., 1991). 그러나 어유의 품질은 어종, 계절, 어획 위치에 따라서 다양하며 안정적인 생산도 어려울 뿐 아니라, 어유로부터 생산한 DHA는 비린내와 같은 특유의 냄새와 맛으로 인하여 미생물로부터 생산이 시도되고 있다(Zu and Ward, 1994; Abril et al., 2003; Kim and Lee, 2005). DHA를 생산하는 미생물로는 해양식물성 플랑크톤과
본 연구에 사용된 균주는
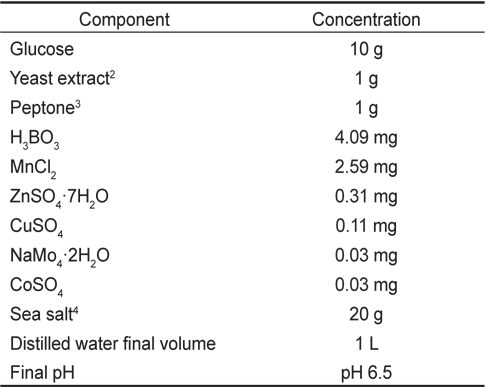
[Table 1.] Composition of GYEP1 medium
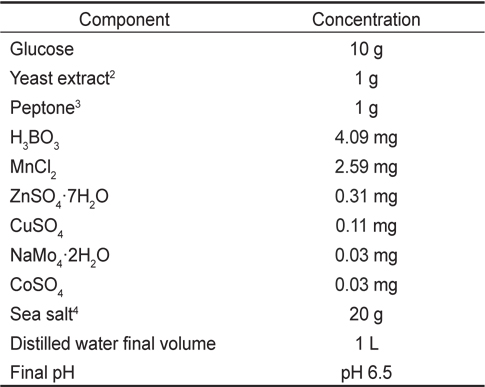
Composition of GYEP1 medium
배양조건은 배양온도, 염분농도, pH, 교반속도와 배양시간을 각각 달리하여 실험하였다. 배양온도에 따른 실험은 진탕배양기(KSI-200L, Koencon Co., Ltd)를 이용하여 15, 20, 24, 28, 32, 그리고 36℃로 실시하였으며, 염분농도에 따른 실험은 Sea salts (S9883, Sigma Chemical Co., St, Louis, USA)를 이용하여 10, 20, 30, 40 그리고 50 psu로 실시하였다. pH에 따른 실험은 0.1 N HCl과 0.1 N NaOH를 이용하여 pH 5, 6, 7, 8 그리고 9로 실험을 실시하였으며, 교반속도에 따른 실험은 50, 100, 150 그리고 200 rpm로 실시하였다. 배양시간에 따른 실험은 접종 후, 24 시간마다 균체를 회수 측정하였다.
영양조건에 따른 실험은 탄소원의 종류, 질소원의 종류 그리고 C/N 비율에 따른 실험을 실시하였다. 탄소원에 따른 성장은 GYEP 배지(Table 1)에서 탄소원을 제외한 나머지 배지 조성에서 탄소원으로 Glucose, Fructose, Lactose, Maltose, Sucrose, Starch, 그리고 Glycerol 을 사용하였으며 실험은 25℃에서 72시간 각각 배양한 후, 소모된 탄소원의 양을 조사하여 영양 요구성을 결정하고, 균체수율, 지질함량과 DHA함량 변화를 알아보고자 하였다. 균체수율과 탄소원의 잔류농도 측정은 시료 채취후, 즉시 시료가 담긴 시험관을 원심분리기(HA1000, HANIL, KOREA)를 통해 5,000 rpm에서 15분간 원심 분리하여 상층액은 잔류 탄소원의 측정에 사용하였으며, 침전물은 균체량 수율, 지질함량 및 지방산분석에 사용하였다. 탄소원의 소모량 측정은 YSI 2700 SELECT (Biochemistry Analyzer YSI 2700 SELECTTM, YSI Co., USA)를 이용하였다.
질소원에 따른 성장은 GYEP 배지(Table 1)에서 질소원을 제외한 조성에서 질소원으로 Tryptone, Peptone, Yeast extract, Urea, Monosodium glutamate, Sodium nitrate 그리고 Ammonium chloride를 이용하여 이들을 각각 0.1% (w/v) 첨가하여 25℃에서 72시간 배양한 후, 균체량 수율, 지질함량과 DHA함량 변화를 측정하였다.
C/N 비율에 따른 실험은 탄소원으로 glucose와 질소원으로 yeast extract를 이용하였다. 질소원인 yeast extract 1 g/L으로 고정시키고, 탄소원인 glucose 농도를 변화시키며 C/N 비율이 1, 5, 10, 15, 20 그리고 25 비율로 조정하였으며 실험은 25℃에서 72시간 각각 배양한 후, 균체량 수율, 지질함량과 DHA함량 변화를 측정하였다.
총 지질 추출은 Bligh and Dyer (1959)에 준하였다. 비커에 균체 5 g 을 취하여 세포분쇄기(homogenizer AM-12, Nihonseiki Kaisha Co. Ltd., Tokyo, Japan)에서 15,000 rpm로 5분간 분쇄한 후, Chloroform과 Methanol을 2:1로 혼합한 추출 용매를 시료의 2배량 넣어 하루 동안 방치한 다음 chloroform 층만을 분리하기 위하여 둥근 플라스크 위에 깔때기를 놓고, 그 위에 Na2SO4를 넣어 서서히 chloroform층만 흘러내리게 하였다. 분리된 chloroform 층은 진공회전농축기(Rotavapor R-114, BUCHI)를 사용하여 40℃이하에서 용매를 완전히 증발시킨 후, 추출된 총 지질의 무게를 측정하였다. 모든 작업은 질소 기류 하에서 행하였다.
지방산 methyl ester 유도체化는 시료 일정량과 내부표준물질(C23:0 methyl ester) 1 mL (1 mg)를 cap tube에 취하고, 0.5 N NaOH-methanol 용액 1.5 mL를 가하여 질소를 충진한 다음, 100℃에서 8분간 가열하여 검화하였다. 방냉 후 12% BF3-methanol 2 mL를 가한 후 tube의 뚜껑을 닫고, 100℃에서 11분간 가열하여 methyl화 하였다. 약 30℃로 냉각한 후 Iso-octane 1 mL를 첨가하고 30초간 vortex mixer로 혼합하였다. 즉시 3 mL의 포화식염수를 가한 다음 흔들어 방치하여 iso-octane층이 분리되도록 하였다. Iso-octane층을 시료 병(4 mL)에 옮긴후, 다시 Iso-octane 1 mL를 첨가한 다음 흔들어 재추출하여 시료 병에 모으고 이를 지방산 methyl ester 시료로 하였다.
지방산 분석에 사용하는 GLC는 OmegawaxTM-320 fused-silica capillary column (30 m×0.32 mm×0.25 μm, i.d., Supelco Co., Bellefonte, PA, USA)를 장착한 Clarus 600 (Perkin Elmer Co. Ltd., USA)를 이용하였다. 분석조건으로 Column은 185℃에서 8분간 유지하고 3℃/min씩 230℃까지 상승시킨 후, 10분간 유지하였다. 이 때 주입기는 250℃, 검출기는 270℃ 그리고 carrier gas는 He (1.0 kg/cm2)을 사용하였다. 지방산의 분석은 동일조건에서 분석한 표준품의 ECL과 비교하여 동정하였고, 지방산 표준품은 14:0, 16:0, 18:1, 18:2, 18:3, 20:0, 22:1, 24:0 (Sigma Chemical Co., St. Louis, MO, USA)과 GC-MS로 동정된 menhaden oil을 사용하였다.
모든 자료는 SPSS (12.0) 프로그램을 이용하여 분산분석(one-way ANOVA)과 회귀분석(Regression Analysis)을 실시하여 Duncan's multiple range test (Duncan, 1955)로 평균간의 유의성(
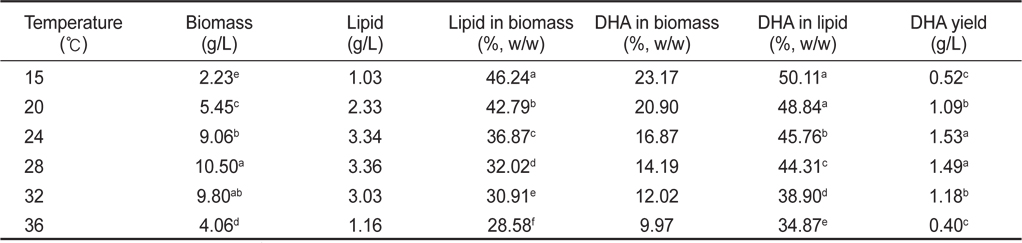
배양온도 15, 20, 24, 28, 32 그리고 36℃에서 배양한 결과는 Table 2에 나타낸 바와 같이 배양온도에 따른 균체량 수율은 각각 2.23, 5.45, 9.06, 10.50, 9.80 그리고 4.06 g/L로 28℃에서 10.50 g/L로 가장 높은 균체수율을 가졌다(
[Table 2.] Effect of culture temperature on biomass, lipid and DHA production
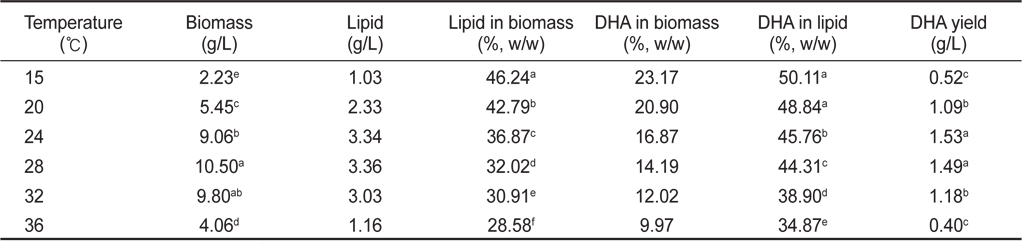
Effect of culture temperature on biomass, lipid and DHA production
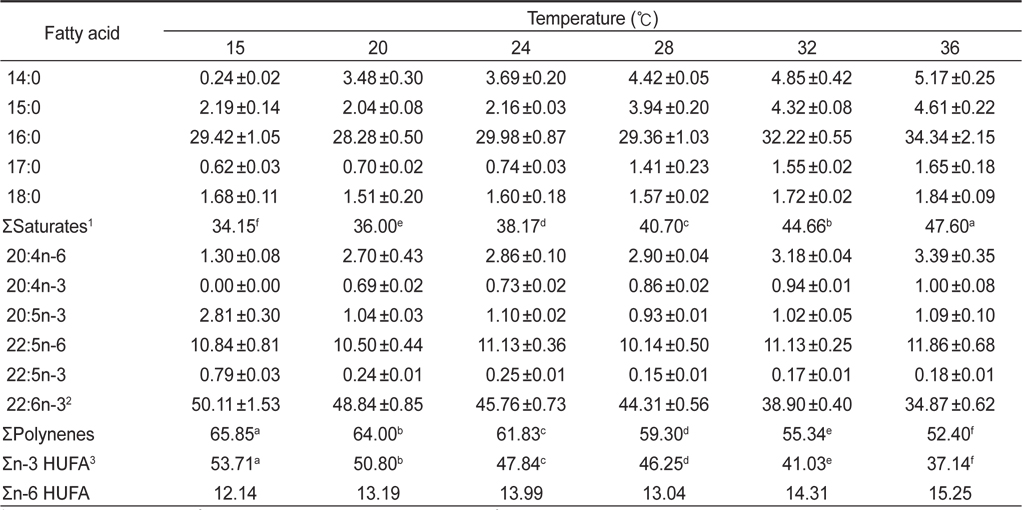
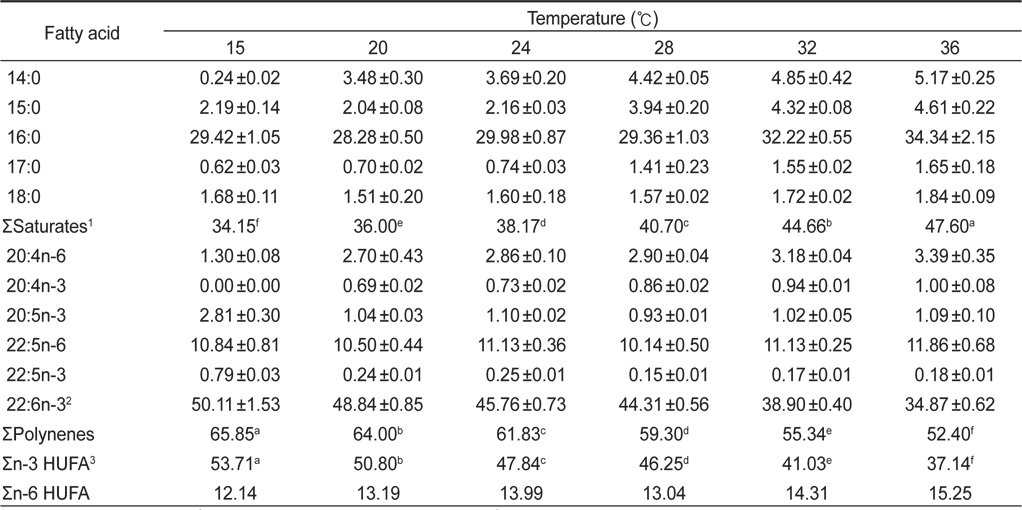
Fatty acid compositions of Schizochytrium mangrovei grown in different temperature (% of total fatty acids)
인지질과 sterol 지방산의 함량과 조성은 온도에 따른 영향을 받는데 식물 조직세포에서 고도불포화지방산은 12℃에서 80%가 형성되나 20℃와 30℃에서는 각각 51%와 30%의 불포화지방산이 합성되며(Browse and Slack, 1993). 온도가 낮으면 불포화지방산의 양이 많아지는 반면 배양 온도가 높으면 포화지방산의 양이 많아진다고 보고되고 있다(Neidelman, 1987). 이번 연구에서도 온도가 높아짐에 따라 포화지방산의 비율이 높아지는 것과 일치하는 것으로 나타났다.
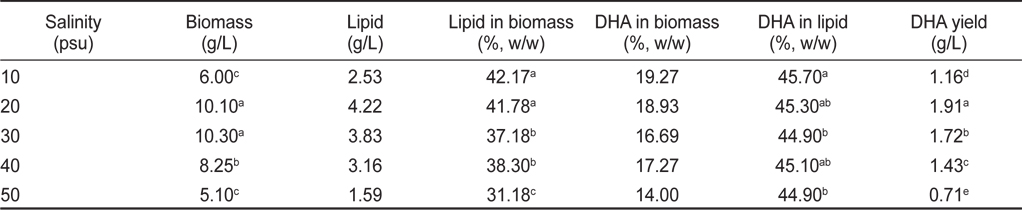
염분농도 10, 20, 30, 40 그리고 50 psu에서 배양한 결과는 Table 4, 5에 나타낸 바와 같다. 염분농도 10, 20, 30, 40 그리고 50 psu에서 배양한 균체량 수율은 각각 6.00, 10.10, 10.30, 8.25 그리고 5.10 g/L로 염분농도가 20과 30 psu일 때 가장 높게 나타났으며(
[Table 4.] Effect of culture salinity on biomass, lipid and DHA production
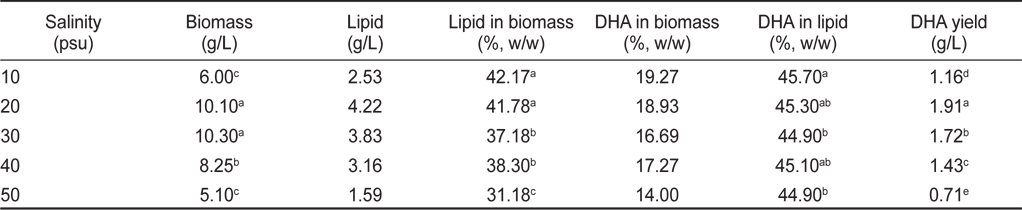
Effect of culture salinity on biomass, lipid and DHA production
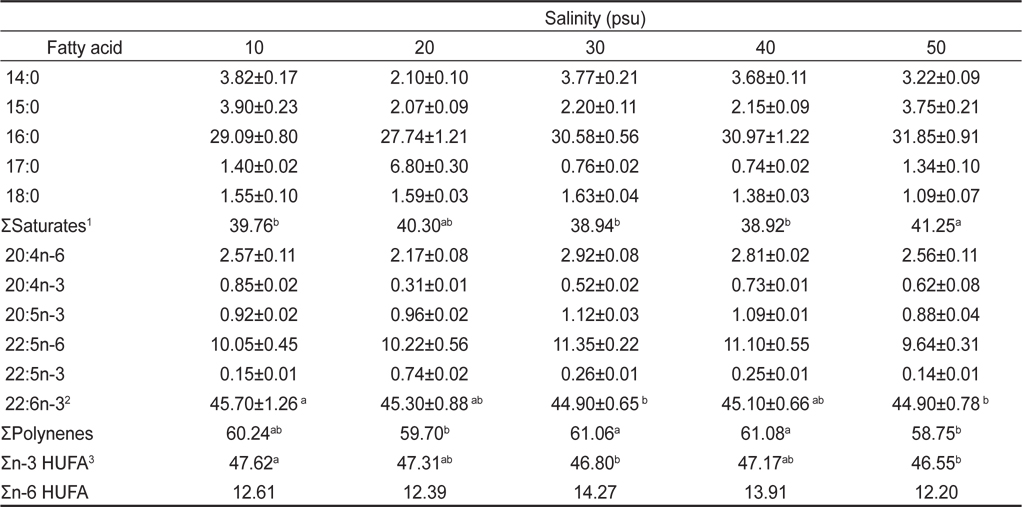
Fatty acid compositions of Schizochytrium mangrovei grown in different salinity (% of total fatty acids)
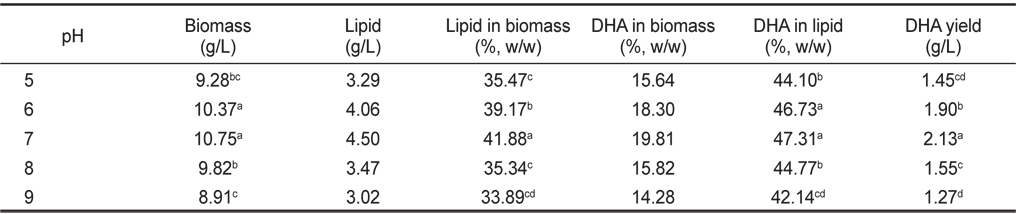
pH 5, 6, 7, 8 그리고 9에서 배양한 결과는 Table 6에 나타낸 바와 같이 pH에 따른 균체량 수율은 pH 5, 6, 7, 8 그리고 9에서 각각 9.28, 10.37, 10.75, 9.82 그리고 8.91 g/L 로 pH 6, 7에서 가장 높게 나타났다(
[Table 6.] Effect of culture pH on biomass, lipid and DHA production
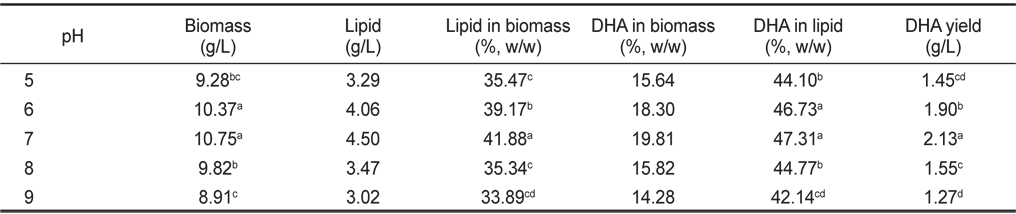
Effect of culture pH on biomass, lipid and DHA production

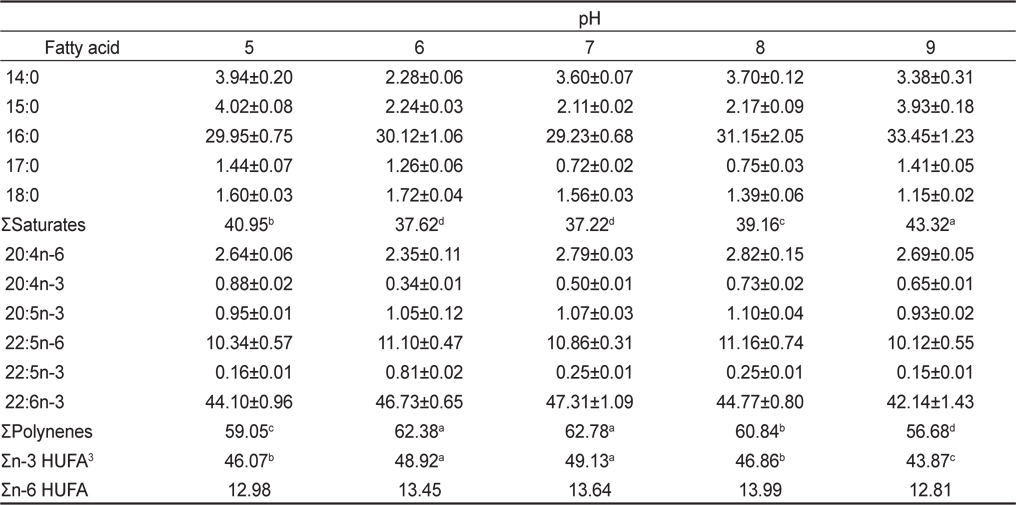
The effect of cultivation pH on the fatty acid compositions of Schizochytrium mangrovei (% of total fatty acids)
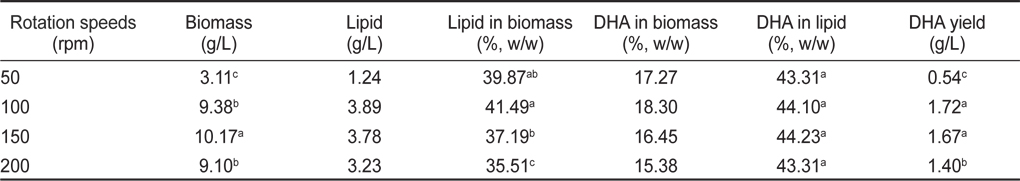
교반속도 50, 100, 150 그리고 200 rpm에서 배양한 균체량의 수율, 지질함량과 DHA함량에 관한 결과는 Table 8에 나타내었다. 교반속도에 따른 균체량 수율은 교반 속도 50, 100, 150 그리고 200 rpm에서 각각 3.11, 9.38, 10.17 그리고 9.10 g/L로 150 rpm에서 10.17 g/L로 가장 높게 나타났으며(
[Table 8.] Effect of culture rotation speeds on biomass, lipid and DHA production
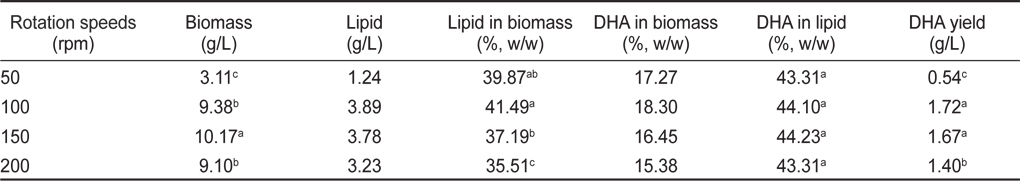
Effect of culture rotation speeds on biomass, lipid and DHA production
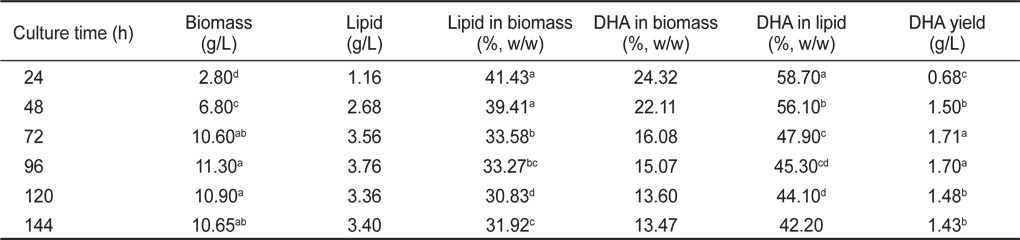
배양시간에 따른 균체량 수율, 지질함량 및 DHA함량은 접종후 24, 48, 72, 96, 120 그리고 144시간 동안 배양하여 측정하였다. 균체량은 접종 후 24, 48 그리고 72 시간동안 배양하였을 때 각각 2.80, 6.80 그리고 10.60 g/L로 급격한 균체성장을 보였지만, 72 시간 이후부터는 성장이 둔화되면서 96, 120 그리고 144시간째 각각 11.30, 10.90 그리고 10.65 g/L으로 균체량의 증가는 없었다(
[Table 9.] Effect of culture rotation speeds on biomass, lipid and DHA production

Effect of culture rotation speeds on biomass, lipid and DHA production
탄소원에 의한 영향으로 Glucose, Fructose, Lactose, Maltose, Sucrose, Starch 그리고 Glycerol을 이용하여 배양한 후 균체량 수율, 지질함량과 DHA함량을 측정한 결과는 Table 10에 나타낸 바와 같다. 그 결과 균체량은 glucose 구에서 10.75 g/L로 가장 높게 나타났으며, 다음으로 fructose구에서는 9.25 g/L로 단당류에서 높은 균체량을 보였으며(
[Table 10.] Effect of culture carbon sources on biomass, lipid and DHA production
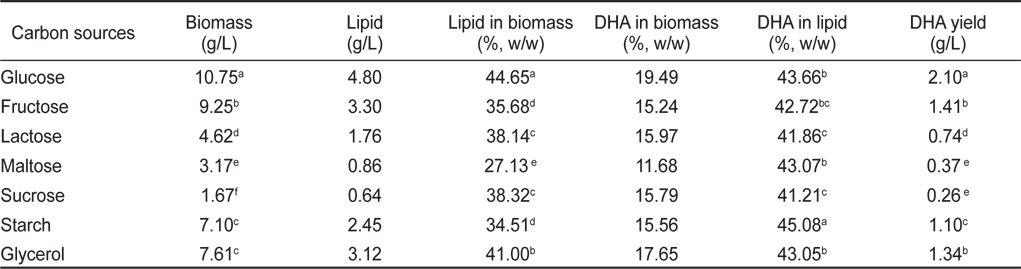
Effect of culture carbon sources on biomass, lipid and DHA production
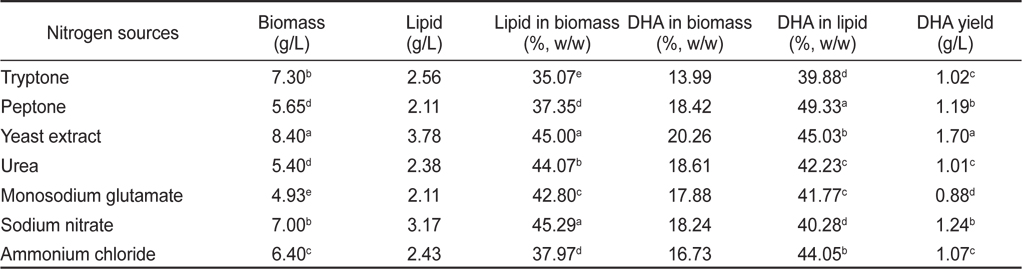
질소원에 의한 영향으로는 Tryptone, Peptone, Yeast extract, Urea, Monosodium glutamate, Sodium nitrate 그리고 Ammonium chloride를 이용하여 각각 배양한 후 균체량 수율, 지질함량과 DHA함량을 측정하였으며 그 결과는 Table 11에 나타내었다. 질소원에 따른 균체량은 yeast extract구에서 8.40 g/L으로 가장 높게 나타났으며(
[Table 11.] Effect of culture nitrogen sources on biomass, lipid and DHA production
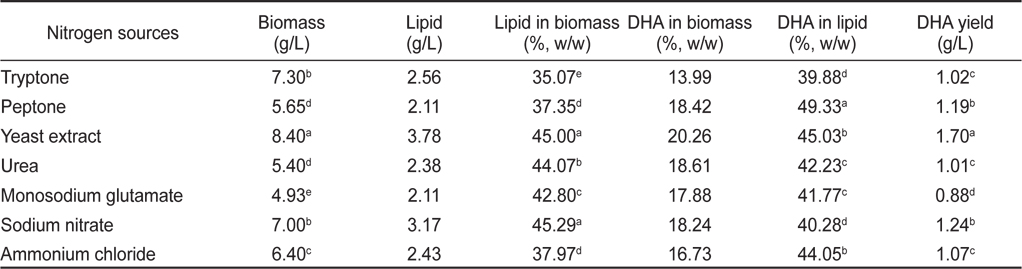
Effect of culture nitrogen sources on biomass, lipid and DHA production
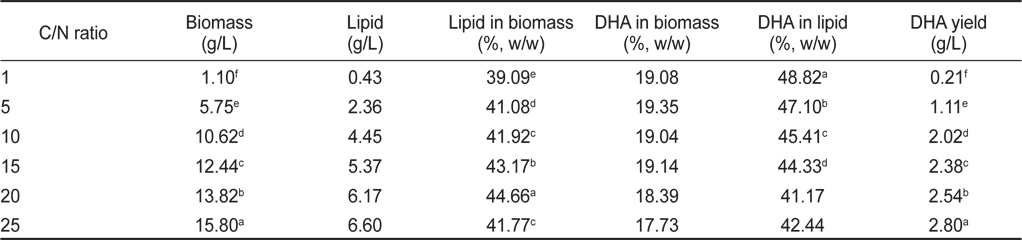
탄소원(C)과 질소원(N)의 비율에 따른 영향은 C/N 비율 1, 5, 10, 15, 20, 그리고 25로 각각 배양한 후 균체량 수율, 지질함량과 DHA함량에 관한 결과를 Table 12에 나타내었다. 균체량은 C/N 비율이 1, 5, 10, 15, 20, 그리고 25에서 각각 1.10, 5.75, 10.62, 12.44, 13.82 그리고 15.80 g/L로 C/N 비율이 증가됨에 따라 균체량도 증가되었지만(
[Table 12.] Effect of culture C/N ratio on biomass, lipid and DHA production
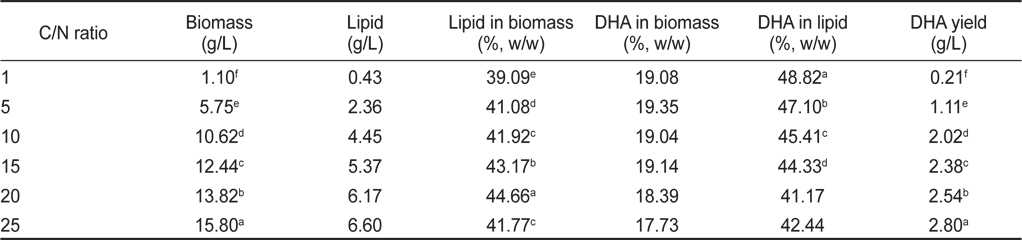
Effect of culture C/N ratio on biomass, lipid and DHA production