This study is to investigate the effects of testosterone on adipogenesis and its molecular mechanism using RT-PCR analysis and transient transfection assays. Castrated(CAST) mice treated with testosterone had lower white adipose tissue weights and expression of adipocyte-specific genes(PPARɣ and aP2) than CAST control mice. Consistent with the in vivo data, testosterone treatment inhibited triglyceride accumulation and expression of adipocyte-specific genes(PPARɣ and aP2) in differentiated 3T3-L1 cells compared with control group. Testosterone-activated androgen receptor(AR) repressed the luciferase reporter gene activity induced by PPARɣ transfection. Thus, these results suggest that testosterone downregulates the actions of PPARɣ on adipogenesis through AR.
지방조직은 지방세포의 증식과 지방세포생성과의 상호작용을 통해 증가된다. 지방세포생성동안 지방세포에서 특이적으로 발현되는 유전자들이 활성화되며, 이러한 유전자들은 peroxisome proliferators-activated receptor ɣ(PPARɣ) 전사조절인자에 의해 조절된다[1].
PPARɣ는 9-cis rerinoic acid receptor와 heterodimer를 이룬 후, 지질대사와 관련된 유전자인 adipocyte fatty acid binding protein(aP2)와 lipotrotein lipase 등의 지방세포-특이적 유전자들의 promoters/enhancers에 존재하는 peroxisome proliferator response elements (PPREs)에 결합하여 PPARɣ-표적유전자의 발현을 조절한다[2].
지방세포의 분화는 성스테로이드 호르몬의 영향을 받는다. Androgen-related steroids는 지방전구세포가 지방세포로 전환되는 것을 방해하였다[3].
따라서 본 연구는 testosterone이 지방세포생성에 대한 PPARɣ 작용을 억제함으로써 지방세포생성의 억제 조절자로 작용하는지를 조사하기 위해, 3T3-L1 지방전 구세포와 정소절제수술한 수컷마우스의 지방조직에서의 중합효소연쇄반응과 일시적인 형질전환 분석을 통해 평가하였다.
모든 실험에서 8주령의 wild-type 수컷 마우스 (C57BL/6J)를 7주 동안 항균 상태에서 12h light/darkness cycle 조건 하에서 고지방식이 사료먹이(High fat diet: 45% kcal fat, Reseatch Diets, New Brunswick, NJ)와 물을 충분히 주면서 사육하였다.
수컷마우스는 무작위로 2그룹(n=8/group) 즉, 정소절제수술 마우스 그룹(CAST)과 정소절제수술 후 실험 기간 마지막 2주 동안 testosterone(5 ㎎/pellet, 60-day release)이 피하주입식으로 처리된 마우스 그룹(CAST +T)으로 분류하였다. 모든 실험 군은 마우스를 죽이기 4시간 전에 사료를 제거하였다. 지방조직은 무게 측정 후 사용할 때까지 –80℃에서 보관하였다.
Mouse 3T3-L1 세포는 6well plates에서 bovine calf serum(Invitrogen, Carlsbad, CA, USA)이 포함된 DMEM 배지로 배양되었다. 2일 후 10% fetal bovine serum (FBS)이 포함된 DMEM배지에 0.5 mmol/L 1-methyl-3-isobutyl-xanthin, 1 μmol/L dexamethasone 및 1 μg/mL insulin이 포함된 지방세포분화배지로 교체하여(d 0) 2일 동안 지방세포분화를 유도한 후(d 2), 2일 마다 10% FBS가 포함된 DMEM배지로 교체하여 6일 동안 배양하였다(d 6). 배양 6일째에 세포의 total RNA를 추출하였고 Oil-red-O 염색액으로 염색하였다. Vehicle이나 testosterone은 지방세포분화배지를 첨가한 2일 동안 처리하였다.
세포를 PBS로 세척하고 10% formaldehyde로 1시간동안 고정시킨 후 PBS로 세척하고 4% Oil-red-O 염색액으로 2시간 동안 염색하였다. 세포를 PBS로 세척한 후 중성지방 축적 정도를 광학현미경으로 분석하였다.
Total RNA는 Trizol(Invitrogen, Avenue Carlsbad, USA)을 사용하여 추출하였으며, 역전사-중합효소 연쇄반응(RT-PCR: reverse transcription-polymerase chain reaction,)을 이용하여 특이적 mRNA의 발현 양을 측정하였다. 표 1은 primer sequences와 PCR conditions이다.
[표 1.] Primer sequences와 PCR 조건

Primer sequences와 PCR 조건
모든 transfection의 경우 well 당 각각 200ng의 plasmid가 사용되었고 lipofectamine(Life technologies, Rockville, MD)을 사용하여 transfection하였다. 반응 6시간 후 신선한 배지 1ml를 첨가하고 vehicle 또는 testosterone을 처리하였다. 처리 24시간 후 배지를 제거하고 배양한 세포를 수확하였다. Luciferase와 β-galactosidase 활성은 판매되고 있는 Promega사 (Promega, Madison, WI, USA)의 kit를 사용하여 측정하였다.
모든 값은 mean ± standard deviation(SD)으로 표시하였다. 통계분석은 unpaired student's t-test와 Tukey’s multiple-comparison test에 의한 one-way ANOVA를 실시하였다. 유의수준은 p<0.05로 설정하였다.
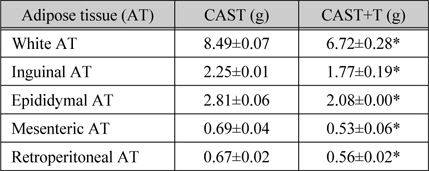
지방조직무게에 대해 testosterone이 억제조절하는지를 조사하였다(표 2). CAST 마우스에 비해 CAST+T 마우스는 총 백색지방조직의 무게가 20.8% 감소되었고 (p < 0.05), 각 부위별 백색지방조직 즉, inguinal, epididymal, mesenteric, 및 retroperitoneal 지방조직의 무게는 각각 21.7%, 25.9%, 23.3% 및 16.9% 씩 감소되었다(p<0.05).
[표 2.] 백색지방조직무게에 대한 testosterone의 영향
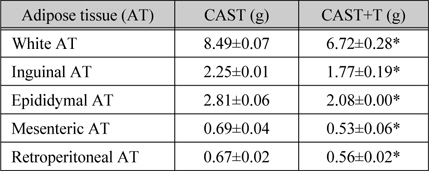
백색지방조직무게에 대한 testosterone의 영향
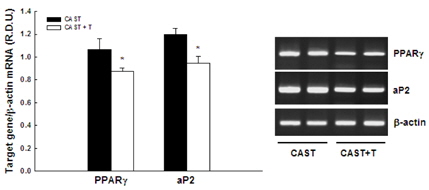
백색지방조직의 무게에 대한 testosterone의 영향이 백색지방조직에서의 PPARɣ 활성과 관련이 있는지를 조사하기 위해, PPARɣ와 지방세포에 특이적으로 발현되는 PPARɣ의 표적유전자인 aP2의 mRNA 수준을 조사하였다(그림 1). CAST 마우스에 비해 CAST+T 마우스는 PPARɣ와 aP2의 mRNA 수준이 각각 18.1%와 20.9% 씩 감소되었다(p<0.05).
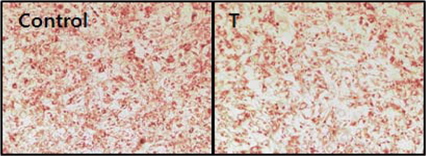
Testosterone이 지방세포분화를 억제조절하는지를 조사하기 위해, Oil-red-O 염색법을 이용하여 6일 동안 지방세포로 분화시킨 3T3-L1 세포에서 중성지방 (triglyceride)의 축적정도를 측정하였다(그림 2). Testosterone이 처리된 세포는 vehicle이 처리된 세포에 비해 중성지방의 축적이 현저히 감소되었다.
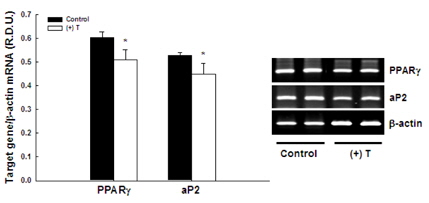
지방세포로 분화된 3T3-L1에서 testosterone에 의해 중성지방 축적이 감소된 것이 PPARɣ와 aP2 유전자 발현의 변화에 의한 것인지를 조사하였다(그림 3). In vivo 실험결과와 일치되게, vehicle이 처리된 세포에 비해 testosterone이 처리된 세포는 PPARɣ와 aP2의 mRNA 수준이 각각 15.4%와 15.1% 씩 감소되었다(p<0.05).
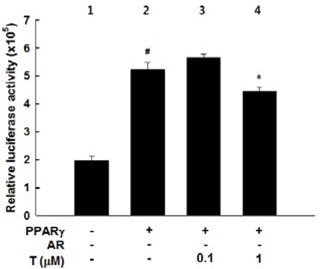
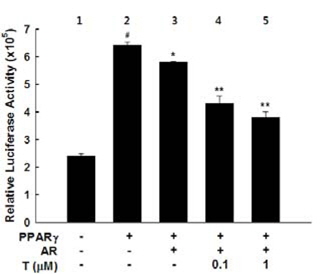
PPARɣ와 PPARɣ에 의존적인 지방세포-특이적 유전자의 발현에 대한 testosterone의 억제효과를 이해하기 위한 분자세포생물학적 메카니즘의 정보를 얻기 위해, 3T3-L1 지방전구세포를 PPARɣ, AR 및 luciferase reporter gene(PPRE3-tk-luc)으로 일시적인 형질전환 하였다(그림 4와 그림 5). PPARɣ을 과발현시킨 세포는 control에 비해 luciferase reporter gene의 발현이 현저히 증가되었다(p<0.05) (그림 4, lane 2 vs lame 1). 그러나 testosterone 처리는 PPARɣ 형질전환에 의해 유도된 luciferase reporter gene의 활성을 감소시켰다(p<0.05) (그림 4, lane 4 vs lame 2).
PPARɣ와 AR를 과발현시킨 세포는 PPARɣ 형질전환에 의해 유도된 luciferase reporter gene의 활성을 억제시켰다(p<0.05) (그림 5, lane 3 vs lame 2). 또한 AR에 의한 PPARɣ reporter gene 활성의 억제작용은 testosterone 처리에 의해 더욱더 효과적으로 억제되었다(그림 5, lane 4 and 5 vs lane 3).
PPARγ 는 지방조직대사를 조절하는 핵심적인 전사 조절인자이며 백색지방조직에서 많이 발현된다[4].
백색지방조직은 성 스테로이드 호르몬의 중요한 표적조직으로서, 지방조직대사는 성 스테로이드 호르몬에 의해서도 조절된다[5]. Testosterone은 다능성 전구 세포(pluripotent precursor cell)가 근육세포로 분화되는 것은 촉진하였지만, 지방세포로 분화되는 것은 억제하였다[6]. 또한 testosterone이 처리된 지방전구세포에서 지방세포-특이적 유전자인 GPDH의 활성이 억제되었다[7]. 이러한 결과들은 testosterone이 직·간접적인 조절기전을 통해 지방세포분화를 억제한다는 것을 시사하고 있다.
따라서 본 연구는 지방세포생성에 대한 testosterone의 조절기전을 조사하기 위해, in vivo와 in vitro 실험에서 testosterone이 지방세포생성에 대한 PPARɣ 작용을 억제하는지를 역전사-중합효소 연쇄반응을 통해 분석하였다.
In vivo 실험과 in vitro 실험 모두에서 testosterone은 PPARɣ와 PPARɣ-의존적인 지방세포-특이적 유전자의 발현을 억제하였다. 이러한 연구결과는 testosterone이 PPARɣ 작용을 억제함으로써 지방세포생성을 억제한다는 것을 시사하고 있다.
Androgens(testosterone과 DHT)의 작용은 androgen receptor(AR)와의 결합을 통해 조절된다[8]. 본 연구는 일시적인 형질전환 분석을 통해 AR을 과발현시킨 3T3-L1 지방전구세포에서 testosterone이 PPARɣ reporter gene의 활성을 억제시킨다는 것을 발견하였다. 이것은 testosterone이 AR 활성을 통해 PPARɣ의 전사를 억제한다는 것을 시사하고 있다.
Testosterone과의 결합으로 활성화된 AR은 표적유전자에 존재하는 androgen response elements(AREs)와 결합하여 표적유전자의 전사를 조절한다[9]. AREs의 DNA 서열은 5
따라서 testosterone에 의해 활성화된 AR이 PPARɣ의 전사작용을 억제한다는 것은, AREs와 PPREs 간의 DNA 서열 유사성으로 인해 testosterone에 의해 활성화된 AR이 PPARɣ와의 경쟁적인 상호작용에 의해 PPARɣ가 PPREs에 결합하는 것을 방해함으로써 PPARɣ 표적유전자의 전사를 억제한 것으로 사료된다.
결론적으로 본 연구의 in vivo와 in vitro data는 지방조직대사에 대한 testosterone의 작용이 PPARɣ-의존적인 지방세포생성을 억제한다는 것을 제시하고 있다. 또한 testosterone metabolism은 신체 지방조직 분포와 복부비만의 조절기전에 대한 향후 연구를 위한 중요한 인자로 고려될 것이다.
본 연구의 in vivo 실험에서의 testosterone 처리는 백색지방조직의 무게를 감소시켰으며 PPARɣ와 PPARɣ-의존적인 지방세포-특이적 유전자인 aP2의 발현을 억제시켰다. In vivo data와 일치되게 in vitro 실험에서도 testosterone은 지방세포생성 뿐만 아니라 PPARɣ와 aP2 유전자 발현을 억제시켰다. 특히 testosterone은 AR 활성을 통해 PPARɣ의 전사를 억제시켰다.
따라서 본 연구는 testosterone이 AR의 활성을 통해 지방세포생성에 대한 PPARɣ의 작용을 억제시킴으로써 지방조직대사를 억제한다는 것을 시사하고 있다.