Various types of MOFs (metal-organic frameworks) were prepared via hydrothermal and post-grafting methods and applied as catalysts for the synthesis of jasminaldehyde, one of the representative perfume intermediates, by Aldol condensation of benzaldehyde with heptanal. Although both acid and base sites could catalyze the reaction, the catalytic performance was strongly dependent on the physical properties as well as the nature of functionalization on MOFs. While the use of sulfonated MOF catalysts led to decrease of jasminaldehyde selectivity regardless of MOFs used, the selectivity change was found to rely on the MOF types in the case of the amine-functionalization. Among the catalysts tested, MIL-101 shows the best catalytic performance, which may suggest that MIL-101 has suitable acid properties to promote the Aldol condensation and the large pore of MIL-101 is also advantageous to alleviate the diffusion problem of bulky products.
금속-유기 구조체(metal-organic framework, MOF)는 넓은 표면적을 나타내는 다공성 결정체 물질 중 하나이며, 단어의 뜻 그대로 금속과 유기물질로 이루어진 골격을 가지고 있는 화합물이다. MOF는 금속의 종류, 금속 클러스터 여부 및 유 기물의 모양과 크기, 배위결합 정도에 따라 다양한 금속과 유기물간의 조합이 가능하며, 최근 들어 가스 저장, 분리, 촉매 등 다양한 분야에서 큰 많은 관심을 받고 있다[1-3].
촉매의 관점에서 보면, MOF는 표면적이 매우 넓을 뿐만 아니라 열려 있는 기공 구조를 가지고 있기 때문에, 기존의 다른 다공성 물질에 비하여 활성점의 분산 및 분자의 이동 측면 에서 유리할 수 있다. 이러한 촉매 특성은 중심 금속의 종류나 개질된 리간드의 종류, 중심 금속과 리간드의 상호작용, 입자의 크기 등 다양한 인자에 의해 달라질 수 있으며, 최근에는 활성, 선택성, 안정성 등에 있어 뛰어난 불균일 촉매로써의 MOF에 대한 연구 결과들이 보고되고 있다[4-5].
MOF의 특징 중 주목할 만한 것은, MOF 자체가 고체산 촉매로 활용될 수 있다는 점이다. MOF 구조 내 금속에 배위하고 있는 물 분자를 제거할 경우 생성되는 비배위 금속자리 (coordinately unsaturated Sites, CUS)는 Lewis 산점으로 작용 할 수 있으며, 이러한 특성을 이용하여 다양한 반응에서 산촉매로 활용되어 왔다[6-8]. 최근에는 CUS에 후처리를 통해 기능기를 도입하거나, 다양한 기능기를 포함하는 유기 리간드와 금속을 이용하여 기능기를 포함하는 MOF를 직접 수열 합성하는 방법도 보고되고 있다[9-10].
한편, 대표적인 방향제 원료 중 하나인 jasminaldehyde는 일반적으로 강산 또는 강염기를 촉매로 사용하여 생산되고 있으나, 이러한 균일계 촉매의 사용은 장치의 부식 및 반응 후 중화 과정에서 대량의 염이 생성되는 문제를 수반한다. 따라서, jasminaldehyde를 환경 친화적인 방법으로 제조하기 위해 다양한 종류의 고체산/염기 촉매에 대한 연구가 진행되어 져 왔다[11-14]. 본 연구에서는, 수열합성 또는 후처리 방법을 통해 산 또는 염기능을 나타내는 다양한 종류의 MOF 물질을 제조하여, jasminaldehyde를 합성하기 위한 benzaldehyde와 heptanal의 알돌 축합반응의 촉매로 활용하였으며, MOF의 물리적인 특성과 기능기의 도입 여부가 촉매 활성에 미치는 영향에 대해 관찰하였다.
Zirconium(IV) chloride (ZrCl4, >99.5%), 1,4-benzene- dicarboxylic acid (H2BDC, 98%), cysteamine (>98%), chromium(III) nitrate nonahydrate (Cr(NO3)3・9H2O, 99%), chromium(VI) oxide (CrO3, 99%), tin(II) chloride dehydrate (SnCl2, 98%), 불산 (hydrofluoric acid, HF, >47%), 염산(hydrogen chloride, HCl, 37% aq.), benzaldehyde (C6H5CHO,>99%), heptanal (C6H13CHO, 95%), tetradecane (C14H30, >99%) 등은 Aldrich 제품을 사용하였다. Mono sodium 2-sulfoterephthalate (H2BDC-SO3H, 98%), monosodium 2-sulfoterephthalate (H2BDC-SO3Na, 98%), 2-nitrobenzene- 1,4-dicarboxylic acid (H2BDC-NO2, 98%), 2-amino-1,4- benzenedicarboxylic acid (H2BDC-NH2, 99%)는 TCI 제품을 사용하였다. 또한, 아세트산 (>99.5%), 플루오르화암모늄(ammonium fluoride, NH4F, >99.9%), 에탄올(ethanol, C2H5OH, >99.5%), 메탄올(methanol, CH3OH, >99.5%), 디메틸포름아미드(dimethylformamide, DMF, HCON(CH3)2, 99%), 황산(sulfuricacid, H2SO4,>96%), 과산화수소(hydrogen peroxide, H2O2, 34.5%) 등은 삼전화학 제품을 사용하였다.
지르코늄 기반의 MOF(zirconium terephthalate metal-organic framework)인 UiO-66는 문헌에 보고된 제조법을 참조하여 제조하였다[15]. 상온에서 ZrCl4 (0.227mmol)과 H2BDC (0.227 mmol)을 DMF (340 mmol)에 넣고 교반 후, 393 K에서 24시간 동안 수열합성하였다. 반응 종료 후 생성된 결정성 고체는 필터링을 통해 회수한 후 디메틸포름아미드로 세척하고, 이후에 393 K 오븐에서 건조하였다.
황산기가 도입된 UiO-66은 후처리 방법(UiO-66-SO3H, grafting) 과 수열합성 방법(UiO-66-SO3H, solvothermal)으로 제조 하였다[16]. 후처리에 의한 황산기의 도입은 UiO-66 구조의 CUS에 cysteamine을 고정화 후, 과산화수소를 이용한 산화반응과 황산 처리 등을 통해 제조하였다. UiO-66-SO3H (Solvothermal) 은 ZrCl4 (1.137 mmol), H2BDC (0.933 mmol), H2BDCSO3H (0.205 mmol) 등을 50 mL의 디메틸포름아미드/아세트산(9 : 1 v/v)에 넣고 교반 후, 393 K에서 40시간 동안 수열합성하였다. 생성된 고체는 원심분리를 통해 분리하고, 디메틸포름아미드, 아세톤 등으로 세척 후 건조하였다.
크롬 기반의 MOF (chromium terephthalate metal-organic framework, MIL-101)는 기존에 알려진 방법을 따라 제조하였다[17]. 먼저, chromium(III) nitrate nonahydrate (Cr(NO3)3, 4 mmol), H2BDC (4 mmol), 불산(1 mmol) 등을 증류수(19.2 mL)에 넣어 교반하였다. 이후에 수열합성 반응기에 혼합 용액을 넣고 493 K에서 8시간 동안 수열합성하였다. 반응 종료 후 생성된 녹색의 고체는 필터링 후 증류수, 에탄올, 플루오르화암모늄, 증류수로 세척 후 건조하였다.
황산기가 도입된 MIL-101-SO3H와 아민기가 도입된 MIL-101-NH2는 Cr(NO3)3에 H2BDC-SO3H 또는 H2BDC-NH2를 적절한 비율로 혼합하여 MIL-101과 유사한 방법으로 수열합성 하였다[10,18]. 황산기와 아민기를 모두 포함하는 MIL-101- NH2-SO3H는 약한 산성을 나타내는 H2BDC-SO3Na와 H2BDCNO2를 이용하여 먼저 황산기와 나이트로기가 도입된 MIL-101- NO2- SO3H를 제조한 이후에 환원 반응을 통해 나이트로 그룹을 아민 그룹으로 변환하였다[19]. 구체적으로는, CrO3(5 mmol), H2BDC-SO3Na (2.5 mmol), H2BDC-NO2(2.5 mmol), 12 M HCl (20 mmol)를 25 mL의 증류수에 넣고 323 K에서 완전히 용해되도록 교반하였다. 이러한 강산성 용액을 수열합성 반응기 넣고 453 K에서 6일 동안 수열합성하였다. 생성된 검은 녹색의 고형물은 증류수, 메탄올, 에탄올 등으로 세척 후 343 K에서 감압을 하며 건조하였다.
제조한 촉매의 비표면적과 세공 부피는 표면 분석기(surface analyzer, BELSORP-Max, BEL, Japan) 를 이용하여 77 K에서 질소 흡착을 통해 측정하였다. 흡착실험 전에, 지르코늄, 크롬 기반의 MOF 촉매들은 각각 393, 423 K에서 감압을 하며 12시간 동안 전처리를 하였다. 비표면적과 세공 부피는 각각 BET (brunauer-emmett-teller)와 MP (micropore analysis) 방법에 의해 계산하였다. 촉매에 함유된 황과 질소량은 원소분석법 (elemental analysis, FlashEA 1112, Thermo)을 이용하여 측정하였다. 제조한 촉매의 형태(morphology)는 Hitachi사의 S-4800 전계방사형 주사현미경(field emission scanning electron microscope, FE-SEM)을 이용하여 관찰하였으며, 위치별 성분 분포는 energy-dispersive X-ray spectroscopy (EDS) 분석을 통하여 확인하였다(EX-250, HORIBA).
Benzaldehyde와 heptanal의 알돌 축합반응은 상압 조건에서 액상반응으로 수행하였다. 촉매 활성 평가 전에 MOF 촉매를 393 K에서 4시간 동안 건조시켜 구조 내 금속에 배위하고 있는 물 분자를 제거하는 방식으로 MOF의 Lewis 산점을 활성화 시켰다. 활성평가는 25 mL 3구 둥근 플라스크 반응기에 benzaldehyde (50 mmol), heptanal (10 mmol), tetradecane (internal standard, 0.5 g)과 촉매 0.05 g을 넣고 293 K에서 4시간 동안 교반하였다. 반응 후 촉매는 원심분리를 통해 반응물과 분리하였다. 반응 생성물은 HP-5 칼럼과 불꽃이온화 검출기(flame ignition detector, FID)가 장착된 가스 크로마토그래피(gas chromatography, GC, HP-6890)를 이용하여 분석하였다. 회수된 촉매는 에탄올과 아세톤으로 세척 후 재평가 하였다.
Jasminaldehyde를 합성하기 위한 benzaldehyde와 heptanal의 알돌 축합반응에 사용한 촉매들은 크게 지르코늄 계열의 MOF인 UiO-66와 크롬 계열의 MOF인 MIL-101에 산점과 염기점을 도입하는 방식으로 제조하였다. Figure 1에 예시한 바와 같이 UiO-66 시리즈의 경우에는, 지르코늄 금속에 링커를 도입 후 산화반응 및 황산처리를 통해 황산기를 도입하거나 (UiO-66-SO3H, grafting), 황산기를 포함하는 리간드를 이용하여 직접 수열합성하는 방식(UiO-66-SO3H, solvothermal)으로 UiO-66에 Brønsted 산점을 도입하였다. 또한, Brønsted 염기점을 포함하는 UiO-66-NH2는 아민기를 포함하는 리간드를 이용하여 직접 수열합성하였다.
MIL-101 시리즈의 경우에는 Figure 2와 같이 Brønsted 산점(MIL-101-SO3H)이나 염기점(MIL-101-NH2)만을 포함하거나, Brønsted 산점과 염기점을 동시에 포함하는 형태로 합성하였다 (MIL-101-NH2-SO3H). MIL-101-NH2-SO3H의 Brønsted 산점과 염기점의 비율은 사용한 H2BDC-SO3Na와 H2BDC-NO2 리간드 비율의 변경을 통해 조절할 수 있으나, MIL-101 구조가 유지될 수 있는 비율로 사용하였다.
제조한 MOF 물질들의 결정학적 특성이나 구조 내 기능기 도입 여부 등의 확인은 이미 보고되었으며[19], 비표면적과 세공부피 등의 물리적인 특성은 Table 1에 예시하였다. UiO-66 구조에 황산기나 아민기를 도입한 경우, 표면적과 세공 부피 는 제조 방법에 크게 의존하였다. 후처리를 통해 제조한 UiO-66 -SO3H (grafting)의 경우에는 비표면적과 세공 부피가 모두 크게 감소하였는데, 이는 후처리 과정에서 UiO-66 구조의 많은 부분이 붕괴되었음을 시사한다. 수열합성의 경우에는, 부피가 큰 기능기의 도입으로 인해 비표면적과 세공 부피에 약간의 감소가 있기는 하나, UiO-66의 표면 특성이 유지되고 있는 것으로 판단된다. MIL-101 유도체들의 경우에도 유사한 경향이 나타났으나, UiO-66 시리즈와 비교하여 표면적과 세공부피가 전체적으로 크게 나타났다.
[Table 1.] Physical properties of various bifunctional MOF catalysts

Physical properties of various bifunctional MOF catalysts
Table 2에는 제조한 MOF 물질들의 원소분석 결과를 예시 하였다. UiO-66 유도체의 경우에는 후처리 방법을 통해 황산 기를 도입하는 것이 수열합성 방법에 비해 많은 양의 황산기를 도입하는데 유리하였다. 하지만, MIL-101에 도입된 황산기 또는 아민기의 량이 UiO-66보다 많았는데, 이는 표면적이 넓은 MIL-101 구조가 기능기를 많이 도입하는데 유리하다는 것을 의미한다. MIL-101-NH2-SO3H의 경우에도, 황산기와 아민기중 하나만을 포함하는 UiO-66 유도체와 비교하여 비표면적과 세공 부피는 2배 이상으로 크며, 동등한 수준의 각기 다른 기능기를 포함하고 있는 것을 알 수 있다.
[Table 2.] Elementary analysis of various bifunctional MOF catalyst

Elementary analysis of various bifunctional MOF catalyst
MOF 구조 내 기능기 도입으로 인한 형태(morphology) 변화를 관찰하기 위해 FE-SEM 분석을 수행하였으며, 그 결과를 Figure 3과 4에 예시하였다. UiO-66 유도체의 경우, 수열합성시에는 도입된 기능기의 종류에 상관없이 UiO-66과 유사한 형태를 유지하고 있었으나, 후처리를 한 경우에는 구조 붕괴로 인해 전체적으로 크게 뭉쳐있는 형태를 나타내는 것을 확인하였다. 하지만, 후처리를 한 경우에도 황과 지르코늄 성분이 고르게 분포되어 있는 것을 EDS 분석을 통해 확인하였으며, 이는 금속의 CUS에 도입된 링커가 산화 및 황산 처리 과정에서도 안정적으로 고정화 되어 있다는 것을 시사한다.
MIL-101 유도체의 경우에는, 기능기의 도입 여부 및 도입된 종류에 따라 각기 다른 형태를 나타냈다. MIL-101은 전형적인 8면체(octahedron) 구조를 지니고 있는데 비하여, MIL-101- SO3H의 경우에는 8면체 구조와 함께 미세한 분말형태가 관찰 되었으며, MIL-101-NH2의 경우에는 8면체 구조 없이 작은 알갱이 형태로만 이루어져 있는 것을 확인하였다. 황산기와 아민기가 모두 도입된 경우에는 8면체, 작은 알갱이, 그리고 미세한 분말 형태 모두가 관찰되었는데, 이는 MIL-101-NH2-SO3H가 황산기와 아민기를 포함하는 MIL-101 유도체들의 특징을 모두 포함하고 있음을 보여준다.
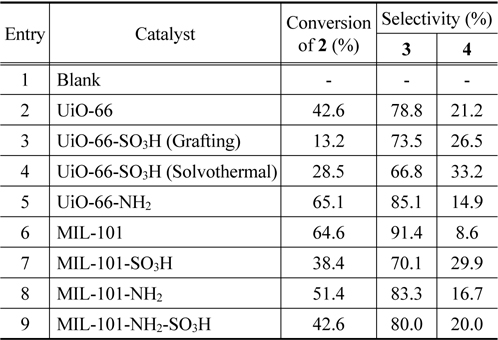
알돌 축합반응은 산 또는 염기 모두 촉매 작용을 할 수 있으며, 촉매의 산/염기 특성에 따라 전환율 및 선택도가 크게 변화하는 것으로 알려져 있다[13]. Jasminaldehyde 생성 반응에서 산점은 benzaldehyde의 carbonyl group을 protonation시 켜 benzaldehyde를 활성화시키고, 염기점은 heptanal enolate를 형성시키는 역할을 한다[12,20]. 따라서, jasminaldehyde의 선택도를 높이기 위해서는 촉매의 산, 염기 특성 및 세공 크기 등의 물리적 특성을 적절히 조절하여Figure 5의 예시된 반응경로 중 heptanal의 self-condensation을 최대한 억제해야 한다. 이러한 측면에서 본 연구에서는 제조한 UiO-66과 MIL-101 유도체들을 benzaldehyde와 heptanal의 알돌 축합반응의 촉매로 활용하였으며, Table 3에 예시한 바와 같이, 전환율과 jasminaldehyde 선택도 모두 촉매의 물리적인 특성과 기능기의 도입 여부에 크게 의존하였다.
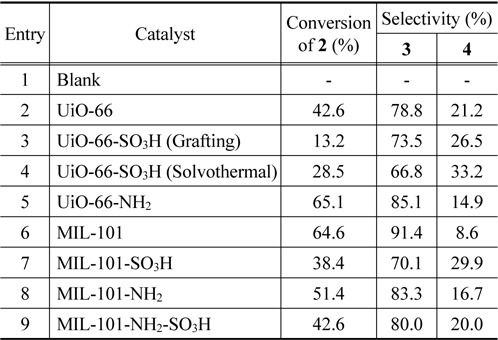
Catalytic performance of various MOF catalysts for aldol condensation of benzaldehyde with heptanal
Lewis 산점만을 가지고 있는 UiO-66와 비교하여(Entry 2), Brønsted 산점을 추가로 포함하는 UiO-66-SO3H를 촉매로 사용한 경우에는 촉매 제조 방법에 상관없이 heptanal의 전환율이 감소하였다(Entries 2 and 3). 특히, 구조의 붕괴가 많이 일 어난 UiO-66-SO3H (grafting)의 경우 전환율이 크게 감소하였는데(Entry 3), 이러한 결과는 크기가 큰 황산기의 도입에 의한 세공 크기 축소 및 구조 붕괴로 인해 반응물의 물질 전달 저항이 커진 것을 시사한다. 또한, 황산기와 같은 강한 산점이 존재할 경우, jasminaldehyde의 선택도가 감소한다는 것을 알 수 있다. 금속 구조에 존재하는 Lewis 산점과 리간드에 도입된 Brønsted 염기점을 동시에 가지고 있는 경우 heptanal의 전환율과 jasminaldehyde의 선택도가 크게 증가한 것은 이러한 결과를 뒷받침해 준다(Entry 5).
MIL-101 유도체들 중에서는 MIL-101의 촉매 활성이 가장 우수하였다(Entry 6). MIL-101-SO3H의 경우, 산점의 양이나 세 기는 증가하였으나, 크기가 큰 황산기의 도입으로 인해 세공내의 물질이동 저항이 증가하여 오히려 전환율이 감소한 것으로 추정되며, 또한, 세공 내의 물질이동 저항이 증가할 경우, heptanal 대비 상대적으로 크기가 큰 benzaldehyde의 활성점 접근이 더 어려워지고, heptanal과 benzaldehyde의 축합반응보다 heptanal의 self-condensation 반응속도가 더 빠르므로, jasminaldehyde의 선택도가 크게 감소하는 것으로 판단된다 [13]. Climent 등은 H-Beta (SAR = 25)를 사용할 경우 강한 산세기로 인해 자기축합(self-condensation)이 증가하고 촉매 비활성화가 빠르게 진행된다고 하였다[13]. MIL-101-SO3H의 경우에도 빠른 촉매 비활성화가 진행되어 활성이 낮게 나타났을 가능성도 있으나, 반응시간을 늘릴 경우에도 전환율이 증가 하는 것으로 보아, 촉매능은 일정 이상 유지되는 것으로 판단 된다.
MIL-101-NH2의 경우, 황산기를 도입한 경우보다 전환율과 jasminaldehyde 선택도가 증가하였는데, 이는 강산점의 감소 와 염기점의 증대로 인한 것으로 판단된다. 하지만, 이 경우에도 아민기 도입에 따른 물질이동 저항이 어느 정도 작용하여, MIL-101 대비 촉매 성능이 열위인 것으로 추정된다.
MIL-101-NH2-SO3H의 경우, 각각 황산기와 아민기를 도입한 경우와 비교하여 전환율과 jasminaldehyde 선택도 모두 중간정도로 나타났는데, 이는 물질이동 저항이 황산기를 도입한 경우보다는 완화되었으나, 아민기를 도입한 경우보다는 크며, 산세기와 염기세기 또한 각각 황산기와 아민기를 도입한 경우의 중간 수준인 것에 기인하는 것으로 판단된다.
이러한 반응 결과는, jasminaldehyde 제조를 위한 알돌 축합반응은 약한 산/염기점을 보유하고 있는 촉매가 선택도 측면에서 유리하고, heptanal, benzaldehyde 등의 반응물과 생성물인 jasminaldehyde가 크기가 큰 것을 고려할 때, 적당한 산세기를 가지고 있으며, 세공 크기가 가장 넓어 크기가 큰 생성물의 물질이동에 유리한 MIL-101의 촉매 활성이 가장 우수하게 나타난 것으로 판단된다.
촉매 활성의 유지 여부를 확인하기 위해 가장 활성이 우수한 MIL-101 촉매의 재사용 평가를 수행하였다. Figure 6에 예시한 바와 같이, 3번의 재사용 동안 heptanal의 전환율과 jasminaldehyde의 선택도가 큰 변화 없이 유지되었으며, 이러한 결과는 촉매가 반응 조건에서 안정하다는 것을 보여준다.
촉매의 안정성 평가는 반응 도중 촉매 분리 후 반응을 계속 진행시키는 방식으로 진행하였다. 촉매를 분리한 이후에는 반응이 더 이상 진행되지 않았으며, 이는 반응 중에 도입된 산, 염기 그룹의 용출이 일어나지 않는다는 것을 시사한다.
구조 내에 Lewis 산점 또는 Brønsted 산, 염기점이 동시에 존재하는 다양한 종류의 이원기능 금속-유기 구조체 물질을 제조하여 benzaldehyde와 heptanal의 알돌 축합반응의 촉매로 활용하였다. 실험 결과, 산 또는 염기점 모두에서 축합반응이 진행되었으나, 촉매 성능은 기능기의 도입 여부 및 종류와 금속-유기 구조체의 물리적인 특성에 크게 의존하였다. 황산기를 도입한 경우에는 세공 내 물질이동 저항이 커져서 전환율이 감소하고 부반응이 증가하는 경향이 관찰되었다. 아민기를 도입한 경우에는, 금속-유기 골격체의 종류에 따라 상반된 경향을 나타내었다. UiO-66의 경우에는 구조 내 염기점의 도입으로 인해 전환율과 jasminaldehyde 선택도 모두 증가하였다. 반면, MIL-101 구조에 아민기를 도입한 경우에는 강산점의 감소와 염기점의 증대로 인해 황산기를 도입한 경우보다 활성이 우수하였으나, MIL-101 보다는 촉매 성능이 열위로 나타났다.
평가한 촉매 중 MIL-101의 촉매 활성이 가장 우수하였으며, 이러한 반응 결과는, jasminaldehyde 제조를 위한 알돌 축합반응은 약한 산/염기점을 보유하고 있는 촉매가 선택도 측면에서 유리하고, 반응물과 축합 반응에 의한 생성물의 크기 가 큰 것을 고려할 때, MIL-101이 적당한 산세기를 가지고 있으며 세공 크기가 가장 넓어 크기가 큰 생성물의 물질이동에 유리한 것으로 판단된다. 제조한 촉매는 3번의 재사용 동안 heptanal의 전환율과 jasminaldehyde의 선택도가 큰 변화 없이 유지되었으며, 반응 중 용출이 발생하지 않았다. 이러한 결과는 촉매가 반응 조건에서 안정하게 유지될 수 있음을 시사한다.