뇌졸중(stroke)은 전 세계적으로 심각한 후유증을 동반하는 가장 흔한 질환 중 하나로1), 지난 30년간 연구자들은 뇌졸중 후 동반되는 뇌손상과 인지 및 각종 기능장애를 극복하기 위한 치료제 개발에 집중해 왔다23). 뇌허혈(腦虛血)에 의한 신경세포의 손상은 초기와 후기로 나누어지는데 초기에는 대부분 뇌졸중에 의해 유발된 허혈(虛血)로 인해 일시적 혈관폐쇄가 일어나 산소부족으로 신경세포가 괴사하게 되고, 후기에는 재관류 후 활성산소에 의해 apoptosis, 즉 지연성세포사(delayed neuronal death)가 일어나게 된다45). 따라서 유리된 유해 활성 산소류에 의한 산화적 스트레(oxidative stress)가 허혈성 뇌손상의 주 원인으로 주목 받고 있으며67), 산화적 스트레스는 후기 재관류 후 유발되는 지연성 세포사에 관여하는 것으로 알려진 각종 염증의 중개물질로도 작용하는 것으로 알려져 있고8), 강력한 항산화 물질로 알려진 비타민(vitamin)과 각종 polyphenol 화합물에 의한 허혈성 뇌손상에 대한 신경보호 효과는 이미 잘 알려져 있다9-11).
허혈성 신경세포 손상은 혈관성 치매의 주된 원인으로12) 다른 치매와 달리 예방과 치료에 가능성이 많은데도 불구하고, 상대적으로 많은 연구가 이루어지지는 않고 있다13). 혈관성 치매는 대부분 뇌졸중의 후속 질환으로 나타나므로 한의학적 범주에서는 중풍(中風), 치매(癡呆), 건망(健忘) 등에 해당한다고 볼 수 있으며14), 원인으로는 심(心), 간(肝), 신(腎)의 허(虛)와 풍(風), 화(火), 담 痰), 어(瘀)의 실(實)로 인식하였다15).
주작환(朱雀丸, Joojakwhan; JJW)은 이천(李梴)의 ≪의학입문(醫學入門)≫16)에 처음 수록되어 있으며 마음과 정신이 안정되지 못하고 건망증이 있으며 화(火)가 잘 내려가지 않아서 때때로 떨고 두근거리는 증상을 치료한다고 하였다. 현재까지 주작환(朱雀丸)의 구성 성분인 복신의 항산화 효과에 의한 신경보호 및 치매 치료 효과17-19)가 비교적 잘 알려져 있고, 침향의 항산화20) 및 신경 안정효과2122)가 알려져 있으며, 인삼 또한 다양한 신경보호 및 치매 치료효과가 잘 알려져 있으나23-25), 주작환(朱雀丸) 자체에 대한 실험적 연구는 잘 알려져 있지 않다.
따라서 본 연구에서는 주작환(朱雀丸)의 허혈성 뇌손상에서 인지 및 운동기능 회복효과를 tMCAO (transient middle cerebral artery occlusion) 백서를 이용하여 infarct 주변부위의 대뇌 위축, 변성 신경세포의 수, caspase-3 및 cleaved poly (ADP-ribose) polymerase (PARP) 면역반응 신경세포의 수적 변화와 limb placing test26) 및 body swing test27), water maze test28)를 이용하여 인지 및 운동 기능 회복효과를 확인하고자 하였다.
본 실험에 사용된 모든 실험동물은 “Guide for the Care and Use of Laboratory Animals [Department of Health, Education, and Welfare Publication (National Institute of Health) 85-23, 1985]에 기초한 대구한의대학교 동물윤리위원회 동물 윤리기준에 준하여 취급하였다.
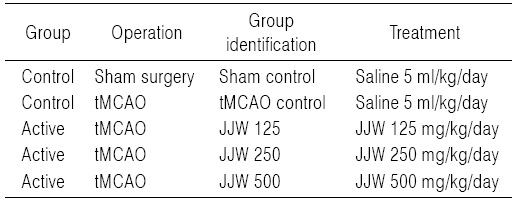
본 실험에 사용된 약재는 대구한의대학교 부속한방병원에서 매입한 것을 관능검사를 통하여 선정하여 사용 하였으며, 본 실험에 사용된 주작환(朱雀丸, Joojakwhan; JJW)의 조성은 Table 1과 같다. 선정된 약제를 전기 미세분쇄기(Sungchang Machine Co., Sungnam, Korea)로 세말하여, 옅은 갈색의 분말을 얻어 실험에 사용하였다. 준비한 주작환(朱雀丸) 세말 분말은 -20℃의 냉장고에 보관 후 실험에 사용하였으며, 본 실험에서 사용한 용매인 멸균 증류수에 100 mg/ml의 농도까지 비교적 잘 현탁되었다.
60마리의 수컷 Sprague-Dawely 백서(6-wk old upon receipt, SLC, Japan)를 24일의 순화과정을 거쳐 실험에 사용하였으며, 순화과정 및 실험 전 기간 동안 온도(20~25℃)와 습도(50~55%)가 조절된 사육실에서 백서용 polycar bonate
[Table 1.] Composition of Joojakwhan Used in This Study

Composition of Joojakwhan Used in This Study
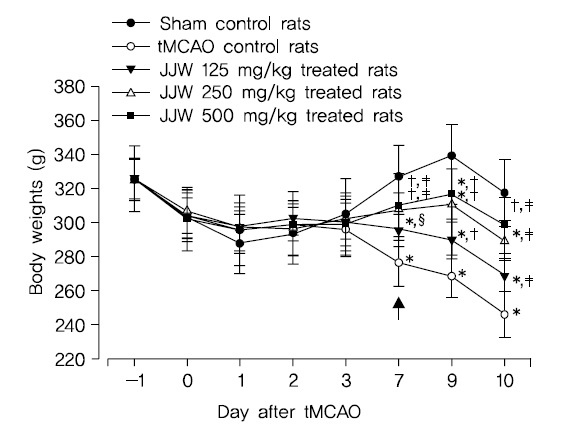
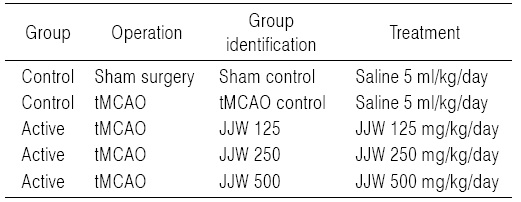
[Table 2.] Experimental Design Used in This Study
Experimental Design Used in This Study
사육 상자에 5마리씩 수용하여 사육하였고, 명암 주기(light:dark cycle)는 12시간 주기로 조절하였으며, 사료(Samyang, Korea)와 음수는 자유롭게 공급하였다. tMCAO (transient middle cerebral artery occlusion) 수술 24시간 후 생존한 실험동물 중 신경운동학적 및 인지행동 검사를 통하여, 유사한 이상 소견을 보이는 실험동물만 선정하여, 실험 군당 8마리씩 무작위 배치 시켜 실험에 사용하였다. 또한 8마리의 위수술 동물을 선정하여, 위수술 대조군으로 사용하였다. 모든 실험동물은 수술일 및 최종 부검일에 각각 18시간 정도 절식을 실시하였으며(이 기간에도 음수는 자유롭게 공급하였다), picric acid로 개체를 식별하였다.
실험동물은 군당 8마리씩 Table 2에 기록한 5그룹으로 구분하였다. 즉, 위수술을 실시한 후 멸균 증류수를 투여한 위수술 대조군(sham control), tMCAO 수술 후 멸균 증류수를 투여한 tMCAO 대조군(tMCAO control), tMCAO 수술 후 주작환(朱雀丸, Joojakwhan; JJW) 125 mg/kg (JJW 125), 250 mg/kg (JJW 250) 및 500 mg/kg (JJW 500) 투여군의 5 군으로 구분하여 실험하였다(Table 2). 주작환(朱雀丸)은 멸균 증류수에 현탁시켜 동물 체중 kg 당 5 ml의 용량으로 매일 1회씩 10일간 금속제 Zonde가 부착된 3 ml 주사기(syringe)를 이용하여, tMCAO 수술 2시간 후부터 강제 경구 투여하였다.
Mild stroke을 유발하기 위해 Longa 등(1989)29)이 언급한 방법에 따라 70% N2O와 28.5% O2가스에 1.5% isoflurane (Hana Pharm. Co., Hwasung, Korea)을 혼합한 마취가스로 전신마취를 시킨 후 수술대에 고정하여 놓고, 경부 피부절개를 통해, 미주신경과 우측 총경동맥, 외경동맥 및 내경동맥을 분리 노출시킨 다음, silicon rubber-coated monofilaments (4-0 fine MCAO suture L56 PK10; Doccol, Redlands, CA, USA; Fig. 1)를 외경동맥으로부터 내경동맥에 23~24 mm 정도 깊이로 삽입하여 내경동맥의 혈류를 일시적으로 차단하였다. 내경동맥 혈류 차단 60분후 monofilament을 제거하고 재관류시켜 tMCAO을 완성하였다. 흡입 전신마취 후 직장온도계와 열 패드를 이용하여 체온을 일정하게 유지시켰으며, 전체적인 사망률은 5%이하(2마리)로 관찰되었다. Sham MCAO는 tMCAO에서와 동일한 방법으로 총경동맥, 내경동맥 및 외경동맥을 노출시킨 다음 monofilament의 삽입 및 재관류를 실시하지 않고, 창강을 폐쇄하였다.
모든 실험동물의 체중을 tMCAO 수술 1일전, tMCAO 수술일(투여 시작일), tMCAO 수술 1, 2, 3, 7, 9 및 최종 희생일에 각각 측정하였으며, 사료섭취에 따른 체중 변화를 최소화하기 위해 tMCAO 수술일 및 최종 희생일에 모든 실험동물은 18시간 정도 절식시켰으며, 실험 시작시의 개체 차이에 의한 체중 변화를 최소화하기 위해 하기의 공식 [1]을 이용하여 투여 시작일에서 투여 10일 후까지의 체중 변화량인 증체량 (body weight gains)을 산출하였다.
EQUATION [1]. Body Weight Gains (g) during 10 Days after tMCAO = (Body weight at the 10 days after tMCAO-body weight at the day of tMCAO)
tMCAO에 의한 신경학적 운동행동 검사는 limb placing test26) 및 body swing 검사27)를 이용하여 평가하였다. 신경학적 운동행동 검사는 tMCAO 수술 1일 전 base line을 설정하기 위해 실시하였으며, 이후 tMCAO 1, 3, 7 및 10일 후에 각각 약물 투여 전 실시하였다.
1) Limb placing test
평가시 관찰자가 실험군 및 실험동물의 개체 번호를 알지 못하도록 하여, 전지 및 후지에 대한 위치 이상 여부를 독립적으로 각각 실시하였다. 전지에 대한 limb placing test를 위해 전지가 자유롭도록 실험동물의 몸통을 잡아, 실험대의 모서리 부분으로 천천히 움직이면서, 시각, 코털(vibrissae) 감각, 촉각 및 고유감각 등 4가지 감각에 대한 배치이상 유무 검사를 실시하였다. 후지에 대해서는 동일한 방법으로 촉각 및 고유감각에 의한 배치 이상 유무를 검사하였다. 각각의 감각에 대한 척도는 즉각적으로 정확하게 배치시키면 0점, 한쪽 발만 배치시키면 1점, 불완전하지만 2초 이상 지연된 이후 배치시키면 2점, 반응이 없으면 3점을 주어, 전지 에 대한 limb placing test는 총점 0점을 정상으로, 12점을 최대 신경 장애 점수로 하였으며, 후지에 대한 검사에서는 총점 6점으로 검사를 수행하였다.
2) Body swing test
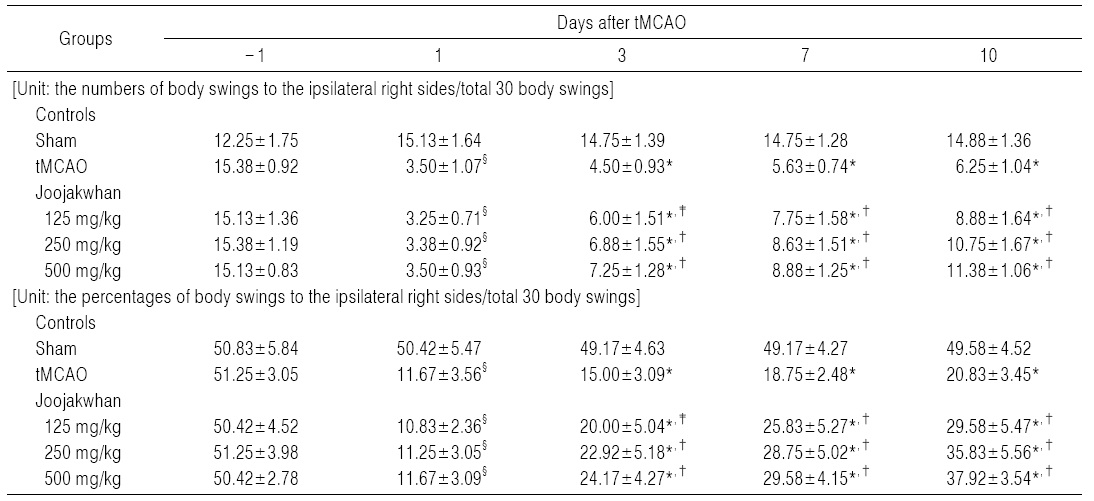
실험동물을 꼬리의 기시부에서 2 cm정도 떨어진 부분을 잡고 실험대에서부터 대략 2 cm 정도 떨어지게 들어 올린 다음 수직선상에서 머리를 좌측 또는 우측으로 10o 이상 움직인 경우를 body swing으로 간주하였다. 정상 동물에서 좌우 body swing의 비율이 대략 1:1인 반면, 오른쪽 tMCAO를 실시한 경우, 실험동물은 수술한 반대편, 좌측으로만 body swing을 실시하는 경향을 나타내므로, 실험동물당 총 30번의 body swing 동안 수술부위의 반대쪽인 왼쪽으로의 body swing 횟수에 대한 수술부위인 오른쪽으로 body swing의 비율을 각각 산출하였다.
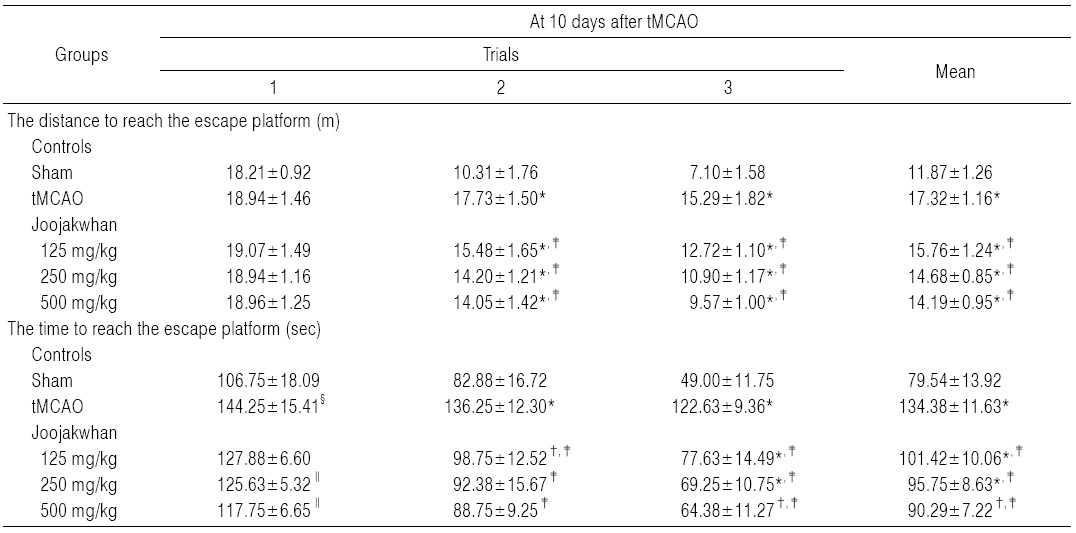
실험동물의 인지행동의 이상 유무를 검사하기 위해, water maze tank test를 Morris (1984)의 방법28)에 따라 tMCAO 10일 후 측정하였다. 모든 실험동물은 3회의 시도 를 통해 water maze tank (150×50 cm) escape platform (15×30 cm)에 도달하기까지의 거리 및 시간을 측정하여, 인지 및 학습 능력의 변화를 관찰하였다. 즉, 검사장비는 직경 150 cm, 높이가 50 cm인 원통형의 검은색 수조가 사용되었고, 직경이 15 cm, 높이가 30 cm인 원형 탈출대(escape platform)을 원통형 수조의 한 사분면의 중앙에 위치시켰으며, 백서의 출발은 escape platform가 위치한 사분면의 대각선 끝에서 실시하였다. 물은 탈출대가 수면으로부터 2 cm 아래에 잠길 정도로 채우고 물의 온도는 22.0±1.0℃를 유지하였다. 수조 안에서 움직이는 백서의 움직임을 a computer interfaced camera tracking system (Smart junior, PanLab, Barcelona, Spain)을 이용하여 기록하였으며, 10분 간격으로 각 3회 동안 연속적으로 실시하여, 백서가 escape platform 위로 도피하기까지 걸리는 시간(초; second)과 거리(m)를 각각 측정하였다. 만약백서가 180초 내에 escape platform을 찾지 못하면 도피시간은 180초로 하였다.
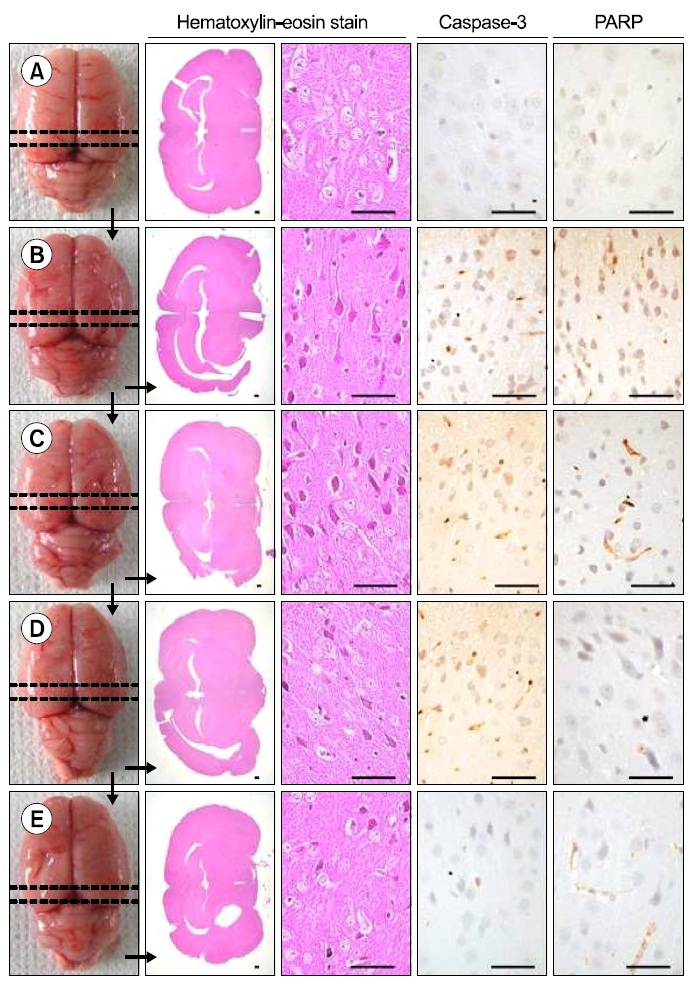
Lee 등30)의 방법에 따라, 최종 희생일에 70% N2O와 28.5% O2가스에 1.5% isoflurane을 혼합한 마취가스로 전신마취를 시킨 후, 뇌조직을 적출한 다음 4℃ 정도의 phosphate buffered saline (PBS, pH 7.4)로 냉각시키고, brain stainless steel coronal matrix (Harvard, MA, USA)를 이용하여, 후뇌에서 2~14 mm 부분의 대뇌를 2 mm 두께로 연속 절편 6개를 준비하고(Fig. 2), 2% 2, 3, 5-triphenyl tetrazolium chloride (Sigma, MO, USA) 용액으로 37oC에서 30 min간 5개의 뇌조직 절편을 염색한 다음, 10% neutral buffered formalin (NBF)에 overnight 고정시켰다. 이후 0.5 mm 간격의 grid 위에 놓은 다음 digital camera (Fujifilm, Tokyo, Japan) 영상을 촬영하여, 대뇌에서 관찰되는 infarct 부위의 면적을 하기의 공식 [2]으로 자동영상분석장치(iSolution FL ver 9.1, IMT i-solution Inc.,Canada)를 이용하여 산출하였다.
EQUATION [2]. Infarct volumes = Σinfarct region area of six cerebral slices×2 mm (thicknesses)
Brain stainless steel coronal matrix로 준비한 마지막 6번째 뇌조직 절편(Fig. 2)을 10% 중성포르말린에 overnight 고정시킨 후, 탈수를 거쳐 파라핀 포매 후 3μm의 절편을 제작하였다. 이후 Hematoxylin & eosin (H&E) 염색을 실시하고, 광학현미경 하에서 관찰하였다. 좀 더 명확한 조직병리학적 변화를 관찰하기 위해, infarct 주변부 대뇌피질의 위축 %를 하기의 공식 [3]을 이용하여 계산하였으며30), 단위 면적(mm2)당 대뇌피질 변성 신경원의 수 역시 자동영상분석장치를 이용하여 산출하였다.
EQUATION [3]. Cerebral Atrophy Formation = (Contralateral cerebral cortex area-ipsilateral cerebral cortex area)/Contralateral cerebral cortex area×100 (%)
준비한 파라핀 포매 뇌 조직 절편을 이용하여, Avidine-Biotin-Peroxidase Complex (ABC) 방법31)으로, caspase-3 및 PARP 면역반응성 신경원을 관찰하였다. 즉, citrate bufferantigen (epitope) retrieval pretreatment를 Shi 등32)의 방법에 준하여 실시한 다음, 0.1% H2O2가 포함된 methanol에 30분간 반응시켜 비특이적 peroxidase 반응을 차단하고, normal goat serum에 1시간 동안 반응시켜 내인성 peroxidase를 제거하였다. 이후 caspase-3 (Anti-cleaved caspase-3 (Asp175) polyclonal antibody; Cell Signaling Technology Inc, Beverly, MA, USA; Dilution, 1:400) 및 PARP (Anti-cleaved PARP (Asp214) rat specific antibody; Cell Signaling Technology Inc, Beverly, MA, USA; Dilution, 1:100) 일차항체에 4℃에 18시간 이상 반응시키고, biotinylated universal secondary antibody (Vector Lab. Inc., CA, USA. Dilution 1:50)에 1시간 상온에서 반응시킨 다음, avidin-biotin complex reagents (Vectastain Elite ABC Kit, Vector Lab. Inc., CA, USA. Dilution 1:50)에 1시간 상온에서 반응시키고, peroxidase substrate kit (Vector Lab. Inc., CA, USA)를 이용하여 발색시켰다. 발색 이후 Mayer’s Hematoxylin으로 대조염색을 실시하고, 광학현미경하에서 관찰하였다. 본 실험에서 10% 이상의 발색반응을 나타내는 세포를 양성 면역반응세포로 간주하고, 단위 면적(mm2)당 대뇌피질내 caspase-3 및 PARP 양성 면역반응 신경원의 수를 각각 자동영상분석장치를 이용하여 산출하였다.
모든 수치는 평균±표준편차로 표시하였으며, 다중비교 검증을 이용하여 통계처리를 실시하였고, 분산동질성을 Levene test를 실시하여 검증하였다. 등분산일 경우, one way ANOVA test를 실시한 다음 least-significant differences (LSD) test로 사후 검증을 실시하여 군 간의 유의성을 측정하였다. 비등분산일 경우에는 비모수 검증인 Kruskal-Wallis H test를 실시한 후 유의성이 인정된 경우에는 Mann-Whitney U (MW) test를 실시하여 군 간의 유의성을 검증하였으며, Bonferroni correction을 시행하였다.
모든 통계처리는 SPSS for Windows (Release 14.0K, SPSS Inc., Armonk, NY, USA)33)를 이용하여 평가하였으며, pvalue가 0.05 이하인 경우 통계적 유의성을 인정하였고, tMCAO에 대한 주작환(朱雀丸)의 뇌보호 효과, 신경운동학적 및 인지행동 장애 회복 효과를 좀 더 명확히 하기 위하여, 주작환(朱雀丸) 투여군과 tMCAO 대조군과의 percent change를 하기의 공식 [4]를 이용하여 각각 측정하였다.
EQUATION [4]. Percentage Changes as Compared tMCAO Control (%) = ((Data of JJW administered groups-Data of tMCAO control)/Data of tMCAO control)×100
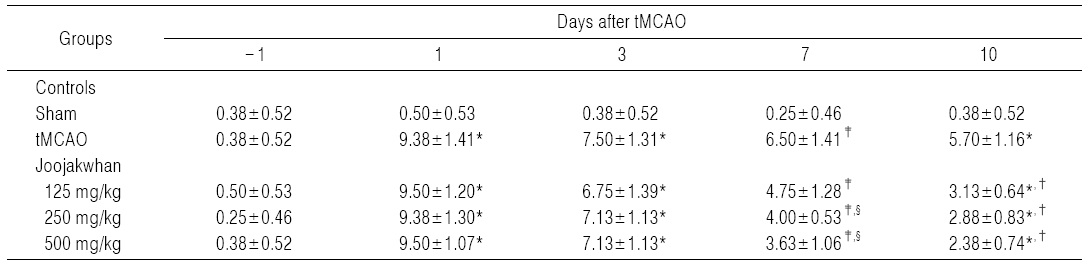
tMCAO 대조군에서는 sham 대조군에 비해 유의성 있는 (p<0.01) 체중의 감소가 tMCAO 7일 후부터 나타나기 시작하여, 실험기간 동안의 증체량 역시 유의성 있는(p<0.01) 감소를 나타내었다. 한편 tMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 증가가 주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 tMCAO 7일 후부터 실험 전기간 걸쳐 나타나, tMCAO 대조군에 비해 유의성 있는 (p<0.01) 체중의 증가를 각각 나타내었다(Fig. 3).
tMCAO 후 10일 동안의 증체량은 주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 tMCAO 대조군에 비해 각각 37.30, 70.32 및 93.65%의 변화를 나타내었다.
[Table 3.] Forelimb Placing Scores Detected in tMCAO Rats
Forelimb Placing Scores Detected in tMCAO Rats
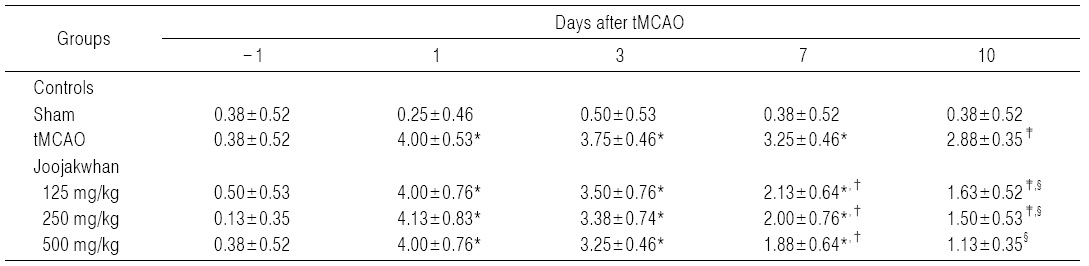
tMCAO수술 24시간 후 신경학적 운동행동 검사 점수가 유사한 실험동물을 선정하여 사용하였으므로, tMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) forelimb placing test 점수의 증가가 tMCAO 24시간 후부터 실험 전 기간에 걸쳐 나타났다. 한편 세 용량의 모든 주작환(朱雀丸) 투여군에서는 각각 tMCAO 7 및 10일에 tMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) forelimb placing test 점수의 감소가 나타났다(Table 3).
주작환(朱雀丸) 125 mg/kg 투여군에서는 tMCAO 대조군에 비해 forelimb placing test 점수가 tMCAO 3, 7 및 10일후 각각 -10.00, -26.92 및 -45.65%의 변화를 나타내었다. 주작환(朱雀丸) 250 mg/kg 투여군에서는 tMCAO 대조군에 비해 forelimb placing test 점수가 tMCAO 3, 7 및 10일 후 각각 -5.00, -38.46 및 -50.00%의 변화를 나타내었다. 주작환(朱雀丸) 500 mg/kg 투여군에서는 tMCAO 대조군에 비해 forelimb placing test 점수가 tMCAO 3, 7 및 10일 후 각각 -5.00, -44.23 및 -58.70%의 변화를 나타내었다.
tMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) hindlimb placing test 점수의 증가가 tMCAO 24시간 후부터 실험 전 기간에 걸쳐 나타났다. 한편 주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서는 tMCAO 대조군에 비해 유의성 있는(p<0.01) hindlimb placing test 점수의 감소가 tMCAO 7 및 10일 후에 나타났다(Table4).
[Table 4.] Hindlimb Placing Scores Detected in tMCAO Rat
Hindlimb Placing Scores Detected in tMCAO Rat
주작환(朱雀丸) 125 mg/kg 투여군에서는 tMCAO 대조군에 비해 hindlimb placing test 점수가 tMCAO 3, 7 및 10일 후 각각 -6.67, -34.62 및 -43.48%의 변화를 나타내었다. 주작환(朱雀丸) 250 mg/kg 투여군에서는 tMCAO 대조군에 비해 hindlimb placing test 점수가 tMCAO 3, 7 및 10일 후 각각 -10.00, -38.46 및 -47.83%의 변화를 나타내었다. 주작환(朱雀丸) 250 mg/kg 투여군에서는 tMCAO 대조군에 비해 hindlimb placing test 점수가 tMCAO 3, 7 및 10일 후 각각 -13.33, -42.31 및 -60.87%의 변화를 나타내었다.
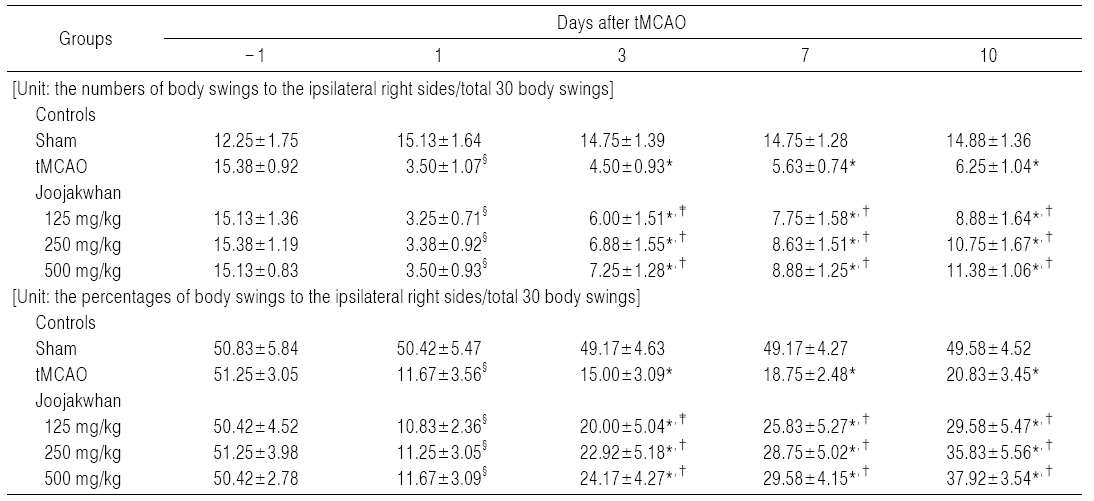
tMCAO 대조군에서는 sham 대조군에 비해 유의성 있는 (p<0.01) 우측으로의 body swing 횟수 및 비율의 감소가 tMCAO 24시간 후부터 실험 전 기간에 걸쳐 나타났다. 한편 주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서는 tMCAO 대조군에 비해 유의성 있는(p<0.01) 우측으로의 body swing 횟수 및 비율의 증가가 투여 용량 의존적으로 tMCAO 3일 후부터 실험 전 기간에 걸쳐 각각 나타났다 (Table 5).
주작환(朱雀丸) 125 mg/kg 투여군에서는 tMCAO 대조군에 비해 우측으로의 body swing 횟수 및 비율이 tMCAO3, 7 및 10일 후 각각 33.33, 37.78 및 42.00%의 변화를 나타내었다. 주작환(朱雀丸) 250 mg/kg 투여군에서는 tMCAO 대조군에 비해 우측으로의 body swing 횟수 및 비율이 tMCAO 3, 7 및 10일 후 각각 52.78, 53.33 및 72.00%의 변화를 나타내었다.
[Table 5.] Body Swing Scores Detected in tMCAO Rats
Body Swing Scores Detected in tMCAO Rats
[Table 6.] Cognitive Behavioral Scores Detected in Water Maze Test of tMCAO Rats
Cognitive Behavioral Scores Detected in Water Maze Test of tMCAO Rats
주작환(朱雀丸) 500 mg/kg 투여군에서는 tMCAO 대조군에 비해 우측으로의 body swing 횟수 및 비율이 tMCAO 3, 7 및 10일 후 각각 61.11,57.78 및 82.00%의 변화를 나타내었다.
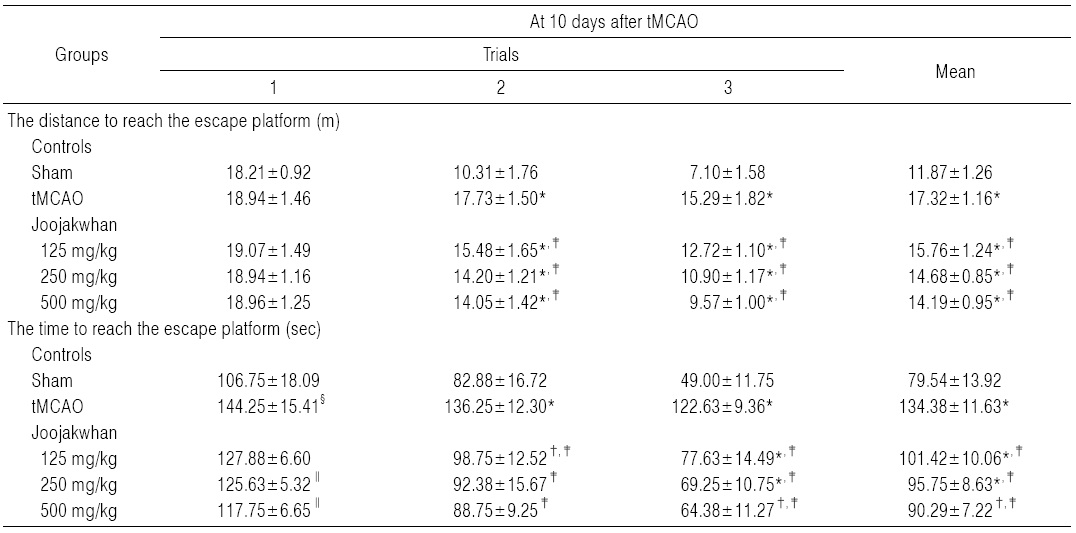
Sham 대조군에서는 water maze tank내에서 escape platform까지의 이동거리 및 시간이 trial을 반복할 때 마다 현저히 감소되었으나, tMCAO 대조군에서는 sham 대조군에 비해 유의성 있는(p<0.01) escape platform까지 움직인 거리 및 시간의 증가가 tMCAO 10일후 나타났으며, trial 횟수에 따른 이동거리 및 시간의 단축 역시 현저히 억제되었다. 한편 모든 세 용량의 주작환(朱雀丸) 투여군에서는 tMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) escape platform까지의 이동거리 감소가 tMCAO 10일 후 trial 2 및 3에서 각각 나타났으며, escape platform까지의 이동시간의 유의성 있는(p<0.01) 감소 역시 모든 trials에서 투여 용량 의존적으로 각각 나타났다(Table 6).
주작환(朱雀丸) 125 mg/kg 투여군에서는 tMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 tMCAO 10일 후 trial 1, 2 및 3에 각각 0.68, -12.68 및 -16.82%의 변화를 나타내었고, escape platform까지의 이동시간이 각각 -11.35, -27.52 및 -36.70%의 변화를 나타내었다.
주작환(朱雀丸) 250 mg/kg 투여군에서는 tMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 tMCAO 10일 후 trial 1, 2 및 3에 각각 -0.02, -19.89 및 -28.71%의 변화를 나타내었고, escape platform까지의 이동시간이 각각 -12.91, -32.20 및 -43.53%의 변화를 나타내었다.
주작환(朱雀丸) 500 mg/kg 투여군에서는 tMCAO 대조군에 비해 water maze tank내에서 escape platform까지의 이동거리가 tMCAO 10일 후 trial 1, 2 및 3에 각각 0.11, -20.78 및 -37.38%의 변화를 나타내었고, escape platform까지의 이동시간이 각각 -18.37, -34.86 및 -47.50%의 변화를 나타내었다.
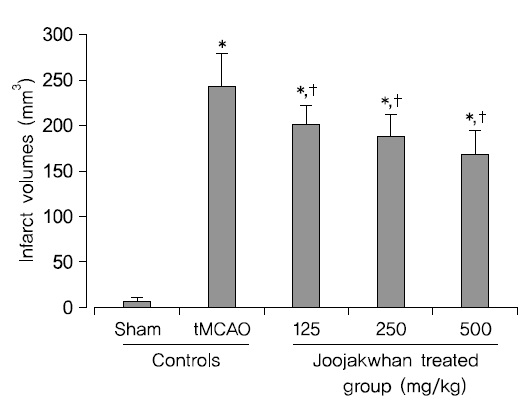
tMCAO 10일 후 최종 부검시, tMCAO 대조군에서는 대뇌피질에서 현저한 infarct 소견이 나타났으며, sham 대조군에 비해 유의성 있는(p<0.05) infarct volume의 증가가 나타났다. 한편 주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서는 tMCAO 대조군에 비해 유의성 있는(p<0.05) infarct volume의 감소가 투여 용량 의존적으로 각각 나타났다(Fig. 2 and 4).
주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 tMCAO 대조군에 비해 각각 -17.34, -22.50 및 -30.74%의 infarct volume의 변화가 나타났다.
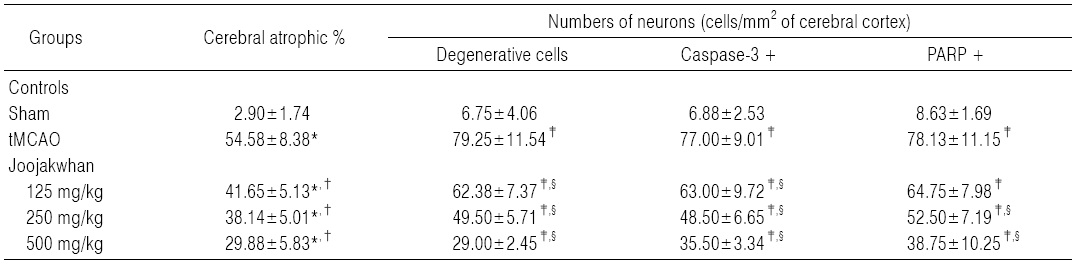
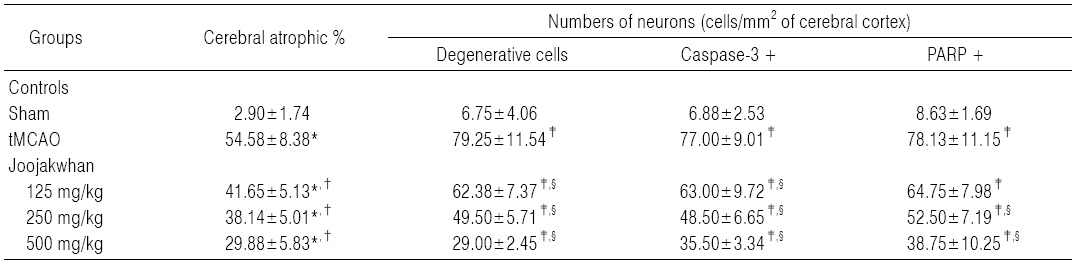
Infarct 주변부위의 조직병리학적 표본에서, tMCAO 대조군에서는 유발부위인 우측 대뇌반구의 유의성 있는 (p<0.05) 현저한 위축과 단위 면적당(mm2) 대뇌피질내 변성신경원, caspase-3 및 PARP 면역 반응세포의 수적 증가가 나타났다. 한편 세 용량의 모든 주작환(朱雀丸) 투여군에서는 tMCAO 대조군에 비해 유의성 있는(p<0.01) 대뇌 피질위축
[Table 7.] Histomorphometry of Peri-infarct/defect Cerebral Cortex in tMCAO Rats
Histomorphometry of Peri-infarct/defect Cerebral Cortex in tMCAO Rats
억제가 나타났으며, 대뇌 피질내 변성 신경원, caspase-3 및 PARP 면역 반응세포의 수 역시 유의성 있는(p<0.05) 감소를 투여 용량 의존적으로 각각 나타내었다(Table7, Fig. 5).
주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 유발부위인 우측 대뇌반구의 위축정도가 tMCAO 대조군에 비해 각각 -23.69, -30.12 및 -42.28%의 변화를 나타내었다.
주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 유발부위인 우측 대뇌피질에서 단위 면적당 변성 신경원의 수가 tMCAO 대조군에 비해 각각 -21.29, -37.54 및 -63.41%의 변화를 나타내었다.
주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 유발부위인 우측 대뇌피질에서 단위 면적당 caspase-3 면역반응 신경원의 수가 tMCAO 대조군에 비해 각각 -18.18, -37.01 및 -53.90%의 변화를 나타내었다.
주작환(朱雀丸) 125, 250 및 500 mg/kg 투여군에서 유발부위인 우측 대뇌피질에서 단위 면적당 PARP 면역반응 신경원의 수가 tMCAO 대조군에 비해 각각 -17.12, -32.80 및 -50.40%의 변화를 나타내었다.
치매는 단기 기억과 다른 인지기능 결함 문제로 특징되어지는 뇌의 기질적 퇴행을 말하며34), 초기에는 가벼운 건망증 정도로 시작하여 시간이 흐르면서 점차 증상이 악화되어 모든 뇌기능을 상실하게 되는 임상증후군이다35). 치매는 크게 뇌의 퇴행성 변화로 일어나는 알츠하이머 치매, 뇌의 동맥경화나 뇌졸중의 후에 속발하는 혈관성 치매, 그 외의 원인 절환에 의한 속발성 치매 등으로 분류할 수 있다36). 이 중 알츠하이머로 인한 치매가 가장 큰 비중을 차지하고 혈관성 치매가 그 다음을 잇는 것으로 알려져 있으며, 국내의 경우에도 전체 치매 환자 중 알츠하이머 치매가 70.5%, 혈관성 치매가 24.4%로, 두 번째로 많은 것으로 추정되고 있다343738).
알츠하이머 치매는 뇌의 퇴행성 변화에 의한 질환으로β-amyloid, estrogen, apolipoprotein E, preseniline, oxidants (hydrogen, superoxide, hydroxyl radicals), 염 증, 신경전달물질 등의 다양한 유발인자가 관여하는 것으로 알려져 있다39).
이와는 달리 혈관성 치매는 일반적으로 뇌혈관 질환에 의해 야기되는 인지장애라 할 수 있다40). 혈관성 치매는 대부분 뇌졸중 이후에 나타는데, 뇌졸중에 의한 허혈로 인해 야기되는 산소부족과 재관류시에 나타나는 활성산소에 의한 허혈성 뇌신경세포의 손상은 혈관성치매의 원인으로 여겨진다4512). 혈관성 치매 초기에는 부분적인 지능 상실과 불면, 건망, 우울증, 기억력 저하 등이 나타나며 감정의 변화가 커지는 경향이 있으나 판단력과 인격은 정상적으로 유지되고 이후 질병의 진행에 따라 기억장애, 지남력상실, 언어장애, 인지장애, 정서장애 등의 증상이 나타나게 된다14).
한의학에서는 아직 서양의학과 같은 치매의 유형적 분류가 이루어지지 않고 있으나 임상적으로 매병(呆病), 건망(健忘), 전광(癲狂)의 범주로 보고 변증시치를 하고 있는데, 혈관성 치매의 경우는 대부분 뇌졸중의 후속 질환으로 나타나므로 한의학적 범주에서는 중풍(中風)에 해당한다고 볼 수있으며 그 증상의 양상에 따라 치매(痴呆), 건망(健忘)의 범주로 볼 수 있다14).
한의학에서 치매(痴呆)에 대한 최초의 언급은 명대 장개빈(明代 張介賓)의 ≪경악전서(景岳全書)≫41)에 “치애증은 평소엔 담이 없다가 울결이 생겼거나 풍을 맞았거나 생각을 많이 하였거나 의심이 생겼거나 놀랐거나 해서 점차 치애증이 된다. 말이 뒤죽박죽이고 거동이 경우에 맞지 않으며 때로는 땀을 많이 흘리거나 우수에 잠긴다. 그 증이 다양하고 기괴하여 이르지 않는 곳이 없다. 맥은반드시 현하거나 삭하거나 대하거나 소하여 변화무상하다(痴獃症 凡平素無痰 而或以鬱結 或以不遂 或以思慮 或以疑惑 或以驚恐而 漸至痴獃 言辭顚倒 擧動不經 或多汗 或善愁 其症則千奇萬怪 無所不至, 脈必或弦或數, 或大或小, 變易不常)…”라고 한 것에 서 볼 수 있으며, 이후 청대(淸代)의 석실비록(石室秘錄)42), 변증기문전서(辨證奇門全書)43) 등에서 치애(痴獃)와 매병(呆病)의 병인병기(病因病機)와 증후(症候)에 관하여 설명하고 있다.
중의학에서는 혈관성 치매를 선망(善忘), 치매(痴呆), 중풍치매(中風痴呆) 등의 범주로 보고 있으며, 임상증상으로는 건망(健忘), 반응지둔(反應遲鈍), 기억력감퇴(記憶力減退), 계산능력저하(計算能力低下), 판단장애(判斷障碍), 대소변실금(大小便失禁), 수족마목(手足痲木), 반신불수(半身不遂) 등이 있다고 하였다. 그 병인병기(病因病機)는 대부분 본허표실(本虛表實), 허실협잡(虛實挾雜)으로 신정허손(腎精虛損), 간양상항(肝陽上亢)이 표(標)가 되고, 중풍(中風) 이후에 뇌락(腦絡) 에 어조(瘀阻) 등이 생겨 뇌수(腦髓)가 손상(損傷)되어 신(腎)의 정기 (精氣)가 뇌(腦)에 도달하지 못하여 원신(元神)이 실양(失養)되어 본병(本病)이 된다고 보아 치료에 있어 표본겸치(標本兼治)를 중요시하였다44).
본 연구에서 사용된 주작환(朱雀丸)은 ≪의학입문(醫學入門)≫16)에 수록된 처방으로 복신(茯神) 80 g, 침향(沈香) 20 g을 가루 내어 팥알정도 크기로 빚은 후 30환을 식후에 인삼(人蔘) 달인 물로 복용한다. 복신(茯神)은 영심안신(寧心安神), 이수(利水)의 효능이 있어 심허(心虛)로 인한 경계건망(驚悸健忘)과 불면경간(不眠驚癎)을 치료하고, 침향(沈香)은 경락(經絡)을 소통시켜 혈(血)이 기(氣)를 따라 행(行)하게 하며 제기(諸氣)를 기르고 위기(衛氣)를 보(保)하며 진기(眞氣)를 강(剛)하게하는 효능이 있다. 인삼(人蔘)은 대보원기(大補元氣), 고탈생진(固脫生津), 안신익지(安神益智)의 효능이 있어 정신(精神)을 안정시키며 경계(驚悸)를 그치게 하고 사기(邪氣)를 제거하며 모든 기허증(氣虛證)에 양호한 효과를 나타내는 약재이다4546).
본 실험에서는 한의학(韓醫學)에서 신경안정제(神經安靜劑) 및 치매 치료제(痴呆 治療劑)로 알려져 있는 주작환(朱雀丸)의 허혈성 뇌손상에서 인지 및 운동기능 회복효과를 mild stroke 동물 모델인 tMCAO 백서304748)에서 평가하기 위해, 주작환(朱雀丸) 125, 250 및 500 mg/kg을 tMCAO 유발 2시간 후부터 매일 10일간 경구투여하고, 체중, infarct volume, 신경학적 운동행동 및 인지적 운동행동 검사의 변화를 관찰하였으며, infarct 주변부위의 대뇌 위축, 변성 신경세포의 수, caspase-3 및 PARP 면역반응 신경세포의 수적 변화를 조직병리학적 및 면역조직화학적 방법으로 각각 관찰하였다. 신경학적 운동행동 검사로 limb placing test26) 및 body swing test27)를 tMCAO 1일전, tMCAO 1, 3, 7 및 10일 후에 각각 측정하였으며, 인지적 운동행동 검사로, water maze test를 Moriss의 방법28)에 따라 tMCAO 10일 후 측정하였다.
중대뇌동맥(middle cerebral artery)의 국소적인 폐쇄는 사람에서 가장 흔한 뇌졸중의 원인으로 알려져 있다49). Tamura 등50)에 의해 처음 개발된 백서 MCA 폐쇄술 (MCAO)은 사람의 뇌졸중에서와 거의 유사한 병리 및 증상을 나타내어4951), 사람의 뇌졸중에 대한 병리와 증상을 연구하는 대표적인 동물 모델로 알려져 있고49), 현재 뇌졸중 치료제 개발에서 가장 일반적으로 이용되고 있다52). 백서에서 MCAO에 대한 기본적인 병리생리학적 연구 역시 많이 수행되어 있고, 기본 자료가 풍부하여 결과 판단에 매우 용이하다5354). 혈관내 필라멘트 (filament) 삽입을 이용한 일시적인 국소 뇌허혈 동물 모델(transient MCAO, tMCAO)은 Koizumi 등55)에 의해 처음 개발된 동물 모델로, 외과적 필요에 따라 필라멘트를 제거하여 재관류를 실시할 수 있어29), 비교적 경미한 뇌졸중에 대한 동물 모델로 각광 받고 있 다304748). 일반적으로 tMCAO 동물 모델에서의 약효 평가는 경색부위(infarct volume), 운동신경(sensorimotor function) 및 인지 행동장애(cognitive motor behavior), 뇌부종 또는 위축 정도, 대뇌 피질의 조직병리학적 변화를 기초로 평가하고 있다3052).
본 실험의 결과 이전의 연구들과 유사하게30474852), tMCAO에 의한 현저한 체중 감소, 신경학적 및 인지적 운동행동 장애소견, 즉 limb placing test score의 증가, 우측으로의 body swing 횟수 및 비율의 감소, escape platform까지의 이동거리 및 시간의 증가와 반복적 trial에 따른 이동거리 및 시간의 단축의 억제가 나타났다. 또한 infarct 주변부위의 조직병리학적 표본에서 유발 우측 대뇌반구의 위축, 대뇌 피질내 단위 면적당 변성 신경원, caspase-3 및 PARP 양성 신경원의 수적 증가가 초래되었다. 이러한 tMCAO에 의한 체중 감소, 신경학적 및 인지적 운동행동 장애 및 infarct주변부위 대뇌 피질 신경원의 변성 소견은 주작환 (朱雀丸) 125, 250 및 500 mg/kg 투여에 의해 각각 현저히 억제되었다. 따라서 주작환(朱雀丸)이 stroke와 같은 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애에 매우 유효한 효과를 나타내는 것으로 판단된다.
tMCAO에 의한 허혈성 뇌손상이 진행됨에 따라 인지 및 운동장애가 초래되고, 결과적으로 현저한 체중 저하가 수반된다56-58). 본 실험의 결과에서도 tMCAO 7일 후부터 sham 대조군에 비해 유의성 있는(p<0.01) 체중의 감소가 모든 tMCAO 수술군에서 나타났으며, 실험기간 동안 증체량 역시 sham 대조군에 비해 유의성 있는(p<0.01) 감소를 나타내었다. 그러나 모든 세 용량의 주작환(朱雀丸) 투여군에서 tMCAO 대조군에 비해 유의성 있는(p<0.01 또는 p<0.05) 체중의 증가가 tMCAO 7일 후부터 투여 용량 의존적으로 나타났다. 이러한 결과는 주작환(朱雀丸)이 tMCAO에 의한 인지 및 행동장애에 의한 체중 감소를 억제하는 직접적인 증거로 판단된다.
TTC는 조직내 탈수소효소(dehydrogenase)와 반응하여 정상조직은 붉은 색으로 관찰되나 허혈성 손상 조직에서는 탈수소효소가 소실되어 백색으로 염색되므로 비가역적 허혈성 뇌손상의 유무를 관찰하는데 흔히 이용된다59). tMCAO시비가역성의 심한 허혈성 뇌손상, 즉 infarct이 형성 된다3052). 본 실험에서도 tMCAO 10일 후 최종 부검 시 tMCAO 대조군에서는 TTC 염색 소견에서 대뇌피질의 국소 infarct 소견이 나타났으며, sham 대조군에 비해 유의성 있는(p<0.01) infarct volume의 증가가 나타났다. 그러나 본 실험에 사용한 세 용량의 모든 주작환(朱雀丸) 투여군에서는 tMCAO 대조군에 비해 유의성 있는(p<0.01) infarct volume의 감소가 투여 용량 의존적으로 나타나 주작환(朱雀丸)이 허혈성 뇌손상에 대한 직접적인 보호 효과를 나타내는 것으로 판단된다.
현재까지 수많은 연구들이 허혈성 뇌손상에 의해 초래되는 infarct size의 변화에만 중점을 두고 후보물질의 약효를 평가해다526061). 그러나 최근 들어, MCAO 모델에서 infarct size의 현저한 감소를 동반한 경우에도 허혈성 뇌손상에 의해 초래되는 인지 및 행동장애에서는 별다른 변화가 관찰되지 않는 경우가 빈번히 보고되고 있다6263). 또한 일부 infarct volume에 영향을 미치지 않는 것으로 알려진 약물들이 오히려 허혈성 뇌손상에 의해 초래되는 인지 및 행동장애는 현저히 감소시킨다고 보고되는 등63-66) infarct volume과 인지 및 행동장애와의 상관관계를 명확히 해야 할필요성이 대두되고 있어 적절한 신경학적 운동행동 및 인지 적 운동행동 검사의 필요성이 요구되고 있다. 이중 limb placing test는 대표적인 신경학적 운동행동 검사로 전지 및 후지의 배치 이상을 등급화 하여, 등급이 높을수록 심한 신경학적 운동행동 이상을 나타낸다26). 또한 body swing test 역시 빈번히 사용되는 신경학적 운동행동 검사로27) 정상동물에서는 좌우측으로의 body swing이 대략적으로 1:1인 반면, 허혈성 뇌손상이 있는 동물에서는 손상 부위로의 body swing이 현저히 감소되어 나타난다. Morris28)의 water maze test 는 대표적인 인지적 운동행동 검사로, 인지행동 장애가 있는 경우 escape platform으로의 이동거리 및 시간이 현저히 연장되며, 특히 trial을 반복할 경우에도 이들 거리 및 시간의 감소가 현저히 억제 된다52). 본 실험의 결과, 주작환(朱雀丸)의 경구투여는 limb placing, body swing 및 water maze test에서 mild stroke 모델인 tMCAO에 의해 초래되는 신경학적 및 인지적 운동행동 이상 소견을 투여 용량 의존적으로 현저히 억제하였다. 이러한 결과는 주작환(朱雀丸)이 허혈성 뇌손상 백서에서 인지 및 운동기능을 회복시키는 직접적인 증거로 판단된다.
본 연구의 결과, Lee 등30)의 tMCAO 백서에서와 유사하게 허혈성 뇌손상에 의해 초래된 infarct 주변부위에 현저한 대뇌피질의 위축이 초래되었으나, 주작환(朱雀丸)은 infarct 주변부위에 대뇌피질의 위축을 유의성 있게(p<0.01) 억제하였으며, 대뇌피질에서 단위 면적당 변성 신경원의 증가역시 유의성 있게(p<0.05) 억제하였다.
Caspase-3 및 PARP는 대표적인 apoptosis 마커로6768), 대뇌피질에서 이들 caspase-3 및 PARP의 증가는 apoptosis에 의한 뇌 손상의 증가를 의미하며, tMCAO 시에도 현저한 대뇌피질내 caspase-3 및 PARP의 발현 증가가 잘 알려져 있다6970). 본 실험의 결과, 세 용량의 모든 주작환(朱雀丸)의 경구투여는 tMCAO에 의해 유발되는 대뇌피질에서 caspase-3 및 PARP 면역반응세포의 수적 증가를 유의성있게(p<0.05) 억제하였다. 따라서 주작환 (朱雀丸)의 구성성분인 복신17-19), 침향20-22) 및 인삼23-25)은 허혈성 뇌손상이 초래되는 인지 및 운동기능 장애에 매우 유효한 회복 효과를 보인 것으로 판단된다.
이상에서, 주작환(朱雀丸)은 mild stroke 모델인 tMCAO에서 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애에 매우 유효한 효과를 나타내는 것으로 관찰되었다. 주작환(朱雀丸)은 복신(茯神), 침향(沈香) 및 인삼(人蔘) 등3종의 약재로 구성되어 있으며, 각 약재는 수많은 생리활성물질을 함유하고 있어, 구성 약재 각각의 생리활성 성분의 검색과 더불어 금후 다양한 방면으로 기전적인 연구를 더 수행해야 할 것으로 판단된다.
tMCAO로 유발한 일시적 국소 뇌허혈 유발 백서에 주작환(朱雀丸)을 투여한 후 측정한 결과, 다음과 같은 결론을 얻었다.
1. 주작환(朱雀丸)은 모든 용량에서 tMCAO 7일 후부터 실험 전기간에 걸쳐 대조군에 비해 유의성 있는 체중의 증가를 나타내었다.
2. 주작환(朱雀丸)은 모든 용량에서 tMCAO 7일 및 10일 후에 대조군에 비해 유의성 있는 Forelimb placing test 점수의 감소를 나타내었다.
3. 주작환(朱雀丸)은 모든 용량에서 tMCAO 7일 및 10일 후에 대조군에 비해 유의성 있는 Hindlimb placing test 점수의 감소를 나타내었다.
4. 주작환(朱雀丸)은 모든 용량에서 tMCAO 3일 후부터 실험 전 기간에 걸쳐 대조군에 비해 유의성 있는 우측으로의 body swing 횟수 및 비율의 증가를 투여 용량 의존적으로 나타내었다.
5. 주작환(朱雀丸)은 모든 용량에서 tMCAO 10일 후에 대조군에 비해 유의성 있는 escape platform까지의 이동거리 감소가 trial 2 및 3에서 나타났으며, 이동시간의 유의성 있는 감소 역시 모든 trials에서 투여 용량 의존적으로 나타내었다.
6. 주작환(朱雀丸)은 모든 용량에서 대조군에 비해 유의성 있는 infarct volume의 감소를 투여 용량 의존적으로 나타내었다.
7. 주작환(朱雀丸)은 모든 용량에서 대조군에 비해 유의성 있는 대뇌 피질 위축 억제 및 대뇌 피질내 변성 신경원, caspase-3 및 PARP 면역 반응세포의 수의 감소를 투여 용량 의존적으로 나타내었다.
이상의 결과로 미루어 보아 주작환(朱雀丸)은 허혈성 뇌손상에 따른 신경학적 및 인지적 운동행동 장애에 매우 유효한 효과를 나타내었다.