배기가스 중에서 비산재는 수은을 산화하거나 흡착하는 능력을 지닌다. 비산재의 수은 산화 및 흡착 효율은 비산재가 가지는 특성에 따라 변하여 일정하지 않다. 본 연구는 비산재 성분과 수은의 반응특성을 이해하기 위하여 비산재 성분물질이 원소수은과 산화수은에 대해 가지는 산화 및 흡착 능력을 평가하였다. 그리고 비산재 시료의 조성에 맞게 합성한 비산재를 시험하였고, 석탄화력발전소에서 수령한 비산재 시료의 결과와 비교하였다. 원소수은에 대해서는 미세탄소분말, 산화구리, 산화철이 높은 산화 또는 흡착효율을 보였고, 염화수은에 대해서는 미세탄소분말, 산화칼슘, 산화구리, 산화마그네슘이 높은 효율을 보였다. 그리고 합성비산재는 비산재 시료와 유사한 수은 산화 및 흡착 효율을 보였다.
석탄에 존재하던 무기물질들은 석탄 연소과정에서 재로 변하고, 이 중 입자가 작고 가벼운 재는 비산하여 배기가스 중에 존재하게 되어 비산재(fly ash)라고 일컫는다. 비산재는 열회수 과정을 거치는 동안 배기가스에 존재하게 되며 입자제어설비에 이르러 배기가스로부터 분리되고 포집된다. 석탄에존재하는 유해물질 가운데 수은은 석탄 연소과정에서 가스상으로 배출되는데, 석탄 배기가스 내에서 수 ppb 농도로 존재하고, 이 중 일부만 입자제어설비 및 탈황설비 등에서 포집된 후 나머지는 대기로 배출된다[1-2]. 입자제어설비 및 탈황설비에서 포집되는 수은의 양은 배기가스에 존재하는 수은의 형태에 큰 영향을 받는다. 일반적으로 다른 물질과 결합하지 않는 원소상태의 수은(원소수은)은 포집되지 않고 대부분이 대기로 배출되는 것으로 알려져 있다[1]. 반면에 산화된 형태의 수은(산화수은)은 배기가스 상에서 또는 입자제어설비에서 비산재에 일부 흡착되거나 탈황제로 사용되는 알칼리성 물질에 상당부분 포집되는 것으로 나타났다[3]. 배기가스에 존재하는 원소수은과 산화수은의 비율은 배기가스의 흐름에 따라 공정의 지점마다 서로 다른 결과를 보인다. 수은의 산화도에 영향을 미치는 인자로는 연료의 종류 및 성상, 연소조건, 배기가스 온도, 배기가스 조성, 비산재 성분, 입자제어설비 및 탈황설비의 특성 등 매우 많은 인자들이 알려져 있고, 이에 대한 연구는 현재도 많은 연구자들에 의해 진행 중에 있다[4-5]. 그리고 본 연구에서는 비산재 성분에 의한 수은의 산화 및 흡착에 대하여 다루고자 한다. 비산재와 수은은 연소로에서부터 입자제어설비까지 상대적으로 오랜 시간 동안 배가가스 중에서 접촉하므로, 비산재가 배기가스 내에서 수은의 산화 및 흡착에 미치는 영향이 클 것임을 예상할 수 있다. 또한 비산재의 성분은 연소된 석탄의 종류에 따라 일정하지 않고, 많은 성분으로 구성되어 있어 비산재와 수은은 매우 복잡한 반응의 형태를 보일 것임을 예상할 수 있다.
비산재와 수은의 산화 및 흡착 특성을 이해하기 위하여 많은 연구들이 진행되어 왔다. Serre and Silcox[6]는 연구초기 단계로서 질소 바탕가스에 수은을 주입하여 석탄 비산재를 시험한 결과 원소수은의 흡착량이 비산재의 미연소탄소분 함량에 따라 증가하지만, 직선적으로 비례하지는 않는 결과를 보여주었다. Dunham et al.[7]은 16가지 석탄 비산재 시료를 고정층 실험장치를 이용하여 원소수은(Hg), 염화수은(HgCl2)에 대한 흡착 특성을 평가하였다. 그 결과 비산재 내에 산화철과 미연소탄소의 함량이 수은 산화 및 흡착에 큰 역할을 하는 것으로 나타났다. 그리고 각 비산재 시료에 대하여 원소수은 및 염화수은에 대한 흡착능력은 서로 비슷한 것으로 나타났다. Norton et al.[8]은 서로 다른 철 함량을 가진 비산재를 모사가스를 이용하여 시험한 결과 산화철 함량이 상대적으로 적은 비산재가 오히려 더 높은 원소수은 산화율을 보였다. 일반적으로 산화철은 원소수은의 산화에 기여하는 것으로 알려져 있으므로, 이 실험결과는 비산재 성분 중에서 산화철 이외에 원소수은을 산화하는 중요한 성분이 존재함을 보여주고 있다. Ghorishi et al.[9]은 산화알루미늄(Al2O3), 이산화규소(SiO2), 산화철(Fe2O3), 산화구리(CuO), 산화칼슘(CaO) 중 3~4가지 성분을 혼합하여 시료를 제조한 후 각 시료의 원소수은 산화효율을 분석함으로써 비산재 성분과 원소수은과의 반응 특성을 평가하고자 하였다. 성분들 가운데 Fe2O3, CuO와 같은 전이금속 산화물들은 원소수은 산화력이 매우 높은 것으로 나타난 반면에 Al2O3, SiO2, CaO는 원소수은을 거의 산화하지 않는 것으로 나타났다. 그러나 배출되는 수은을 원소수은과 산화수은으로 분리하여 종분석을 수행하지 않았으므로 각 성분이 원소수은의 산화와 흡착 중에 어느 곳에 관여하였는지는 이 연구결과로부터 알 수 없다. Bhardwaj et al.[10]은SiO2, Al2O3, 산화마그네슘(MgO), CaO, 이산화티타늄(TiO2), Fe2O3, 미세탄소분말과 원소수은의 반응 특성을 실험하였으며 수은의 종분석도 수행하였다. 그 결과 Al2O3, SiO2, CaO, MgO, TiO2는 원소수은의 산화 및 흡착 효율이 모두 매우 낮은 것으로 나타났으며, Fe2O3와 미세탄소분말은 원소수은의 산화와 흡착에 대하여 높은 효율을 나타내었다. 이상의 연구동향을 요약해 보면, 비산재의 성분 가운데 Fe2O3, CuO, carbon black 의 영향이 가장 큰 것으로 나왔으나, 각 성분이 수은의 산화 및 흡착에 기여하는 정도는 비교분석되지 않았다. 그리고 지금까지의 연구결과는 주로 원소수은에 대해서만 국한되어 있다.
본 연구는 비산재 성분과 수은의 반응 특성에 대한 이해도를 높이기 위하여 비산재 성분인 SiO2, Al2O3, CaO, MgO, TiO2, CuO, Fe2O3, 미세탄소분말이 원소수은과 산화수은에 대해 가지는 산화 및 흡착 능력을 평가하였다. 그리고 원소수은 실험에서는 수은 종분석을 수행하여 비산재의 각 성분이 수은의 산화 및 흡착에 기여하는 정도를 성분별로 비교분석하였다. 또한 비산재를 합성하여 시험한 결과를 비산재 시료의 시험 결과와 비교함으로써 비산재의 수은 산화 및 흡착능력에 비산재 성분이 미치는 영향을 조사하였다.
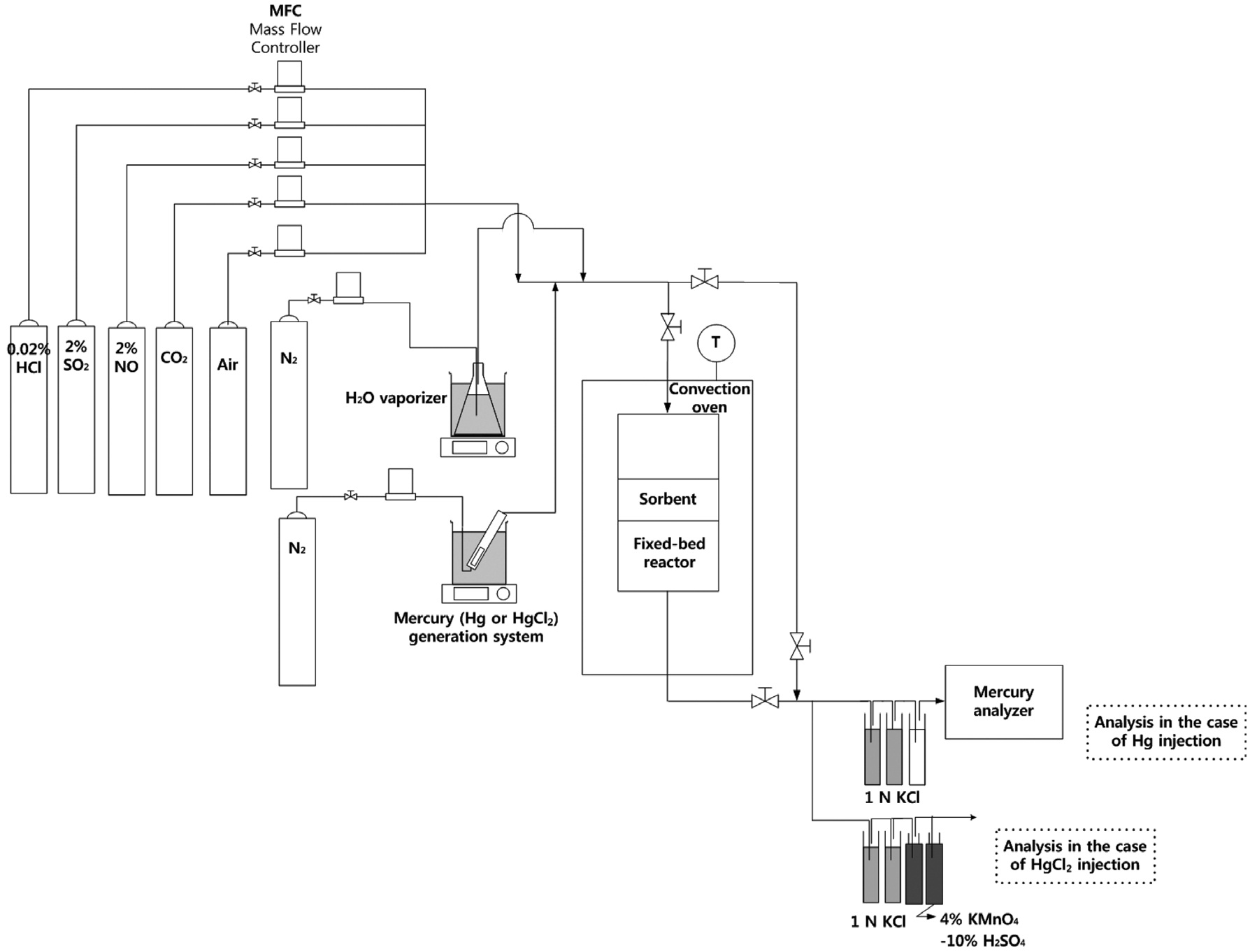
비산재 시료, 비산재 성분 물질과 수은의 상호 반응 특성을 조사하기 위하여 Figure 1과 같은 고정층 실험장치를 구성하였다. 실험장치는 크게 모사가스 주입부, 고정층 반응부, 수은분석부로 구분할 수 있다. 모사가스 제조를 위하여 99.99% 질소, 99.99% 이산화탄소, 0.02% 염화수소, 2% 이산화황, 2% 일산화질소, 공기를 함유한 실린더를 사용하였다. 각 실린더에서 나오는 가스의 유량을 정밀하게 조절하기 위하여 질량유량조절기(mass flow controller, Brooks Model 5850E, Brooks Instru-ment, USA)를 사용하였다. 수증기는 미리 일정한 온도로 유지시킨 수조에 물이 들어있는 삼각플라스크를 넣고, 질소 가스를 흘려 넣어주어 주입하였다. 이 때 발생된 수증기가 응축되는 것을 방지하기 위하여 가스가 흐르는 테플론관(teflon tubing)을 가열 테이프(heat tape)로 감아 100 ℃ 이상의 온도를 유지하였다. 원소수은 또는 염화수은 증기를 발생시키기 위하여 각각의 투과관(permeation tube, Dynacal permeation tubes, VICI Me-tronics, USA)을 사용하였다. 투과관을 유리관에 넣고 가열판(hot plate, Fisher Scientific Isotemp Digital Stirring Hotplates, Fisher Scientific, USA)를 이용하여 일정한 온도로 유지시킨 수조에 넣은 후, N2 가스를 투과관이 들어있는 유리관에 흘려 넣어주어 Hg 또는 HgCl2 증기를 발생시켰다. 석탄 연소가스 조성비를 모사하기 위하여 모사가스 주입부에서 12% CO2 , 7% H2O, 5% O2 , 500 ppm SO2 , 200 ppm NO, 20 ppm HCl, 60~80 μg/m3 Hg 또는 HgCl2 , balance N2 의 조성을 가지는 가스가 제조되었다. 본 연구에서 산화수은을 대표하는 물질로 염화수은을
사용한 이유는 배기가스 중에서 산화수은은 대부분 염화수은의 형태로 존재하는 것으로 예상되기 때문이다[1]. 고정층 반응부에는 내경 1.27 cm의 고정층 반응기를 강제순환오븐(OF-22GW, Jeio Tech, Korea) 안에 위치시켜 일정한 온도가 유지되도록 하였다. 고정층 반응부의 온도는 석탄화력발전소에서 열교환기 이후의 배기온도와 입자제어설비의 온도를 고려하여 140 ℃로 유지하였다. 수은 분석부에서는 수은분석에 일반적으로 통용되는 습식법인 온타리오 하이드로법을 적용하고, 가스상 원소수은 분석기(RA-915M, Lumex, Cyprus)를 이용하였다. Figure 1에는 Hg이 주입되었을 경우와 HgCl2가 주입되었을 경우의 수은 분석부 모식도를 각각 보여주고 있다. 먼저 Hg이 주입되는 경우에는 임핀져 두 개에 1 N 염화칼륨수용액을 넣어 산화수은이 포집되도록 하였고, 20% 수산화나트륨수용액을 두어 산성가스로 인한 수은분석기 간섭을 방지하였다. 임핀져를 통과한 가스는 원소수은 분석기를 통과하게 하여 배출되는 원소수은의 농도를 연속적으로 측정할 수 있도록 하였다. 그리고 HgCl2가 주입되는 경우에는 원소수은 분석기를 사용하기에 제약이 있어 습식법을 통한 수은 분석만 실행하였다. Figure 1에서 보는 바와 같이 첫 번째와 두 번째 임핀져에는 1 N KCl 수용액을 넣었고, 세 번째와 네 번째 임핀져에는 4% 과망간산칼륨-10% 황산수용액을 넣어 배출되는 수은을 모두 포집하였다.
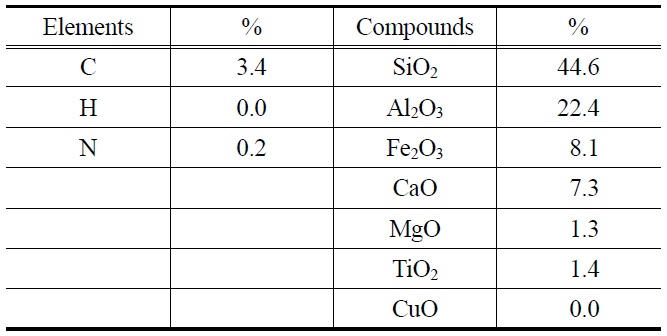
본 실험에서 사용한 시료의 양은 100 mg이고, 각 시료를 SiO2 (granules, Fisher Scientific, USA) 6 g과 혼합한 후 고정층 반응기에 위치시켰다. 산화규소 과립을 사용하는 이유는 고정층 반응기내 압력강하를 감소시키고, 적은 양의 시료가 고정층 내에서 고르게 분포되도록 하기 위함이다. 그리고 예비실험에서 6 g SiO2를 원소수은과 염화수은에 대하여 반복 시험한 결과 0~4% 범위에서 수은 저감을 나타내었고, 4% 정도의 상대적으로 높은 수준의 수은 저감은 주입농도의 변동폭이 컸던 염화수은 실험에서 나타났다. 따라서 원소수은 및 염화수은에 대한 SiO2의 반응성은 무시할 수 있을 정도로 낮음을 확인하였다. 비산재의 성분을 대표하는 물질로 사용된 TiO2, Al2O3, MgO, CaO, CuO, Fe2O3는 삼전화학에서 구매하였다. 비산재에 포함된 미연소 탄소는 미세탄소분말과 유사한 특성을 가지는 것으로 문헌에 보고되어 있어[11], 미세탄소분말을 Cabot Corporation으로부터 구매하여 사용하였다. 그리고 석탄 화력발전소로부터 수거한 비산재도 100 mg을 실험에 사용하였으며, 이 비산재를 성분 분석한 결과는 Table 1에 나타나있다. 비산재 시료에 대한 원소분석은 표준분석법(ASTM D5373-08)에 따라 수행하였으며, 무기화합물에 대한 분석은 X-선 형광분석기(X-ray fluorescence spectrometry, XRF)를 이용하였다. Table 1에 나타난 조성을 바탕으로 비산재 성분을 혼합하여
[Table 1.] Elements and compounds in the fly ash sample
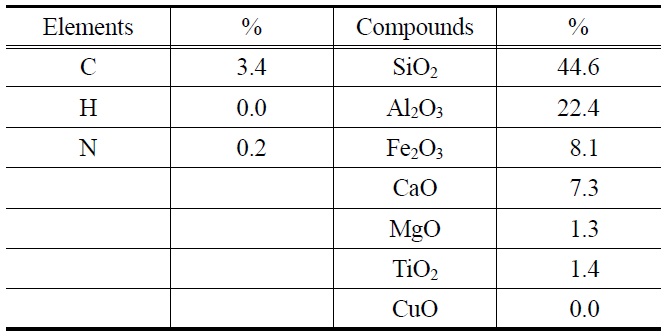
Elements and compounds in the fly ash sample
합성 비산재 시료를 제조하였다. 다만 비산재의 성분분석 결과에서 100%에 미달하는 함량만큼은 원소수은 및 염화수은과의 반응성이 매우 낮은 SiO2로 보충하여, 100 mg 합성비산재를 제조하였다.
각 시료를 고정층 반응기에 위치시킨 후 오븐의 온도를 140℃로 승온하였다. 오븐을 승온하는 동안 모사가스는 우회경로(bypass line)를 통하여 흐르도록 하여 모사가스 중의 수은 농도가 60~80 μg/m3 범위에서 일정하게 유지됨을 확인하였다. Hg 실험의 경우에는 가스상 원소수은 분석기를 이용하여 확인하였고, HgCl2 실험의 경우에는 1 N KCl 수용액과 4%KMnO4-10% H2SO4 수용액을 반복 분석하여 확인하였다. 오븐의 온도가 140 ℃로 일정하게 유지되고, 모사가스 중의 HgCl2의 농도가 60~80 μg/m3 범위에서 일정하게 유지됨을 확인한 이후에 모사가스를 고정층 반응기 내의 시료에 주입하여 실험을 시작하였다. Hg 실험의 경우 시료를 거쳐 배출되는 가스에 존재하는 산화수은 농도는 1 N KCl 흡수액을 액상 수은분석기(RA-3060, NIC, Japan)를 이용하여 분석한 후 결정하였고, 배출가스에 존재하는 원소수은의 농도는 가스상 원소수은 분석기를 통해 결정하였다. HgCl2 실험의 경우에는 1 N KCl 흡수액과 4% KMnO4-10% H2SO4 흡수액을 액상 수은분석기를 이용하여 분석하여 배출되는 수은의 농도를 결정하였다.
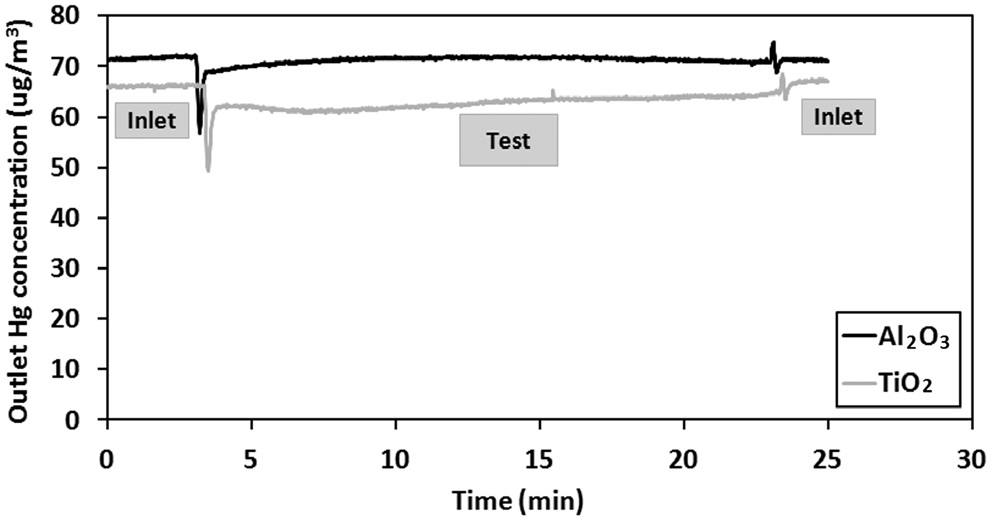
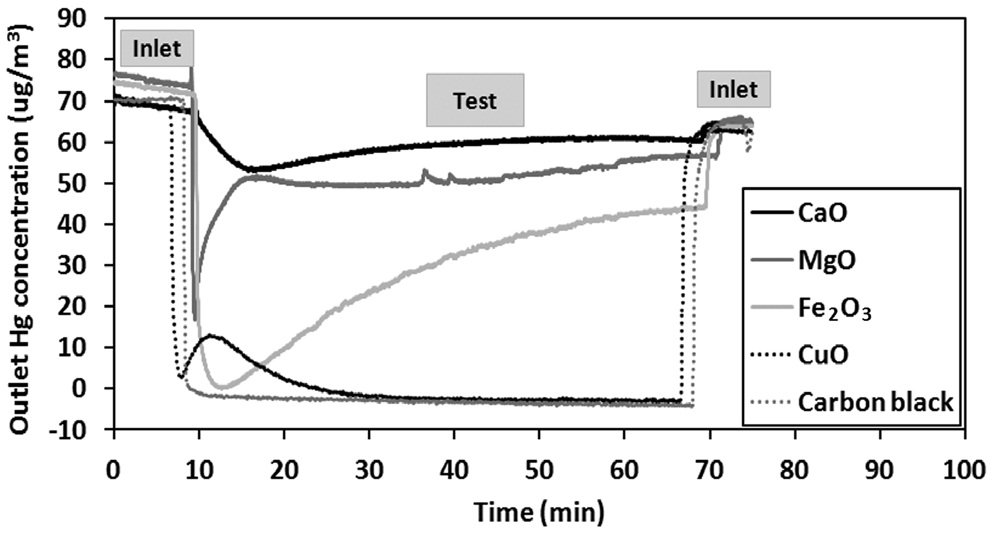
Hg에 대한 비산재 성분의 산화 및 흡착능력은 가스상 원소수은 분석기에서 연속적으로 측정된 결과를 분석함으로써 먼저 평가할 수 있다. Figure 2와 3은 비산재의 각 성분을 시험하는 동안 배출되는 원소수은의 농도변화를 보여주고 있다. 또한 시험을 전후로 우회경로를 이용하여 원소수은의 주입농도가 60~80 μg/m3 범위에서 일정하게 유지되는 것도 확인하였다. 본 연구는 각 성분의 흡착능력을 서로 비교하는데 목적이 있으므로, 각 성분에 대하여 동일한 시간동안 시험을 진행하였다. 앞 단원에서 설명한 바와 같이 원소수은 분석기를 통한 측정은 배출되는 산화수은을 흡수한 이후에 이루어지므로, 시료가 원소수은을 산화하거나 흡착하는 모든 경우에 대해 배출되는 원소수은의 농도가 감소된다. 그리고 시료가 원소수은을 산화하였는지 흡착하였는지 여부는 KCl 용액 분석
결과를 통하여 알 수 있다. Figure 2는 TiO2와 Al2O3에 대한 결과로 배출 원소수은 농도가 주입 농도와 거의 동일함을 보여주고 있다. 이는 TiO2와 Al2O3가 모사가스 조건에서 원소수은을 산화하거나 흡착하지 않음을 보여준다. 그리고 Figure 3을 통해 미세탄소분말과 CuO는 원소수은과 매우 높은 반응성을 가지고, CaO와 MgO는 상대적으로 낮은 반응성을 가짐을 알 수 있다. 이는 미세탄소분말이 원소수은에 대해 높은 흡착력을 가지고, CuO의 높은 산화력을 가지는 반면에, 알칼리성분인 CaO와 MgO는 원소수은의 산화 및 흡착능력이 낮기 때문으로 판단된다. 그리고 비산재 성분이 원소수은의 산화와 흡착 각각에 대해 미치는 영향은 수은의 종분석 결과를 토대로 평가하였다.
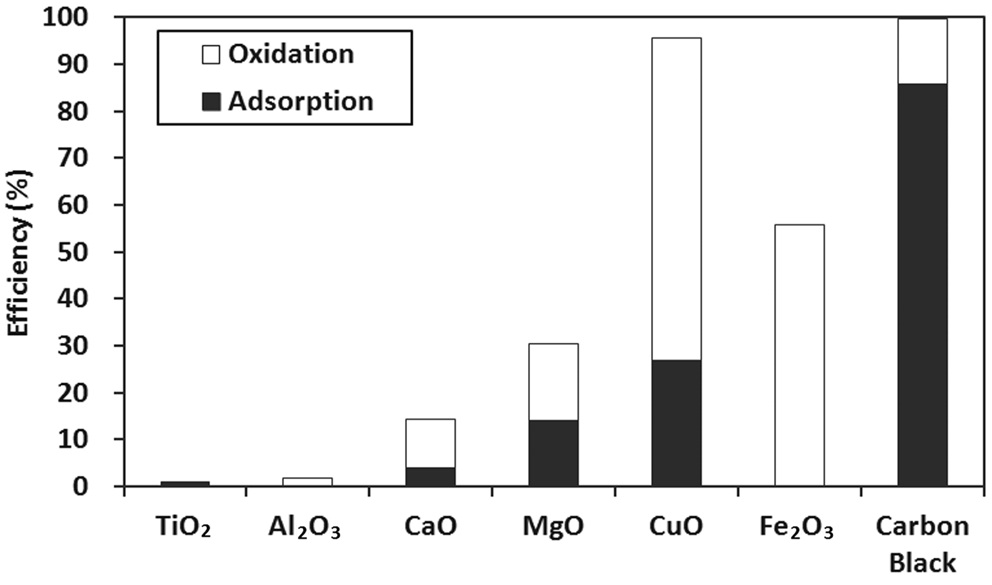
수은에 대한 종분석은 다음과 같은 방법으로 실시하였다. Figure 2와 3에 나타난 결과를 통해 각 성분을 시험하는 동안 배출되는 원소수은의 농도를 구하였고, 시험 전후로 우회경로를 이용하여 측정된 결과를 평균하여 원소수은의 주입농도를 구하였다. 배출되는 산화수은의 농도는 실험이 끝난 후 KCl용액을 분석하여 구하였으며, 원소수은 주입농도에서 원소수은의 배출농도와 산화수은의 배출농도를 차감하여 수은 흡착농도를 구하였다. 이와 같은 방법으로 시료의 수은 산화효율과 흡착효율을 결정하였으며, 결과는 Figure 4에 나타나있다.
Figure 4의 수은 종분석 결과를 통해 CuO는 수은의 산화에 주로 관여하고, 미세탄소분말은 수은의 흡착에 주로 관여함을
알 수 있다 . 그리고 Fe2O3는 수은의 산화에만 관여하는 것으 로 나타났다 . 이 실험결과로 판단해 볼 때 , Fe2O3, CuO, 미세탄 소분말은 수은과의 반응성이 커서 비산재의 수은 산화 및 흡착 에 이 성분들이 매우 중요할 역할을 함을 알 수 있다 .
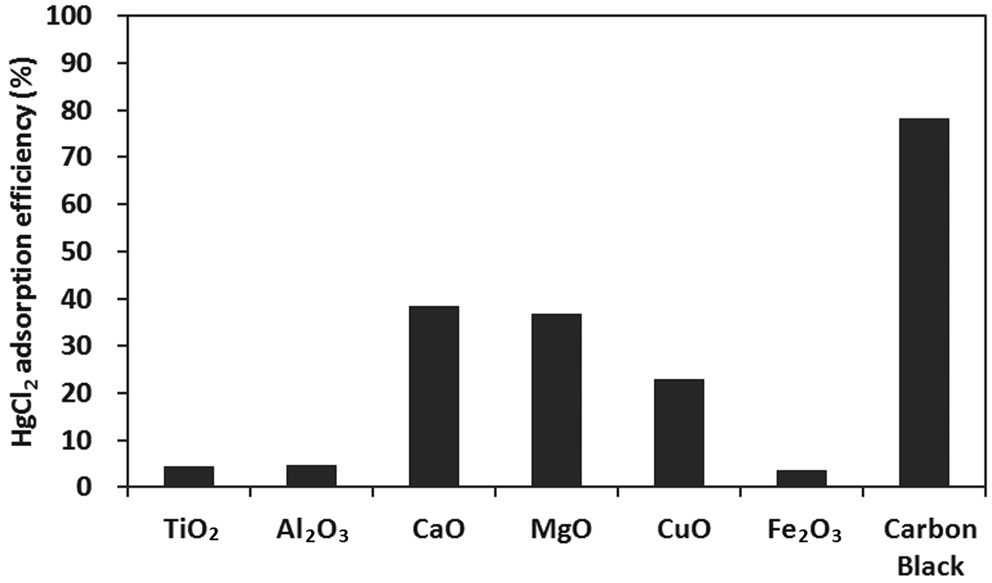
HgCl2 실험에서는 원소수은 분석기를 사용하기에 제약이 있어 습식법을 통한 수은 분석만 실행하였다 . 비산재 성분에 대한 시험에 들어가기 앞서 HgCl2의 주입농도를 반복 분석하 여 모사가스 중의 HgCl2의 농도가 60~80 μg/m3 범위에서 일정 하게 유지됨을 확인하였다 . 또한 시험을 마친 후에도 HgCl2 의 주입농도를 분석하여 시험 전후의 주입농도 변화 여부를 확인하였다 . 이와 같이 시험 전후로 측정된 결과를 평균하여 염화수은의 주입농도를 구하였으며 , 각 성분을 시험하는 동안 배출되는 HgCl2도 흡수액을 분석하여 구하였다 . 그리고 HgCl2 의 주입농도와 배출농도의 차이로부터 HgCl2에 대한 각 시료 의 흡착효율을 구하였다 .
Figure 5에 나타난 결과를 보면 알칼리성 물질인 CaO 와 MgO 가 HgCl2에 대한 흡착력을 가짐을 알 수 있다 . 그리고 전 이금속 중에서 CuO 는 HgCl22에 대한 흡착력을 가지지만 Fe2O3 는 흡착력이 거의 없는 것으로 나타났다 . 원소수은에 대한 실 험결과에서도 Fe2O3는 원소수은을 산화시키는 역할은 하지만,
산화된 수은이 전혀 Fe2O3에 흡착되지 않는 결과를 보였는데 , 유사한 결과가 HgCl2 실험에서도 나타났다 . HgCl22를 주입하 는 과정에서는 Hg와는 달리 시간에 따른 HgCl2 주입농도의 변동폭이 컸으므로 TiO2, Al2O3에 대한 흡착효율은 HgCl2 주 입농도의 변동폭에 따른 실험오차에 의해 발생한 것으로 판 단된다. 그리고 Hg 실험에서와 마찬가지로 미세탄소분말은 HgCl2에 대한 매우 높은 흡착효율을 보였다 . 따라서 배기가 스 중에서 비산재의 수은 흡착효율은 비산재의 미연소탄소분 함량에 따라 크게 변화할 것으로 예상되었다 .
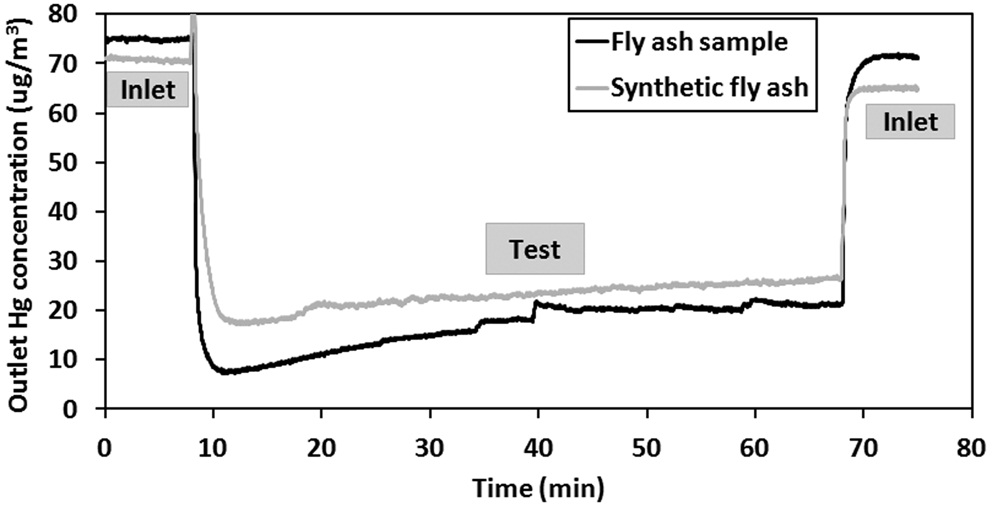
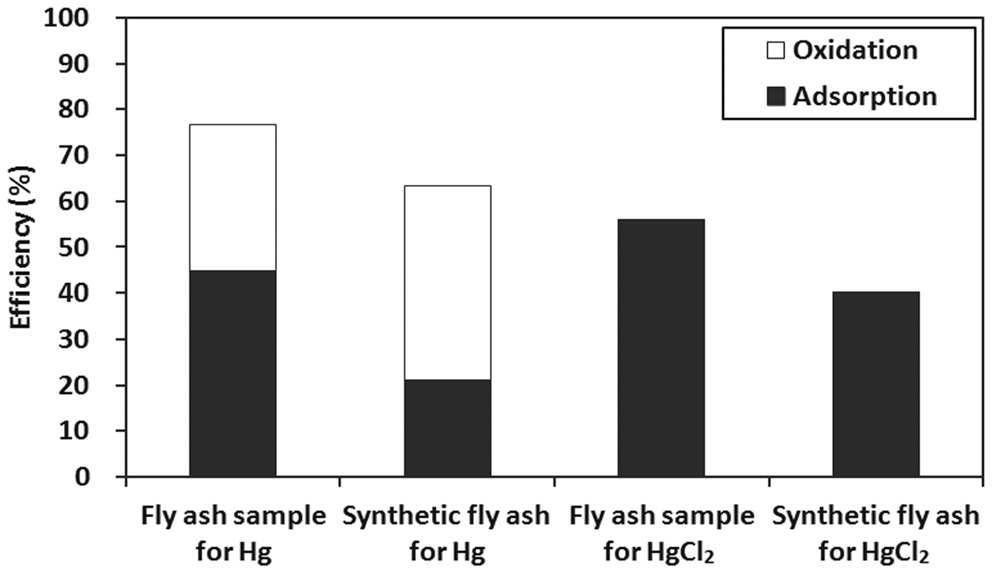
비산재의 수은 산화 및 흡착 능력에 비산재 성분이 미치는 영향을 조사하기 위하여 Table 1 에 나타난 비산재의 성분 함 량으로 비산재를 합성하여 Hg, HgCl2에 대한 실험을 수행하 였다. 그리고 이 결과를 비산재 시료의 실험결과와 비교하였 다. 시험에 사용된 합성비산재의 총 질량은 100 mg 이고, 비산 재 시료도 100 mg 이 시험에 사용되었다 . Hg 또는 HgCl2 실험 의 과정과 분석방법은 앞 단원들에서 설명한 내용과 동일하 다. Figure 6은 비산재 시료와 합성 비산재를 시험하는 동안 배출되는 원소수은의 농도를 보여주고 있다 . 그림에서 보면 합성 비산재가 비산재 시료보다 조금 낮은 수준의 효율을 보 여준다 . 그리고 Figure 7에 나타난 종분석 결과와 HgCl2 흡착 효율 결과에서도 합성 비산재가 비산재 시료보다 조금 낮은
수준에서 유사한 경향성을 보이고 있다 . 따라서 비산재의 수 은 산화 및 흡착효율을 결정하는 인자들 중에서도 비산재 성 분조성이 매우 큰 역할을 함을 알 수 있다 .
배기가스 중에서 비산재의 수은 산화 및 흡착특성을 이해 하기 위하여 비산재 성분이 원소수은과 염화수은에 대해 가 지는 산화 및 흡착 능력을 평가하고 , 비산재 시료의 조성에 맞게 비산재를 합성하여 시험한 결과 다음과 같은 결론을 얻 었다. 비산재 성분 중에서 원소수은과 반응성이 높은 물질은 Fe2O3, CuO, 미세탄소분말이며 , CuO 는 수은의 산화에 주로 관여하고 , 미세탄소분말은 원소수은의 흡착능력이 높았다 . 반면에 Fe2O3는 원소수은의 산화에만 관여하고 흡착능력이 매우 낮은 것으로 나타났다 . 알칼리성 물질인 CaO와 MgO, 전이금속인 CuO는 염화수은에 대한 흡착능력을 가지지만 , Fe2O3는 흡착력이 거의 없는 것으로 나타났다 . 미세탄소분말 은 염화수은에 대해서도 매우 높은 흡착효율을 보여 비산재 의 성분 가운데 수은 흡착에 가장 큰 역할을 하는 것으로 판 단되었다. 비산재 시료의 조성에 맞게 비산재를 합성하여 시 험한 결과 비산재 시료와 유사한 경향을 보여 , 비산재 성분 조성이 비산재의 수은 포집효율을 결정하는 매우 중요한 인 자가 됨을 알 수 있었다 .