본 논고에서는 가스 흡착․분리 산업에서 광범위하게 적용되고 있는 압력순환흡착(pressure swing adsorption, PSA) 기술의 전형적인 흡착조건인 15~40 ℃의 온도와 4~6 bar의 압력에서 금속-유기 골격체(metal-organic frameworks, MOF)와 제올라이트 이미다졸레이트 골격체(zeolite imidazolate frameworks, ZIF)의 CO2 흡착성능을 살펴보고 이들이 가지고 있는 장․단점을 분석해보고자 한다. CO2는 H2, CO, N2 및 CH4와 같은 기체분자들에 비해 큰 분극률을 가지므로 동일한 세공크기라면 흡착제의 비표면적이 클수록 높은 흡착량을 보이며, CO2의 분자크기(3.3 Å)보다 큰 세공으로 이루어진 흡착제라면 상기 흡 착조건에서의 CO2 흡착성능은 세공크기에 크게 영향을 받는다. MOF와 ZIF의 CO2 흡착성능은 이들의 골격을 이루는 금속 과 유기링커의 종류, 세공크기, 비표면적, 흡착조건(온도와 압력) 등에 따라 달라질 수 있지만, 특히 흡착압력의 영향이 절 대적이다. 다시 말하면, CO2의 흡착압력이 비슷할 경우 MOF와 ZIF의 CO2 흡착량에 미치는 상기 인자들의 영향은 비교적 작다. 15 bar 이상의 CO2 흡착압력에서 이 흡착제들이 수십 mmol/g의 흡착성능을 나타낸다고 할지라도, 전형적인 PSA 공정조건에서 이들의 CO2 흡착성능은 제올라이트, 활성탄과 같은 벤치마크 흡착제들의 성능과 유사하거나 오히려 낮을 뿐만 아니라, 이들의 가격은 벤치마크들에 비해 매우 높기 때문에 경제성 확보에 어려움이 있다.
일반적인 지구온난화(global warming)의 원인과 메카니즘 에 대한 다양한 방법의 과학적 연구성과들이 축적되어오면서 이를 유발하는 대표적인 물질로 이산화탄소(CO2)를 지목하 고 있다[1]. 유엔기후변화협약의 부속의정서인 교토의정서 (Kyoto Protocol)는 CO2를 포함해 메탄(CH4), 아산화질소(N2O), 수소불화탄소(HFCs), 과불화탄소(PFCs) 및 육불화황(SF6)로 이루어진 6 종류를 지구온난화물질(흔히 온실가스로도 칭함)로 규정하고 있으며[2], 이들에 대한 감축노력들이 우리나라를 포함한 세계 여러 나라들에서 활발히 추진되고 있다.
가장 대표적인 온실가스인 CO2 외에 상기한 온실가스들의 지속적인 감축을 위한 정책적인 진흥, 제도적 규제와 기술개발도 중요하지만, 상대적으로 매우 안정한 기상물질에 해당 되는 CO2의 배출저감을 위한 정책적, 제도적 수단과 더불어 이의 주요 배출원에 해당하는 에너지 생산ㆍ이용체계에 대한 전환도 요구되고 있다. 100년 기준으로 CO2는 1의 지구온난화지수(global warming potential, GWP)를 갖는데, 상기 온실 가스 중에 상대적으로 낮은 GWP를 갖는 CH4와 N2O의 GWP 가 각각 21과 310인 것에 비하면[3] CO2의 GWP는 매우 낮은 편이다. CO2의 낮은 GWP에도 불구하고 지구온난화 방지 측면에서 CO2의 배출억제를 위한 정책적, 제도적, 기술적 대책 들이 핵심을 이루는 이유 중에 하나는 인위적으로 배출되는 온실가스 총량에서 CO2가 차지하는 비율이 가장 높기 때문인데, 2010년 기준으로 CO2 환산(CO2 equivalent, CO2-e) 총온실 가스량(약 49 Gt CO2-e) 중에서 약 62%가 CO2이다[4].
상술한 바와 같은 이유들 때문에 우리나라를 포함한 세계 여러 나라들에서는 CO2의 배출저감을 위하여 신재생에너지 기술개발과 보급 확대를 통한 화석연료 사용 억제, 소각과 매립 중심의 기존 폐기물 처리방식의 패러다임 전환과 유ㆍ무기성 폐기물의 자원화, 에너지 다소비형 산업공정의 효율화 와 고도화, 에너지 효율향상용 전ㆍ후방산업 육성 등이 활발히 추진되고 있다[3,5]. 이와 같은 CO2 배출저감을 위한 노력들은 고정연소, 이동연소, 공정배출 및 간접배출로 구분되는 CO2 배출활동 영역에 따라 적용성이 결정될 수 있는데, 이동연소와 간접배출의 경우보다는 고정연소와 공정배출의 경우에 직접적인 감축기술의 적용이 상대적으로 용이하다[6]. 직접적인 감축기술의 대표적인 예는 대량의 화석연료를 연소키는 고정원 배기가스로부터 CO2를 건식 또는 습식으로 분리ㆍ포집한 후 이를 특정 매체에 저장하는 CO2 포집저장기술(carbon dioxide capture and storage, CCS)이다. 건식 분리공정은 적합한 흡착제 표면에 CO2를 흡착시킨 후 다시 탈착시키는 기술이 널리 연구ㆍ개발되고 있는데, 적용하고자 하는 배기가스의 온도영역에 따라 저온, 중온 및 고온 흡착제로 구분할 수 있다[7]. 저온용 CO2 흡착제로는 가스 분리 및 정제 산업에서 광범위 하게 사용되고 있는 제올라이트, 활성탄 등과 같은 전통적인 다공성물질들이 널리 사용되어 왔고, 최근에는 금속-유기 골격(metal-organic framework, MOF)이나 제올라이트 이미다졸 골격(zeolitic imidazolate framework, ZIF)으로 이루어진 새로 운 다공성물질들이 저온용 CO2 흡착제로 활발히 연구되고 있다[8,9].
본 논고에서는 저온(실온에서 35 ℃ 이하)에서 CO2의 흡착ㆍ분리 목적으로 왕성하게 개발되고 있는 MOF 및 ZIF 계열 흡착제들의 최근 연구동향을 살펴보고, 지금까지 CO2를 포함한 H2, CH4 등과 같은 가스들의 흡착분리공정에서 가장 광 범위하게 적용되고 있는 대표적인 벤치마크 흡착제들(제올라이트와 활성탄)의 CO2 흡착성능과 상기 MOF계 다공성물질 들의 흡착성능을 비교ㆍ분석하고자 한다. 또한, 기존의 제올라이트나 활성탄을 사용하고 있는 압력순환흡착(pressure swing adsorption, PSA) 기술과 같은 CO2 흡착분리공정의 설계 및 운영 조건, 경제성 등을 감안할 때 가장 활발히 연구되고 있는 MOF계 흡착제들이 가지고 있는 근본적인 한계와 향후 해결 되어야 할 과제들을 다루고자 한다.
2. 흡착제의 세공크기와 CO2의 물리 ㆍ 전자적 특성
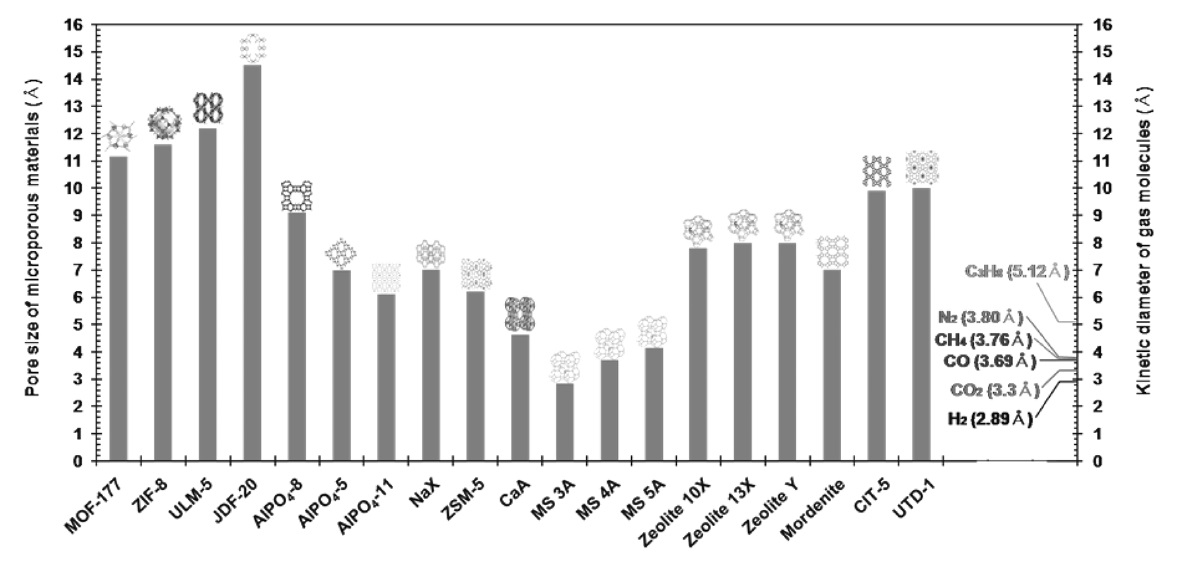
1932년 McBain[10]에 의해 5 Å 이하의 세공크기를 갖는 차바자이트(chabazite) 표면에서 여러 기체분자들의 흡착특성 과 관련한 선행연구들이 상세히 조사되었는데, 해당 제올라이트의 세공크기보다 작은 기체분자들은 세공내부로 들어가 흡착되었으나 이보다 큰 분자들은 흡착되지 못하는 현상을 관찰할 수 있었고, 이 현상의 원인을 분자체(molecular sieve, MS) 효과라는 개념을 최초로 도입하여 설명하였다. 이후 다 공성물질의 세공크기와 기체의 분자크기는 기체분자들의 흡착 거동을 이해하는 핵심적인 인자의 하나로 인식되고 있다. 따 라서, 잘 발달된 세공구조를 갖는 제올라이트들에서 흔하게 관찰되는 분자체 효과와 CO2의 흡착성능을 이해하기 위하여 이들과 대표적인 MOF계 다공성물질들의 세공크기와 CO2의 분자크기를 비교해 볼 필요성이 있다.
Figure 1은 여러 종류들의 제올라이트계 흡착제들과 최근에 주목받고 있는 MOF계 다공성물질들에 해당하는 MOF-177과 ZIF-8의 세공크기와 CO2를 포함해 H2, CO, CH4, N2 및 C3H8의 분자크기를 보여주고 있다. CaA, MS 3A, MS 4A, MS 5A와 같은 제올라이트 계열의 흡착제들은 상대적으로 5 Å 이하의 작은 세공크기(3.0~4.8 Å)를 가지고 있고, AlPO4-5, AlPO4-11, NaX, ZSM-5, 제올라이트 13X, 제올라이트 Y, 모더나이 트(mordenite) 등과 같은 제올라이트들은 6.1~8.0 Å의 세공크기를 갖는다. CFI 골격으로 이루어진 CIT-5 (CIT = California Institute of Technology)[11], DON 골격을 갖는 UTD-1 (UTD = University of Texas at Dallas)[12,13], AlPO4-8와 같은 제올라이트들은 9.3~10 Å의 비교적 큰 세공크기로 이루어져 있고, ULM-5 (ULM = Universite Le Mans)[14]과 JDF-20 (JDF = Jilin Davy Faraday)[15]는 이들보다도 더 큰 세공크기(각각 12.2와 14.5 Å)를 갖는 것을 알 수 있다. 대표적인 MOF계 다공성물질인 MOF-177의 세공크기는 약 11.2 Å으로 보고되었고 상온에서 매우 높은 CO2 흡착량을 갖는 것으로 알려져 있다[16]. ZIF 계열에 속하는 ZIF-8의 세공크기는 11.6 Å 정도이며, ZIF계 금
속-유기 다공성물질들은 MOF 계열에 비해 매우 뛰어난 열안정성(thermal stability)과 수산화나트륨 용액, 유기용제(메탄올, 벤젠) 등에 대하여 강한 내구성도 갖추고 있는 것으로 알려졌다[9,17].
위에서 언급된 대부분의 제올라이트들과 금속-유기계 다공성 물질들의 세공크기에 비하면 CO2의 분자크기(3.3 Å)는 훨씬 작으므로 이들의 세공 내부로 확산되어 흡착될 것으로 기대되지만, MS 3A와 MS 4A의 경우 CO2의 흡착은 어렵고 (또는 매우 느릴 것으로 예측되고) 이보다 작은 분자크기를 갖는 H2 (2.89 Å)의 흡착분리에 적합할 것으로 보여진다(Figure 1). CO2의 분자크기보다 더 큰 CO (3.69 Å), CH4 (3.76 Å), N2 (3.80 Å) 및 C3H8 (5.12 Å)의 세공 내 흡착을 위해서는 이들 보다 큰 세공크기를 갖는 흡착제들이 적합할 것이다[18]. 그러나, 나노다공성물질들의 기체 흡착성능은 지금까지 논의된 흡착제와 흡착시키고자 하는 기체분자의 크기에 따른 분자체 효과만에 의해 좌우되지는 않으며, 기체분자와 흡착제간의 물 리흡착에 영향을 미치는 반 데르 왈스 힘(van der Waals force)에 의해 크게 좌우된다. 따라서, 흡착제의 세공크기와 기체의 분자크기 외에, 이와 같은 힘에 직접적으로 관계되는 기체분자들의 전자적 특성도 중요하게 고려되어져야 할 것이다.
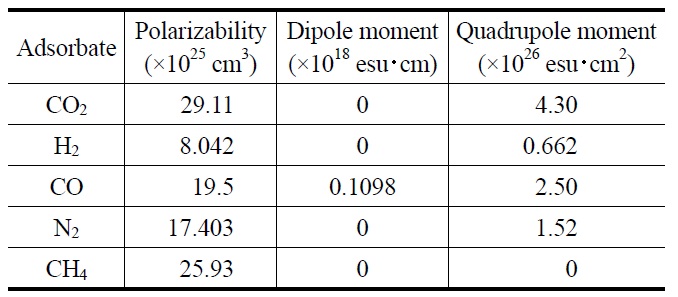
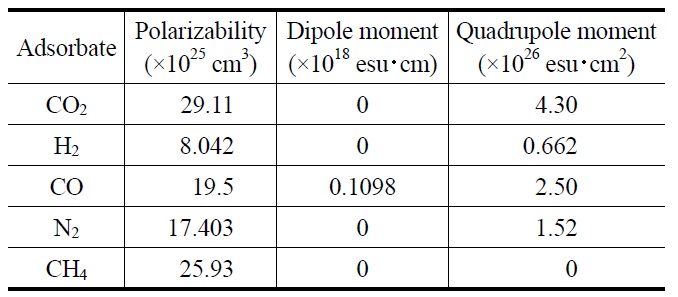
흡착제와 기체분자간에 작용하는 반 데르 왈스 힘에 영향 을 미칠 수 있는 기체분자의 전자적 특성들로는 기체분자의 쌍극자 모멘트(dipole moment), 사극자 모멘트(quardurpole moment), 분극율(polarizability) 등이며, 각 기체분자가 갖는 이러한 전자적 성질의 차이에 의해 기체분자들의 흡착특성이 현저히 달라질 수 있다[18]. Table 1은 본 논고에서 다루고자 하는 CO2를 포함해 H2, CO, N2 및 CH4와 같은 대조군으로 선택된 기체분자들의 전자적 특성을 나타내고 있다. CO2의 분극율은 29.11 × 1025 cm3로 선택된 대조용 기체분자들보다 크
[Table 1.] Electronic properties of CO2 with reference gases
Electronic properties of CO2 with reference gases
며, 이러한 특성만을 고려할 경우 흡착제의 표면적이 클수록 CO2의 흡착량은 증가할 것이다. 다른 말로 표현하면, 흡착제의 물리화학적인 특성이 같고 동일한 화학적 조성으로 이루어진 동일 흡착제일 경우, 분극율이 가장 낮은 H2 (8.042 × 1025 cm3) 의 흡착량이 가장 낮게 나타날 것이다. CO가 0.1098 × 1018 esuㆍ cm의 쌍극자 모멘트를 가지는 반면에, CO2, H2, N2 및 CH4의 쌍극자 모멘트는 없으므로 높은 분극특성을 갖지 않는 흡착제 표면에서도 CO2의 물리적 흡착은 잘 일어날 것으로 생각 된다.
기체분자의 전자적 특성들 중에서 물리적 흡착성능에 가장 큰 영향을 주는 것은 기체분자의 사극자 모멘트인데, CO2의 사극자 모멘트는 4.30 × 1026 esuㆍcm2이고 이는 Table 1에 있는 기체분자들 중에서 가장 크다. 이러한 사실은 전기장 구배가 큰 흡착제일수록 CO2 흡착에 유리할 것임을 말해주고 있다 [19]. 반면에, 사극자 모멘트가 상대적으로 작은 H2와 N2 같은 경우에는 흡착제의 전기장 구배 정도에 큰 영향을 받지는 않을 것으로 생각된다. 이러한 전기장 구배의 특성을 변화시킬 수 있는 방법으로는 흡착제 표면의 전하밀도를 달리하는 기술(표면개질, 이온교환 등)을 생각해 볼 수 있다. 이상에서 서술된 바와 같이 CO2 흡착분리용 흡착제 선정 시, 흡착제의 세공크기와 기체분자의 분자크기 외에 상기와 같은 CO2의 전자적 특성과 흡착제 표면특성들도 함께 고려되어야 원하는 흡착제의 CO2 흡착성능을 극대화할 수 있다.
3.1. MOF 및 ZIF 계열 흡착제들의 CO2 흡착성능
금속과 금속 이온 사이에 카르복실기(COO-)가 링커(linker)로 기능하여 1차원 골격을 이루고, 이들이 2차원, 3차원으로 결합하여 금속-유기 카르복실레이트 골격체를 형성하는데, 이렇게 이루어진 골격체를 최초로 MOF라고 명명하고 이를 다 공성 흡착제로 발전시키는 데에 있어서 Yaghi 그룹은 지대한 공헌을 하였다[8]. 그 이후 공유결합 유기 골격체(covalent organic frameworks, COF)와 ZIF와 같은 다공성물질들이 학계 에 잇달아 보고되면서[9,20,21], 금속-유기 골격계 다공성물질들이 CO2, H2, CH4 등의 분리ㆍ정제용 흡착제로 활발하게 연구되어오고 있다.
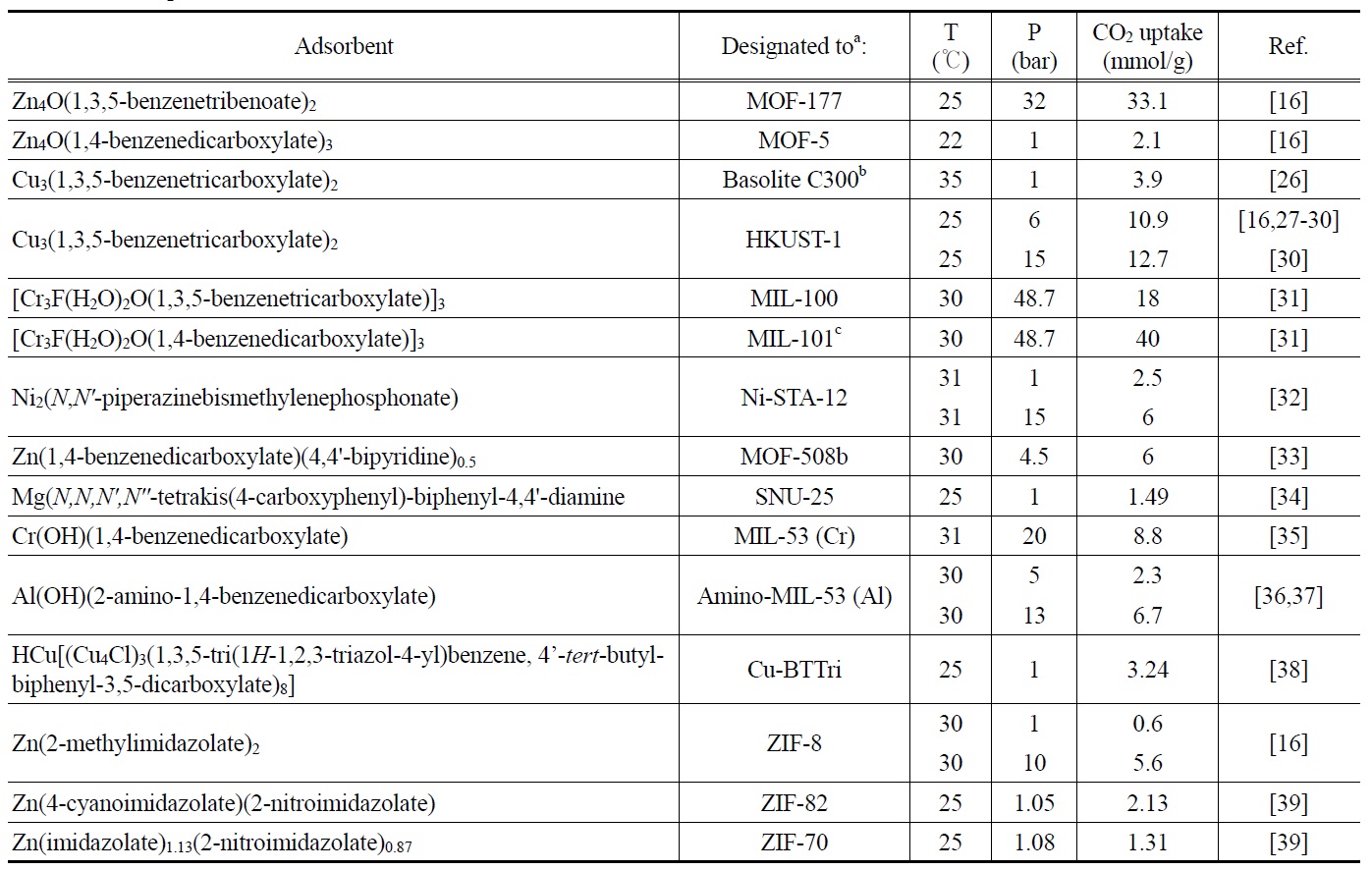
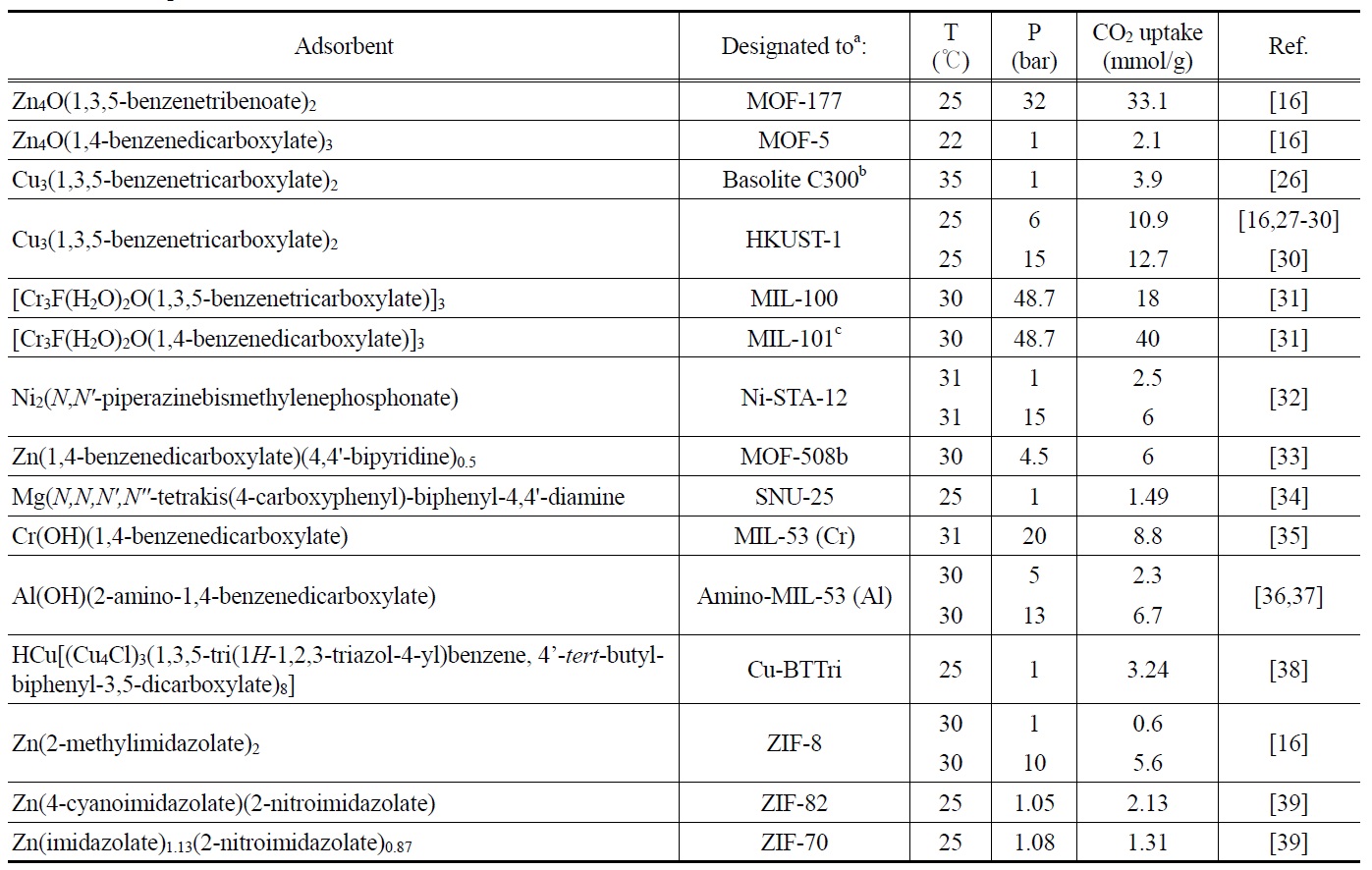
Table 2에서는 지금까지 보고된 주요 MOF와 ZIF 계열의 유기-금속 골격체들의 CO2 흡착량을 보여주고 있는데, 흡착 성능에 많은 영향을 미치는 흡착조건들(온도와 압력)을 비교해 볼 때 흡착온도는 22~35 ℃로 문헌에 주어진 데이터 사이에 그 범위가 비교적 넓지는 않으나 흡착압력의 경우 1에서
[Table 2.] CO2 uptakes on MOF and ZIF materials at chosen conditions
CO2 uptakes on MOF and ZIF materials at chosen conditions
48.7 bar까지 그 폭이 매우 넓다. 특히, CO2를 선택적으로 흡착ㆍ분리할 목적으로 산업계에서 널리 적용되고 있는 PSA의 전형적인 흡착 온도와 압력은 각각 15~40 ℃와 4~6 bar (드물게 10 bar까지)라는 사실을 감안하면[22-24], 상기 흡착제들 중 일부의 흡착압력은 지나치게 높은 것임을 알 수 있다. 그럼에도 불구하고, 흡착제별, 흡착압력별로 구분하여 CO2 흡착량을 비교해 봄으로써 주어진 흡착온도 범위에서 해당 다공성물질들 이 CO2 흡착제로서 유망성을 가지고 있는지를 파악해 볼 수 있을 것이다.
최근 Yaghi 그룹에 의해 보고된 MOF-177[16]은 25 ℃의 흡착온도와 32 bar의 흡착압력에서 33.1 mmol/g의 CO2 흡착량을 나타났는데(Table 2), 동일한 흡착조건에서 MOF-74 (10.3 mmol/g)와 MOF-505 (10.1 mmol/g)에 비해 3배 이상 높았다. 이러한 MOF-177의 흡착성능은 후에 PCN-6X (porous coordination network) 시리즈 MOF들 중에서 PCN-68 (Cu3(H2O)3(ptei)ㆍ 13H2Oㆍ33dmf, ptei = 5,5'-((5'-(4-((3,5- dicarboxyphenyl)ethynyl) phenyl)-[1,1',3',1''-terphenyl]-4,4''-diyl)-bis(ethyne-2,1-diyl))diisophthalate, dmf = N,N-dimethylformamide, S
상기의 흡착온도 범위와 1 bar 부근의 흡착압력에서 지금 까지 보고된 다양한 MOF들의 CO2 흡착성능을 비교해 보면, MOF-5가 2.1 (22 ℃), Basolite C300이 3.9 (35 ℃), Ni-STA-12가 2.5 (31 ℃), SNU-25가 1.49 (25 ℃), Cu-BTTri가 3.24 (25 ℃), ZIF-8이 0.6 (30 ℃), ZIF-82가 2.13 (25 ℃), ZIF-70이 1.31 mmol CO2/g (25 ℃)의 흡착량을 나타냈다(Table 2). 서로 다른 연구그룹에 의해 연구되어진 관계로 흡착온도 차이로 인해 일률적인 비교가 어려운 측면이 있으나, MOF와 ZIF 계열 흡착제들의 CO2 흡착량이 전통적인 흡착제로 널리 사용되어져 온 활성탄이나 제올라이트에 비해 현저히 높은 것은 아니며, 특히 ZIF계 다공성 금속-유기 골격체들의 CO2 흡착성능은 상대적으로 낮은 편이라는 사실을 알 수 있다. PSA 공정의 압 력과 유사한 흡착압력에서 보고된 MOF-508b, Amino-MIL- 53 (Al) 및 HKUST-1의 CO2 흡착량은 각각 6 (30 ℃, 4.5 bar), 2.3 (30 ℃, 5 bar) 및 10.9 mmol CO2/g (25 ℃, 6 bar)였고, 후자의 두 MOF의 경우 동일한 흡착온도를 유지한 상태에서 흡착 압력을 각각 13과 15 bar로 증가시키면 CO2 흡착량은 각각 6.7과 12.7 mmol/g로 증가하는 것을 알 수 있었다(Table 2). 30 ℃의 흡착온도와 상대적으로 매우 높은 압력에 해당하는 48.7 bar에서 Cr 금속들이 1,3,5-benzenetricarboxylate에 링크되어 3차원 구조를 이루는 MIL-100 (MIL = Materials of Institut Lavoisier, S
3.2. MOF계 및 벤치마크 흡착제의 CO2 흡착성능 비교
전술하였듯이 CO2 흡착분리 뿐만 아니라 공기정제, 산업용 가스 정제(수분 제거), CH4 정제와 업그레이딩, refinery off-gas로부터 수소 생산 등에서 제올라이트, 활성탄, 실리카겔, 활성 알루미나 등과 같은 전통적인 흡착제들이 널리 사용되고 있다[7,19,40]. 최근 활발한 연구개발이 이루어지고 있는 MOF계 다공성 금속-유기 골격체들 중에서 MOF-177이 가장 우수
한 CO2 흡착성능을 보이는 것으로 알려져 있는데[31], 상기의 재래식 흡착제들과 MOF-177의 CO2 흡착성능을 주어진 흡착 온도에서 압력의 함수로 직접적으로 비교함으로써 PSA 공정조건에서 보다 바람직한 흡착제 선택의 방향성을 파악할 수 있을 것으로 기대된다.
Figure 2는 지금까지 보고된 MOF계 흡착제들 중에서 가장 높은 CO2 흡착성능을 갖는 것으로 알려진 MOF-177과 PCN-68[16,25]의 CO2 등온흡착곡선과 벤치마크 흡착제로 널리 인식되고 있는 제올라이트 13X와 Kansai Coke and Chemical의 MAXSORB(활성탄 계열)의 등온흡착곡선을 보여주고 있다. MOF-177과 PCN-68는 25 ℃의 흡착온도에서 CO2 흡착압력의 증가와 함께 그 흡착량이 증가하다가 일정 압력 이상에서 는 더 이상 증가하지 않고 포화상태에 도달하는 전형적인 Langmuir 등온흡착곡선을 나타내고 있다. CO2 흡착에 있어서 포화점에 도달하는 CO2 흡착압력을 살펴보면, MOF-177은 약 32 bar에서 포화상태에 이르는 반면에 PCN-68은 이보다 더 높은 약 42 bar가 되어야 포화점에 도달한다. 이들의 흡착곡선들을 벤치마크 흡착제들에서 얻어진 것들과 비교해 보면, 제올라이트 13X는 매우 낮은 CO2 흡착압력(약 5 bar)에서 CO2에 의한 표면 포화현상을 보여주고 MAXSORB의 경우에는 측정된 42 bar까지도 서서히 CO2 흡착량이 증가하는 것을 볼 수 있다. 이들 4 종류의 흡착제들에서 CO2 흡착과 관련하여 주목할 필요성이 있는 첫 번째 특징은 MOF-177과 PCN-68은 적어도 15 bar 이상의 흡착압력이어야 MAXSORB 흡착제보다 우수한 CO2 흡착성능을 기대할 수 있고, 높은 CO2 흡착압력이 요구되는 흡착공정에 더 적합할 것이라는 점이다. 두 번째는 6 bar 이하의 낮은 CO2 흡착압력에서 벤치마크 흡착제들의 CO2 흡착성능이 오히려 더 우수한 것으로 나타나므로
[Table 3.] CO2 uptakes on MOF and ZIF materials at 25 ℃
CO2 uptakes on MOF and ZIF materials at 25 ℃
CO2 흡착분리용 공정특성을 우선적으로 고려하여 적합한 흡착제를 선정할 필요가 있다는 점이다.
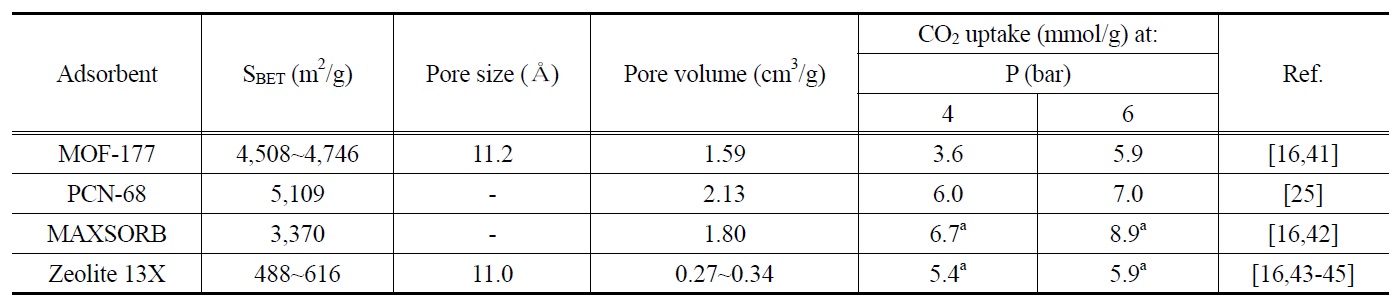
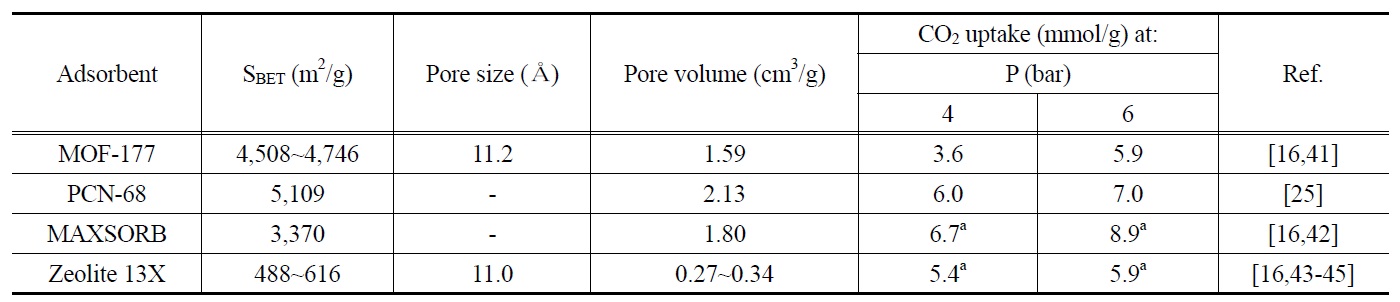
상술한 특징적인 현상들에 더하여 MOF-177, PCN-68, 제올라이트 13X 및 MAXSORB가 갖는 물리화학적인 특성과 CO2 흡착성능간의 관계를 좀 더 고찰해봄으로써 CO2 흡착분리를 위한 PSA 공정용 흡착제 선정 시 반드시 고려해야 할 주요 체크포인트들을 알아보고자 한다. Table 3은 상기 CO2 흡착제 4종에 대한 주요 물성(BET 비표면적, 세공크기 등)과 PSA 흡착분리공정의 전형적인 운전압력 범위(4~6 bar)에서의 CO2흡착량을 나타내고 있다. MOF-177의 비표면적은 합성회분(synthesis batch)에 따라 다소 달라질 수 있었는데 대략 4,500에서 4,750 m2/g의 비표면적을 갖는 것으로 보고되었고, 이러한 MOF의 세공크기는 11.2 Å 정도이며 세공부피는 약 1.6 cm3/g 이었다[16,41]. MOF-177보다 더 큰 비표면적(5,100 m2/g)을 갖는 PCN-68의 세공부피는 2.13 cm3/g였다[25]. 이들 MOF계 CO2 흡착제와의 대조용으로 선정된 제올라이트 13X와 MAXSORB의 물성 데이터도 Table 3에 주어져 있는데, MAXSORB 의 비표면적은 3,300 m2/g 이상으로 제올라이트 13X보다 훨 씬 넓은 비표면적을 가지고 있다[16,42-45]. 제올라이트 13X의 세공크기는 MOF-177과 매우 유사한 것을 알 수 있으며, 이의 세공부피는 0.34 cm3/g 이하로 4종의 CO2 흡착제들 중에 서 가장 작았다[43-45].
상기와 같은 각기 다른 물성을 갖는 MOF계 흡착제들과 벤치마크들의 CO2 흡착성능을 4와 6 bar의 흡착압력에서 고찰해 보면, 벤치마크들의 CO2 흡착량이 오히려 더 높거나 비교 할 만한 수준임을 알 수 있다(Table 3). 즉, 주어진 흡착압력에 관계없이 MOF-177의 CO2 흡착성능(4와 6 bar의 흡착압력에 서 각각 3.6과 5.9 mmol/g)은 두 벤치마크의 성능보다 낮게 나타났고, PCN-68일지라도 MAXSORB와 비슷한 수준이거나 약간 낮은 것을 확인할 수 있다. 이러한 사실로부터 알 수 있는 것은 MOF-177 및 PCN-68과 같은 MOF계 흡착제들이 15 bar 보다 높은 압력에서 벤치마크 흡착제보다 높은 CO2 흡착성능을 갖는다고 할지라도 PSA 흡착분리공정에서 널리 적용되는 4~6 bar의 흡착압력에서는 제올라이트와 활성탄 같은 재래식 흡착제들이 더 적합할 수 있음을 강하게 시사하고 있다. 따라서, CO2 흡착분리를 위한 PSA 공정용 흡착제 선정 뿐만 아니라 경제성 분석에서 이러한 점들이 고려되어야 한다.
PCN-68과 MOF-177을 포함하는 여러 종류의 MOF 및 ZIF 계열의 흡착제들과 제올라이트 13X, MAXSORB, BPL과 같은 범용 흡착제들의 CO2 흡착성능과 0.5~50 bar까지의 흡착 압력을 영역별로 구분하여 도시하였을 때 상술한 바와 매우 유사한 결론 및 시사점들이 도출될 수 있었는데, 그 결과들은 Figure 3에서 보여주고 있다. CO2의 흡착압력이 1 bar 또는 그 미만일 경우, 인용된 흡착제들의 종류에 관계없이(MOF와 ZIF라고 할지라도) 3.5 mmol/g 이하의 CO2 흡착량을 보여준다[16,26,32,34,38,39]. 동일한 흡착제에서 가해지는 흡착압력 의 증가와 함께 CO2의 흡착량도 증가하는데 그 증가의 정도 는 흡착제의 종류에 의존적인 것으로 나타났다. 즉, 흡착압력의 범위가 4~6 bar로 동일하지만 제올라이트 13X, MAXSORB, PCN-68, MOF-177, HKUST-1, MOF-508b 및 Amino-MIL-53 (Al)의 CO2 흡착성능은 2.3~10.9 mmol/g으로 흡착제의 종류에 따라 영향을 받았다[16,25,27-30,33,36,37]. 또한 흡착압력
의 범위가 10~20 bar일 때 전기한 흡착제들 중 일부(제올라이트 13X, HKUST-1, Amino-MIL-53 (Al))와 BPL, Ni-STA-12, MIL-53(Cr) 및 ZIF-8에서도 유사한 현상을 관찰할 수 있었고 [16,32,35,46,47], 30~50 bar와 같이 매우 높은 흡착압력에서는 MOF와 ZIF 계열 흡착제 뿐만 아니라 MAXSORB에서도 높은 CO2 흡착량을 나타냈다. 이와 같이 상대적으로 매우 높은 흡착압력을 PSA 공정에 적용하는 경우는 흔치 않으므로, 그와 같은 흡착조건에서 우수한 CO2 흡착성능을 나타내는 것은 PSA 공정용 흡착제로서의 실효성은 그리 많지 않다고 볼 수 있다.
3.3. MOF 및 ZIF 계열 다공성 흡착제의 상용성과 경제성
CO2 흡착분리용 PSA 공정을 설치ㆍ운영하는 데 있어서 소요되는 초기투자 및 운전 비용은 해당 공정의 경제성을 좌우 하는 매우 중요한 인자이다. 초기투자비 산출에 직접적인 영향을 미치는 요소들로는 PSA 공정에 적용되는 흡착제의 종류와 사용량, 흡착칼럼의 숫자와 이를 구성하는 재질, 밸브, 컴프레서, 계측 및 제어 장비 등이 적시될 수 있는데[48], 본 논고에서는 MOF와 ZIF 계열 다공성 흡착제를 흡착ㆍ분리 공정에 사용할 경우 이에 소요될 수 있는 흡착제 비용을 산정해보고자 한다.
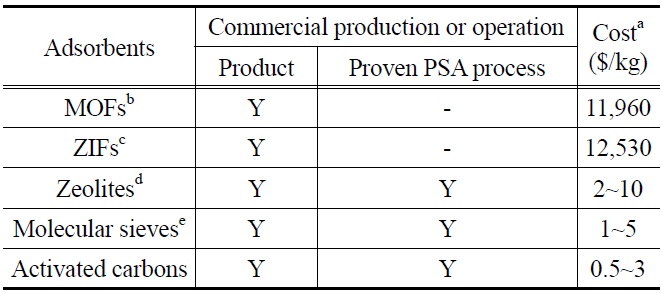
현재 3종의 MOF (Basolite C300, Basolite A100, Basolite F300)와 1종의 ZIF (Basolite Z1200)가 BASF에서 생산되고 있으므로(Table 4), 이들 금속-유기 골격계 다공성물질들을 CO2 흡착제로 사용하는 데는 제한이 없을 것으로 생각된다. 그러나, Table 4에 주어져 있듯이 이들은 매우 고가이므로 상용 PSA 공정에 적용할 경우 지나친 흡착제 비용을 유발할 것이다. 앞에서 기술한 주요 가스 분리정제산업에서 널리 사용되고 있는 제올라이트, 제올라이트계 분자체 및 활성탄과 같은 벤치마크 흡착제들의 가격은 0.5~10 $/kg에 지나지 않고 MOF 및 ZIF 계열 흡착제들의 가격에 비해 매우 저렴하므로, 흡착제 가격 측면에서만 본다면 재래식 흡착제의 사용량을 증가시켜 요구 되는 CO2 흡착성능을 달성하는 것이 경제성 확보 측면에서 훨씬 더 유리할 것으로 판단된다.
[Table 4.] Availability and cost of MOF and ZIF materials
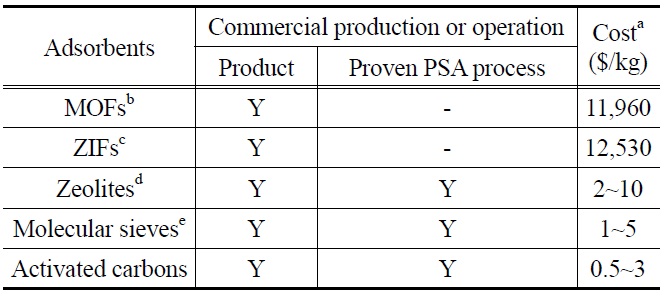
Availability and cost of MOF and ZIF materials
위에서 기술된 MOF 및 ZIF 계열 흡착제들이 가지고 있는 경제성 측면의 약점 외에도, 벤치마크 흡착제들의 경우 1960년부터 수많은 가스 분리ㆍ정제공정에 적용되어 그 기술성과 적용성 등이 상업적으로 충분히 검증되었으나[18,40], 금속-유기 골격계 흡착제들은 PSA를 포함한 가스 분리ㆍ정제공정에 상업적으로 적용된 사례가 아직 보고된 바 없으므로 상업성에 대해 검증되지 않았다는 또 다른 단점을 가지고 있다(Table 4). 따라서, MOF 및 ZIF 계열 다공성물질들의 취약점으로 이미 지적된 PSA 공정압력에서 상대적으로 낮은 CO2 흡착성능 에 더하여, 상용성과 경제성 측면에서 이들의 명확한 한계 때문에 현 단계에서 4~6 bar와 같은 저압용 CO2 흡착제로는 적합하지 않은 것으로 생각된다.
최근 CO2 흡착제로서 가장 주목받고 있는 MOF 및 ZIF 계열 다공성물질들의 CO2 흡착성능은 이들의 종류(그로 인한 금속과 유기 링커의 차이), 세공크기, 비표면적 등과 같은 물성과 흡착 온도 및 압력과 같은 흡착조건에 영향을 받았지만, 이러한 영향인자들 중에서 특히 흡착압력이 비슷하면 다른인자들의 영향은 그리 크지 않았다. 가스 분리ㆍ정제 산업에서 널리 사용되고 있는 PSA 공정의 온도(15~40 ℃)와 압력(4~6 bar)에서 MOF계 다공성물질들 중에서 가장 우수한 CO2 흡착성능을 나타내는 것으로 알려진 MOF-177과 PCN-68의 CO2 흡착성능을 제올라이트 13X, MAXSORB와 같은 벤치마크 흡착제들과 비교하였을 때, MOF계 다공성물질들의 CO2 흡착량은 벤치마크와 비슷하거나 약간 더 낮았다. 상기 벤치 마크에 비해 MOF-177과 PCN-68의 비표면적이 훨씬 큼에도 불구하고 이러한 결과를 나타내는 가장 큰 원인은 세공크기 에서의 차이에 따른 CO2와 흡착점간의 극성 상호작용 정도가 서로 달랐기 때문으로 이해된다. 상기한 바와 같은 전형적 인 CO2 흡착분리용 PSA 공정조건, 금속-유기 골격계 다공성 흡착제들의 매우 높은 원가와 이들을 적용한 상용 PSA 공정 운용사례 부재 등을 고려하면 제올라이트나 활성탄과 같은 지금까지 충분히 검증된 벤치마크 흡착제들이 CO2 흡착분리용 PSA 흡착제로 더 바람직할 것으로 생각되고, 상기한 MOF 및 ZIF 계열 다공성물질들의 한계들을 극복하기 위한 후속연구들이 지속적으로 이루어져야 할 필요성이 있다.


![A capacity of MOF-177, PCN-68, zeolite 13X and MAXSORB carbon for CO2 adsorption at 25 ℃. All the uptake values used here have been produced using data in the supporting information[16,25].](http://oak.go.kr/repository/journal/12979/CJGSB2_2013_v19n4_370_f002.jpg)
![A comparison of the extent of CO2 adsorption at 22~31 ℃ on representative MOFs and ZIFs with conventional adsorption materials (Zeolite 13X, BPL and MAXSORB) as a function of adsorption pressure. The uptakes at 6 bar in Table 3 were chosen here. Details of adsorption conditions are provided in Tables 2 and 3 [46,47].](http://oak.go.kr/repository/journal/12979/CJGSB2_2013_v19n4_370_f003.jpg)