라만 분광학과 분자 모델링을 이용하여 메탄과 육불화황의 혼합 기체 가스 하이드레이트의 성장거동을 연구하였다. 라만 분광학 결과에 의하면 메탄을 객체 가스로 사용할 경우 메탄이 물 분자로 이루어지는 가스 하이드레이트 호스트 구조 내의 큰 동공을 채우고 차례로 작은 동공이 채워지게 되는데 반하여 육불화황을 혼합한 경우 육불화황과 메탄이 경쟁적으로 큰 동공을 채우고 이어 작은 동공에는 메탄만 채워지는 방식으로 전체 가스 하이드레이트 구조가 안정화됨을 관찰하였다. 분자 모델링에 의한 결합에너지 계산 결과 큰 동공의 경우 육불화황은 -26.9 kcal/mol, 메탄은 -24.2 kcal/mol의 결합에너지를 보여 육불화황이 채워지는 것이 약간 더 안정함을 알 수 있었고 작은 동공의 경우 육불화황은 1.2 kcal/mol, 메탄은 -22.0 kcal/mol로 큰 크기의 육불화황이 작은 동공에는 채워질 수 없음을 보여주었다. 이와 같은 접근법은 향후 다양한 객체 기체 가스 하이드레이트의 성장거동을 예측하는데 적용될 수 있을 것이다.
기존의 증류식과 막(역삼투압) 분리를 이용하는 해수 담수화 방식[1]과 더불어 가스 하이드레이트(gas hydrate) 공정을 도입하는 것을 주요 내용으로 하는 새로운 개념의 해수 담수화 기술이 고려되어왔다[2-4]. 천연가스 수송관 내에 메탄, 에탄, 프로판 등이 물 분자와 반응하여 얼음과 유사한 가스 하이드레이트가 형성됨으로써 파이프라인이 막히는 문제에서 주목 받기 시작하여 이후 인위적으로 고압, 저온 상태에서 저분자량의 가스와 액체인 물분자를 물리화학적으로 결합시킴으로써 가스 하이드레이트 결정을 형성시키는 가스 하이드레이트 공정이 개발되었다[5,6]. 이 공정을 해수에 적용하면 생성된 가스 하이드레이트 결정이 염과 분리되어 순수해지고 이러한 1차 과정으로 해수 중 90% 정도의 염분을 제거하는 것이 가능하다. 이후 일반 정수방식의 막 분리 후처리 공정을 도입하면 해수 담수화를 실현할 수 있을 것으로 예상된다[2-5]. 가스 하이드레이트의 생성 과정을 해수 담수화에 실용화함에 있어 가장 중요한 것은 해수 중의 염 성분을 낮은 에너지 비용으로 물과 분리할 수 있는 객체(guest) 기체의 선정과 운전조건의 확립이다. 물 분자들로 이루어진 호스트(host) 구조에 저분자량의 기체 분자들이 포획되어 형성되는 결정성 화합물인 가스 하이드레이트의 구조에 대해 가스 분자의 종류와 생성 조건에 따른 분류는 다양한 참고문헌들을 통해 확인할 수 있다[6,7]. 이 중 본 연구에서 관심을 가지는 구조는 메탄(CH4) 하이드레이트 즉, CS-I 구조이다. 호스트 구조의 형태는 동공에 포획되는 객체 분자의 크기에 의해 주로 결정되는데 직경이 0.4~0.55 nm 범위의 객체 분자들이 CS-I 구조를 생성하는 것으로 알려져 있으며 Table 1에 정리한 바와 같이 큰 동공과 작은 동공들로 이루어져 있다. 자체 실험 결과 메탄 하이드레이트의 전형적인 형성 조건은 2 ℃, 35 bar인데 육불화황의 경우 훨씬 유리한 조건인 2 ℃ 35 bar에서 가스 하이드레이트가 형성됨을 알 수 있었고[8-10] 이를 이용하여 객체 기체로 메탄에 육불화황을 첨가해 주었을 때 예상한 바와 같이 기존 메탄 하이드레이트에 비해 유리한 조건에서 가스 하이드레이트가 형성됨은 물론 성장 속도도 증가됨을 확인하였다.
이에 본 연구에서는 메탄만을 객체 기체로 사용한 경우와 육불화황을 혼합한 경우 가스 하이드레이트의 성장 거동을 라만 분광학(Raman spectroscopy)을 이용하여 실험적으로 관찰하였으며 이를 분자 모델링(molecular modeling)을 통하여 이론적으로 설명하였다. 이를 위해 이전 연구[8-10]에서 사용한
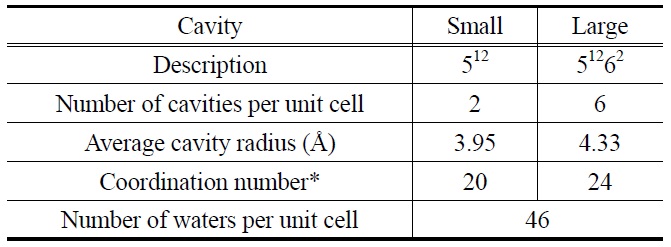
[Table 1.] Geometric properties of CS-I type gas hydrate
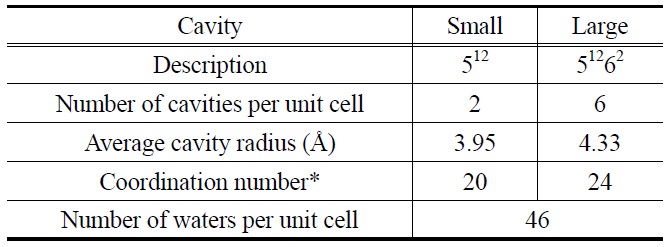
Geometric properties of CS-I type gas hydrate
것과 동일한 라만 시스템을 이용하여 객체 기체로 메탄만 사용한 경우와 육불화황을 혼합한 경우에 대해 각각 시간에 따른 라만 스펙트럼(spectrum)의 변화를 관찰하였다. 또한 한편으로 분자모델링 계산을 위해 CS-I 구조의 작은 동공과 큰 동공의 호스트 구조를 각각 구현하고 여기에 메탄과 육불화황이 각각 포획된 구조의 결합에너지를 구하여 상대 비교함으로써 실험적으로 얻은 라만 분광학 결과를 이론적으로 설명하였다.
가스 하이드레이트 공정 장비 자체는 본 연구와 직접적인 관련이 없기 때문에 이전 연구의 참고문헌[8-10]을 통해 확인할 수 있다. 라만 스펙트럼 측정은 다음과 같은 장치 구성을 통해 가능한데, 반응기 바깥 석영창(quartz window)에 60 mm 작동 거리를 가진 Unilab II 프로브(probe)가 붙어 있고 다시 광섬유(optical fiber)로 라만 분광기(모델명 Sentinel, 제조사 Bruker)에 연결된다. 라만 측정을 위해 사용된 Nd-Yag 레이저(laser)의 파장(wavelength)과 파워(power)는 각각 532 nm와 100 mW이다. 가스 하이드레이트 공정 조건은 메탄만을 객체 기체로 사용한 경우와 육불화황을 혼합한 경우 모두 274.15 K와 5.0 MPa이었다.
계산은 밀도 범함수 이론(density functional theory, DFT)으로 이루어졌으며 분자 모델링 소프트웨어인 Gaussian 09[11]에 내재되어 있는 DFT-D (density functional theory-dispersion correction)/PBE (Perdew-Burke-Ernzerhof) 범함수[12]를 사용하였고 기저 집합(basis set)으로 TNP (triple numerical pola-rized)형을 채택하였다[13,14]. 모든 주어진 구조에 대하여 대칭 조건(symmetry constraint) 없이 모든 전자를 고려한 구조 최적화(geometry optimization)를 진행하였으며 또한 최적화 된 구조 모두 진동수 계산(frequency calculation)을 통해 국부 최소 에너지(local minimum energy)를 가짐을 확인하였다.
3.1. 메탄 및 육불화황 혼합 가스 하이드레이트 성장에 관한 라만 분광학 결과
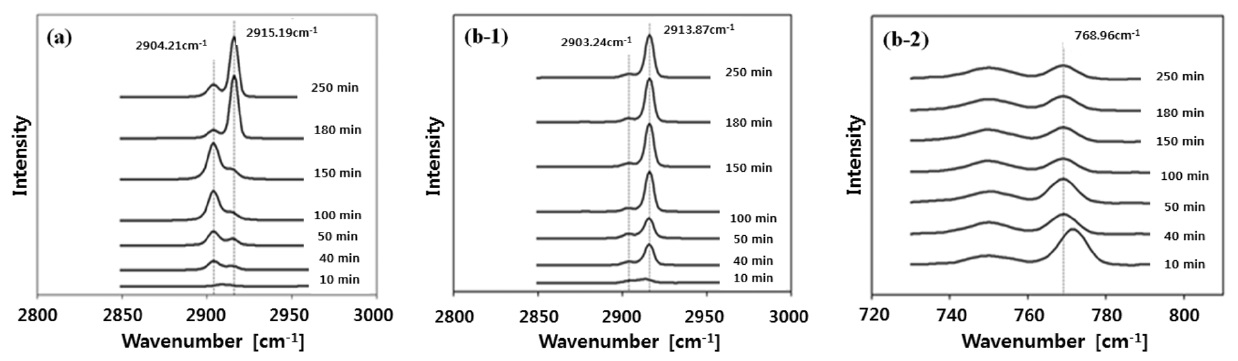
Figure 1에 가스 하이드레이트 성장 과정을 라만 분광기로 측정한 스펙트럼을 객체 가스로 메탄만을 사용한 경우(Figure 1(a))와 육불화황을 혼합한 경우(Figure 1(b))에 대해 각각 나타내었다. 먼저 메탄만 객체 기체로 사용한 경우 Figure 1(a)에서 나타나 있듯이 시간이 증가함에 따라 2,904.21 cm-1 (큰 동공의 메탄)과 2,915.19 cm-1 (작은 동공의 메탄) 두 피크의 상대적인 크기(intensity)가 변하는 것을 볼 수 있는데 초반에는 2,904.21 cm-1의 피크가 크게 나타나고 시간이 지나면서 2915.19 cm-1의
피크가 커진다 . 메탄이 큰 동공을 먼저 채워 가스 하이드레이트 구조가 안정되기 시작하고 이어 작은 동공을 채우는 방식으로 가스 하이드레이트가 성장하는 것을 보여준다 .
반면 육불화황이 메탄에 첨가된 경우는 Figure 1(b)와 같이 재미있는 현상이 나타난다 . Figure 1(b-1)은 Figure 1(a)와 마찬가지로 메탄에 대해 라만 스펙트럼을 측정한 것인데 메탄만 객체 기체로 사용된 경우 (Figure 1(a)) 와 달리 물론 완전히 2,903.24 cm-1(큰 동공의 메탄)의 피크가 없는 것은 아니나 2,913.87 cm-1(작은 동공의 메탄)의 피크의 크기가 상대적으로 현저히 크게 나타난다 . Figure 1(b-2) 의 육불화황에 대해서는 768.95 cm-1(큰 동공의 육불화황 )의 피크만 관찰될 뿐 추가적인 피크 (작은 동공의 육불화황)가 관찰되지 않는다 . 그리고 768.95 cm-1(큰 동공의 육불화황 )의 피크도 시간이 지남에 따라 그 크기가 오히려 약간 감소하는 것으로 보인다. 이는 육불화황이 작은 동공에는 포획되지 않으며 큰 동공을 채워 가스 하이드레이트 구조를 안정화시키고 작은 동공은 메탄이 채워간다고 해석할 수 있다 . 물론 큰 동공에는 Figure 1(b-1)에 나타나 있듯이 메탄도 육불화황과 경쟁적으로 채워진다 . 즉, 객체 가스로 메탄에 육불화황이 혼합된 경우 육불화황이 큰 동공을 채우면서 가스 하이드레이트 형성을 시작 (initiation)하는 역할을 하고 메탄이 작은 동공과 일부의 큰 동공을 채워 주어 전체적인 구조를 안정화시키는 것이 합리적인 설명으로 판단된다. 이는 서론에서 언급한 육불화황이 혼합된 경우 가스 하이드레이트 성장 속도도 개선된다는 실험 결과와도 일 관성을 가진다 . 다음 절에서 분자모델링을 이용한 정량적인 해석으로 이러한 정성적인 해석을 뒷받침할 것이다 .
3.2. 메탄 및 육불화황 혼합 가스 하이드레이트의 결합 에너지 계산 결과
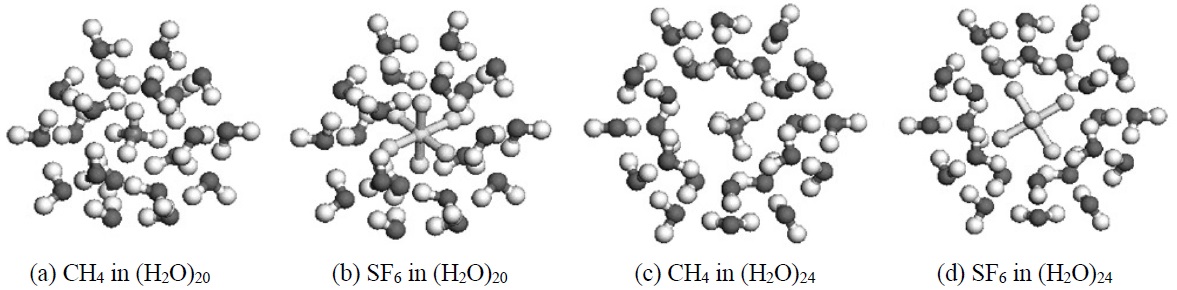
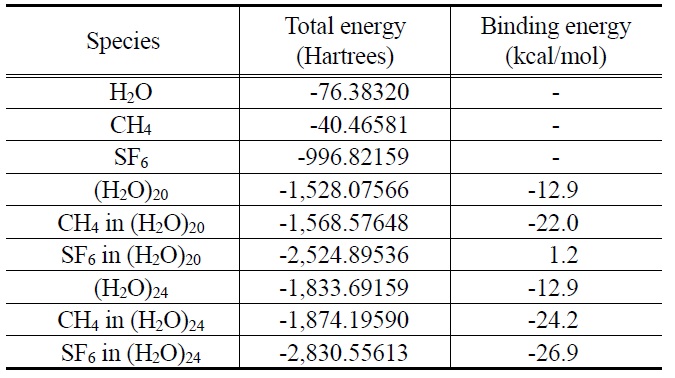
Figure 2는 객체 기체가 배제되어 물 분자들로만 이루어진 호스트 구조의 작은 동공과 큰 동공을 각각 (H2O)20와 (H2O)243차원 구조로 구현한 것을 보여준다 . 두 구조 모두 구조 최적화가 이루어진 상태이다 [15,16]. 물론 육불화황의 경우 단일 객체 기체로 사용되면 CS-II 구조의 가스 하이드레이트를 형성하며 이 때 큰 동공은 (H2O)28로 더 크기가 크지만 [17,18] 본 연구에서 육불화황은 메탄 가스 하이드레이트를 형성하는 데 있어서 열역학적 , 속도론적 이점을 취하기 위해 일부 혼합하는 것을 가정하므로 계산에서는 CS-I 구조를 고수한다 .
이제 Figure 2의 물 분자들로 이루어진 호스트 구조 내에 객체 기체를 삽입하여 구조 최적화를 진행하면 되는데 최종적으로 본 연구에서 얻고자 하는 정량적인 지표는 결합에너지(binding energy, BE)이다. 우선 메탄과 육불화황을 각각 작은
동공과 큰 동공에 삽입한 후 Figure 2에서와 마찬가지로 국부 에너지가 최소가 되는 구조(local minima)들을 최적화를 통해 얻을 수 있고 이들을 Figure 3에 나타내었다. 가시적으로 관찰할 수 있듯이 육불화황의 경우 작은 동공에 삽입되기에는 크기가 다소 커 보이고 메탄의 경우는 큰 동공에 너무 여유 있게 위치해 있음을 알 수 있다. 그리고 육불화황과 메탄이 각각 큰 동공과 작은 동공에 삽입된 경우가 그림으로 보기에도 안정되어 보인다.
이러한 정성적인 해석의 정량화를 위해서 결합에너지를 아래와 같이 정의하여 계산하였다. 예를 들어 메탄이 작은 동공에 삽입된 경우 결합에너지는 다음과 같다.
식 (1)의 우측 첫 번째 항은 Figure 3 의 객체 가스가 삽입되어 구조 최적화된 가스 하이드레이트 구조의 에너지가 되며 우측 두 번째 항은 Figure 2의 구조 최적화된 호스트 구조의 에너지, 그리고 우측 세 번째 항은 구조 최적화된 단일 기체 분자의 에너지에 해당한다 . 이렇게 하여 계산된 결합에너지를 Table 2에 정리하였다. 각 구조의 총 에너지는 Hartrees의 단위로 표시했으며 결합에너지는 익숙한 kcal/mol의 단위로 나타내었다 . 다만 작은 동공과 큰 동공의 결합 에너지는 결합된 물 분자의 개수에 따라 달라지므로 아래와 같이 정의된다.
먼저 작은 동공 [(H2O)20]에 메탄이 삽입된 경우 결합에너지는 -22.0 kcal/mol 로 자발적인 (spontaneous) 반응이 가능함을 보여주고 있으나 육불화황이 삽입된 경우 결합에너지는 1.2 kcal/mol로
[Table 2.] Calculated binding energies of CH4 and SF6 gas hydrates
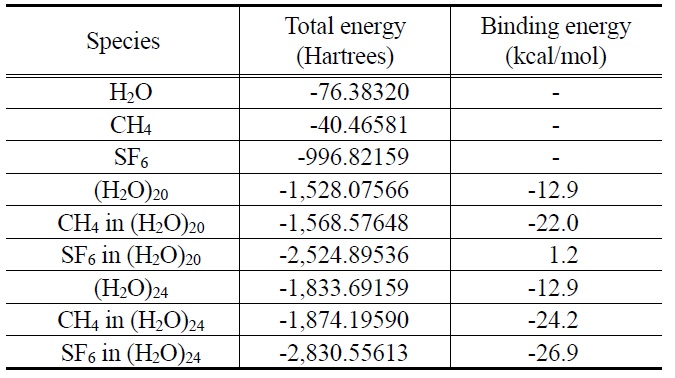
Calculated binding energies of CH4 and SF6 gas hydrates
양의 값을 가져 작은 동공에는 SF6가 자발적으로 삽입될 수 없음을 알 수 있다 . 이는 Figure 1(b-2) 에서 관찰한 바와 일치한다 . 반면 큰 동공 [(H2O)24]의 경우 메탄이 삽입된 경우 결합에너지가 -24.2 kcal/mol, 육불화황이 삽입된 경우 -26.9 kcal/mol 로 육불화황이 메탄보다 상대적으로 더 유리하게 삽입될 수 있음을 보여준다 . 그러나 그 차이가 앞서 작은 동공의 경우와 달리 크지 않다 . 따라서 결합에너지 계산 결과는 메탄과 육불화황을 객체 기체로서 혼합한 경우 큰 동공에 육불화황이 삽입되고 작은 동공에 메탄이 삽입되지만 메탄이 여전히 큰 동공에서 육불화황과 경쟁적으로 삽입되는 Figure 1(b)의 라만 스펙트럼 결과를 정량적으로 잘 설명하고 있다.
분자모델링을 이용한 연구는 현상학적으로 관찰된 실험결과를 정량화하고 시각화하는데 매우 유용하며 탁월한 것을 알 수 있었다 . 메탄과 육불화황을 객체 기체로 혼합한 경우의 가스 하이드레이트 성장 거동을 라만 분광학으로 관찰하여 정성적으로 해석하였고 분자모델링을 이용한 결합에너지 계산을 통하여 메탄과 육불화황이 호스트 구조의 큰 동공과 작은 동공에 삽입되는 경향을 정량적으로 분석해 내었다 . 이와 같은 접근법으로 다양한 객체 기체에 대하여 큰 동공과 작은 동공에 각각 삽입될 경우의 결합에너지를 추가적으로 계산하고 이를 데이터베이스화하여 비교한다면 향후 혼합 객체 기체의 가스 하이드레이트 성장 거동을 예측할 수 있을 것으로 기대된다.
![Optimized host structures of the small cavity [(H2O)20] and large cavity [(H2O)24] in CS-I type gas hydrate.](http://oak.go.kr/repository/journal/12960/CJGSB2_2013_v19n4_476_f002.jpg)