본 연구에서는 환경친화적인 측면을 고려하여 제철소 및 석유화학공장에서 많이 발생되는 부생가스인 일산화탄소와 산소를 이용하여 글리세롤로부터 글리세롤 카보네이트를 합성하는 공정에 대하여 연구하였다. 글리세롤의 산화성 카르보닐화 반응활성은 회분식 고압반응기에서 다양한 금속촉매(Cu, Pd, Fe, Sn, Zn, Cr계)에 대한 영향과 산화제, 일산화탄소와 산소의 몰 비율, 촉매량, 용매의 종류, 반응 온도 및 시간, 탈수제 첨가에 대한 반응조건들을 확인하였다. 특히, 염화구리 촉매가 우 수한 반응 활성을 나타내었고, 니트로벤젠 용매상에서 글리세롤:일산화탄소:촉매의 몰 비율이 1:3:0.15, 일산화탄소:산소의 몰 비율이 2:1, 전체 반응압력이 30 bar, 반응온도 413 K, 반응시간 4시간 동안 염화구리(I)와 염화구리(II) 촉매에 대한 수율 은 각각 최대 44%와 64%를 보였다. 이러한 결과로부터 구리촉매의 산화수에 따라 반응활성이 큰 차이가 보이는 것을 확인 하였으며, 산화제로서의 산소의 역할은 글리세롤의 카르보닐화 반응 후 산화반응이 수반되어 부생성물인 물을 생성하는데 중요한 역할을 하고 있는 것을 확인할 수 있었다.
최근 석유화학 산업에서 지속적 녹색성장이 가능한 신재생 에너지 산업으로의 전환이 이루어지고 있으며, 특히 바이오에너지 및 바이오산업의 비중이 높아지고 있다. 바이오에너지원 으로 각광 받는 바이오디젤(biodiesel)은 생분해성이 있고, 독성이 없으며 황 함유량이 적은 환경친화적인 연료이다. 또한 디젤(diesel)에 비하여 이산화탄소의 배출량이 적으며, 온실가스 저감효과가 탁월하다는 장점이 있다[1]. 이러한 장점으로 바이오디젤의 생산량이 증가함에 따라 바이오디젤의 8~10 wt% 정도의 부산물인 글리세롤(glycerol, GL)의 생산량도 증가하고 있다. 전 세계적으로 글리세롤 부산물 생산량은 2001년 6만톤에서 40만톤으로 급증하여, 전체 글리세롤 총 생산량 50% 를 점유하여 글리세롤 생산이 과잉공급 상태로 전환되었으며, 글리세롤의 가치가 낮아져 바이오디젤 산업의 경쟁력을 떨어뜨리는 요인이 될 수 있다[2]. 또한 부산물 자원의 재활용은 사회 발전 및 환경 보전 측면에서 매우 중요한 문제이므로 부산물 글리세롤의 고부가가치화를 위한 기술개발이 필요한 실정이다. 그 중에 글리세롤 유도체 중 하나인 글리세롤 카보네이트(glycerol carbonate, GC)는 색소, 유약, 풀, 화장품, 의 약품 제조를 위한 고부가 공정의 용매로 주로 사용되고 있으며, 기존 글리세롤 보다 7배 이상의 고부가가치를 갖는 화합물이다.
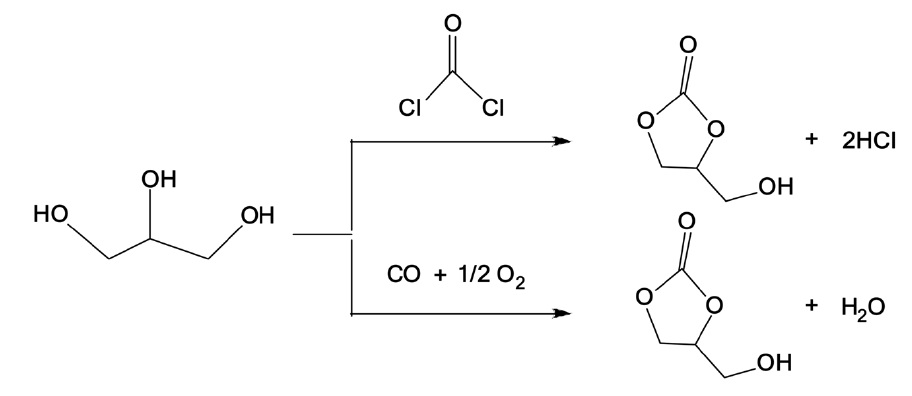
글리세롤 카보네이트는 글리세롤과 디알킬 카보네이트 (dialkyl carbonate), 알킬렌 카보네이트(alkylene carbonate), 요소(urea), 이산화탄소, 포스겐(phosgene), 일산화탄소 등의 카르보닐 화합물의 원료에 따라 다양한 방법으로 합성할 수 있다. 하지만 디알킬 카보네이트와 알킬렌 카보네이트는 석유화학공정으로 합성되어지므로 원료가격 경쟁력에 문제가 될 수 있으며, 요소를 사용한 공정에서는 부산물로 암모니아 독성가스가 생성되는 단점이 있다[3-6]. 최근 이산화탄소를 직접 반응시켜 글리세롤 카보네이트를 합성한 결과가 보고되었다. 이 방법은 이산화탄소 원료가 매우 값이 싸고, 반응 후 부산물로 물이 생성되는 청정공정이다. 하지만, 현재 확인된 반응촉매 종류가 많지 않고 고압이 필요하며, 그 수율이 약 6%로 현저히 낮은 단점이 있다[7]. 또한 값싼 카르보닐 화합물의 원료로 포스겐을 이용할 수 있으나, 맹독성 포스겐의 사용 규제와 염 산의 부산물 발생과 같은 환경적인 문제로 점차 일산화탄소를 이용한 산화성 카르보닐화(oxidative carbonylation) 공정으로 대체되고 있다(Figure 1). Teleset al.[8]은 염화구리(I) 촉매상에서 글리세롤로부터 연속적인 일산화탄소와 산소의 혼합가스를
주입하는 반회분식 방법을 통해 글리세롤 카보네이트를 합성한 결과를 보고한 바 있으며, 용매를 사용하지 않은 조건과 비활성 용매상를 사용한 조건에서 각각 63시간 동안 47%와 20시간 동안 96%의 최대 수율을 보였지만, 염화구리 촉매의 구체적인 반응조건에 대한 영향은 발표된 바가 없었다.
따라서, 본 연구에서는 회분식 고압반응기를 이용하여 글리세롤의 산화 카르보닐화 반응에 사용되는 금속 촉매의 영향과 글리세롤 카보네이트 수율에 미치는 영향을 파악하기 위하여 산화제, 일산화탄소와 산소의 몰 비율, 촉매량, 용매의 종류, 반응 온도 및 시간, 탈수제 첨가에 대한 적합한 반응조건을 조사하고자 하였다.
글리세롤 카보네이트의 반응물은 Sigma-Aldrich사의 순도 99.9%인 글리세롤과 (주)유니온가스사의 순도가 99.95%인 일산화탄소(CO), 순도가 99.995%인 산소(O2) 가스를 사용하였다. 사용된 촉매는 Junsei사의 순도가 95%인 염화구리(I)와 Wako 사의 순도가 95%인 염화구리(II), Kojima chemicals사의 순도 가 99%인 염화팔라듐, Sigma-Aldrich사의 순도가 97%인 염화 철(III), 순도가 98%인 염화주석, 염화아연, 순도가 95%인 염화크롬(II)을 사용하였다.
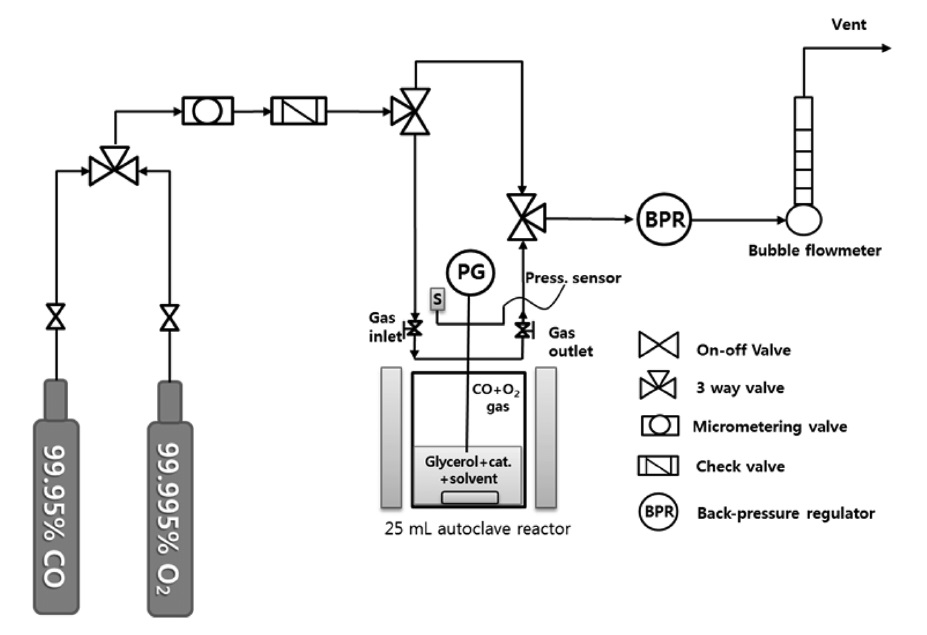
글리세롤 카보네이트 합성을 위한 실험장치는 Figure 2에서 보는 바와 같이 반응온도 및 교반속도가 제어가 가능한 25mL 용량의 고압반응기(autoclave reactor)에서 수행하였으며, 반응기 내부는 반응생성물과 금속벽면과의 마찰을 방지하기 위해 테프론 라이너 처리하였다. 반응기 내부에 반응물인 글리세롤과 용매를 넣은 후에 비활성 기체인 아르곤 가스를 불어 넣어 내부의 수분 및 공기를 제거하였다. 그 후에 반응가스를 주입하고, 원하는 반응압력 및 온도, 시간으로 빠르게 교반 하며 실험을 진행하였다. 반응 완료 후 반응기는 즉시 저온항 온조에서 냉각 후 압력을 서서히 제거하였다. 반응물 및 생성물을
정량하기 위하여 불꽃 이온화 검출기(flame ionization detector; FID)를 장착한 가스크로마토그래피(gas chromatography; GC, HP-5890)를 사용하였다. 사용된 분리용 컬럼 (column)은 Crosslinked 5% PH Me Siloxane column으로 HP-5 (15 m × 0.53 mm × 1.5 μm)를 사용하였다. 가스크로마토그래피의 작동 조건으로 주입부 온도는 473 K와 검출부는 523 K로 설정하고 오븐온도는 363 K를 시작으로 483 K까지 온도 승온 프로그램을 이용하여 분석하였다.
3.1. 금속염화물 촉매의 영향
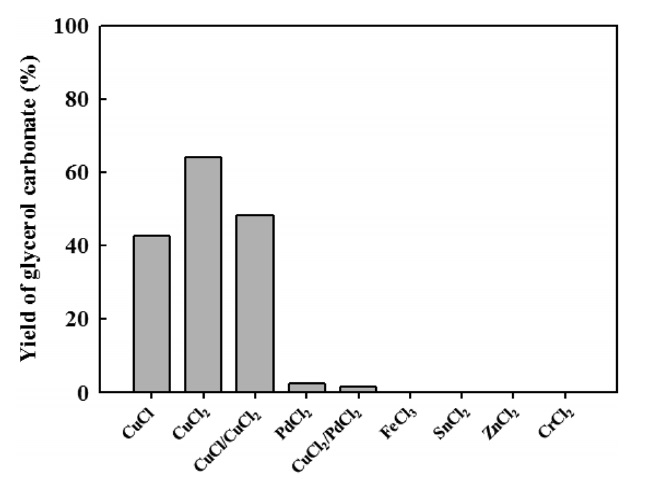
글리세롤 카보네이트 합성은 니트로벤젠 용매상에서 글리세롤:일산화탄소:촉매의 몰 비율이 1:3:0.15, 반응가스로 일산화탄소:산소의 몰 비율이 2:1, 상온에서 반응초기 압력이 30bar, 반응온도 413 K, 반응시간 4시간의 조건에서 염소이온으로 결합된 다양한 금속 촉매에 대한 반응활성을 Figure 3에 나타내었다. 그 결과 전이금속인 구리(Cu)와 팔라튬(Pd)계의 촉매에서 높은 반응활성을 보였으며, 그 중에 염화구리(II) 촉매가 글리세롤 카보네이트 합성에 가장 우수한 반응활성을 보였으며, 최대 약 64%의 수율을 나타내었다. 염화구리(I)/염화구리(II)의 물리적으로 혼합한 경우에는 단독의 염화구리(I) 촉매보다 약 6%의 높은 수율을 보였다. 염화구리(I)와 염화구리(II) 촉매의 반응활성으로부터 금속촉매의 산화수와 음이온에 대한 영향이 크다는 것을 알 수 있었다. 또한, 염화팔라듐은 산화 카르보닐화 반응에 높은 반응활성을 보이는 것으로 보고되고 있으나[9], 염화구리(I)/염화팔라듐의 물리적으로 혼합한 결과에서도 낮은 반응 수율을 보였다. 이러한 결과는 생성된 글리세롤 카보네이트가 다시 2차 반응을 일으켜 수율이 감소되어진 것으로 사료되며, 디카르보닐화 및 가수분해의
2차 반응이 일어나 글리시돌 등의 보다 안정한 화합물로의 전환이 쉽게 진행되는 것으로 보고되고 있다[10,11]. 철(Fe)과 주석(Sn), 아연(Zn), 크롬(Cr)계 촉매에 대한 글리세롤 카보네이트 수율은 나타나지 않았다.
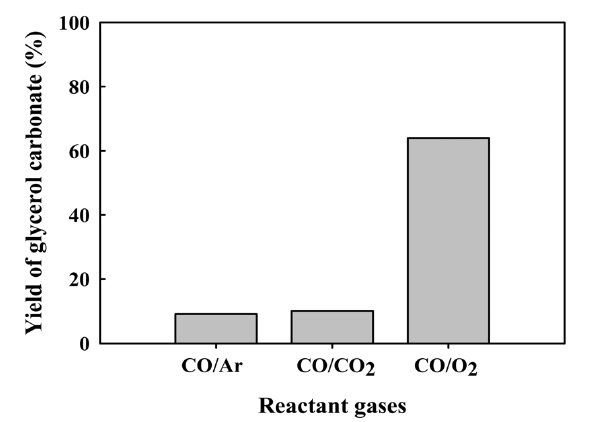
산화성 카르보닐화 반응이 진행되기 위해서 산화제가 존재 해야 하며, 산화제가 존재하지 않을 경우와 산화제 종류에 따른 글리세롤 카보네이트 합성 수율을 Figure 4에 비교하여 나타내었다. 사용된 촉매는 글리세롤 카보네이트 합성에 우수한 반응활성을 보인 염화구리(II)를 사용하여 산화제가 없이 일산화탄소 단독의 경우와 산화제인 산소와 이산화탄소를
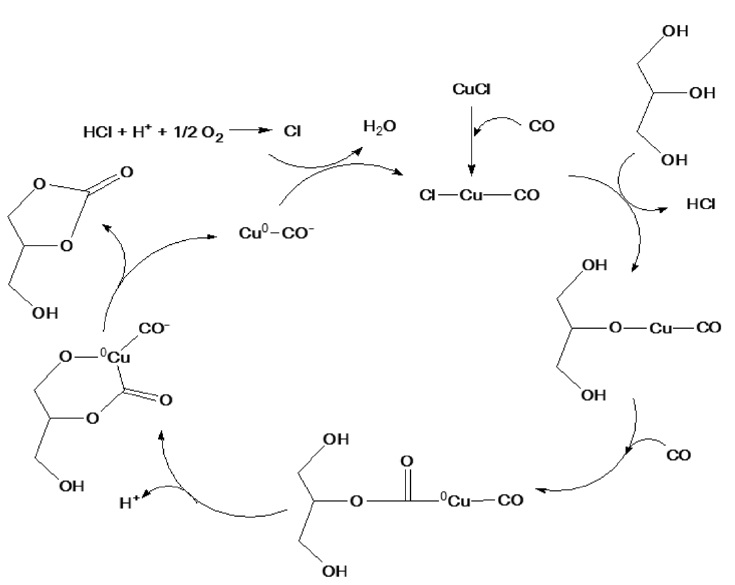
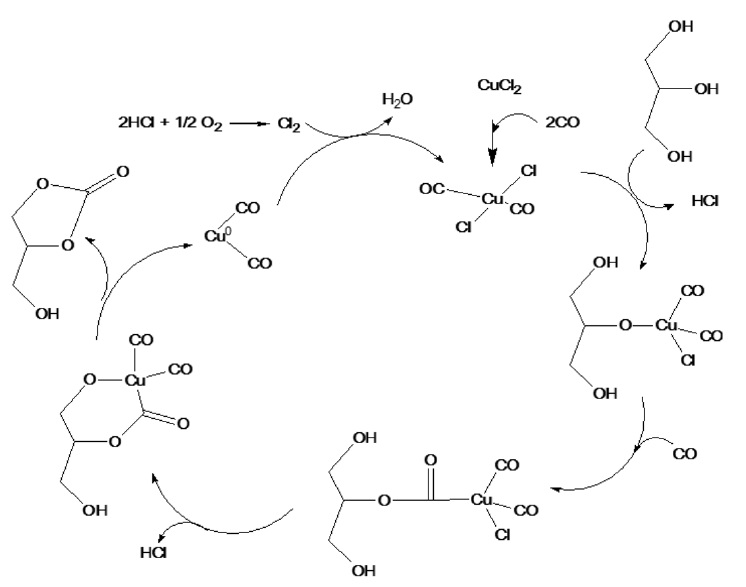
첨가 하였을 때 반응활성을 비교하였다. 그 결과, 단독의 일산화탄소의 경우보다 일산화탄소의 0.5 몰 비율의 산소를 첨가하였 을 때 약 60% 높은 반응수율을 보임을 확인하였다. 이러한 결과는 Hua et al.[9]의 팔라듐계 촉매에 대한 글리세롤의 산화 카르보닐화 반응에 대한 메카니즘과 Zhang과 Bell[12]의 구리계 촉매에 대한 메탄올의 산화 카르보닐화 반응에 대한 메카니즘과 같이 구리 할로겐화물과 같은 촉매의 존재 하에서 글리세롤의 카르보닐화 반응이 진행된 후 산화반응이 수반되어야 함을 알 수 있었다[13,14]. 또한 이에 대한 염화구리 촉매하 에서 글리세롤로부터 글리세롤 카보네이트 합성 메카니즘을 Figure 5와 6과 같이 제안하였다. 산화제로서 첨가된 이산화탄소는 단독의 일산화탄소만 반응시킨 결과와 크게 수율의 차이를 보이지 않았으며, 이러한 결과로부터 산화반응에 크게 기여하지 않는 것으로 사료된다.
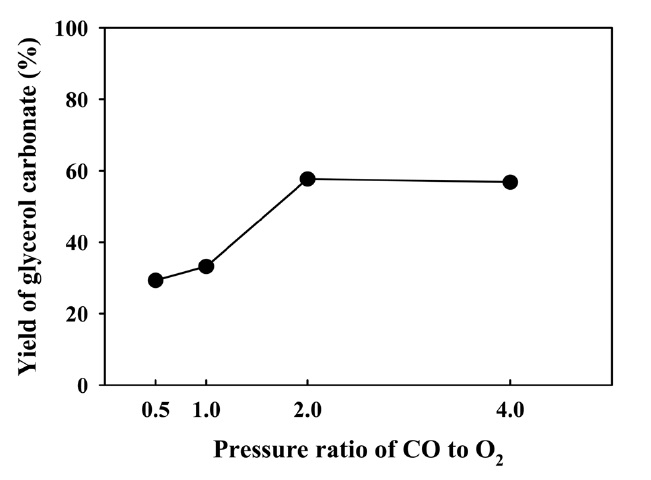
산화성 카르보닐화 반응의 주요 반응조건으로 일산화탄소 와 산소의 몰 비율에 따른 글리세롤 카보네이트의 반응활성 결과를 Figure 7에 보였다. 반응 전체 압력은 일정하게 유지하고 일산화탄소와 산소의 몰 비율을 0.5에서 4.0까지 변화시켜 반응활성을 확인하였다. 그 결과 몰 비율 2.0 이상의 조건에서는 더 이상 글리세롤 카보네이트 수율이 증가하지 않았다. 이러한 결과는 Figure 1과 같이 화학양론식으로 계산하면 글리세롤 1 몰, 일산화탄소 1 몰, 산소 0.5 몰이 반응하여 글리세롤 카보네이트 1 몰이 생성되며, 반응물에 대하여 과량의 산소는 더 이상 글리세롤 카보네이트 생성에 관여하지 않은 것으로 사료된다.
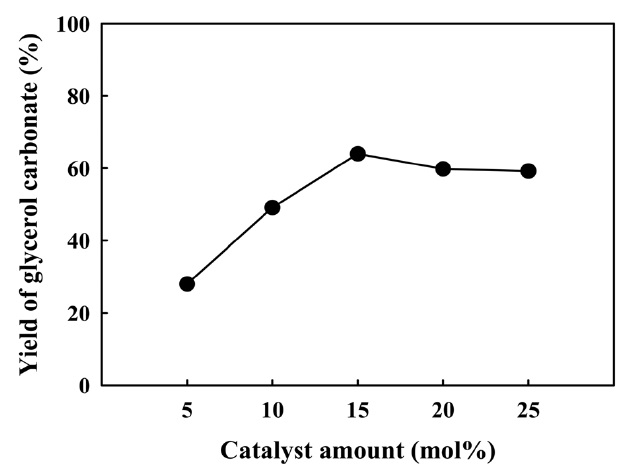
Figure 8은 글리세롤 카보네이트 합성을 위해 염화구리(II) 촉매량에 따른 반응활성을 나타낸 결과이다. 글리세롤 몰
비율을 기준으로 5 mol%에서 15 mol%로 증가할수록 글리세롤 카보네이트 수율은 약 28%에서 약 64%로 현저하게 증가하였으나, 15 mol% 이상의 범위에서는 더 이상 글리세롤 카보네이트 수율이 증가하지 않았다. 공정운전 측면에서 볼 때 경제적인 촉매의 양은 10~15 mol% 범위가 적절하다고 판단된다.
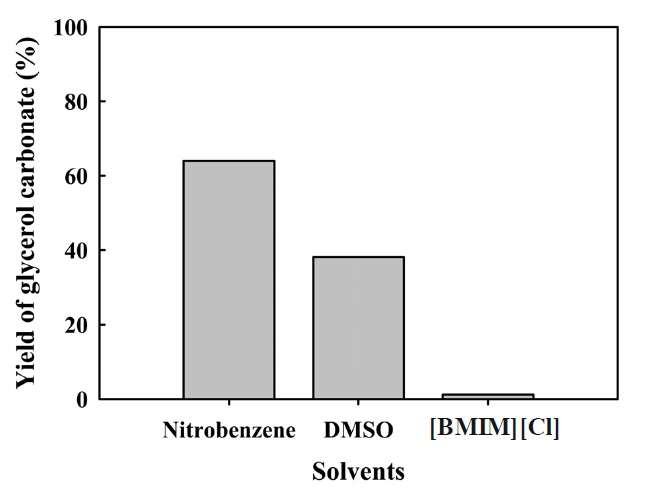
글리세롤 카보네이트 합성을 위해 글리세롤의 부반응을 줄이고, 반응수율을 높이고자 용매를 사용하여 촉매 반응을 진행 하였다. 산화성 카르보닐화 반응에 적합한 용매를 선별하기 위해 대표적인 니트로벤젠의 비극성 용매와 DMSO (dimethyl sulfoxide)와 [BMIM] [Cl] 이온성액체의 극성용매에 따른 반응활성 결과를 Figure 9에 나타내었다. 그 결과, 비극성 용매인 니트로벤젠상에서 글리세롤 카보네이트 수율이 가장 높게 나타남을 확인하였다. 이러한 결과로 살펴볼 때, 일산화탄소 가스는 전이금속 촉매상에서 높은 반응활성을 가지며, 상대적 으로 극성용매에서 일산화탄소와 구리 촉매간의 착화합물 형성이 잘 이루어져 본 반응에서의 극성용매는 반응 용매로 적절하지 않다고 판단되어 진다[15].
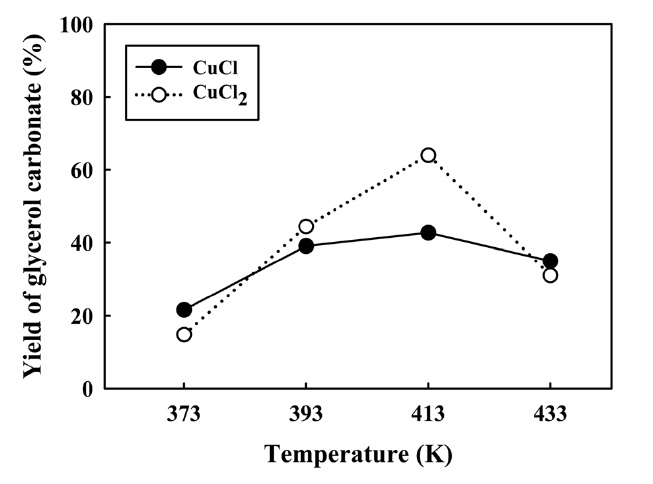
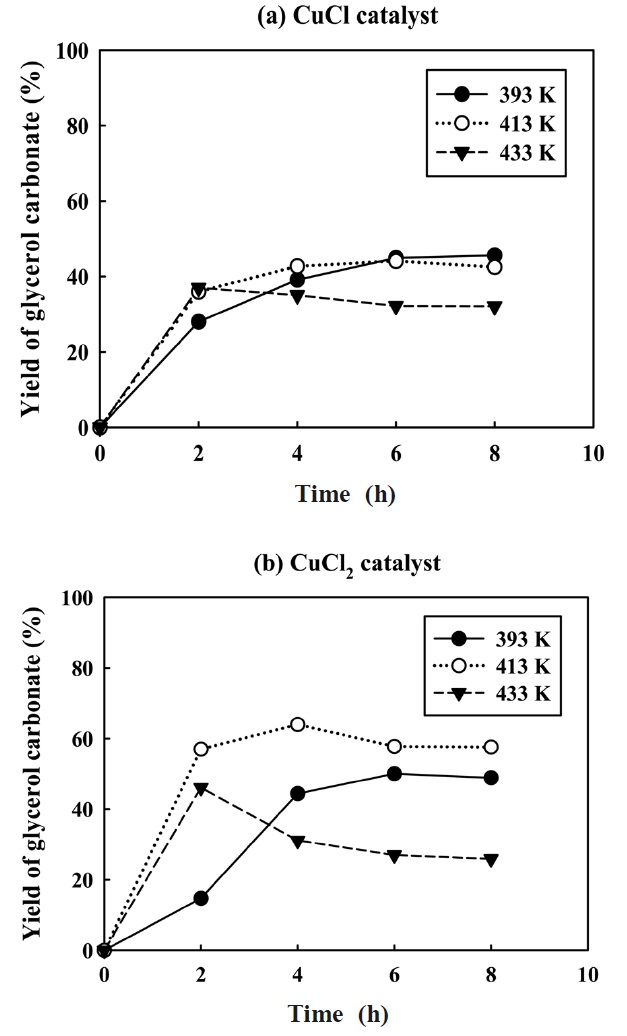
글리세롤 카보네이트 합성을 위한 반응의 최적조건을 찾기 위해 염화구리(I)과 (II)의 촉매에 대한 반응 온도와 시간에 따른 반응활성을 비교하였다. 다른 조건은 고정시키고 반응온도 373 K~433 K 범위에서 반응활성을 조사하여 Figure 10과 11에 나타내었다. 염화구리(I) 촉매는 반응온도 393 K~433 K 범위에서 2시간 이후 글리세롤 카보네이트 수율의 변화가 크지 않았으며, 반응온도 393 K에서는 6시간 동안에 최대 45%의 수율에 도달한 반면에, 반응온도 413 K에서는 4시간 동안에 최대 44%의 수율에 도달하였다. 반응온도 433 K에서는 2시간 이후 37%의 수율에서 서서히 감소하는 경향을 보였다. 반면에
염화구리(II) 촉매는 반응온도 413 K에서 높은 활성을 보였으며, 4시간 동안 최대 약 64%의 수율을 보였다. 반응온도 393 K에서는 반응시간 6시간 동안에 50%의 최대 수율에 도달하였으며, 반응온도 433 K에서는 반응시간 2시간 이후 46% 수율이 감소하는 것을 알 수 있었다. 이러한 결과는 생성된 글리세롤 카보네이트가 염화구리 촉매에 의해 2차 반응이 진행되어 분해에 의한 수율 감소로 사료되어지며, 글리세롤 카보네이트는 금속염 촉매에서 글리시돌 등으로 전환되는 결과들이 보고된 바 있다[10-11].
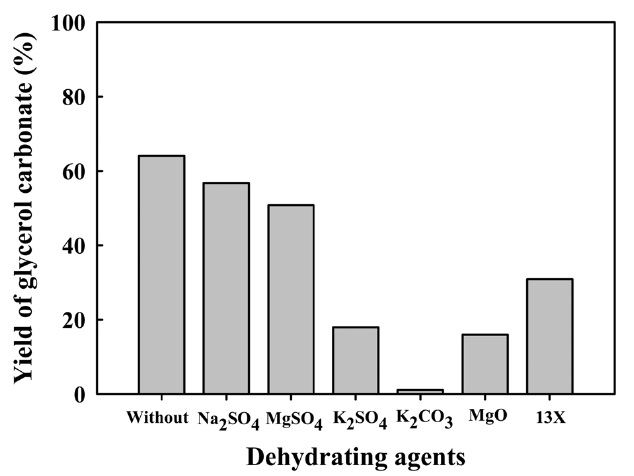
글리세롤의 산화성 카르보닐화 반응에서 부산물로 물이 생성되므로, 이론적 열역학적 평형의 제한에 따라 글리세롤 카보네이트 생성에 한계가 따른다[16]. 이에 글리세롤 카보네이트의 반응수율 증가를 위해 Figure 12에서 보는 바와 같이 탈수제 6종을 첨가하여 그에 따른 반응활성을 조사하였다. 그 결과, 탈수제 6종에 대해 탈수제를 첨가하지 않은 것보다 반응수율이 낮게 나타났으며, 탈수제 첨가는 촉매의 산화 카르보닐화 반응을 저하시키는 것으로 사료되어진다.
본 연구에서는 환경적 측면을 고려하여 제철소 및 석유화학 공장에서 많이 발생되는 부생가스인 일산화탄소와 산소를 이용하여 글리세롤로부터 글리세롤 카보네이트를 합성하는 공정에 대한 연구를 수행하였다. 글리세롤의 산화성 카르보닐화 반응에 대해 연구한 결과, 구리계 촉매가 글리세롤 카보네이트 합성에 우수한 반응활성을 보였으며, 니트로벤젠 용매상에서 글리세롤:일산화탄소:촉매의 몰 비율이 1:3:0.15, 일산화탄소:산소의 몰 비율이 2:1, 상온에서 반응초기 압력이 30 bar, 반응온도 413 K, 반응시간 4시간 동안에 염화구리(I)과 염화구리(II) 촉매에 대해 각각 약 44%와 약 64%의 최대 수율을 보였다. 구리촉매에 대한 반응활성은 금속의 산화수에 따라 수율 차이가 보였으며, 산화제로서의 산소의 역할은 글리세롤 의 카르보닐화 반응 후 산화반응이 수반되어 부생성물인 물을 생성하는데 중요한 역할을 하는 것으로 확인하였다.
바이오디젤 생산량 증가와 함께 공정부산물로 증가하고 있는 글리세롤로부터 제철소 및 석유화학에서 발생되는 잉여 부생가스(일산화탄소와 산소)를 이용한 글리세롤 카보네이트 합성은 환경친화적으로 중요한 대체공정 중의 하나이다. 하지만, 경제성을 확보하기 위해서는 산화 카르보닐화 반응에 대한 고선택성 및 고수율과 내구성이 우수한 촉매 개발 연구가 더 이루어져야 할 필요가 있다.