파클리탁셀(paclitaxel)은 주목나무(yew tree)의 표피에서 발견된 디테르페노이드(diterpenoid) 계열의 항암물질로 난소암, 유방암, 카포시 종양(Kaposi's sarcoma) 및 비소세포성 폐암(nonsmall cell lung cancer, NSCLC) 치료용으로 미국 식품의약국(food and drug administration, FDA) 허가를 취득하여 현재 가장 많이 사용되고 있는 항암제이다[1]. 최근에는 주목나무에서 캘러스(callus)를 유도하고 종균배양을 거쳐 주배양기에서 파클리탁셀을 대량으로 생산할 수 있는 식물세포배양방법이 각광받고 있다[2,3]. 식물세포배양방법은 기후, 환경 등의 외부 인자에 의한 영향을 받지 않고 생물반응기 내에서 안정적으로 생산이 가능하기 때문에 일정한 품질의 파클리탁셀을 얻을 수 있다는 장점이 있다.
식물세포배양으로부터 높은 순도(>98%)의 파클리탁셀을 얻기 위하여 여러 단계의 추출 및 정제 공정이 필요하다. 일반적으로 분리 및 정제 과정은 원료인 바이오매스(파클리탁셀을 함유한 식물세포)로부터 파클리탁셀을 먼저 유기용매로 추출하고, 전 처리 공정을 거쳐 최종 정제를 통하여 제품을 생산하게 되는데, 이 과정에서 특히 전 처리 공정은 최종 정제 비용에 많은 영향을 미친다[4-6]. 기존의 연구들[7-9]에서는 정제를 위한 전 처리 공정으로 고가의 크로마토그래피를 이용하거나 전 처리 없이 추출을 거친 크루드파클리탁셀(crude paclitaxel)을 고성능액체크로마토그래피(high performance liquid chromatography, HPLC)에 의해서 바로 최종 정제하고 있다. 이들 방법은 경제적 측면에서 많은 문제가 있으며 또한 스케일 업 및 대량생산에 많은 어려움이 따른다. 이러한 문제점들을 해결하기 위하여 효율적인 전 처리 공정의 개발이 매우 중요하다. 전처리 공정으로 흡착제 처리 및 침전에 의해 고순도의 크루드파클리탁셀을 얻을 수 있는 방법이 보고되어 있다[10]. 식물유래 타르 및 왁스 성분을 흡착제 처리로 제거한 후에 침전 공정에 의하여 고순도(>50%)의 크루드파클리탁셀을 얻을 수 있어 매우 간단하고 편리하게 전 처리할 수 있는 방법이다. 식물유래 타르 및 왁스 성분은 파클리탁셀의 분리/정제에 많은 악영향을 미치는데, 특히 HPLC 정제 공정에서 칼럼의 충진재(resin)수명을 단축시킬 뿐만 아니라 처리량을 감소시키고 많은 양의 유기용매 사용을 유발함으로 전 처리 공정에서 반드시 제거되어야 한다[1]. 주로 상용흡착제인 활성백토(active clay), 활성탄(activated carbon), 차콜(charcoal), 실로퓨트(sylopute) 등이 식물유래 타르 및 왁스 성분 제거를 위한 흡착제 처리 공정에 활용되어 왔다[11,12]. 또한 상용흡착제의 주요 성분인 실리카와 알루미나를 이용한 흡착제 처리 효과에 대한 연구가 진행되고 있다[13,14]. 하지만 바이오매스 유래 항암물질 파클리탁셀 정제를 위하여, 실리카-알루미나와 같은 무기계 혼합 흡착제를 이용한 흡착제 처리 효과에 관한 체계적 연구는 전무한 실정이다. 특히 실리카와 알루미나는 서로 상반되는 전하(electric charge)를 띄고 있어 이들 혼합 흡착제의 효과는 우수할 것으로 판단되어 본 연구에서는 분무열분해(spray pyrolysis)에 의해 다공성 메조기공 실리카-알루미나 흡착제를 제조하여 흡착제 처리 효과를 조사하였다. 궁극적으로 바이오매스 유래 파클리탁셀 정제에 가장 효과적인 실리카-알루미나 혼합 흡착제를 제안하고자 하였다.
본 실험에 사용된 식물세포배양액은
식물세포배양액으로부터 회수한 바이오매스와 메탄올의 비율을 1/1 (w/v)로 하여 실온에서 30 분 동안 추출하여 여과하고, 바이오매스에 새로운 메탄올을 첨가하여 동일한 방법으로 4회 반복하여 추출을 수행하였다[10]. 추출 여액을 모아 농축기(CCA-1100, EYELA, Japan)에서 40 ℃, 감압상태에서 농축(원액의 30%)하고 농축액에 메틸렌 클로라이드를 첨가(농축액의 25%)하고 실온에서 30분 동안 액-액 추출을 3회 반복 수행하였다. 액-액 추출 후 상 분리를 통해 극성불순물은 상층인 메탄올 층으로 제거하고, 파클리탁셀은 하층인 메틸렌 클로라이드 층으로 회수하여 실온, 감압상태에서 농축/건조하였다. 건조된 시료를 흡착제 처리에 사용하였다[17]. 실리카-알루미나 흡착제 처리에 사용된 시료의 순도는 6.7%이었다.
분무열분해 공정에 의해 다공성 메조기공 실리카-알루미나를 제조하였다. 알루미늄 전구체로 질산알루미늄(aluminum nitrate) (Al(NO3)3?9H2O, Aldrich)를 사용하였고, 실리카 전구체로는 테트라에틸오르쏘실리케이트(tetraethylorthosilicate, TEOS, Aldrich)를 사용하였다. 기공 형성을 위한 주형제로는 폴리(에틸렌 글리콜) 블록 폴리(프로필렌 글리콜) 블록 폴리(에틸렌 글리콜)(P123, Aldrich)를 사용하였다. 분무용액은 실리카 전구체를 녹인 용액에 알루미늄 전구체를 녹이고, P123을 첨가하여 제조하였다. 알루미늄 전구체와 실리카의 전체 농도는 0.2 M로 고정하였고, 알루미늄 기준 유기 템플릿 P123의 몰 비는 0.07로 고정시켜 주었다. 알루미늄과 실리카의 몰비는 0~1로 변화시켜주었다. 제조한 분무용액은 초음파 액적 발생장치(aerosol generator, 진동자 6개, 1.7 MHz, 동림엔지니어링)를 이용하여 액적화를 한 다음 운반기체를 통하여 반응기내로 이동시켰다. 운반기체로는 공기를 사용하였으며, 유량은 10 L/min으로 고정하였다. 건조부와 반응부의 반응기는 길이 1,200 mm, 직경 55 mm인 석영관을 각각 사용하였다. 건조부를 2구역으로 나누고 각각의 온도를 T1 = 300 ℃, T2 = 350 ℃, 반응부의 온도는 T3 = 600 ℃로 고정시켰다. 최종 반응부를 통과한 입자들은 테플론 필터를 이용하여 포집하였다. 제조된 분말에 잔존하는 유기물들을 없애기 위해 전기로 내에서 소성시켜 제거하였다. 전기로의 온도는 550 ℃(승온 속도: 1 ℃/min) 공기분위기 하에서 4시간 동안 소성시켰다. 소성 후 얻은 분말의 질소 흡착/탈착 등온선은 200 ℃에서 전처리 후 Micrometrics 사의 ASAP 2000을 이용하여 -196 ℃에서 측정하였다. 상대압력 0.06~0.3 범위에서 흡착 데이터와 Brunauer-Emmett-Teller (BET)법을 이용하여 표면적을 계산하였다[18]. 기공부피는 상대압력 0.995에서 흡착 부피로부터 계산하였으며 기공크기는 17~3000 A 범위에서 탈착 등온선으로부터 Barrett-Joyner-Halenda (BJH)법을 이용하여 계산하였다.
건조된 시료를 메틸렌 클로라이드에 20% (v/w) 비율로 녹이고 실리카-알루미나 흡착제를 건조된 시료 대비 50% (w/w) 비율로 각각 첨가하여 40℃에서 30 분 동안 교반하며 반응시킨 후 여과하였다. 여과액은 30 ℃, 감압상태에서 건조하여 헥산 침전에 이용하였다.
흡착제 처리 후 건조된 시료를 메틸렌 클로라이드에 녹여 헥산에 떨어뜨려 침전을 유도하여 비극성불순물을 제거하였다(메틸렌 클로라이드/헥산 = 1 : 10, v/v). 헥산 침전 후 여과를 통하여 얻어진 침전물을 35 ℃에서 24 시간 진공건조 하였다. 건조된 침전물의 순도와 수율을 측정(HPLC 분석)하여 흡착제 처리 효과를 확인하였다.
파클리탁셀 함량 분석을 위해 HPLC 시스템(Waters, USA)과 Capell Pak C18 (250 × 4.6 mm, Shiseido, Japan) 칼럼을 사용하였다. 이동상은 아세토니트릴과 증류수 혼합용액(35/65∼65/35, v/v, 구배용매조성법)을 유속 1.0 mL/min으로 흘려주었다. 시료 주입양은 20 μL이며 227 nm에서 UV에 의해 검출하였다. HPLC 분석은 표준정량곡선을 이용하였으며 표준시료는 Sigma-Aldrich 제품(순도: 95%)을 사용하였다[19].
열중량분석(thermogravimetric analysis, TGA) (SDTQ600, Shimadzu, Japan)를 사용하여 흡착제 처리 후 흡착제에 붙어 있는 불순물(유기물)의 양을 측정하였다. 온도를 변화시킴에 따른 무게의 변화를 측정하여 유기물의 양을 정량 분석하였으며 공기를 주입하고 온도는 800 ℃까지 변화시켰다.
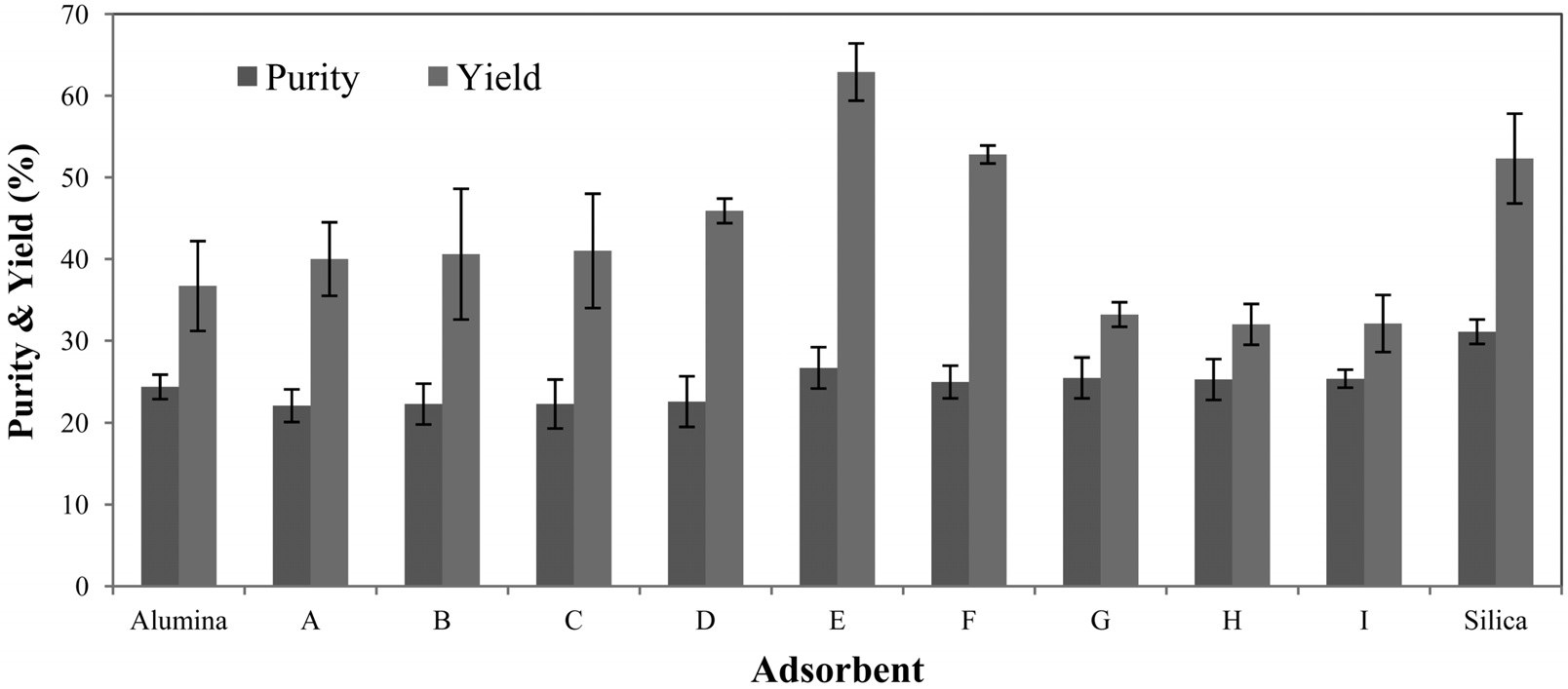
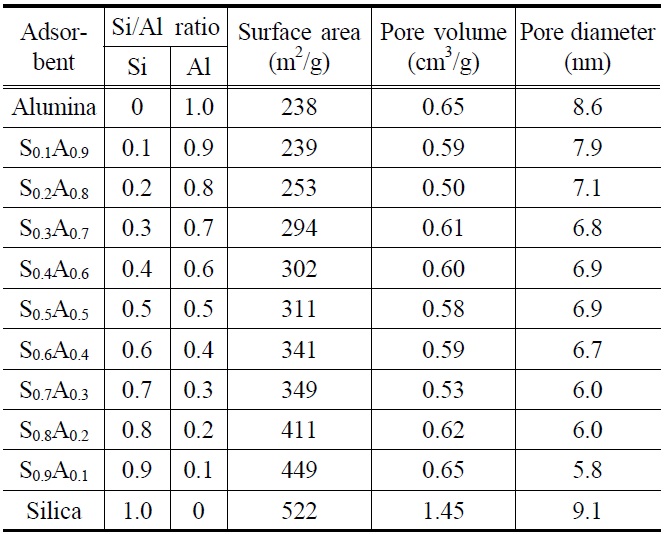
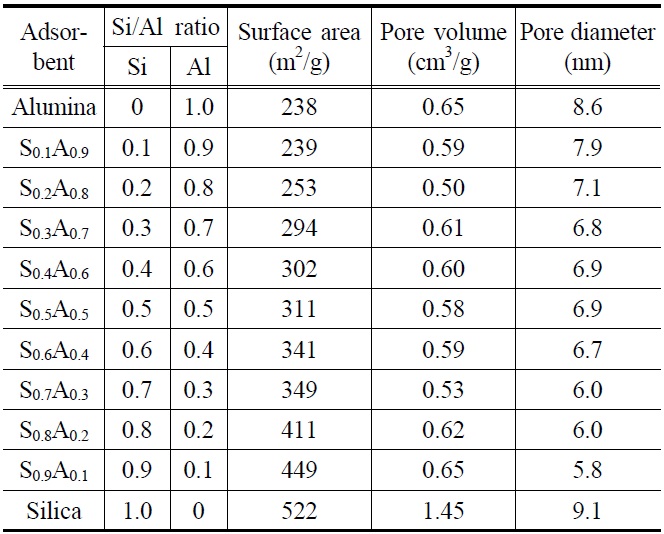
바이오매스로부터 파클리탁셀 정제를 위하여, 실리카와 알루미나를 일정 비율로 혼합하여 기공크기(기공지름: 5.8~7.9 nm)가 비슷한 다공성 메조기공 실리카-알루미나 흡착제를 합성/제조하여 흡착제 처리 효과를 조사하였다. 실험에 사용된 실리카-알루미나 혼합 흡착제는 Table 1에 나타내었다. 실리카-알루미나 혼합 흡착제의 경우 실리카 함량이 증가할수록 흡착제의 물리적 특성(표면적, 기공부피, 기공지름) 중 특히 표면적이 증가함을 알 수 있었다. 실리카와 알루미나 함량이 다른 아홉 가지 실리카-알루미나 혼합 흡착제와 효율 비교를 위한 순수 실리카와 알루미나 흡착제를 각각 사용하여 흡착제 처리와 헥산 침전을 수행한 결과를 Figure 1에 나타내었다. 실리카-알루미나 S0.1A0.9 (Si/Al 몰비 = 0.1/0.9)~S0.5A0.5 (Si/Al 몰비= 0.5/0.5)까지
[Table 1.] Physical properties of mesoporous silica, alumina, and silica-alumina
Physical properties of mesoporous silica, alumina, and silica-alumina
파클리탁셀의 수율이 증가하다가 S0.5A0.5 (Si/Al 몰비 = 0.5/0.5) 이후 다시 파클리탁셀의 수율이 감소함을 알 수 있었다. 반면 순도(~25%) 차이는 전반적으로 미미함을 알 수 있었다. 흡착제 S0.5A0.5을 사용하였을 때 가장 높은 수율(~63%)로 파클리탁셀을 얻을 수 있었으며 실리카(수율: ~52%)와 알루미나(수율: ~37%)를 각각 단독으로 사용하여 흡착제 처리를 수행한 결과보다 더 효과적임을 알 수 있었다. 실리카와 알루미나 흡착제의 경우 일정한 기공크기에서 최대 파클리탁셀 수율을 얻기 위해 적절한 표면적이 요구되는데, 이는 적절한 표면적 이상에서는 불순물뿐만 아니라 파클리탁셀도 많이 흡착/제거되어 파클리탁셀 수율이 감소하기 때문이다. 비슷한 기공크기(평균 기공지름: ~5 nm)에서 최대 파클리탁셀 수율을 얻기 위한 최적의 흡착제 표면적은 알루미나(277 m2/g)보다 실리카(575 m2/g)가 2배 이상 더 크다[14,20]. 실리카-알루미나 혼합흡착제에서도 실리카 함량이 증가할수록 흡착제의 표면적이
증가하였고 S0.5A0.5(표면적: 311 m2/g)에서 최대 파클리탁셀 수율을 나타내었으며 이후 다시 수율이 감소하는 경향을 보였다. 이러한 결과는 실리카-알루미나 혼합 흡착제(S0.5A0.5)의 적절한 표면적에 기인하는 것으로 판단된다[20].
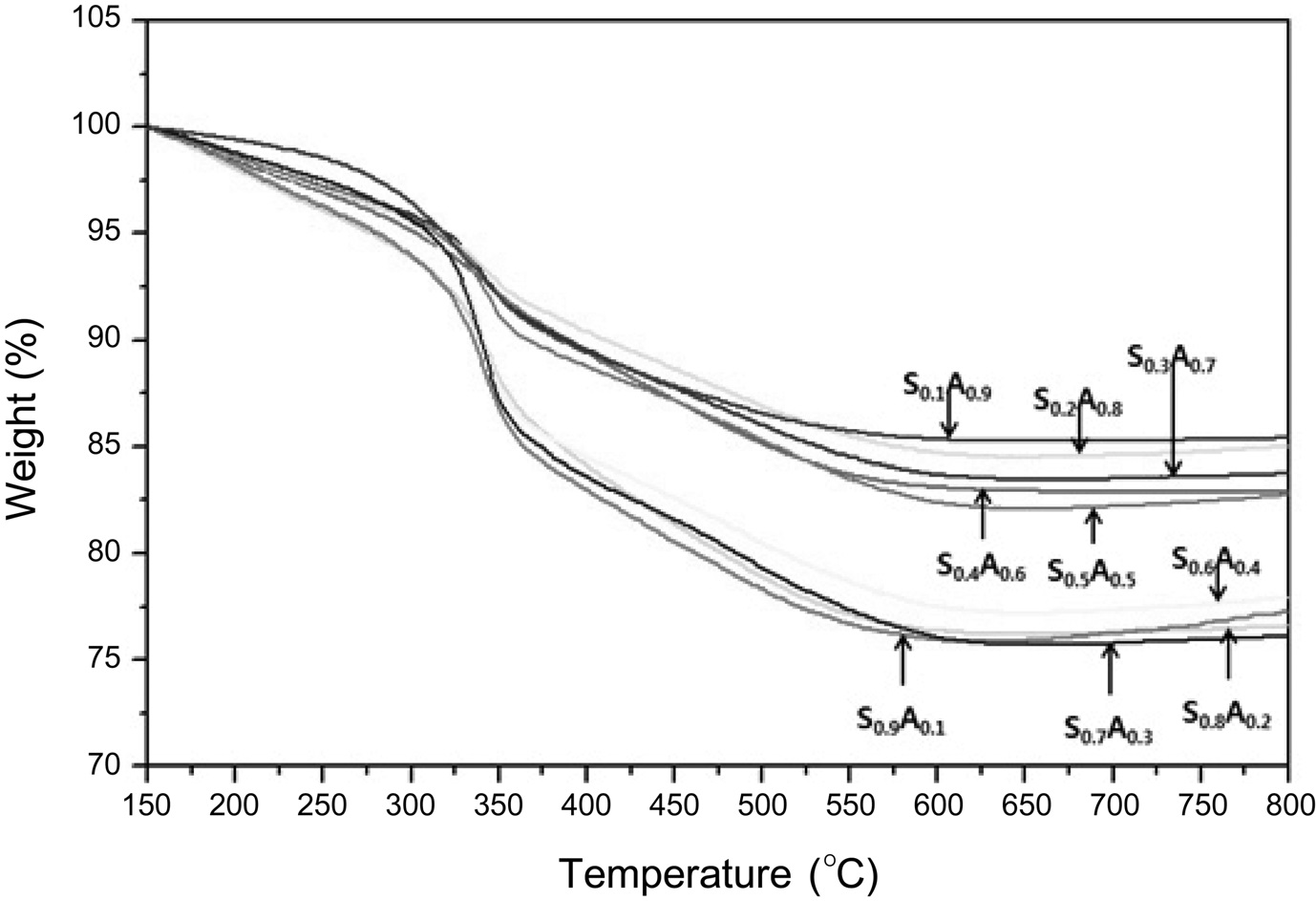
흡착제 처리 후 흡착제에 붙은 총 유기물의 양을 정량하기 위하여, TGA 분석을 수행하였다[13]. Figure 2에서 보는 바와 같이 흡착제에 붙은 유기물의 양은 S0.1A0.9 (15.5 wt%), S0.2A0.8 (16.2 wt%), S0.3A0.7 (16.5 wt%), S0.4A0.6 (17.1 wt%), S0.5A0.5 (17.9 wt%), S0.6A0.4 (22.8 wt%), S0.7A0.3 (23.8 wt%), S0.8A0.2 (24.1 wt%), S0.9A0.1 (24.3 wt%)으로 실리카의 함량이 증가할수록 많은 유기물(타르 및 왁스 성분 포함)이 흡착/제거되는 것을 확인 할 수 있었다. 이러한 결과로부터 알루미나 함량이 많을 경우 타르 및 왁스 성분과 같은 불순물 제거율이 낮은 반면 실리카의 함량이 많을 경우 불술물 제거율이 높을 뿐만 아니라 알루미나보다 표면적이 넓어 파클리탁셀의 흡착량도 많은 것으로 판단된다. 결국 실리카-알루미나 혼합 흡착제 S0.5A0.5의 적절한 표면적으로 가장 높은 파클리탁셀 수율을 얻을 수 있는 것으로 판단된다.
본 연구에서는 분무열분해(spray pyrolysis)에 의해 다양한 혼합비의 다공성 메조기공 실리카-알루미나 흡착제를 제조하여 항암물질 파클리탁셀의 정제에 이용하였다. 흡착제 S0.5A0.5 (Si/Al 몰비 = 0.5/0.5)을 사용하였을 때 가장 높은 수율(~63%)로 파클리탁셀을 얻을 수 있었으며 실리카(수율: ~52%)와 알루미나(수율: ~37%)를 각각 단독으로 사용하여 흡착제 처리를 수행한 결과 보다 더 효과적임을 알 수 있었다. 흡착제 처리 후 흡착제에 붙은 유기물의 양을 정량하기 위하여 TGA 분석을 수행한 결과, 실리카의 함량이 증가할수록 많은 유기물(타르 및 왁스 성분 포함)이 흡착/제거되는 것을 확인할 수 있었다.