본 연구에서는 프린터 토너의 대전량 제어제로 사용되는 아연 착화합물 제조시 금속염과 다가알코올을 첨가함에 따라 변화되는 입자 형태, 평균 입도 및 마찰대전량에 대해 고찰하였다. 아연 착화합물을 제조하기 위해 염화아연과 3,5-di-tert-butyl salicylic acid를 사용하였다. 다가알코올을 첨가함에 따른 입자 형태 변화를 확인하기 위해 아연 착화합물 제조시 폴리에틸렌글리콜(PEG-300), 글리세린 및 에틸렌글리콜을 첨가하였고, 금속염인 염화알루미늄을 첨가함으로써 변화되는 입자크기를 확인하였다. 또한 금속염과 다가알코올을 동시에 첨가하여 입도 변화를 확인한 결과, 각각 단독으로 첨가 했을 때보다 아연착화합물의 평균 입도가 더 많이 감소하는 것을 확인할 수 있었다. 특히, 알루미늄 착화합물의 함유량이 30 wt%이고 염화아연에 대한 PEG-300의 몰비를 3으로 하였을 때 아연 착화합물의 평균 입도가 2.33 μm로 순수한 아연 착화합물의 평균 입도인 5.28 μm의 44.1%로 가장 많이 감소한 것을 알 수 있었다.
복사기, 레이저 프린터 등에 사용되는 토너는 열가소성 고분자수지, 안료, 왁스, 대전량(帶電量) 제어제(制御劑) 등을 원료로 사용하여 제조된다[1-4]. 이 중에서 대전량 제어제는 전하제어제(電荷制御劑)라고도 하며 토너에 1~5 wt% 첨가되는데, 토너입자가 마찰될 때 정전기를 잘 띠게 하여 정전기적 인력으로 원하는 글자나 그림을 나타나게 하는 역할을 하는 아주 중요한 원료 중 하나이다[5,6]. 이런 대전량 제어제는 금속이 중심 원자가 되어 반응한 여러 종류의 금속 착화합물이 주종을 이루고 있으며 토너를 제조할 때 사용되고 있다. 대전량 제어제로 사용하는 금속 착화합물을 구성하는 금속에는 철(Fe), 아연(Zn), 알루미늄(Al), 지르코늄(Zr), 칼슘(Ca), 크롬(Cr) 등이 있고, 금속 착화합물의 배위자인 유기화합물에는 방향족히드록시카복실산, 방향족카복실산 유도체, 방향족아조화합물 등이 있다[7].
대전량 제어제를 사용하는 토너의 직경은 제조사와 종류에 따라 다르지만, 흑백토너의 평균 직경은 보통 10~15 μm이고, 칼라토너의 평균 직경은 대부분 6~8 μm이다. 칼라토너의 평균 직경은 흑백토너의 평균 직경의 대략 절반 정도이기 때문에 칼라토너에 사용되는 대전량 제어제는 흑백토너에 사용되는 대전량 제어제보다 직경이 작아야 한다. 최근에 칼라토너의 사용량이 증대됨에 따라 흑백토너의 경우보다 미세한 대전량 제어제의 수요가 증가하고 있다. 이러한 대전량 제어제의 직경은 대전량 제어제의 종류 및 제조 방법 등에 따라 달라진다. 대표적으로 아연 금속을 중심 원자로 하고 3,5-di-tertbutyl salicylic acid를 배위자로 결합시킨 아연계 대전량 제어제(아연 착화합물)의 평균 직경은 5~6 μm이다. 이보다 작은 직경의 아연계 대전량 제어제를 생산하는 방법으로는 제트밀(jet mill, fluid energy mill) 등으로 분쇄하는 방법이 있다. 그러나 이 방법은 분쇄설비인 제트밀 외에도 고압공기공급설비, 집진설비 등의 부대설비가 많이 필요하기 때문에 넓은 공장 부지와 많은 투자비가 소요된다. 그뿐만 아니라 분쇄에 투입된 에너지의 98% 이상이 손실되어 분쇄에 투입된 에너지효율은 0.1~2%이다[6]. 따라서 비용은 많이 들고 분쇄 효율이 낮기 때문에 제조원가가 상승한다는 단점이 있다.
또한 착화합물이 형성될 때에 반응물질들끼리 접촉하는 액적의 크기를 미세하게 조절하면, 그 액적 크기 이하의 결정이 형성되어 미세한 대전량 제어제를 제조할 수 있는 방법을 고려할 수 있다. 그러나 대부분의 착화합물 형성 반응은 매우 빠르게 (1×10-1~1×10-11 s 이내) 진행되고[8] 이와 동시에 입자가 형성되기 때문에 교반속도의 증가, 분무 액적의 미세화 등의 물리적 방법으로는 아연계 대전량 제어제의 입자 크기를 5 μm 이하로 제조하기는 어렵다. 따라서, 이러한 문제점을 해결하고자 방향족히드록시카복실산, 방향족카복실산 유도체 등을 배위자로 하고 배위 중심 금속으로 아연을 사용한 대전량 제어제의 연구는 많이 진행되어 있으나[9,10] 이 연구들은 착화합물 생성반응을 조절하여 결정입자의 크기를 작게하려는 목적으로 연구된 것이 아니다.
따라서, 본 연구에서는 분쇄 공정을 거치지 않고, 착화합물의 생성 반응 지연 및 입자의 성장 제어를 통한 아연계 미세대전량 제어제를 합성하기 위하여, 금속염인 염화알루미늄 및 다가알코올 첨가가 아연 착화합물 입자 크기 조절에 미치는 영향을 고찰하였다. 금속염으로 지르코늄옥시클로라이드를 사용한 연구[11]의 후속 연구로 진행된 본 연구에서는 금속염 및 다가알코올을 각각 단독으로 또는 동시에 첨가하여 합성한 아연 착화합물의 대전량의 변화도 관찰하였다.
염화아연(ZnCl2, Kanto Chemical Co., 98%), 3,5-di-tert-butyl salicylic acid (C15H22O3, Hangzhou Fulaite Plastic Development Co., 99.5%), 수산화나트륨 (NaOH, 덕산약품공업(주), 98%)을 사용하여 아연 착화합물을 합성하였다. 합성 방법은 이전 연구[11]와 동일하게 식 (1)과 같은 중화반응 그리고 식 (2)와 같은 아연 착화합물 생성 반응으로 되어 있다.
합성한 아연 착화합물에 대하여 입도분포분석기(particle size distribution analyzer, BI-DCP, Brookhaven Instrument Co.)를 사용하여 평균 입도를 측정하였으며, 주사전자현미경(scanning electron microscopy, JCM 5000, Jeol Co.)을 사용하여 그 입자 형태를 관찰하였다. 또한 퓨리에변환적외선광도계(Fourier transform infra-red spectrometer, Nicolet 6700, Thermo)를 사용하여 적외선흡수분광분석을 하였으며, 원소분석기(elemental analyzer, FLASH EA-2000, FLASH EA-1112, Thermo Finnigan) 및 유도결합플라즈마방출분광기(inductively coupled plasma emission spectrometer, ICAP 6000, Thermo elemental)를 사용하여 원소(C, H, O, Zn)의 함유량을 분석하였다.
수산화나트륨과 3,5-di-tert-butyl salicylic acid를 식 (1)과 같이 반응시킨 후에 염화아연 수용액 대신에 염화알루미늄(AlCl3, Junsei Chemical Co., 98%) 수용액을 사용하여 알루미늄 착화합물을 합성하였고, 주사전자현미경을 사용하여 그 입자 형태를 관찰하였다.
아연 착화합물을 합성하는 실험에서 다른 금속염을 소량첨가함으로써 아연 착화합물의 입자가 성장하는 동안에 다른 금속 착화합물이 형성되게 하여 아연 착화합물 입자 성장을 억제하고, 그 결과 미세한 아연 착화합물을 얻고자 하였다. 소량 첨가된 금속염으로는 염화알루미늄(AlCl3)을 사용하였다. 염화아연 수용액에 염화알루미늄을 첨가하여 착화합물을 합성하였는데, 생성된 전체 착화합물에 대하여 알루미늄 착화합물의 함유량이 5~30 wt%이 되도록 염화알루미늄을 첨가하였다. 아연 착화합물을 합성하는 실험에서 다가알코올을 첨가함으로써 아연이온이 리간드와 반응하는 속도 즉, 아연 착화합물의 입자가 성장하는 속도를 낮추어 미세한 아연 착화합물을 얻고자 하였다. 첨가된 다가알코올은 에틸렌글리콜(ethylene glycol (HOCH2CH2OH), 삼전화학(주), 99.5%), 글리세린(glycerin(HOCH2CHOHCH2OH), 삼전화학(주), 99%), 폴리에틸렌글리콜(polyethylene glycol(PEG-300) (HO-(CH2CH2O)nH, (주)그린소프트켐, 98%) 등 극성이 강한 수용성 물질을 사용하였다. 염화아연에 대한 다가알코올의 몰비는 1 : 0.5~1 : 3이었다. 다가알코올은 염화아연을 물에 용해할 때 함께 투입하였다. 금속염과 다가알코올을 각각 단독으로 염화아연 수용액에 첨가하기도 하고, 금속염과 다가알코올을 동시에 염화아연 수용액에 첨가하여 아연 착화합물을 합성하였고, 입도분포분석기를 사용하여 평균 입도를 측정하였으며, 주사전자현미경을 사용하여 그 입자 형태를 관찰하였다.
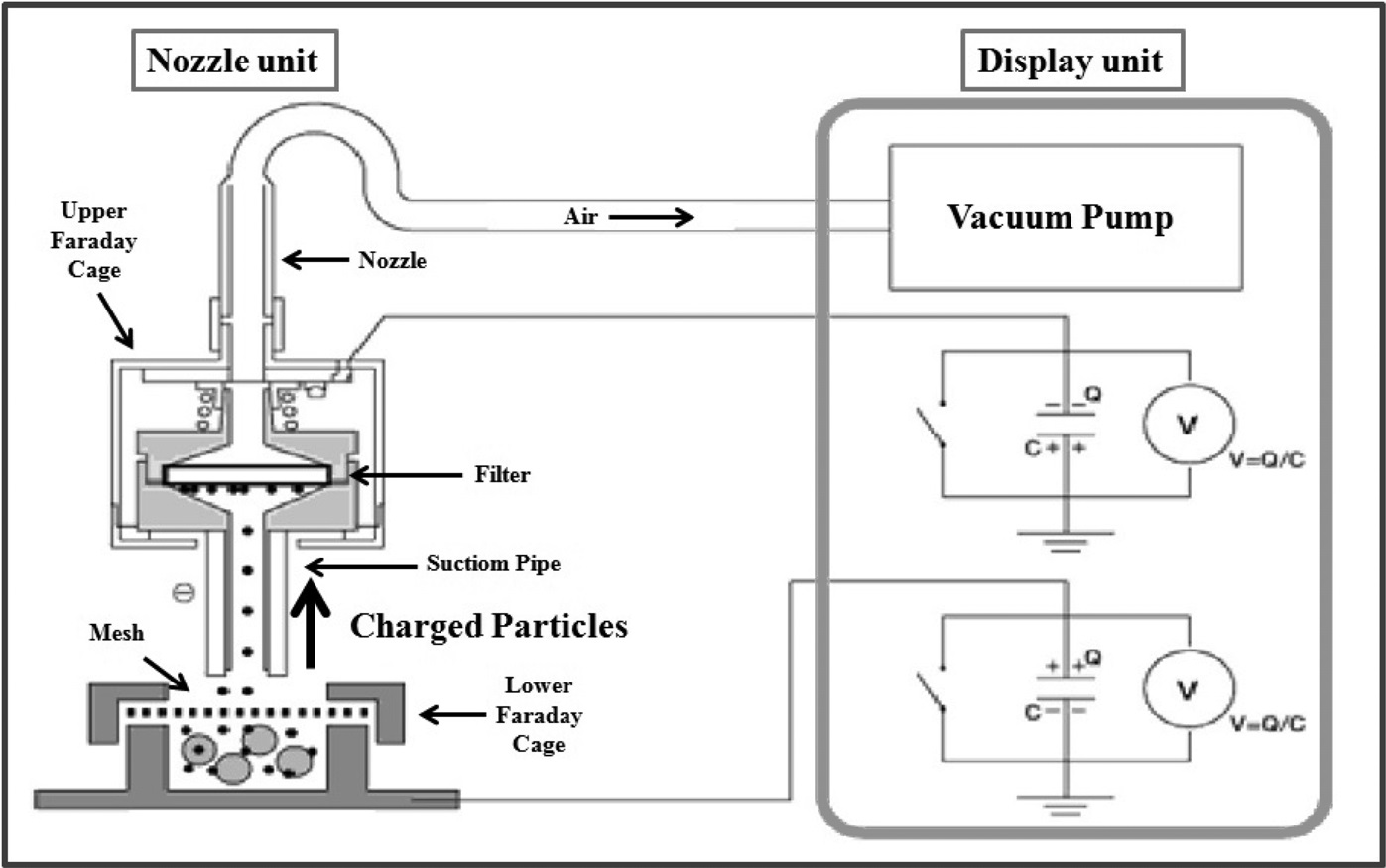
합성한 아연 착화합물의 대전량을 흡입식 대전량 측정기(TREK JAPAN Co., Model No. 212HS)를 사용하여 다음과 같이 측정하였다. 내경 5.5 cm, 내용적 270 cm3의 유리병에 캐리어(carrier) 입자로 일본 철분회사(鐵粉會社)의 마그네타이트(magnetite) 분말(제품명: FH96-150) 99 g과 아연 착화합물 분말 1 g을 함께 넣고 뚜껑을 닫은 다음, 볼밀(ball mill)로 유리병을 100 rpm 속도로 5분간 회전시킴으로써 캐리어인 마그네타이트와 아연 착화합물을 마찰시켜서 정전기를 띠게 한다. 이렇게 대전된 혼합물 1 g을 Figure 1의 하부 패러데이케이지(Faraday cage)에 넣고 250 mesh의 스텐레스 망(stainless mesh)을 대고 패러데이케이지의 뚜껑을 덮는다. 그리고 상부 패러데이 케이지의 내부에 공극이 1 μm인 여과지를 넣고 결합한 후에 무게를 측정하고 노즐(nozzle)에 연결한다. 진공펌프를 작동시키면서 상부 패러데이케이지의 흡입관(suction pipe)을 하부 패러데이케이지의 스텐레스 망(stainless mesh)에 가볍게 밀착시킨 상태에서 3분 동안 천천히 원형으로 회전시킨다. 이때 크기가 큰 캐리어 입자는 스텐레스 망에 걸려서 흡입되지 않고 크기가 작은 아연 착화합물 입자만 상부 패러데이케이지로 흡입되어 상부 패러데이케이지에 정전기를 띠게 하고 전하량이 측정된다. 동시에 하부 패러데이케이지에는 같은 양의 전하량이 반대 부호로 측정된다. 상부 패러데이케이지를 노즐로부터 분리시킨 후에 다시 무게를 측정하여 상부 패러데이케이지에 흡입된 아연 착화합물 입자의 무게 즉, 흡입량을
측정하여 식 (3)으로부터 대전량을 구한다.
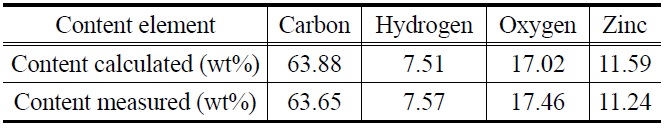
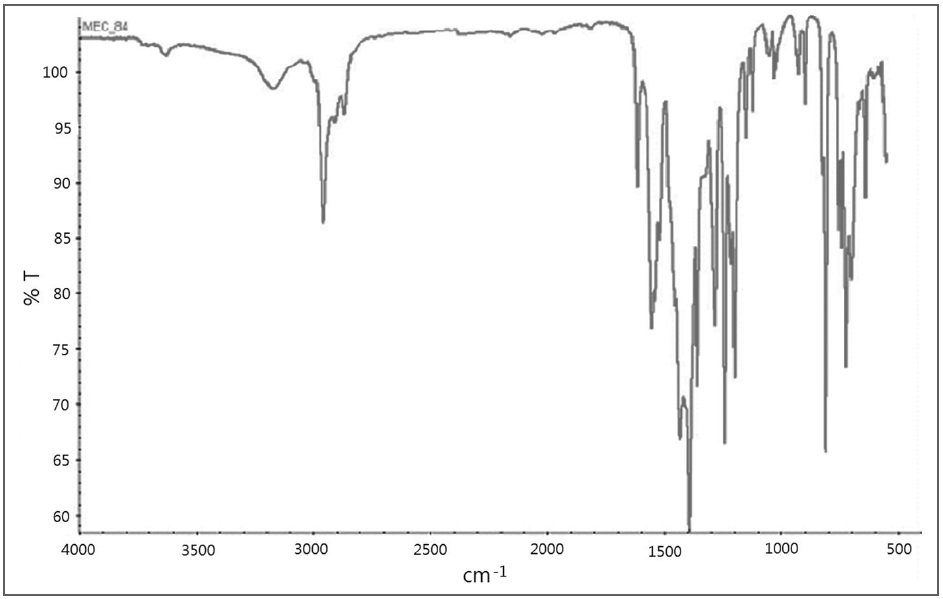
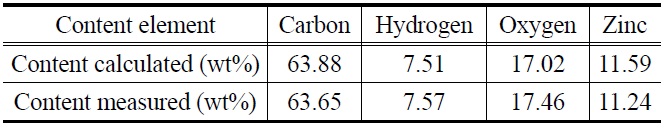
아연 착화합물의 적외선흡수분광 결과를 Figure 2에 나타내었다. Figure 2에서 보는 바와 같이 카르보닐기의 신축 진동에 해당하는 1,680과 1,690 cm-1에서의 흡수성이 사라지는 것으로 나타났으며, 이 결과로부터 3,5-di-tert-butyl salicylic acid가 그것의 아연 염으로 전환되었음을 확인할 수 있었다. 또한 원소(C, H, O, Zn)의 분석 결과를 Table 1에 나타내었다. Table 1이 3,5-di-tert-butyl salicylic acid의 아연염이 생성되었음을 확인할 수 있었다. 또한 아연 착화합물의 대전량을 온도 20~22 ℃, 상대습도 36~38%인 환경에서 측정한 결과 -70.6 μC/g이었다.
3.2. 알루미늄 착화합물의 함유량에 따른 입자 형태의 변화
아연 착화합물과 알루미늄 착화합물의 전자주사현미경 사진을 Figure 3에 나타내었다. Figure 3(a)에서 볼 수 있는 바와 같이 아연 착화합물은 침상형(針狀形) 입자 형태이며 입자의 크기는 5~6 μm 정도이었다. Figure 3(b)에서 볼 수 있는 바와 같이 알루미늄 착화합물은 원판형(圓板形) 입자 형태이고, 크기는
[Table 1.] The results of elemental analysis on zinc complex compound
The results of elemental analysis on zinc complex compound
아연계 대전 제어제 보다 훨씬 작은 나노크기임을 알 수 있다.
또한 염화알루미늄을 염화아연 수용액에 첨가하여 아연 착화합물 생성 반응을 시키면 아연 착화합물과 알루미늄 착화합물이 동시에 생성된다. 생성된 전체 금속 착화합물에 대하여 알루미늄 착화합물의 함유량이 5, 10, 15, 20, 25, 30 wt%가 되도록 염화알루미늄의 첨가량을 조절하여 아연 착화합물을 합성하였고, 각각의 주사전자현미경 사진을 Figure 4에 나타내었다.
Figure 4에서 보는 바와 같이 염화알루미늄을 첨가하지 않고 합성한 아연 착화합물(Figure 3(a))에 비하여 염화알루미늄을 첨가하여 합성한 아연 착화합물 입자의 크기가 작아졌다. 알루미늄 착화합물의 함유량이 5 wt%에서 30 wt%까지 증가할수록 크기가 작은 입자의 비율이 증가하고 있다. 염화알루미늄을 첨가하지 않고 합성한 아연 착화합물(Figure 3(a))과 알루미늄 착화합물의 함유량이 5 wt%인 아연 착화합물(Figure 4(a))의 입자 형태를 비교해 보면, 염화알루미늄을 첨가하지 않고 합성한 아연 착화합물(Figure 3(a))은 폭이 두꺼운 침상형의 입자 형태이지만 알루미늄 착화합물의 함유량이 5 wt%인 아연착화합물(Figure 4(a))은 폭이 가늘고 길이가 짧은 침상형의 입자 형태로 되어 있다. 이러한 경향은 알루미늄 착화합물의 함유량이 증가할수록 더욱 심해졌다.
알루미늄 착화합물의 함유량이 증가할수록 결정의 크기가 작아지는 현상은 다음과 같이 설명할 수 있다. 염화알루미늄을 염화아연 수용액에 첨가하여 사용하면, 아연 착화합물이 생성되면서 침상형의 큰 입자가 형성될 때에, 혼합되어 있던 염화알루미늄으로부터 알루미늄 착화합물이 생성되면서 원판형의 작은 입자가 함께 성장한다. 이는 침상형의 큰 입자가 형성되는 동시에 원판형의 작은 입자가 형성되어 침상형의 큰 입자의 성장을 방해하기 때문에 입자 크기가 작아진 것으로 사료된다.
알루미늄 착화합물의 함유량이 20~30 wt%인 아연 착화합물(Figure 4 (d)~(f))은 아연 착화합물(Figure 3(a))의 입자 형태인 침상형의 입자와 알루미늄 착화합물(Figure 3(b))의 입자형태인 원판형의 입자가 혼재되어 있는데 알루미늄 착화합물의 함유량이 증가할수록 원판형의 입자 형성이 증가하고 있다. 그러나 알루미늄 착화합물의 함유량이 5 wt%인 아연 착화합물(Figure 4(a))은 원판형의 입자가 거의 없고 대부분 침상형의 입자로 구성되어 있다. 알루미늄 착화합물의 함유량이 10~15 wt%인 아연 착화합물(Figure 4(b)~(c))은 원판형의 작은 입자가 소량 존재하고 있는 것을 확인하였다.
3.3. 아연 착화합물의 입자 크기 및 대전량에 미치는 금속염의 첨가의 영향
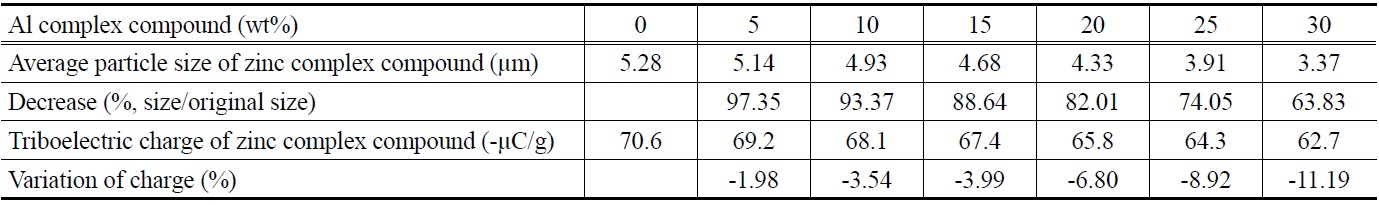
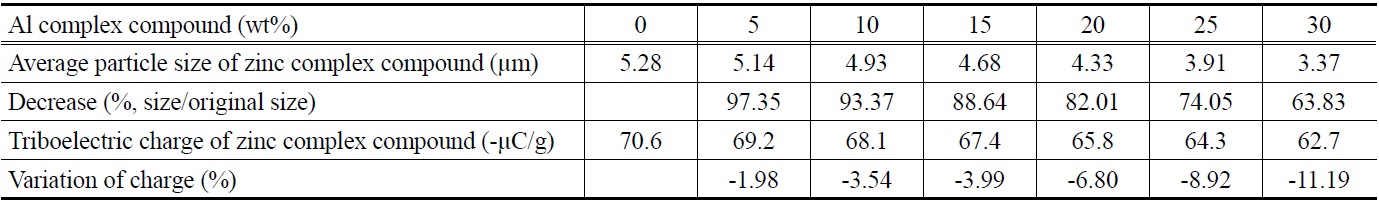
소량 첨가된 금속염으로 염화알루미늄을 사용하여 아연 착화합물을 합성하였고, 그 평균 입도 및 대전량을 측정하여 Table 2에 나타내었다. 또한 식 (4)와 같이 대전량 변화를 계산하여 Table 2에 함께 나타내었다.
Table 2에서 보는 바와 같이, 다른 금속염을 첨가하지 않은 경우의 아연 착화합물의 평균 입도는 5.28 μm이고, 염화알루미늄을
The average particle size and the triboelectric charge amount of zinc complex compound which is mixed with aluminium(III) chloride
The average particle size and the triboelectric charge amount of zinc complex compound which is mixed with polyhydric alcohols
첨가한 경우 그 첨가량이 증가함에 따라 아연 착화합물의 평균 입도는 감소하였다. 알루미늄 착화합물의 함유량이 30 wt%인 아연 착화합물의 평균 입도는 3.37 μm이었으며, 금속염을 첨가하지 않은 경우의 아연 착화합물의 평균 입도인 5.28 μm의 63.8%의 크기로 감소하였다. 이 결과로 보아 알루미늄 착화합물의 함유량이 30 wt%를 초과하도록 염화알루미늄을 첨가하면 아연 착화합물의 평균 입도는 더욱 더 감소할 것으로 사료된다. 그러나 염화알루미늄의 사용량을 증가시키면 아연 착화합물의 생성량은 감소하고 알루미늄 착화합물의 생성량이 증가하여 다른 종류의 대전량 제어제가 되기 때문에 알루미늄 착화합물의 함유량은 30 wt%까지를 실험 범위로 정하였다.
순수한 아연 착화합물의 대전량은 -70.6 μC/g이고, 순수한 알루미늄 착화합물의 대전량은 -53.7 μC/g으로 아연 착화합물의 대전량보다 알루미늄 착화합물의 대전량이 낮았다. Table 2에서 보는 바와 같이 아연 착화합물의 대전량은 알루미늄 착화합물의 함유량이 증가함에 따라 감소하였다. 이러한 결과는 순수한 아연 착화합물의 대전량보다 대전량이 낮은 알루미늄 착화합물의 함유량이 증가하기 때문에 아연 착화합물의 대전량이 감소하는 것으로 판단된다.
3.4. 아연 착화합물의 입자 크기 및 대전량에 미치는 다가알코올의 첨가의 영향
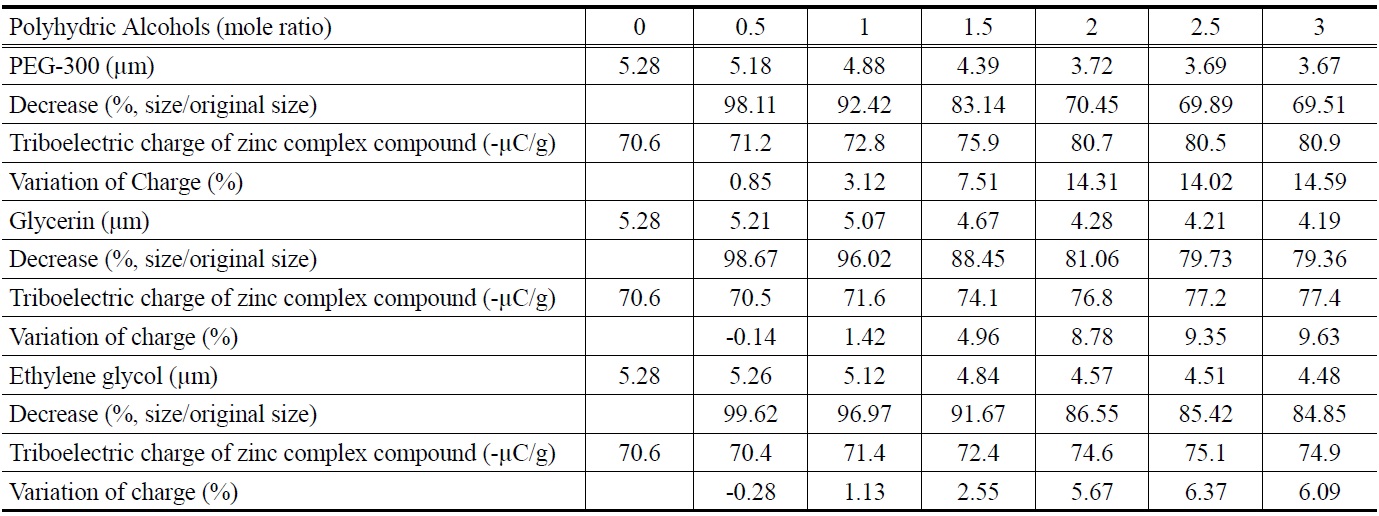
첨가한 다가알코올은 에틸렌글리콜, 글리세린, PEG-300 등극성이 강한 수용성 물질이며, 이를 첨가하여 합성한 아연 착화합물의 평균 입도 및 대전량을 Table 3에 나타내었다. Table 3에서 보는 바와 같이, 3가지 경우 모두 염화아연에 대한 다가알코올의 몰비가 증가할수록 아연 착화합물의 평균 입도는 감소하였는데, 그 이유는 이전의 연구[11]에서 고찰한 바와 같다.
그러나 3가지 경우 모두 염화아연에 대한 다가알코올의 몰비가 증가할수록 아연 착화합물의 대전량은 증가하였는데, 대전량의 증가폭은 PEG-300의 경우가 제일 컸고, 그 다음은 글리세린, 에틸렌글리콜 순으로 평균 입도가 작아질수록 대전의 증가폭은 커졌다. 이러한 결과는 알루미늄 착화합물이 혼재되어 있지 않은 상태에서 순수한 아연 착화합물의 평균 입도가 감소함에 따라 아연 착화합물 입자의 표면적이 증가하고 그에 따라 마찰에 의한 표면 전하의 발생이 증가하기 때문으로 사료된다.
3.5. 아연 착화합물의 입자 크기에 미치는 금속염과 다가알코올의 동시 첨가의 영향
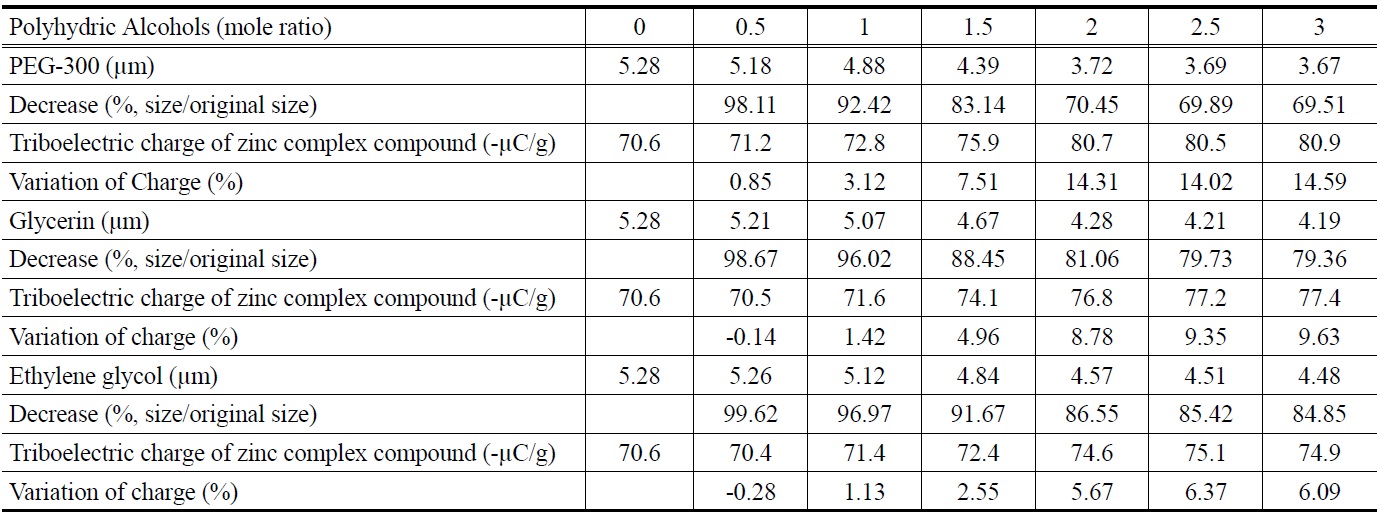
PEG-300과 염화알루미늄을 함께 첨가하여 합성한 아연 착화합물의 평균 입도를 Figure 5에 나타내었다. Figure 5에서 보는 바와 같이, PEG-300의 첨가량이 증가할수록, 아연 착화합물의 평균 입도는 감소하였는데, 그 양상은 Table 3에서 살펴본 바와 같다. 즉, 염화아연에 대한 PEG-300의 몰비가 2까지는 아연 착화합물의 평균 입도가 큰 폭으로 감소하다가 그 이후에는 거의 감소하지 않았으며, 이러한 경향은 알루미늄 착화합물의 모든 함유량(5~30 wt%) 영역에서 동일하게 나타났다. 또한 알루미늄 착화합물의 함유량이 증가할수록 아연착화합물의 평균 입도는 감소하였는데 이러한 경향은 Table 2에서 고찰한 바와 같다. 또한 아연 착화합물의 평균 입도는 다가알코올과 금속염을 함께 첨가하면 더 큰 폭으로 감소하는 것을 알 수 있는데, 이러한 현상은 다가알코올에 의한 반응지연 작용과 다른 금속 착화합물에 의한 입자 성장 억제 작용이
동시에 일어나기 때문으로 해석할 수 있다.
Figure 5의 평균 입도 감소폭이 최대치를 나타낼 때는 염화아연에 대한 PEG-300의 몰비가 3이고, 알루미늄 착화합물의 함유량이 30 wt%일 때인데, 평균 입도는 2.33 μm로 순수한 아연 착화합물(Figure 3(a))의 평균 입도인 5.28 μm의 44.1%의 크기였다. 이 결과로부터 염화알루미늄이 아연 착화합물 입자의 성장을 억제하는 효과가 있다는 것을 알 수 있었다[12]. 그리고 이 크기 즉, 2.33 μm는 흑백토너에 사용되는 순수한 아연 착화합물(Figure 3(a))의 평균 입도인 5.28 μm의 대략 절반 이하의 크기인 44.1%로 칼라토너용 아연 착화합물(대전량제어제)의 바람직한 평균 입도이다. 이로써 분쇄 공정을 거치지 않고, 반응 단계에서 반응속도와 결정 성장을 조정하여 아연 착화합물의 입자 크기를 미세화 할 수 있었다.
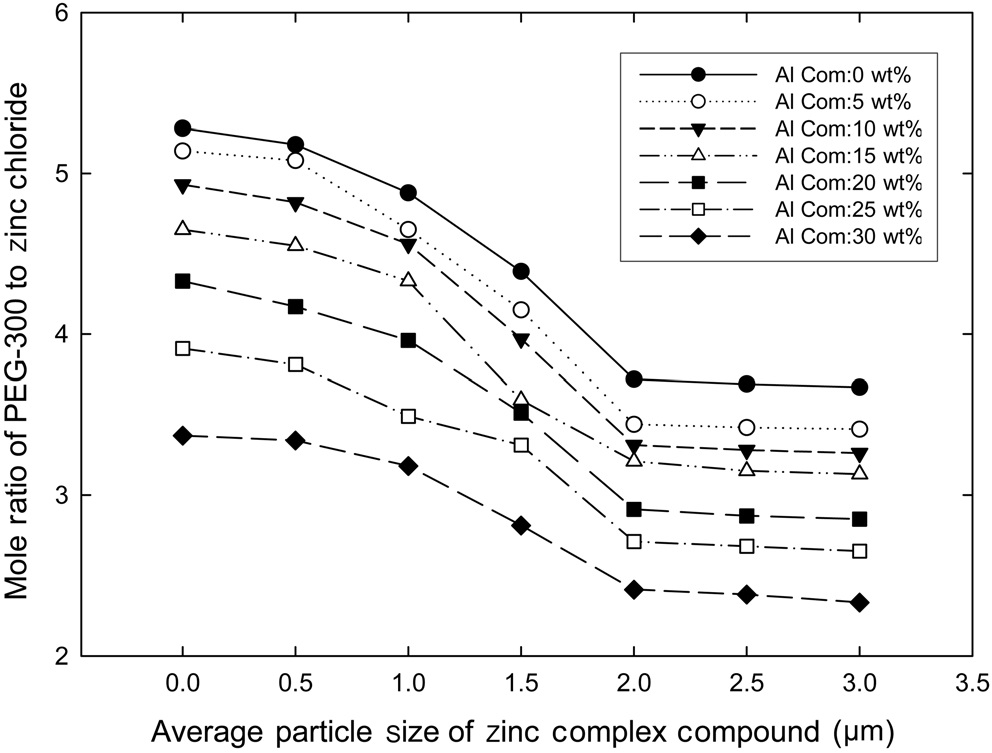
글리세린을 사용하고 염화알루미늄을 첨가하여 합성한 아연 착화합물의 평균 입도를 Figure 6에 나타내었다. 글리세린의 첨가량이 증가함에 따라 그리고 알루미늄 착화합물의 함유량이 증가할수록 아연 착화합물의 평균 입도는 감소하였는데 이러한 경향은 Figure 5에서 살펴본 바와 같았다. 다가알코올로 글리세린을 사용한 Figure 6의 경우가 다가알코올로 PEG-300을 사용한 Figure 5의 경우보다 아연 착화합물의 평균 입도의 감소폭이 작았다. 이는 Table 3에서 고찰한 바와 같이, 글리세린이 PEG-300보다 반응 지연 작용이 약하기 때문인 것으로 파악된다. 평균 입도가 가장 많이 감소한 때는 염화아연에 대한 글리세린의 몰비가 3이고, 알루미늄 착화합물의 함유량이 30 wt%일 때인데, 평균 입도는 2.48 μm로 순수한 아연 착화합물(Figure 3(a))의 평균 입도인 5.28 μm의 47.0%의 크기였다.
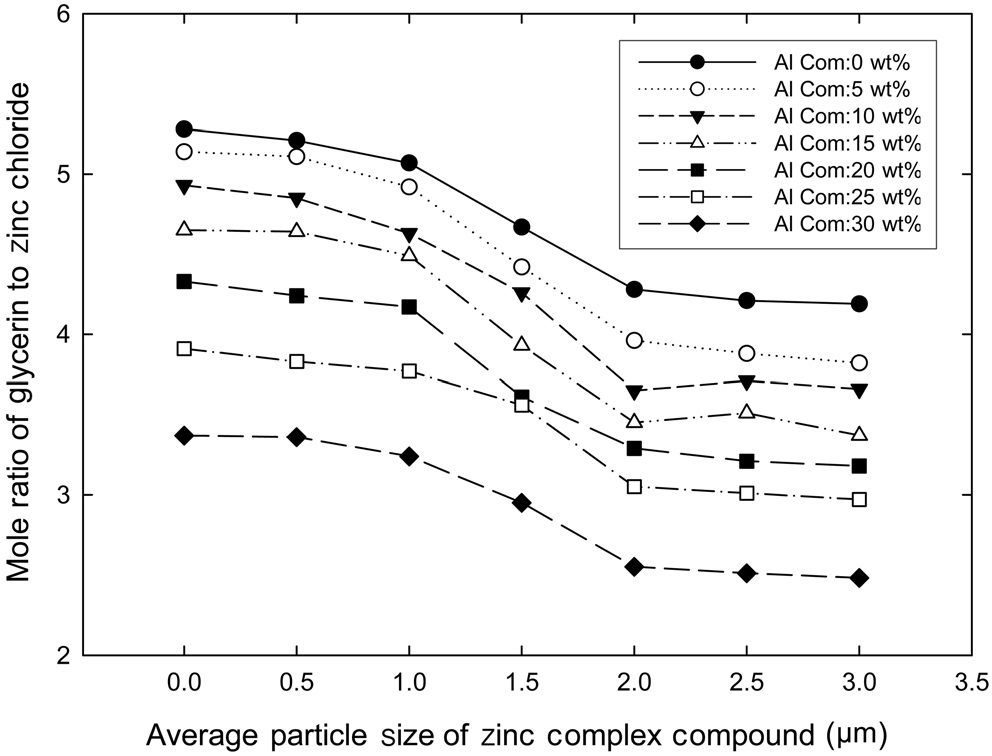
에틸렌클리콜을 사용하고 염화알루미늄을 첨가하여 합성한 아연 착화합물의 평균 입도를 각각 Figure 7에 나타내었다. 에틸렌클리콜의 첨가량이 증가함에 따라 그리고 알루미늄 착화합물의 함유량이 증가할수록 아연 착화합물의 평균 입도는 감소하였는데 이러한 경향은 Figure 5와 6의 경우와 같았다.
다가알코올로 에틸렌클리콜을 사용한 경우(Figure 7)가 PEG-300을 사용한 경우(Figure 5) 또는 글리세린을 사용한 경우 (Figure 6)보다 아연 착화합물의 평균 입도의 감소폭이 작았다. 이는 Table 3에서 고찰한 바와 같이, 에틸렌클리콜의 반응지연 효과가 글리세린이나 PEG-300의 반응 지연 효과보다 작기 때문이다. 평균 입도가 최대로 감소한 때는 염화아연에 대한 에틸렌클리콜의 몰비가 3이고, 알루미늄 착화합물의 함유량이 30 wt%일 때인데, 평균 입도는 각각 2.73 μm로 순수한 아연 착화합물(Figure 3(a))의 평균 입도인 5.28 μm의 51.7%의 크기였다.
앞서 나온 결과를 토대로 알루미늄 착화합물의 함유량이 30 wt%일 때 다가알코올의 종류 및 몰비에 따라 합성된 아연착화합물의 평균 입도 분포값을 통해 아연 착화합물의 평균 입도 감소폭은 에틸렌클리, 글리세린, PEG-300 순으로 커진 것을 알 수 있었다. 또한 PEG-300의 몰비 변화에 따라 합성된 아연 착화합물의 평균 입도 변화가 가장 큰 것을 확인할 수 있었고 그 다음은 글리세린, 에틸렌클리콜 순인 것을 확인하였다. 이는 3.4에서 언급한 것과 같이 다가알코올의 종류와 몰비에
The quantity of triboelectric charge and the average particle size of zinc complex compound which is mixed with metallic salts and polyhydric alcohols (mole ratio of PEG-300 to zinc chloride : 2)
따라 아연이온을 채울 수 있는 배위자리가 서로 다르기 때문에 나타난 결과로 볼 수 있다. 특히, 2개의 OH기(극성기)와 다수의 CH2CH2O(극성기)를 가지고 있는 PEG-300의 경우 다른 다가알코올에 비해 배위자리가 많이 존재하고 다량의 아연이온을 빨리 채울 수 있다. 이로 인해 아연 착화합물의 입자 형성을 더 많이 방해하기 때문에 작은 크기의 입자가 생성되는 것으로 사료된다.
3.6. 아연 착화합물의 대전량에 미치는 금속염과 다가알코올의 동시 첨가의 영향
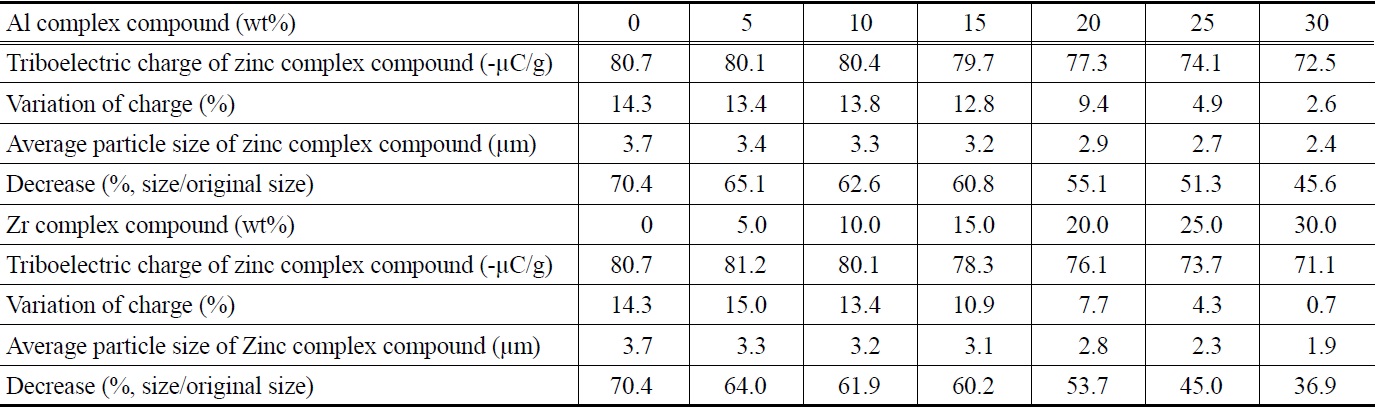
순수한 아연 착화합물의 대전량은 -70.6 μC/g, 순수한 알루미늄 착화합물의 대전량은 -53.7 μC/g, 순수한 지르코늄 착화합물의 대전량은 -41.6 μC/g 등과 같이 아연 착화합물, 알루미늄 착화합물, 지르코늄 착화합물순으로 대전량이 작아지고 있다. 따라서 아연 착화합물에 혼재하는 알루미늄 착화합물, 지르코늄 착화합물 등의 함유량이 증가함에 따라 아연 착화합물의 대전량은 감소하는데, 이는 Table 2에서 확인한 바와 같다. 또한 염화아연에 대한 다가알코올의 몰비가 증가함에 따라 아연 착화합물의 입자 크기는 작아지고 Table 3에서 살펴본 바와 같이 대전량은 증가한다. 염화아연 수용액에 금속염과 다가알코올을 동시에 첨가하여 아연 착화합물을 제조하면 위와 같이 대전량에 미치는 상반된 영향을 받게 된다.
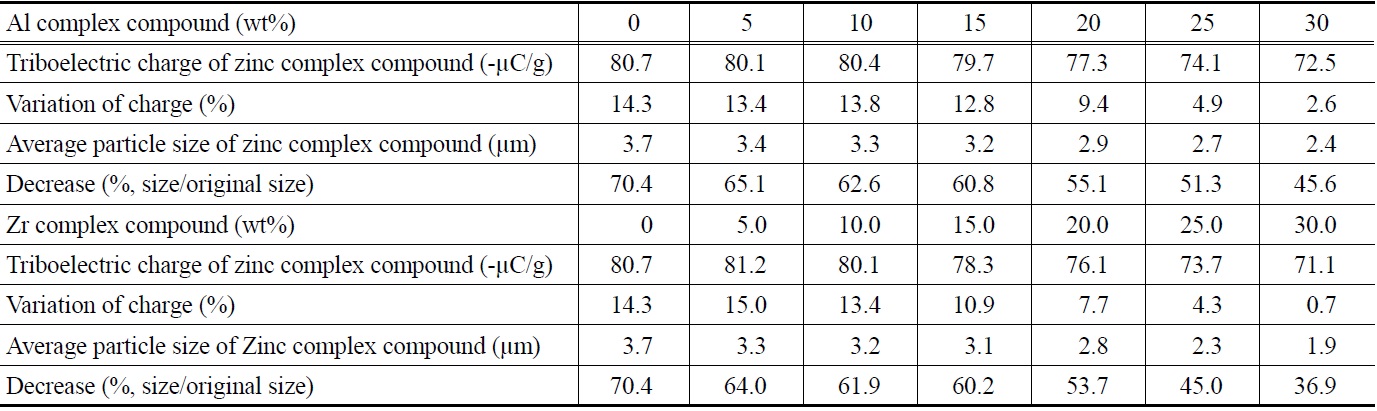
이와 같은 상반된 영향을 고찰하기 위하여 PEG-300과 염화알루미늄을 동시에 첨가하여 합성한 아연 착화합물의 대전량을 측정하였다. 염화아연에 대한 PEG-300의 몰비가 2 이상에서는 아연 착화합물의 평균 입도의 감소폭이 극히 적기 때문에 상용 생산에서는 염화아연에 대한 PEG-300의 몰비를 2로 하는 것이 타당하다. 따라서 염화아연에 대한 PEG-300의 몰비가 2일 때, 알루미늄 착화합물의 함유량이 5~30 wt%인 아연착화합물의 대전량을 온도 20~22 ℃, 상대습도 36~38%인 조건에서 9회 반복 측정하고 최빈값 구간의 데이타 4~7개를 평균하여 Table 4에 나타내었다. 또한 이전의 연구[11]에서 합성한 지르코늄 착화합물의 함유량이 5~30 wt%인 아연 착화합물의 대전량도 함께 나타내었다.
Table 4에서 볼 수 있는 바와 같이, 염화아연에 대하여 PEG-300을 몰비로 2만큼 첨가하고 금속염을 첨가하지 않은 아연착화합물의 대전량은 -80.7 μC/g인데, 알루미늄 착화합물 및 지르코늄 착화합물의 함유량이 증가함에 따라 아연 착화합물의 대전량은 감소하였다. 이는 대전량이 각각 -53.7 μC/g, -41.6 μC/g으로 아연 착화합물의 대전량 -80.7 μC/g보다 낮은 알루미늄 착화합물과 지르코늄 착화합물이 아연 착화합물에 혼재되어있기 때문으로 해석되는데, 이러한 경향은 Table 2에서 살펴본 바와 같다.
Table 4에서 아연 착화합물의 평균 입도가 순수한 아연 착화합물의 평균 입도인 5.28 μm의 절반 정도 내지 그 이하인 경우를 보면, 알루미늄 착화합물 및 지르코늄 착화합물의 함유량이 25~30 wt%인 경우인데, 이때의 대전량은 순수한 아연 착화합물의 대전량인 -70.6 μC/g과 유사하거나 5% 이내의 범위에서 약간 높았다. 따라서 염화아연에 대한 PEG-300의 몰비를 2로 하고 알루미늄 착화합물의 함유량을 25~30 wt%로 하여 아연 착화합물을 제조하면 순수한 아연 착화합물의 대전량 수준을 유지하면서 순수한 아연 착화합물의 평균 입도의 대략 절반 내지 그 이하가 되는 아연 착화합물을 제조할 수 있다. 또한 염화아연에 대한 PEG-300의 몰비를 2로 하고 지르코늄 착화합물의 함유량을 25~30 wt%로 하여 아연 착화합물을 제조하면 순수한 아연 착화합물의 대전량 수준을 유지하면서 원래의 아연 착화합물의 평균 입도의 45% 정도 또는 40% 이하가 되는 아연 착화합물을 제조할 수 있음을 알았다.
본 연구에서는 금속염인 염화알루미늄와 다가알코올인PEG-300, 글리세린 및 에틸렌글리콜 등을 단독 또는 동시에 첨가하여 합성한 아연 착화합물의 입자 형태와 평균 입도 변화에 대하여 고찰하였다. 알루미늄 착화합물의 함유량이 30 wt%일 때 아연 착화합물의 평균 입도는 3.37 μm로 감소하였다. 또한 염화알루미늄과 다가알코올을 동시에 첨가하면 각각 단독으로 첨가했을 때보다 아연 착화합물의 평균 입도가 더 많이 감소하였으며, 특히 알루미늄 착화합물의 함유량이 30 wt%이고 염화아연에 대한 PEG-300의 몰비가 3인 경우 아연 착화합물의 평균입도는 2.33 μm로 순수한 아연 착화합물의 평균 입도인 5.28 μm의 44.1%의 크기로 평균 입도가 가장 많이 감소한 것을 알 수 있었다.
본 연구를 통해 염화알루미늄을 첨가하고 PEG-300, 글리세린, 에틸렌글리콜 등의 다가알코올을 첨가하여 아연 착화합물의 아연 착화합물을 합성함으로써 분쇄 공정을 거치지 않고, 반응 단계에서 반응속도와 입자 성장을 조절하여 미세하면서도 대전 특성이 유지되는 바람직한 대전량 제어제를 합성할 수 있었다.