알츠하이머병(Alzheimer’s disease, AD)은 초로기 또는 노년기에 발생하는 원인 불명의 진행성 치매를 초래하는 질환으로, 노령사회 진입의 특성인 65세 이상 고령인구 증가에 따라 환자의 비율이 높아질 것으로 예측되는 질환이다1).
환자의 뇌는 특히 대뇌피질의 뇌신경세포의 소실로 인해 광범위한 뇌회의 위축이 나타나며 결과적으로 뇌실이 상대적으로 커지게 된다. 조직학적 소견으로 신경반(neuritic plaque)과 신경원섬유농축(neurofibrillary tangle, NFT)이 나타난다2).
한의학적으로 치매는 ?病, 健忘, 癲狂의 범주에 포함된다3). ?病에 관해 明代 張4)은 病因을 情緖상의 문제로 보았고 病理는 逆氣가 心에 있는 것과 肝膽二經의 氣不淸으로 보았으며 胃氣와 元氣의 强弱으로 可治와 不治로 나누었다. 淸代 陳5)은 ?病의 원인을 情緖의 불균형으로 보았고 治痰을 중요하게 보았다. 錢6)은 肝氣鬱滯와 胃氣衰退가 원인이 된 胸中之痰의 積滯를 언급하고 治法으로 開氣鬱結 逐其痰 健其胃을 제시하였다. 淸代 王7)은 老年虛衰로 인해 腦髓가 空虛하게 되면 ?病에 걸릴 수 있음을 설명하였다. 통괄적으로 치매의 병기는 虛實이 挾雜된 것이 많은데 本虛表實로 나눌 수 있고 虛한 것은 肝腎不足, 氣血虧虛로 實한 것은 痰濁阻竅, 氣滯血瘀로 나눌 수 있다3).
蓮根은 本草名으로 藕節로, 연꽃(蓮)
동결건조한 연근 추출물(LRE)의 무게를 재고 100 mg을 1 ml의 증류수에 넣고 녹인 후 0.2 um filter로 불순물을 제거한 후 세포 실험에 사용하였다. A
실험에 사용한 neuroblastoma cell line, SH-SY5Y 세포는 American Type Culture Collection (Rockville, MD, USA)에서 구입을 하였다. 세포는 37℃, 5% CO2 incubator에서 10% Fetal Bovine Serum (FBS; Invitrogen, USA)이 함유된 DMEM (Invitrogen, USA) 배지를 사용하여 배양하였다. 오염 방지를 위해 항생제로 100 unit/ml penicillin, 100
MTT (tetrazolium3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, Sigma) assay는 Sladowski의 방법15)을 따라 행하였다. MTT assay는 탈수소 효소작용에 의하여 노란색의 수용성 기질인 MTT tetrazolium을 청자색을 띄는 비수용성의 MTT formazan으로 환원시키는 세포의 능력을 이용하는 검사법이다. MTT formazan의 흡광도는 580 nm의 파장에서 최대가 되며, 이 파장에서 측정된 흡광도는 살아있고 대사가 왕성한 세포의 산화환원력을 반영한다.
MTT assay는 우선 12 well plate에 SH-SY5Y 세포 (1×105/well)를 12시간 배양한 후 FBS가 없는 배지로 교환하여 16시간동안 안정화시키고, 여러 농도로 약물을 첨가하여 24시간 동안 배양하였다.
그리고 MTT 2 mg/ml를 넣고, incubator에서 4시간 배양한 후 dimethylsulfoxide (DMSO; Sigma)로 용해시켜 570 nm의 파장에서 microplate reader (Molecular devices, USA)로 흡광도를 측정하여 세포 생존률을 계산하였다.
세포생존율(Cell Viability, %)은 다음과 같이 정의를 하였다. 정상군의 값을 control로 하고 이때의 O.D. 값을 세포의 생존도가 100%라고 정의하고, 나머지 군의 측정한 O.D. 값을 상대치로 환산을 하면 다음과 같다.
Cell Viability=(실험치/control 군)
모든 세포 용해질들은 표본 완충제(62.5 mmol/1 Tris-HCl, pH 6.8, 2% SDS, 20% glycerol, 10% 2-mercaptoethanol) 내에 boiling cell에 의해 만들어졌다. 단백질 정량은 bicinchoninic acid (BCA, Pierce)법을 사용하였다. 정량된 단백질 시료 50
세포내에서 Superoxide dismutase (SOD)의 활성도 측정은 SOD assay kit (Cell Biolabs, Inc. USA)를 사용하였으며 작용원리는 xanthine/xanthine oxidase를 사용하여 superoxide anion을 생성하고 생성된 superoxide anion은 chromogen에 의해 수용성의 formazan dye를 생성하게 되는데 이 때 세포내에 존재하는 SOD의 양에 따라 생성되는 formazan dye가 줄어들게 된다. 최종적으로 생성된 formazan dye는 spectrophotometer (Molecular Device, USA)를 사용하여 490 nm 파장에서 측정하였다.
세포내에서 Catalase의 활성도 측정은 Catalase activity assay kit (Cell Biolabs, Inc. USA)를 사용하였다. 본 실험법의 작용기전은, 일차적으로 세포내 존재하는 catalse에 의해 외부에서 넣어준 H2O2가 물과 산소로 해리되고 남은 H2O2가 Horse radish peroxidase (HRP)에 의해 3,5-dichloro-2-hydroxy-benzenesulfonic acid (DHBS), 4-aminoantipyrene (AAP)과 반응하여 Quinoneimine dye를 생성하게 된다. 최종적으로 생성된 Quinoneimine dye는 spectrophotometer (Molecular Device, USA)를 사용하여 520 nm 파장에서 측정하였다.
모든 측정값은 평균값 표준편차(mean±S.D.)로 표시하였고, 각 실험군 간의 통계학적 분석은 window용 SPSS Program의 student t-test로 검정하여 p값이 0.05 이하인 경우 유의한 것으로 인정하였다.
SH-SY5Y cell에 A
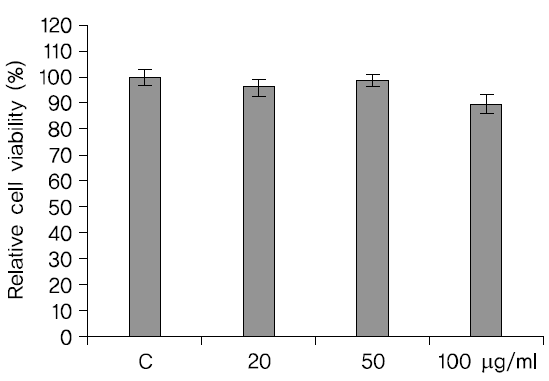
SH-SY5Y cell에 각각 20, 50
SH-SY5Y cell에 蓮根 추출물을 각각 20, 50
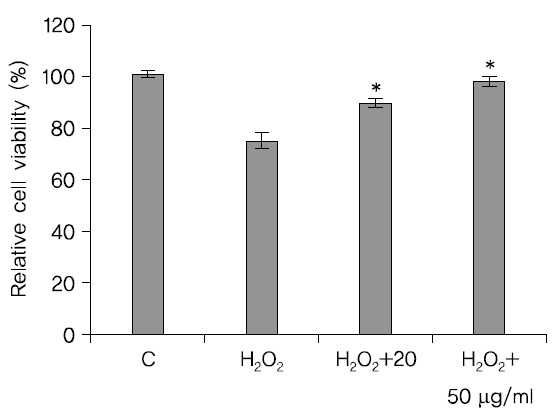
처리하고 24시간이 지난 후에 MTT 방법으로 세포생존율을 관찰한 결과 H2O2만을 처리한 SH-SY5Y cell의 세포 생존율보다 蓮根추출물을 처리한 세포의 생존율이 높았고 농도는 20
세포생존율이 높았다. 실험그룹들의 부적 통제집단과의 차이는 통계적으로 유의미 하였다(Fig. 3).
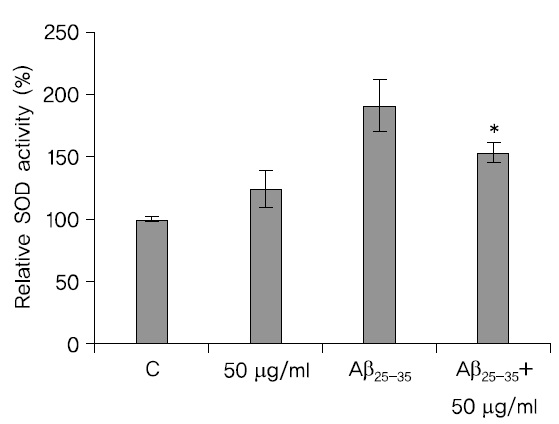
SH-SY5Y cell에 50
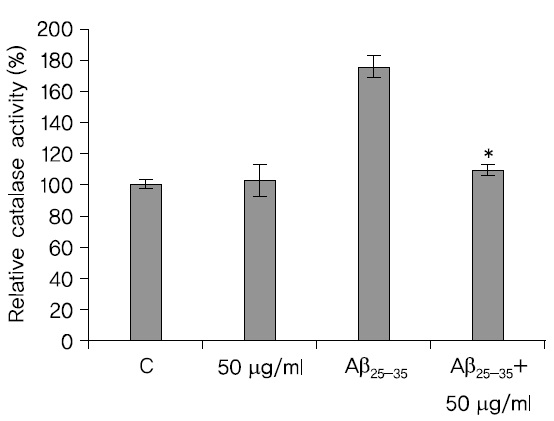
카탈라제 활성은 A
SH-SY5Y cell에 50
SH-SY5Y cell에 50
SH-SY5Y cell에을 50
후 20
AD는 초로기 또는 노년기에 발생하는 원인 불명의 진행성 치매를 초래하는 질환으로서 65세 이상의 인구 중 약 8%가 발병하는 것으로 알려져 있다. 평균수명 연장 및 출산율감소의 특성으로 대변되는 고령사회의 도래로, 65세 이상의 인구 비율은 현재 점점 증가하는 추세이며 가까운 미래에는 환자의 수가 폭증할 것으로 예측된다. 2000년에는 7.2%였던 비율이 2019년 14.4%로 2026년에는 20%로 증가하여 초고령 사회로 진입하게 될 것으로 관측하는데, 이와 같은 노인 인구의 증가로 AD환자 또한 증가할 것으로 예측할 수 있다1,3).
임상 증상으로는 진행성 치매를 들수 있으며, 초기부터 뚜렷한 기명장애, 기억장애, 방향상실을 보이고, 실독, 실인, 실행, 공간 지남력 상실 등이 나타나게 된다. 환자는 서서히 기억력이 감퇴하고 언어구사 및 다른 사람들과의 대화가 힘들어지며 점차 간단한 일상 업무 수행이 어려워진다. 그리고 시간, 장소에 대한 개념이 흐려지는데 특히 공간의 분별력이 나빠지고 자신이 잘 알고 있던 장소조차 기억하지 못하게 된다. 학습을 통한 새로운 지식을 습득이 어렵고 어떤 일을 미루어 생각하거나 판단하는 능력이 떨어짐은 물론 간단한 계산조차 못하게 된다. 병이 더 진행되면 성격변화를 동반한 행동심리 증상이 나타나며 결국에는 아주 단순한 일상생활능력마저 유지하기 힘들고 자기 자신을 돌보지 못하게 되어 대소변도 가리지 못하게 될 수 있다2,3).
환자의 뇌를 살펴보면, 신경반과 신경원섬유농축이 특정적으로 나타나게 되는데, 신경반은 독성단백질인 A
AD의 발병원인으로는 아밀로이드 증폭가설(amyloid cascade hypothesis), 타우농축체가설(tautangle hypothesis)이 두 축을 이루고 있고 그 외 콜린성 가설, 신경염증가설(neuroinflammation hypothesis), 그리고 혈관성 치매가 동반하는 복합성 치매를 의미하는 혈관가설 등이 발병원인을 설명하고 있다2).
AD의 원인은 독성단백질인 A
A
뇌의 95% 이상은 지방으로 구성되어 있어 이런 ROS의 공격을 받으면 산화되는데, 이러한 손상으로 유발된 순차적 신호전달에 의해 세포사멸이 일어난다18). 이와 같은 ROS에 의한 손상으로부터 세포를 보호하는 효소계 항산화제로는 superoxide dismutases (SOD), Catalase, peroxidase, glutathione 등이 있다22).
SOD는 생명체가 산소를 소비하는 호흡과정에서 발생하는 초과산화음이온(Superoxide anion)을 산소 (O2)와 과산화수소(H2O2)로 불균등화하는 반응을 촉매함으로써 세포를 보호하며23) 이렇게 하여 생성된 과산화수소는 Catalase나 glutathion peroxidase에 의해 제거될 수 있다24).
타우농축체가설(tautangle hypothesis)은 신경세포에 존재하여 미세소관과 결합하는 단백질인 Tau이 과인산화되어 신경세포의 기능을 잃어버리고 세포내에 신경원섬유농축(neurofibubriliary tangle; NFT)이라는 타우단백의 응집체를 만들어 세포사(cell death)를 유도한다는 설이다2). Tau의 주요 기능은 단백질 내 여러 serine 또는 threonine 위치의 인산화와 탈인산화의 균형 조절을 통하여 미세소관의 안정성을 조절하는 것인데 과인산화되면 정상 미세소관의 구조가 파괴되고 축삭 수송(axonal transfort)이 이루어지지 못하게 된다는 것으로 점차적으로 신경세포기능 장애가 일어나고 나아가 사멸을 유발한다2,25). 현재 비정상 타우단백의 생성을 억제하는 GSK-3
신경염증가설은 미세아교세포, 성상세포들의 활성화에 따른 염증반응에 의해 신경세포사멸이 이루어진다는 설이고 혈관가설은 혈관성 위험요소들에 의해 신경세포 퇴행이 유발된다는 설이다2).
NF
JNK는 MAPKs (Mitogen-activated protein kinase)의 하나로, MAPKs는 세포증식, 분화, apoptosis와 같은 다양한 세포반응들의 조절에 관여하는 serine/threonin kinase이다29). JNK는 화학적, 또는 환경적 스트레스에 대한 반응에 의해 활성화되고, 종종 apoptosis의 유도에 관련되어 있다.
한의학에서는 치매를 ?病 健忘 癲狂을 근거로 변증시치를 한다. 明代 張4)은 <景岳全書·雜證謨>의 癲狂痴?에서 痴?를 최초로 언급하였다. 病因으로 “痴?證 凡平素無痰而或以鬱結 或以不遂或以思慮或以疑貳 或以驚恐而漸致痴?”라 하여 情緖상의 문제로 보았고 病理로 “脈必或弦或數 或大或小 變易不常此其逆氣在心 或肝膽二經 氣有不淸而然”이라 하여 逆氣가 心에 있거나 肝膽二經의 氣不淸을 원인으로 보았다. 증상은 “言辭顚倒 擧動不經 惑多汗惑善愁 其證則天奇萬怪 無所不至”로 인격의 변화와 행동 이상에 대하여 언급은 하였으나 기억장애에 대한 구체적 언급은 없다. 치료는 胃氣와 元氣의 强弱으로 可治와 不治로 나눌 수 있으며 大驚으로 인한 경우 신속히 元氣를 회복하여야 한다고 하였다.
淸代 陳5)은 <石室秘錄>에서 “胸腹之中 無非痰氣故癡?無奇法 治痰則癡?也”라 하여 胸中의 痰과 “內鬱抑不舒 憤怒而成者有之”라 하여 情緖의 불균형을 ?病의 원인으로 보았고 증상은 “?病如癡 而??不言也 如饑而悠悠如失也 意慾癲而不能心慾狂而不敢 有時睡數日不醒 有時坐數日不眠 有時將己身衣服密密縫補 有時將他人物件深深藏藏掩 與人言則煎語而神遊 背人言則低聲而泣訴 與之食則厭薄而不呑不與食則呑炭而若快”라 하여 치매와 유사한 증상을 언급하였다. 치료로서 “無非痰氣 故治?奇法 治痰卽治?也”라 하여 治痰의 중요성을 강조하였다.
<辨證奇聞>6)에서 “人有終日不言不語 不飮不食 忽笑忽歌 忽愁忽哭 與之所饌則不受 與之糞穢則大喜 與之依不服 與之草木之葉則又大喜 人以爲此?病不必治也”라 하여 병전과 다른 성격과 인격의 변화에 대해서 서술하였고 “終日 閉戶獨居 口中?? 多不可解將自己衣服 鍼線蜜蜂 與之飮食 時而用 時而不用 嘗有數日 고腹 而不呼飢餓者 見炭最善 食之如爽口之物人皆棄之” 외부환경과의 소외, 언어곤란, 식사상태변화 등에 관해 언급하였다. 병리로는 肝氣鬱滯와 胃氣衰退가 원인이 된 胸中의 痰이 積滯되는 것을 언급하고 치법으로 開氣鬱結 逐其痰 健其胃을 제시하였다. 淸代 王7)은 <醫林改錯>에서 “靈機記性不在心在腦”라 하여 精神思惟活動이 腦에 의해 이루어짐을 인식하였고, “小兒無記性者 腦髓未滿 高年無記性者 腦髓漸空”이라 하여 老年虛衰로 인해 腦髓가 空虛하게 되면 ?病에 걸릴 수 있음을 설명하였다.
蓮根은 藕 또는 藕根 光藕節 藕節?라고도 한다. 性味는 甘? 平하고 歸經은 心胃肝經이며 止血, 瘀血을 제거하는 효능이 있어서 ?血, 吐血, 喀血, 尿血, 便血, 血痢, 血崩 등 각종의 出血 증후에 사용할 수 있으나 藥力이 완화하므로 佐藥으로서 사용하는 경우가 많은 약재이다8-11).
최근까지의 蓮根에 관한 연구를 살펴보면 蓮根은 藥食同原이라는 말처럼 약재뿐만 아니라 만두피, 청포묵, 떡 같은 식품으로도 연구가 많이 되어 왔다30-32). 歸經이 腎으로 언급되어 있지는 않지만 급성신부전33)과 만성신부전34), 신독성35)에서 효과가 보고되었고 콜레스테롤혈증36)의 효과 및 항당뇨활성성분37)에 대해서도 보고되었다. 蓮根은 뇌와 뇌혈류에 관한 연구도 꾸준히 있어 왔는데 스트레스 실험12)에서는 혈청내 ALT감량으로 간보호에 대한 효과뿐만 아니라 뇌조직내 noradrenalin 증가와 혈청 corticosterone 감소도 보고되었고, 뇌혈류역학에 미치는 효과24), 국소뇌혈류량에 조절효과25)가 있다는 보고도 있었다.
AD의 한의학적 병리기전이 本虛表實로서, 노쇠로 인한 肝腎기능 저하를 바탕으로 痰飮이나 瘀血이 저체되어 뇌의 퇴행적인 변화가 온 것이다. 따라서 기존에 연구된 蓮根의 신경보호효과와 타우와 A
산화적 스트레스에 대한 蓮根 추출물의 세포보호효과를 관찰한 결과 H2O2로 독성을 유발시킨 대조군의 세포 생존율이 75.4%에 비해 50
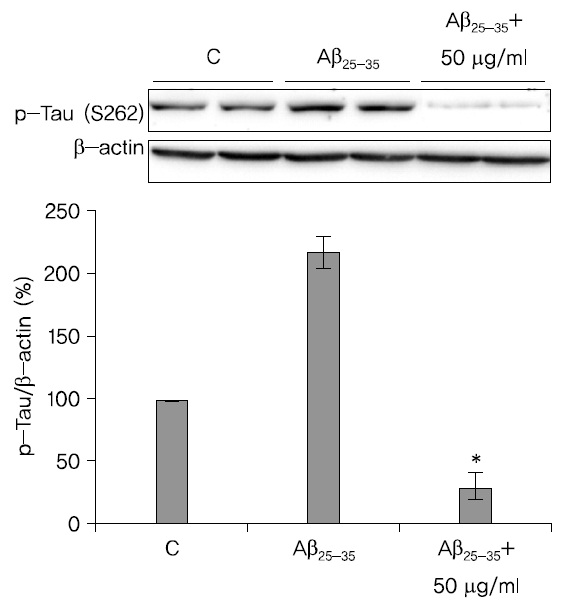
蓮根추출물이 Tau의 인산화에 미치는 영향을 관찰한 결과 蓮根추출물은 Tau의 인산화를 저해시킴을 확인하였다. A
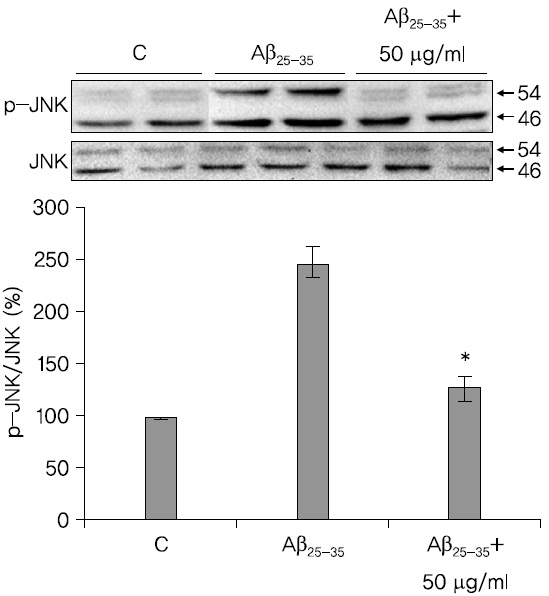
蓮根추출물이 JNK의 인산화에 미치는 영향을 관찰한 결과 蓮根추출물은 JNK의 인산화를 저해시킴을 확인하였다. 이것은 세포사멸시 발생하는 산화적 스트레스를 억제시키고, 그 이후의 신호전달 체계인 JNK의 활성을 저해함으로써 세포사멸을 억제시킴을 시사하는 것이다.
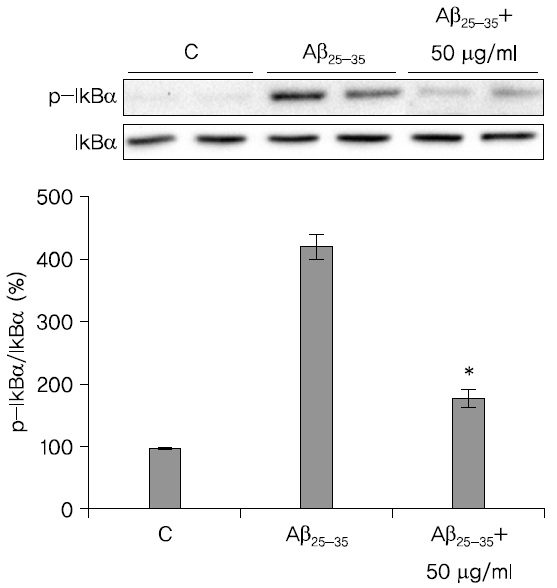
蓮根 추출물이 IkB
이상의 결과는 蓮根추출물이 신경세포보호효과, 항산화효과, 항인산화효과를 나타낸다. 이는 A
AD를 유발하는 A
1. H2O2로 세포독성을 일으킨 SH-SY5Y cell에서 산화적 스트레스로 유발되는 세포사멸을 억제함을 나타냈고, 50
2. A
3. A
4. A
5. A
6. A
7. 신경세포 사멸 억제 기전은 A