溫膽湯은 ≪備急千金要方≫에서 “治大病後 虛煩 不得眠, 此膽寒故也, 宜服溫膽湯方”1)이라 기록된 이후 후대의가들에 의해 心膽虛怯, 觸事易驚, 夢寐不祥, 虛煩不得睡 등의 膽이 虛寒하여 나타나는 증상에 사용되어 왔다2). 本方은 정신적 스트레스가 자율신경에 실조를 초래하고 위장기능장애로 인한 痰飮을 생성시켜 나타나는 神經性 症狀에 쓰는 代表 處方이다3).
우울증은 여성의 경우 10∼25%, 남성의 경우 5∼12%가 발병한다. 비정상적인 슬픔, 절망, 자신을 우울하게 만드는 미래에 대한 어두운 생각과 더불어 섭식장애와 수면장애(불면증, 수면과다), 집중력 저하, 부적절한 죄책감과 성적 욕구의 감소가 나타난다4). 또한 우울감은 일상에서 겪는 많은 스트레스에 대한 가장 보편적인 반응 중의 하나로 여겨지고5-7)있다. 한편 스트레스는 부신 피질에서 스트레스 호르몬인 glucocorticoid가 방출시키고, 지속적인 스트레스 호르몬의 방출로 인한 활성산소종(reactive oxygen species, ROS)의 과도한 생성은, 우울증, 알츠하이머 병과 같은 뇌질환에 영향을 미친다8).
Serotonin (5-HT)은 주요 monoamine 신경전달물질 중의 하나로 melatonin의 전구체이며 혈소판에서 유리되고, 장관점막, 송과체, 중추신경계를 포함한 많은 체내조직내에 고농도로 존재하며, 위액분비의 억 제작용, 평활근 수축작용을 가지고 있다9,10). Serotonin은 우울증, 불안증, 정신분열병, 강박장애, 공황장애 등의 정신질환의 병태생리에 관련이 있는 것으로 알려져 있으며11), 우울증의 모노아민 가설은 우울증의 원인과 병태생리를 뇌의 세로토닌의 감소와 기능의 저하로 설명하고 있다12).
세로토닌은 tryptophan에서 5-hydroxytryptophan 을 경유하여 생합성 되며, 각 단계에서는 tryptophan hydroxylase (TPH), aromatic L-amino acid decarboxylase (AADC)가 촉매하고 있으며, TPH가 serotonin 생합성 과정의 rate-limiting 효소이다13).
溫膽湯과 관련된 실험연구로는 실험적 연구들로 심혈관 질환14,15), 수면장애16-18) 및 항산화19,20)에 관한 연구가 있었으나, 溫膽湯 계열 처방의 우울증의 모노아민 가설과 관련된 연구는 아직 접하지 못하였다.
이에 저자는 和胃, 消積, 淸熱, 安神의 효능이 있는 溫膽湯에 胸腹의 氣滯를 疏暢시키는 烏藥3)을 가미한 溫膽湯加味方이 우울증의 중요한 신경전달물질인 serotonin의 대사과정에 어떠한 영향을 미치는지 알아보고자 P815 세포내의 serotonine 함량 및 5-HTT, TPH-1, mRNA의 활성 변화 및 항산화 효능을 측정한 바 약간의 지견을 얻었기에 보고하는 바이다.
1) 약재
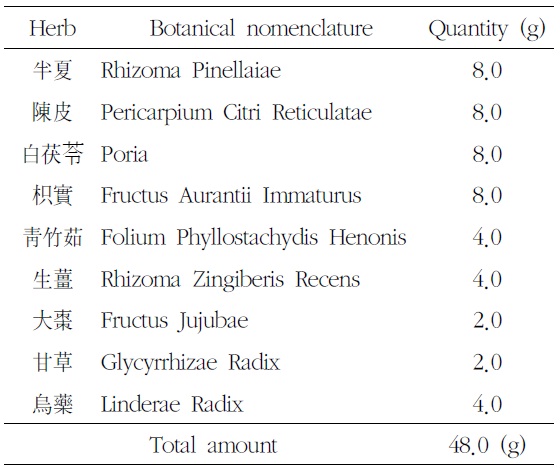
본 실험에 사용한 溫膽湯加味方 (OnDam-tang-Kami-bang, ODK)은 ≪東醫寶鑑·夢≫2)의 溫膽湯에 烏藥을 4.0g 가미한 것으로, 대전대학교 부속한방병원에서 구입한 후 정선하여 사용하였다. 처방 1첩의 내용과 용량은 다음과 같다(Table 1).
[Table 1.] Prescription of OnDam-tang-Kami-bang (ODK)
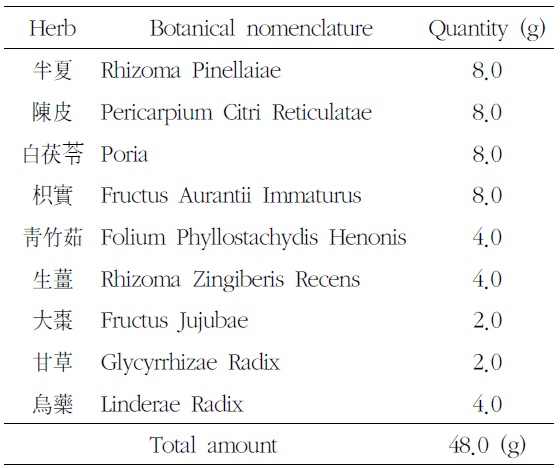
Prescription of OnDam-tang-Kami-bang (ODK)
Cell culture는 FBS (Gibco-BRL, USA), DMEM (Gibco-BRL, USA), 10 mm HEPES, 2 mm L-glutamine, 1 mm sodium pyruvate, 100 U/ml penicillin, 100
3) 기기
열탕추출기(대웅, Korea), Rotary vaccum evaporator (Buchi B-480, Switzerland), Freeze dryer (EYELA FDU540, Japan), CO2 incubator (Forma scientific Co., USA), Clean bench (Vision scientific Co., Korea), Autoclave (Sanyo, Japan), Micro-pipet (Gilson, France), Water bath (Vision scientific Co., Korea), Vortex mixer (Vision scientific Co., Korea), Spectrophotometer (Shimazue, Japan), Centrifuge (Sigma, USA), Deep freezer (Sanyo, Japan), Thermocycler system (MWG Biotech., Germany), Ice maker (Vision scientific Co., Korea), Homogenizer (OMNI, USA), Plate shaker (LabLine, USA) 및 ELISA reader (Molecular Devices, USA), C18역상 HPLC columne (Hypersil, USA), HPLC (Shimazu, Japan)의 기기를 사용하였다.
1) 검액의 조제
溫膽湯加味方 144 g에 증류수 1,000ml에 넣고 2 시간 동안 가열한 후 여과하여 얻은 액체성분을 rotary vacuum evaporator에서 감압 농축하여 약리성분을 추출하였다. 농축된 용액을 freeze dryer로 동결 건조하여 5.55 g의 분말을 얻었다. 얻어진 분말은 냉동고(?20℃)에 보관하면서 사용 시에는 필요한 농도로 phosphate buffer에 희석하여 0.22
2) P815 세포의 배양
P815 세포는 동아대학교 의과대학에서 분양 받았으며, 배양은 10% fetal calf serum, 100 unit/ml penicillin과 100
P815 세포(2×105 cells/cm2, 60 mm culture dish)를 배양한 다음, 이 세포에 溫膽湯加味方 처방을 50
3) Ez-cytox를 이용한 세포 생존 측정
배양한 세포를 phosphate buffered saline (PBS)으로 3회 세척한 다음 96multi well에 2×104 cells/well 의 세포수가 되도록 산정하여 사용하였다. 세포는 FBS가 들어있는 DMEM 배양액에서 50
이후 세포 생존을 Ez-cytox 분석법에 의해서 분석 하였다. Ez-cytox 분석법은 배양이 완료된 세포에 50
4) DPPH free radical scavenging 활성 측정
시료의 free radical 소거 활성은 stable radical인 DPPH에 대한 환원력을 측정한 것으로, 농축한 시료를 각각 ethanol로 희석하여 IC50 값을 나타낼 수 있는 농도가 포함되도록 농도별로 제조하였다. 여기에 2,2'-diphenyl-2-picrylhydrazyl을 methanol에 녹여 0.1 mM DPPH 용액을 제조하였다. 이 DPPH 용액 2 ml를 준비한 시료 1 ml와 섞은 뒤 30분간 상온의 암소에서 보관하였다. 517 nm에서 분광광도계를 사 용하여 흡광도를 측정하였다. 다음의 식을 이용하여 각 시료의 농도 별 free radical scavenging activity 곡선을 그린 뒤, 50%의 DPPH free radical scavenging activity (DPPH IC50)를 나타내는 값을 구하였다.
Free radical scavenging activity (%)=[1-(시료 첨 가구의 흡광도/시료 무첨가구의 흡광도)]×100
5) SOD 활성 측정 실험
96-well plate의 각 well에 sample solution 20
6) Serotonin 함량 측정
Serotonin 함량은 HPLC형광광도계법으로 측정하였다. 세포 내부의 serotonin 농도를 분석하기 위하여, 약물을 처리한 세포의 배지를 제거한 후, 1×PBS pH 7.2의 완충액을 이용하여 세포를 2번 세척하였다. 1×PBS 200
각각의 시료중의 단백질 함량을 측정하여 보정하였으며, 단백질 함량은 bovine serum albumin을 표준물질로 하고 Bradford's method21)를 이용하여 측정하였다.
HPLC Condition: column, TSK-gel ODS 120T (5
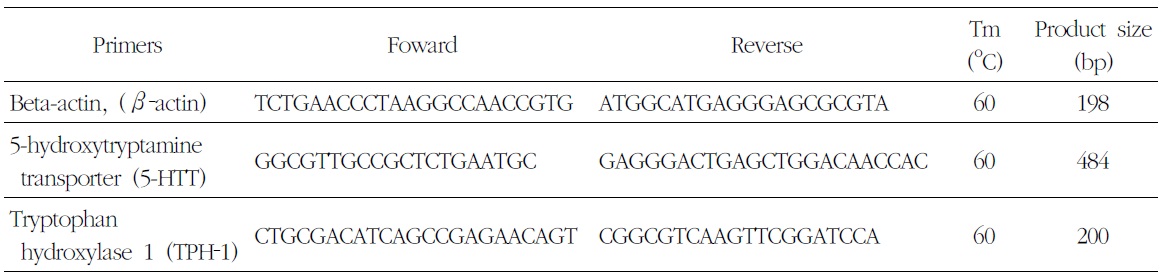
7) Real-time PCR을 이용한 mRNA 측정
P815세포 pellet에 RNAzolB을 첨가하여 세포를 용해시킨 후 chloroform 200
[Table 2.] Sequences of Primer Set Used Quantative Real-Time PCR
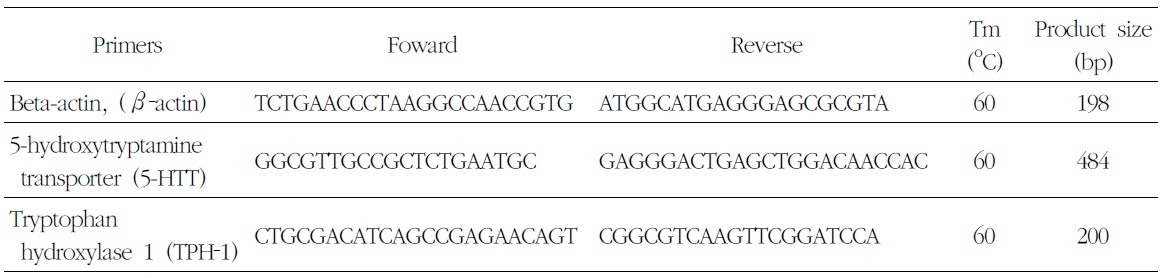
Sequences of Primer Set Used Quantative Real-Time PCR
분 동안 반응시킨 후 실온에서 3분 동안 방치한 다음 10×buffer, 10 mM dNTP, AMV reverse transcriptase, 50 mM MgCl2 및 DEPC treated water를 넣고 37℃에 서 1시간 동안 반응시켜서 reverse transcriptase (RT) product를 만든다. 만들어진 RT product (template cDNA)를 사용하여 real-time PCR (Bio Rad)를 사용 하여 측정한다.
각 유전자 발현 정도를 real-time PCR을 이용해 측정하였다. 각 sample의 추출된 RNA에 2X SYBR green master mix (BioRad) 25
8) 통계 처리
실험결과는 mean±standard error로 기록하였다. 유의성 검증은 Student's t-test를 이용하여 분석하였으며 p<0.05에서 유의한 것으로 판정하였다.
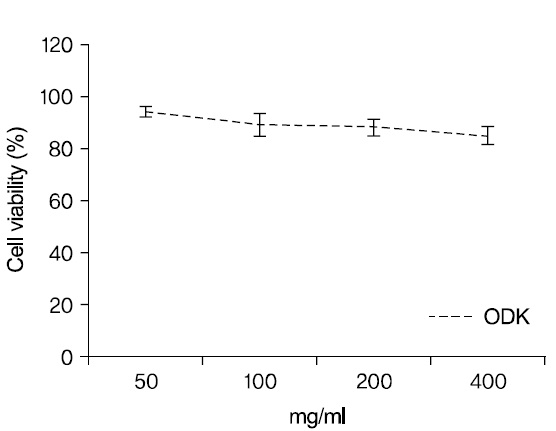
P815 세포주에 溫膽湯加味方을 50
94.3±2.24 (%), 100
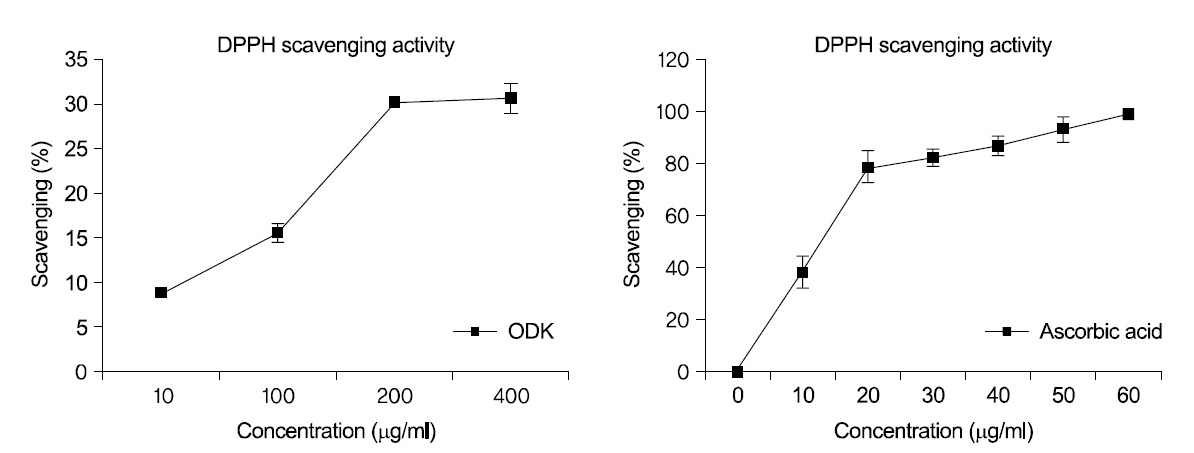
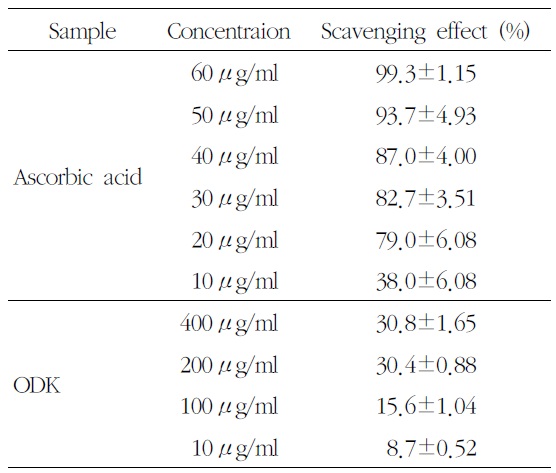
DPPH를 이용한 free radical 소거 반응으로 溫膽 湯加味方의 항산화 작용을 측정한 결과, 400
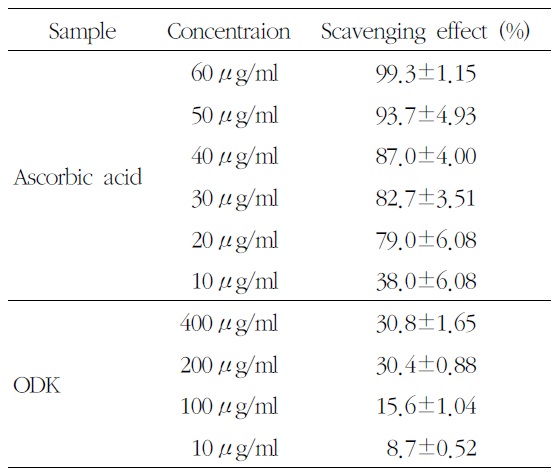
Effect of OnDam-tang-Kami-bang (ODK) on DPPH Radical나 차츰 정신적인 증상의 개념으로 귀결되scavenging Activity
溫膽湯加味方은 100
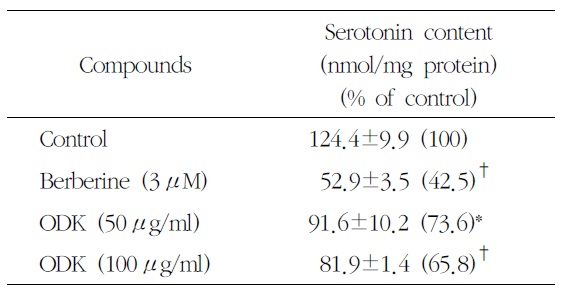
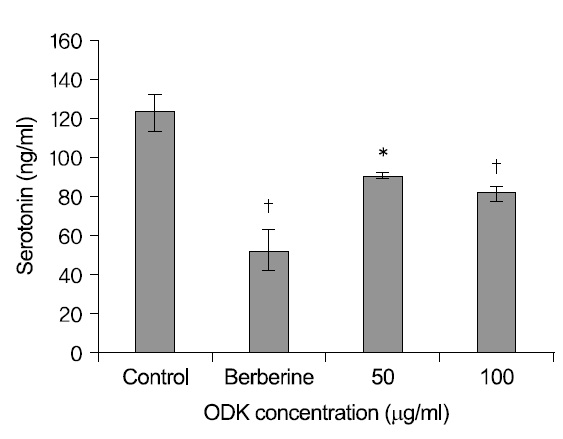
溫膽湯加味方이 P815 세포 내부의 serotonin 농도에 미치는 영향을 분석한 결과 溫膽湯加味方 50
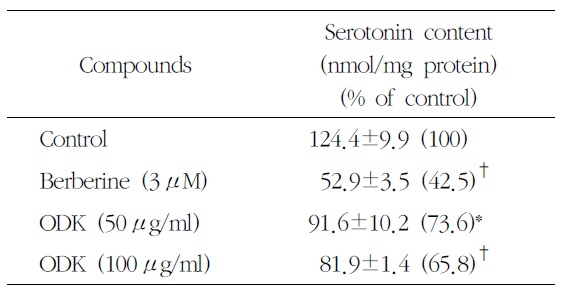
Effects of OnDam-tang-Kami-bang (ODK) on the Intracellular Serotonin Content in P815 Cells
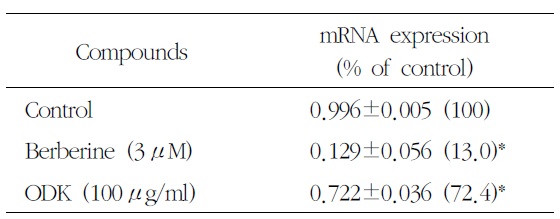
[Table 5.] Effect of OnDam-tang-Kami-bang (ODK) on 5-HTT mRNA in P815 Cells
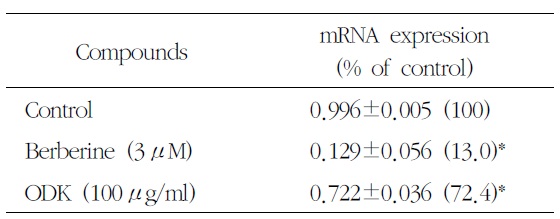
Effect of OnDam-tang-Kami-bang (ODK) on 5-HTT mRNA in P815 Cells
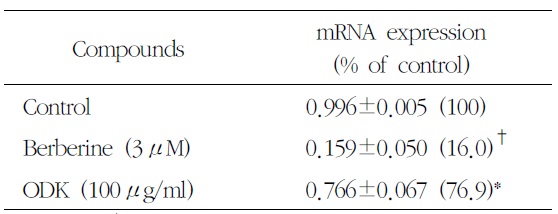
[Table 6.] Effect of OnDam-tang-Kami-bang (ODK) on TPH-1 mRNA in P815 Cells
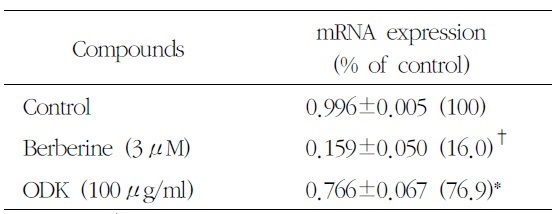
Effect of OnDam-tang-Kami-bang (ODK) on TPH-1 mRNA in P815 Cells
에서 91.6±10.2 ng/ml protein (87.4%), 100
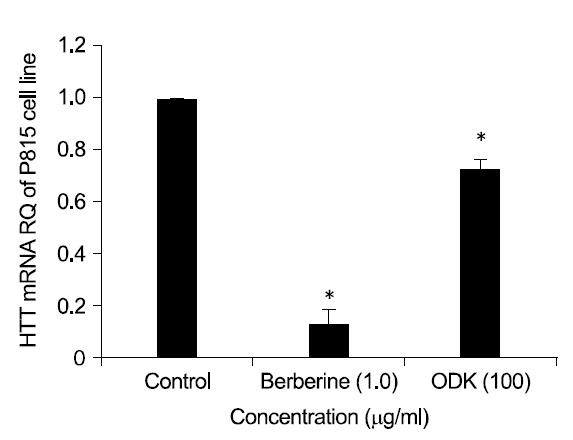
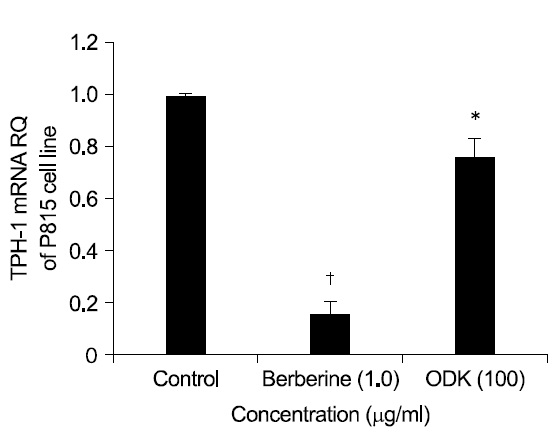
5-HTT, TPH-1의 mRNA 발현을 측정한 결과 溫膽 湯加味方 100
溫膽湯은 和胃, 消積, 淸熱, 安神의 효능으로 心膽 虛怯, 觸事易驚, 夢寐不祥, 虛煩不得眠 등의 신경증에 사용되어 왔다. 本方은 脾의 健運機能이 失調되어 內 生한 痰이 膽을 沮滯하여 膽氣가 疏泄할 수 없기 때문에 鬱滯되어 痰火를 生成하고 化熱되어 膽氣가 橫逆 하여 胃氣의 上逆을 일으키거나 혹은 熱痰이 擾動으로 발생하는 神經性 症狀에 쓰는 代表 處方으로, 정신적 스트레스는 뇌신경을 긴장, 흥분시키고 결국 자율 신경에 실조를 초래하고 그 결과 소화기계에 영향을 끼쳐 위장기능장애로 인한 痰飮이 생길 수 있으며, 이 痰飮이 다시 뇌신경을 방해하는 것으로 해석할 수 있다3).
우울증은 우울하거나 들뜨는 기분의 장애가 주축이 되는 일련의 정신장애를 일컫는 기분장애 중 저조한 기분에 있는 상태를 말하는 것으로 여러 가지 종류 의 정신장애 및 신체장애에서 나타나며, 서로 연결성을 가지고 있는 증상들로 이루어지는 증후군이다22). 우울증의 주요증상은 우울한 기분, 흥미와 즐거움의 상실, 피로감의 증대와 활동성 저하를 초래하는 기력 감퇴이고, 기타 증상으로 집중력과 주의력의 감소, 수면장애, 식욕감퇴를 말하고 있는데, 이는 한의학적으로 볼 때, 鬱證과 유사하다고 할 수 있다23).
우울증의 원인으로는 생물학적 원인과 사회심리학적 원인으로 크게 대별되는데, 이 중 생물학적 원인에는 유전적 요인, 체질적 요인, 신경생화학적ㆍ생리 학적 요인 등이 있다23). 이 중 가장 잘 알려진 이론이 모노아민 가설이다24).
우울증의 모노아민 가설이란 monoamine을 고갈 시키는 reserpine과 같은 약물을 우울증 환자에게 투여하면 우울증을 유발한다는 것을 관찰한 뒤 제기된 학설로 모노아민, 특히 노르에피네프린이나 세로토닌 활성도 감소가 우울증의 발병에 중요한 역할을 한다는 가설이다. 서양의학에서 우울증의 약물요법으로 주로 이용되는 삼환계 항우울제와 monoamine 산화효소억제제의 약리기전을 보면, 삼환계 항우울제 (TCA)는 monoamine의 재흡수를 억제하여 시냅스의 monoamine치를 상승시키고, monoamine의 분해를 억제하는 monoamine 산화효소억제제(MAOI)는 monoamine 분해효소를 억제하여 시냅스의 monoamine 치를 상승시키는 것으로 알려져 있다. 이 중 세로토닌은 세로토닌의 대사산물인 5-HIAA (5-Hydroxyindoleacetic acid)가 우울증 환자의 뇌척수액에서 감소 하였다는 보고와 선택적 세로토닌 재흡수차단제가 우울증 치료에 기여한 지대한 영향으로 우울증과 가장 밀접한 단가아민이 되었다25).
Serotonin은 뇌세포에서 자연적으로 생성되는 아마노산인 트립토판(tryptophan)에서 두 단계를 거쳐 만들어진다. 트립토판은 tryptophan hydroxylase에 의해 5-HTP (5-Hydroxytryptophan)라 부르는 중간산물로 변환되고, 다음에는 5-hydroxy-tryptophan decarboxylase에 의해서 serotonin (5-HT)으로 변환 된다. 이때 tryptophan hydroxylase (TPH)의 활성에 따라 반응속도가 결정되어지며, 이는 뇌 속의 L-trp 의 활용에 영향을 미친다4). 즉, 세포 내 serotonin 양은 serotonin 합성 속도를 조절하는 TPH의 효소 활성에 의해 결정된다26).
항우울제 약물 중 selective serotonin reuptake inhibitors (SSRIs)는 SERT에 의해 5-HT가 이동하는 것을 막는다4).
한의학에서의 鬱證은 서양의학의 우울증과 대비 할 수 있는 용어로서, 이를 “心神一如”, “形神一體”의 一元論的 관점으로 보았는데, 초기에는 氣機가 疏通 되지 못해 생기는 諸病症이라는 다소 포괄적인 의미였으나 차츰 정신적인 증상의 개념으로 귀결되었다27). 분류에 있어서 ≪東醫寶鑑≫2)에서는 氣鬱, 血 鬱, 食鬱, 痰鬱, 熱鬱, 濕鬱의 六鬱로 나누었고, ≪한 의진단명과 진단요건의 표준화연구한의학 변증분류≫28)에서는 肝鬱脾虛, 肝鬱氣滯, 痰迷心竅, 心脾兩 虛, 脾腎兩虛 등으로 주로 氣鬱型과 血虛型으로 나누어 辨證施治하고 있다.
한편 우울증에서는 정상보다 체내의 free radical 생성이 증가되어 있는 것으로 보고되고 있는데29), free radical이란 하나 또는 여러 개의 홀수전자를 지닌 분자를 의미하며 생체내의 분자들과 활발히 반응 하여 여러 병적상태를 유발하는 것으로 알려져 있다. 이와 같은 활성산소들의 수와 활성의 증가로 세포손상과 변성이 활발히 일어나는 단계를 산화성 자극이 증가하였다고 하며, 건강상태에서도 기저수준의 산 화성 자극이 존재하나 만성질병, 노화, 중독, 손상 등 에서는 병적으로 산화성 자극이 증가하여 세포손상과 고사를 유도하는 것으로 알려져 있다. 인체는 이를 예방하기 위해 다양한 항산화 기전을 가지고 있으나 이를 초과하는 산화성 자극의 증가는 필연적으로 질병의 발생과 진행을 가져오게 된다30). 인체는 이러한 분자들의 방어기작으로 catalase, glutathione peroxidase, SOD 등의 효소적 방어체계와 glutathione, ascorbic acid, α-tocopherol, uric acid 등과 같은 비효소적인 방어체계를 가지고 있다. 그러나 물리화학적 자극이나 정신적 스트레스 등에 의해 생산과 억제의 균형이 깨져 과생산되고, 결국 free radical은 파킨슨병, 알츠하이머병, 정신분열증, 그리고 우울증 등 신경정신 질환들의 요인이 된다고 알려져 있다31).
이에 저자는 溫膽湯加味方이 우울증 활용 가능성 을 실험적으로 규명하고자 P815 세포에서 Ez-cytox 분석법을 이용한 세포 생존, DPPH free radical 소거 작용, superoxide dismutase (SOD) 활성 및 세포내 5-HT, Tryptophan hydroxylase 1 (TPH-1) 등의 함량 및 역전사 중합효소 연쇄반응을 이용한 유전자 발현에 미치는 영향을 측정ㆍ관찰하였다.
본 실험에서는 P815라는 세포주를 이용하였는데 이 세포는 TPH를 비교적 많이 발현하는 세포로서 TPH 연구에 많이 이용된다. P815 세포는 F1 hybrid mice의 ascitic tumour에서 유래한 것으로 serotonin 을 생합성, 저장 및 분비하며, TPH 및 AADC를 발현 하고 histamine을 생합성, 저장 및 분비하며, histamine 생합성 효소인 histidine decarboxylase를 발현 한다32).
溫膽湯加味方의 세포독성 여부를 판단하기 위하여 Ez-cytox 분석법을 시행하였다. 50
溫膽湯加味方의 항산화 능력을 알아보기 위하여 DPPH free radical 소거작용과 SOD 활성을 측정하였다. DPPH free radical의 안정성, 높은 민감도 및 검사의 편의성 등으로 인해 DPPH free radical 소거법은 항산화 작용 평가에 흔히 사용되는 검사법이다30).
농도별 溫膽湯加味方 추출물 처리 후 DPPH free radical 소거능은 농도 의존적으로 증가하여, 400
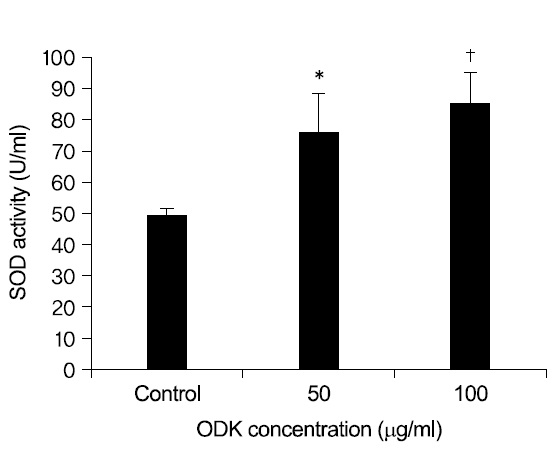
한편 SOD는 주로 세포 내 세포질 또는 미토콘드리아 내에 분포하며 대표적인 활성산소중의 하나인 Superoxide anion을 과산화수소와 산소 분자로 전환 시키는 반응을 촉매하는 중요한 항산화 효소 중의 하 나이다33).
溫膽湯加味方의 SOD 활성을 측정한 결과, 溫膽湯 加味方 100
위의 두 실험의 결과에 의거하여 溫膽湯加味方은 항산화효능이 있을 것으로 추측하며, free radical 산화 작용과 관련된 신경정신과 질환에 응용될 수 있을 것으로 사료된다.
溫膽湯加味方이 serotonin 합성에 미치는 영향을 살펴보기 위해 P815 배양 세포에 溫膽湯加味方을 처리한 후 HPLC-형광광도계법으로 세포 내부의 serotonin 농도를 분석한 결과, 50
Serotonin의 합성 속도를 조절하는 5-HTT의 mRNA와 TPH의 mRNA는 溫膽湯加味方 100
위의 두 실험 결과에서 溫膽湯加味方은 P815 세포 내 serotonin 함량과 5-HTT, TPH-1의 mRNA 발현을 모두 유의하게 감소시켜 溫膽湯加味方이 특정세포내의 serotonin 함량을 조절하는 효과를 보였다고 할 수 있다.
본 실험의 양성대조군으로 사용된 berberine의 경우, 이 등34)의 보고에 따르면 P-815 세포내에서 serotonin함량과 TPH-1의 발현이 감소되었다고 하여, 본 연구와의 결과가 일치하게 나타났다. 반면 Peng35)의 연구에서는 berberine의 동물실험에서는 항우울 효과및 전두부와 해마부위의 serotonin함량의 증가가 있었다고 보고하고 있다.
Berberine과 비슷한 결과를 보인 Ethaverine의 경우에서도 김36)의 보고에 따르면 P-815 세포내에서 serotonin함량과 TPH-1의 발현을 감소시켰고 또한 이 등37)의 ethaverine의 동물실험연구에서 항우울효과를 보고하였고, 이 등34)의 연구에서는 ethaverine 이 동물실험에서는 항우울효과를 나타내고 있으나, 뇌에서의 serotonin 함량에는 변화가 없다는 결과를 보고하였다.
상기 연구로 볼 때 溫膽湯加味方이 항산화효과가 있었고 P815 세포에서의 serotonin 함량감소를 보여 세로토닌을 조절하는 기능이 있는 것으로 판단된다. 상기의 베르베린, 에타베린의 연구결과로 미루어 볼 때 溫膽湯加味方 역시 항우울효과가 있을 가능성이 있으며 향후 溫膽湯加味方의 동물실험 연구 등을 통해 항우울효과에 대한 확인이 필요하리라 사료된다.
溫膽湯加味方의 항산화 효능과 P815세포 내에서 serotonin 대사과정에 미치는 영향을 알아보기 위하여 SOD 소거능, serotonin 농도, 5-HTT, TPH-1의 mRNA 활성 변화를 관찰한 결과, 다음과 같은 결론을 얻었다.
1. 溫膽湯加味方은 DPPH radical 소거능과 SOD 활성도를 유의성 있게 증가시켰다.
2. 溫膽湯加味方은 50, 100
3. 溫膽湯加味方은 100