백금(Pt)과 루테늄(Ru)의 조성비가 일산화탄소(CO) 산화반응에 미치는 영향을 조사하고자 탄소를 지지체(support)로 사용한 20 wt% 백금과 백금-루테늄 시리즈 촉매(Pt : Ru = 7 : 3, 5 : 5, 3 : 7)를 콜로이드 방법(colloidal method)으로 합성하였다. 다양한 물리·화학적 분석장비인 투과전자현미경(transmission electron microscopy, TEM)과 X-선 회절(X-ray diffraction, XRD), 에너지 분산형 X-선 분석기(energy dispersive X-ray spectroscopy, EDS)를 이용하여 구조·화학적 특성을 분석하고, X-선 광전자 분광법(X-ray photoelectron spectroscopy, XPS)을 통해 전자적 특성 변화를 확인하였다. 더불어 일산화탄소 벗김 전압전류실험(CO stripping voltammetry)을 이용하여 전기화학적 거동을 분석하였다. 합성된 촉매들 중 Pt5Ru5/C가 가장 낮은 개시 전위(vs. Ag/AgCl)와 가장 큰 일산화탄소의 전기화학적 활성화 표면적(CO EAS) 값을 나타냈으며 이를 통해 Pt5Ru5/C이 일산화탄소의 전기화학적 산화반응에 있어 가장 효과적인 촉매임을 확인하였다. Pt5Ru5/C의 격자상수 변화를 통한 구조적 특성변화 및 백금 d-밴드의 페르미 레벨 변화를 통한 전자적 특성변화 그리고 이작용기(bifunctional)의 효과가 일산화탄소의 전기화학적 산화반응에 대한 활성을 증진시켰다고 사료된다.
고분자 전해질 연료전지(polymer electrolyte membrane fuel cell, PEMFC)는 화학에너지를 전기에너지로 바꿔주는 매우 효율적인 에너지 변환 장치이며, 다른 연료전지에 비해 저온에서의 원활한 작동, 긴 수명, 상대적으로 가벼운 무게, 빠른 시동 등의 많은 이점들이 있다[1-3]. 그러나 고분자 전해질 연료전지에 사용되는 촉매는 주로 탄소에 담지된 백금(Pt)으로 가격적인 측면에서 불리하고, 일산화탄소(CO)와 강하게 결합해 표면이 쉽게 피독되는 성질을 가지고 있어 촉매의 활성이 떨어진다는 단점이 있다. 현재까지는 수소생산이 천연가스 개질을 통해 이루어지므로 고순도 공정을 거쳐서 수소를 제조하더라도 수에서 수십 ppm의 일산화탄소를 포함하게 된다[4-6]. 따라서 극히 소량의 일산화탄소가 포함된 수소라 할지라도 이것을 연료로 사용하게 되면 전극촉매들의 활성점들이 피독돼 전체적인 연료전지 성능이 크게 감소된다[7,8]. 이러한 문제를 해결하기 위한 방안으로 생산단계에서 완전히 일산화탄소를 제거할 수 있는 개질기의 개발, 백금계열의 2원계 혹은 3원계 촉매 개발 및 비백금 전극촉매의 개발에 초점을 맞추어서 연구가 진행되고 있다[9-12]. 그 중에서 일산화탄소의 피독효과를 최소화하고 전극촉매의 성능을 향상시킬 수 있는 가장 간단한 방법 중 하나가 백금에 제 2의 원소를 첨가함으로써 2원계 (bimetallic) 합금 촉매를 제조하는 것이다.
현재까지 고분자 전해질 연료전지 연료극(anode)의 일산화탄소 내피독성을 증가시키기 위한 2원계 촉매로 백금-루테늄(Pt-Ru), 백금-주석(Pt-Sn), 백금-티타늄(Pt-Ti), 백금-이리듐 (Pt-Ir), 백금-금(Pt-Au), 백금-몰리브데넘(Pt-Mo) 등이 보고되고 있다[9,10,13]. 백금 합금 촉매의 경우, 제 2의 금속이 낮은 과전압에서 물을 해리시켜 수산화이온(OH-)을 형성하고, 이때 생성된 수산화이온이 백금 촉매에 피독되어 있는 일산화탄소를 이산화탄소(CO2)로 빠르게 산화시킴과 동시에 이를 효과적으로 제거한다(이작용기성 매커니즘)[14-16]. 또한 백금과 제 2 원소간의 상호작용으로 인한 백금의 페르미 레벨 변화는 백금과 일산화탄소 흡착물 사이의 결합을 약하게 하여 백금으로부터 쉽게 탈착되도록 한다(전자적 효과)[17]. 이처럼 구조·전자적 특성이 변화된 백금 근간 촉매는 일산화탄소 내피독성을 증진시킨다.
본 연구에서는 백금(Pt)과 루테늄(Ru)의 조성비가 일산화탄소 산화반응에 미치는 영향을 조사하고자 서로 다른 백금 : 루테늄 원자비로 합성된 20 wt% PtRu/C 시리즈 촉매를 제조하고, 이의 구조·전자적 특성을 분석하였다. 탄소 지지체에 담지된 20 wt% Pt/C, Pt7Ru3/C, Pt5Ru5/C, Pt3Ru7/C 촉매들을 콜로이드 방법(colloidal method)으로 합성하였다. 다양한 물리· 화학적 분석장비인 투과전자현미경(transmission electron microscopy, TEM)과 X선 회절(X-ray diffraction, XRD), 에너지 분산형 X-선 분석기(energy dispersive X-ray spectroscopy, EDS)를 이용하여 구조·화학적 특성을 확인하고, X-선 광전자 분광법(X-ray photoelectron spectroscopy, XPS)을 통해 전자적 특성 변화를 확인하였다. 더불어 일산화탄소 벗김 전압 전류실험(CO stripping voltammetry)을 이용하여 전기화학적 거동을 분석하였다.
본 연구에서 탄소를 지지체(support)로 사용한 20 wt% 백금, 백금-루테늄 시리즈 촉매(Pt : Ru = 7 : 3, 5 : 5, 3 : 7)는 에틸렌글리콜(C2H6O2, Junsei Chemical Co.)을 환원제이자 안정제로 사용하여 콜로이드 방법으로 합성하였다. PtRu/C 촉매를 합성하기 위해 Vulcan XC-72R (Cabot Corp., SBET = 236.8 m2/g) 탄소를 지지체로, 백금염(H2PtCl6?xH2O, Aldrich)과 루테늄염(RuCl3?6H2O, Aldrich)을 전구체(precursor)로 사용하였으며 촉매합성 방법은 다음과 같다. 먼저 금속입자의 균일한 분산 및 고담지를 목적으로 탄소 지지체의 표면처리 및 세척을 진행하였다. Vulcan XC-72R 탄소를 6 M 염산(HCl, 37%) 용액에 넣고 12시간 동안 교반한다. 산 처리된 탄소가 pH 5.5 정도될 때까지 증류수를 이용해 수회 세척한 후 5시간 동안 120 ℃에서 완전히 건조시킨다. 각 원자비로 계산된 양의 금속염들을 50mL 에틸렌글리콜에 용해시킨 후, 수산화나트륨(NaOH, 50%)용액을 첨가하여 pH 12까지 조절한다. 금속 염들이 포함된 용액에 3시간 동안 160 ℃ 열을 가해 백금과 백금-루테늄 콜로이드를 만든다. 그 다음 백금, 백금-루테늄 콜로이드가 탄소 지지체에 잘 담지되도록, 상온까지 식힌 콜로이드 용액을 앞서 전 처리한 탄소와 섞어 24시간 동안 교반한다. 교반이 끝난 후, 촉매를 진공필터 시스템을 이용하여 걸러내어 증류수로 수회 세척하고 여과한 뒤 동결건조기(freeze-dryer)를 이용하여 건조시킨다. 동결건조기를 이용함으로써 합성된 촉매 입자들이 응집되지 않고 탄소 지지체 위에 골고루 분산되어 있을 것으로 기대한다. 최종적으로 합성된 Pt/C과 PtRu/C 촉매를 질소 분위기 100 ℃에서 2시간 동안 완전히 건조한다. 제조한 촉매는 백금과 루테늄의 원자비에 따라 PtxRuy/C (nominal atomic ratio)로 표기하였다.
탄소 지지체에 담지된 백금-루테늄 촉매들의 결정구조를 분석하기 위해 Rigaku Rotalflex (RU-200B) XRD 기기를 사용하였다. 발생원으로 Cu Kα (λ = 1.5401 A)를 사용하였으며, 이 때 사용한 전압과 전류는 40 kV, 100 mA이다. 먼저 0.025°/3 s 주사 속도로 2
일산화탄소 산화를 위한 전극촉매의 활성도는 Solartron Analytical Instrument (AMETEK model 1400) 장비를 이용하여 순환 전압 전류법(cyclic voltammetry, CV)으로 측정하였다. 모든 전기화학 실험은 Ag/AgCl (3 M KCl sat.)을 기준전극(reference electrode)으로 백금봉(Pt)과 유리상 탄소(glassy carbon)를 각각 상대전극(counter electrode)과 작업전극(working electrode)으로 이용한 3-전극 시스템을 사용하였다. 본 연구에서는 합성된 촉매를 증류수에 넣어 잘 분산시킨 후, 5 wt%나피온용액(Dupont)을 넣어 고분산의 용액상태인 촉매잉크를 제조하였다. 유리상 탄소(glassy carbon) 전극표면을 1 μm, 0.3μm, 0.05 μm Al2O3 페이스트(ALLIED high tech products Inc.)에 차례로 연마한 뒤, 2.5 μL 촉매잉크(금속 양 6.42 μg)를 전극에 박막형태(thin porous film)로 담지하여 건조 후 사용하였다. 각 촉매재료는 작업전극 0.07 cm2의 일정한 면적 위에 담지되었으며, 전기화학적 시험에 앞서 충분한 안정화를 거쳐 시행되었다[18].
일산화탄소 벗김 전압전류법(CO stripping voltammetry)은 0.5 M 황산(H2SO4) 수용액 상에서 50 mV/s 스캔 속도, 0.20 V~0.80 V 전위구간 조건에서 수행되었다. 고순도 질소 가스를 3시간 동안 불어넣어 산소를 제거한 0.5 M H2SO4 용액상에서 0.05 V (vs. Ag/AgCl)를 걸어주면서 20분 동안 일산화탄소(순도: 99%) 가스를 넣어 촉매표면에 일산화탄소 분자가 흡착되도록 한다. 전극표면에 흡착된 일산화탄소를 유지시키기 위해 동일한 전압을 걸어주면서 질소 가스를 20분 동안 불어넣어 전해질 용액 내의 일산화탄소 가스를 제거하고 순환 전압전류법을 측정하였다.
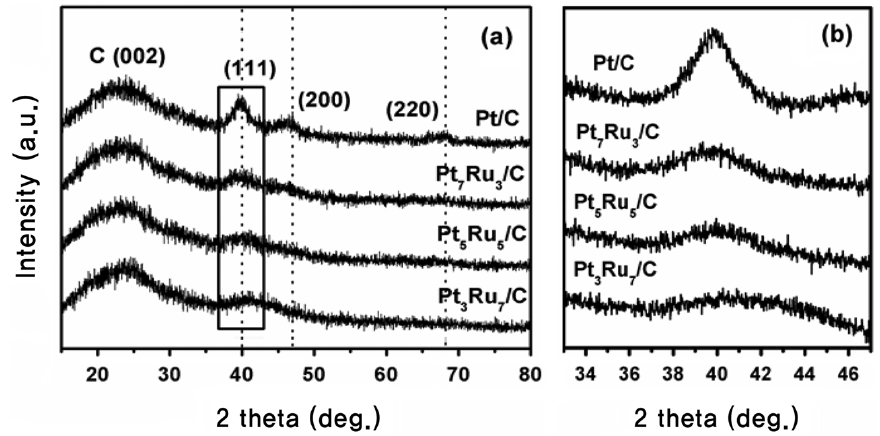
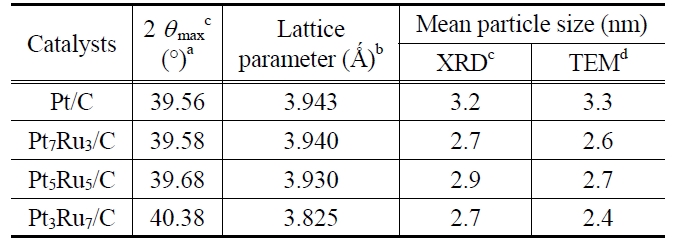
Figure 1은 20 wt% Pt/C과 서로 다른 백금 : 루테늄 원자비로 합성된 20 wt% PtRu/C 시리즈 촉매의 XRD 분석 결과이다. Figure 1(a)에서 모든 촉매는 대략 39°, 46°, 68°에서 백금
의 면심 입방 구조(face centered cubic, FCC) (111), (200), (220)면 특성 피크를 잘 나타내고 있다[19]. XRD 분석결과, 백금 면심 입방 구조 피크 외에 조밀 육방 구조(hexagonal closed packed, HCP)인 루테늄 금속이나 루테늄 산화물(oxide)에 관련된 피크는 발견되지 않았으며, 이는 루테늄 원자가 백금의 면심 입방 구조 안에 들어가 백금-루테늄 합금을 형성한 증거로 여겨진다[20,21]. Figure 1(b) 결과에 따르면, 백금에 루테늄이 첨가됨으로써 형성된 작은 입자의 영향으로 피크가 점점 넓어지고, 첨가된 루테늄 함량이 증가함에 따라 백금(111) 피크의 2
합성한 촉매의 입자형상 및 크기를 알아보기 위해서 수행
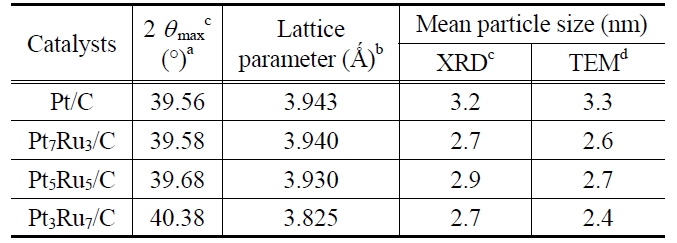
[Table 1.] Structural parameters for the Pt/C and PtRu/C catalysts measured using XRD and TEM
Structural parameters for the Pt/C and PtRu/C catalysts measured using XRD and TEM
한 TEM 분석 이미지를 Figure 2에 나타내었다. 다음 식 (1)을 이용하여 촉매의 입자 크기를 계산한 결과, PtRu/C 시리즈 촉매가 Pt/C 촉매에 비해 다소 작은 크기로 합성되었음을 확인할 수 있었다.
d = mathematical mean particle diameter
ni = frequency of the catalyst particles with a diameter of size di
이 결과는 앞서 XRD 분석으로부터 계산된 입자크기와 유사하다. XRD와 TEM 결과를 통해 볼 때, 루테늄 함량이 증가하더라도 합금의 입자 크기는 크게 달라지지 않아 이것으로 구조적인 관점에서 입자크기가 촉매의 활성 정도를 결정짓는 요소가 아니라는 것을 알 수 있다. 즉, 나노사이즈 효과가 각 촉매의 활성 차이에 영향을 주지 않았다고 볼 수 있다. Figure 2(c)에 삽입된 EDS 스펙트럼은 나노입자의 순도와 화학적 성분 조성을 보여준다. 스펙트럼에서 보여지는 것과 같이 백금과 루테늄을 제외하고 불순물로 보여지는 물질은 존재하지 않으며, 합성단계에서 계산된 값인 원자비와 실제 합성된 금속입자의 원자비가 백금 : 루테늄(5 : 5)로 거의 동일함을 확인하였다.
XRD, TEM, EDS와 같은 물리·화학적 분석 결과를 통해 백금과 백금-루테늄 입자가 성공적으로 합성되었으며, 지지체로 사용한 탄소위에 균일한 크기로 잘 분산되었음을 확인하였다. 이로부터 에틸렌글리콜을 용매 및 환원제로 이용한 콜로이드 방법이 균일한 모양 및 크기를 갖는 촉매를 합성하는데 적합한 방법임을 알 수 있다[23,24].
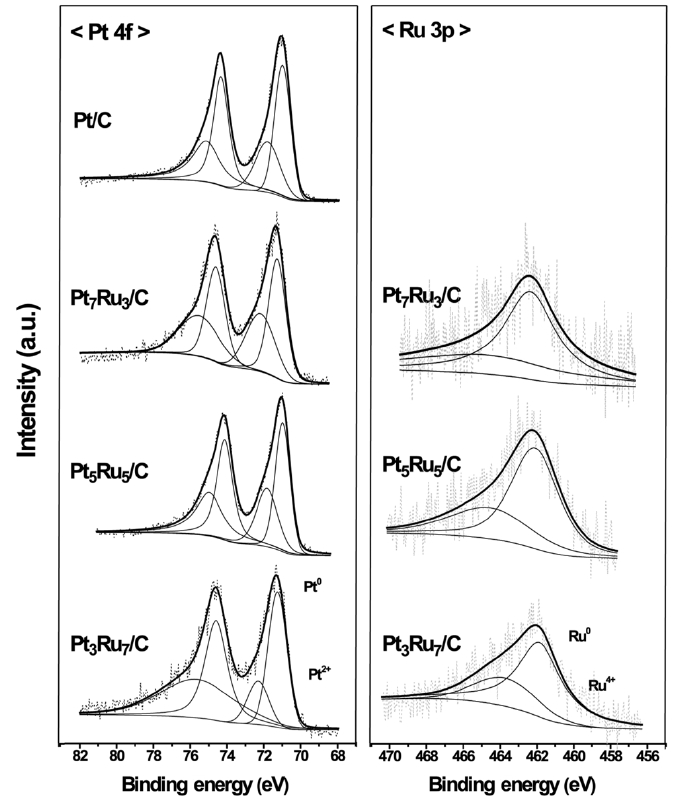
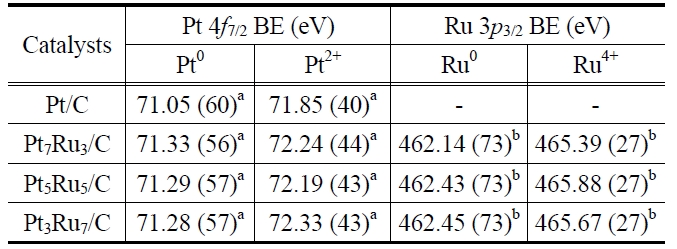
Figure 3은 탄소에 담지된 백금과 백금-루테늄 시리즈 촉매
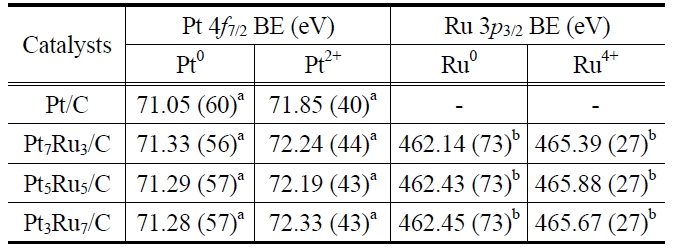
[Table 2.] Electronic parameters of the catalysts measured using XPS measurements
Electronic parameters of the catalysts measured using XPS measurements
의 XPS 분석 결과이다. XPS 분석을 통해서 촉매의 각 원소 Pt 4
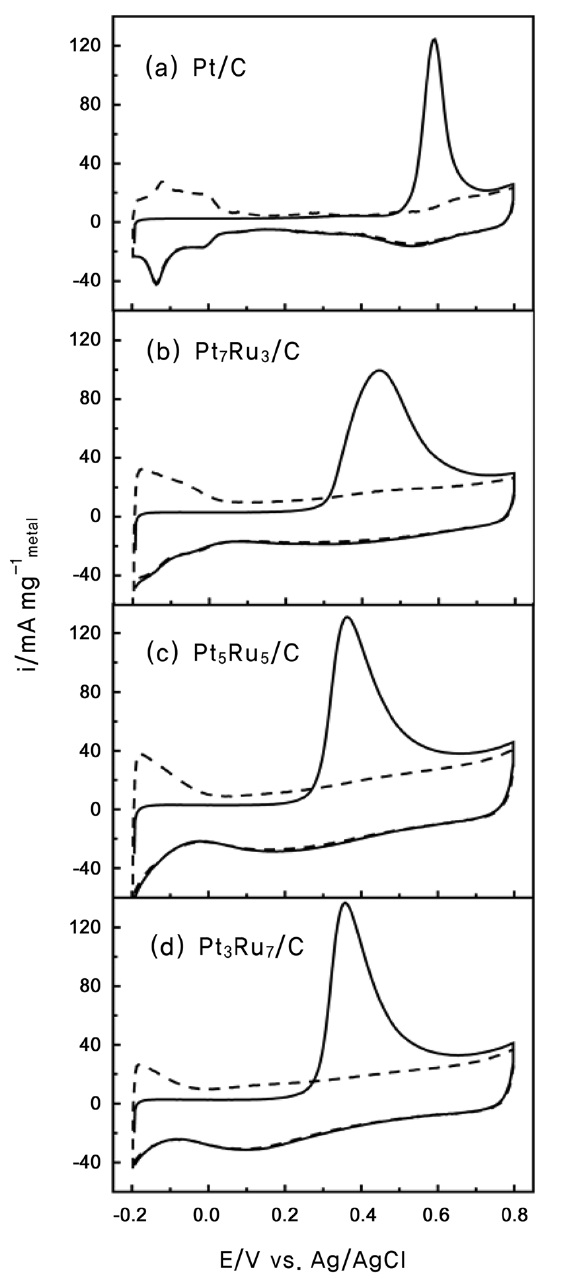
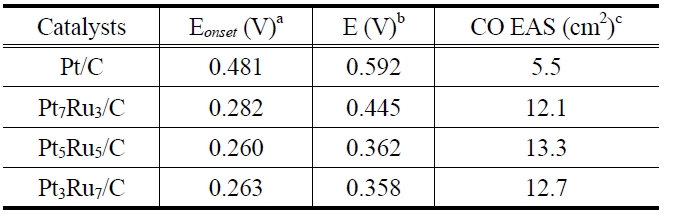
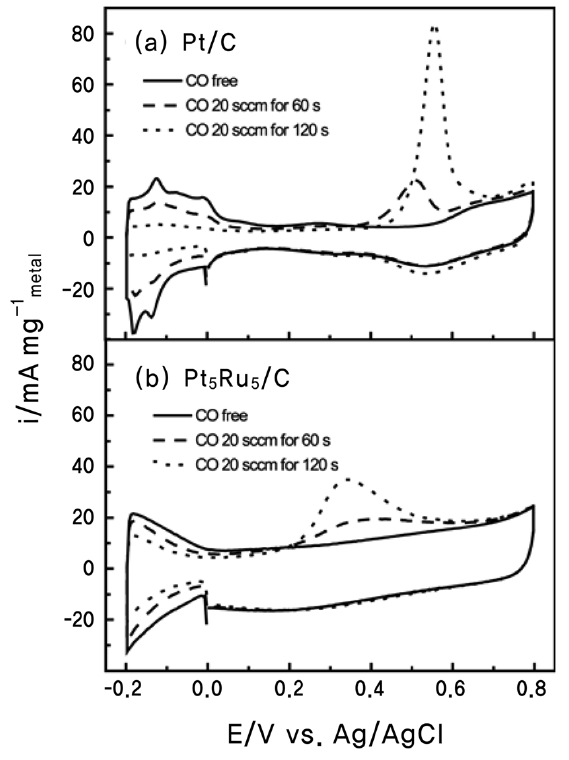
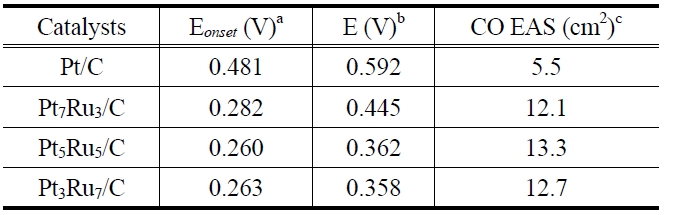
합성한 촉매들의 일산화탄소 산화반응에 대한 활성을 조사하기 위해 촉매표면에 일산화탄소를 흡착한 후 0.5 M 황산(H2SO4) 수용액, 50 mV/s 스캔 속력 조건에서 일산화탄소 벗김 전압전류(CO stripping voltammetry) 실험을 수행하였다[28]. Figure 4는 Pt/C, Pt7Ru3/C, Pt5Ru5C, Pt3Ru7/C 촉매들의 일산화탄소 벗김 전압전류 곡선이다. Pt/C 촉매의 경우, 첫 번째 사이클(실선)의 약 0.59 V (vs. Ag/AgCl) 근처에서 뾰족한 일산화탄소 산화반응 피크가 나타나고, 두 번째 사이클(점선)에서 일산화탄소가 흡착되지 않은 깨끗한 백금 표면의 피크와 유사한 그래프가 나타났다. 이를 통해 첫 번째 사이클에서 촉매 표면에 흡착된 일산화탄소 분자가 완전히 산화된다는 것을 유추할 수 있으며, 이러한 형상의 피크는 Pt/C 뿐만 아니라 PtRu/C 시리즈 촉매에서도 유사하게 나타나고 있음을 확인할 수 있다. Figure 4에 보이는 바와 같이 촉매 표면에 흡착된 일산화탄소가 산화되는 시작하는 개시 전위(vs. Ag/AgCl)가 Pt/C> Pt7Ru3/C > Pt3Ru7/C > Pt5Ru5/C 순서로 점점 낮은 전위 방향으로 이동하고 있다. 이로부터 모든 촉매들 중에서 Pt5Ru5/C이 촉매표면에서 일산화탄소를 산화시킴에 있어서 가장 낮은 활성화에너지를 가짐을 유추할 수 있다. 일산화탄소 흡착에 관한 Pt/C 및 PtRu/C 촉매의 전기화학적 활성화 표면적(electrochemical active surface, EAS)을 각각 420, 484 μC/cm2 전하 값을 이용하여 계산하였으며, Table 3에 나타내었다. 루테늄 함량이 증가할수록 EAS 값이 증가하여 Pt5Ru5/C 촉매에서 가장 큰 EAS 값을 보였다. Pt/C에 비해서 모든 PtRu/C 촉매의 EAS 면적이 더 컸으며, 특히, Pt5Ru5/C은 13.3 cm2로 Pt/C에 비해 2.5배 정도 큰 CO EAS 값을 나타냈다[29].
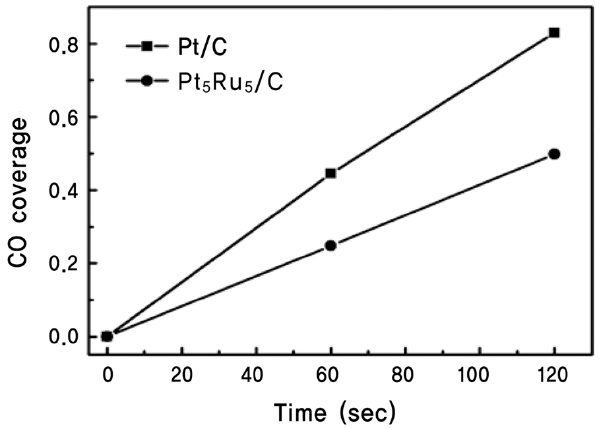
제조한 촉매 중, 대표적으로 Pt/C 과 Pt5Ru5/C 촉매에 대해서 일산화탄소를 불어넣어준 시간에 따른 일산화탄소 벗김 전압전류 실험과 그 결과로부터 계산된 흡착된 일산화탄소(
[Table 3.] The quantitative analysis of the cyclic voltammograms for the prepared catalysts
The quantitative analysis of the cyclic voltammograms for the prepared catalysts
간을 0초에서 120초로 증가시키자, 시간에 비례하여
기존의 고분자 전해질 연료전지(PEMFC)의 가장 큰 문제 중 하나는 수소를 연료로 사용하는 연료극(anode)에서 촉매 활성 면적의 감소로 인해 전체적인 연료전지 성능이 크게 떨어진다는 점이다[7,8]. 이는 전극으로 사용되는 백금 촉매가 수소연료에 포함되어 있는 일산화탄소에 의해서 활성점이 피독되기 때문이다. 따라서 백금에 제 2의 원소를 첨가해 피독효과를 최소화하고 방지함으로써 전극촉매의 활성을 증가시키고자 하였다. 연구결과, 기존의 순수한 백금 금속 촉매보다 구조·전자적 특성이 변화된 백금-루테늄 촉매가 일산화탄소 산화반응에 대해 더 높은 활성을 보였다.
XRD 분석(Figure 1, Table 1)을 통해서 루테늄의 함량이 증가함에 따라 백금의 격자 상수가 감소하는 것을 확인하였다. 본 연구에서는 3.930 A의 격자상수 값을 가지는 Pt5Ru5/C 촉매가 가장 높은 성능을 보였으며, 이는 합금화로 인한 백금의 구조적 특성 변화가 일산화탄소의 전기화학적 산화반응에 영향을 미쳤다고 설명할 수 있다[23]. Figure 4와 Table 3을 통해서 백금에 루테늄을 첨가함으로써 일산화탄소 산화반응의 개시 전위(vs. Ag/AgCl)가 감소하고 CO EAS 값이 증가하는 것을 확인하였다. 이러한 촉매활성의 증가 요인으로 전자적 효과(electronic effect)와 이작용기성(bifunctional) 매커니즘을 들 수 있다.
1) 전자적 효과(electronic effect) : Figure 3과 Table 2에서 예상할 수 있듯이, 백금과 루테늄이 합금을 이루게 되면 백금에서 루테늄으로 전자가 이동하게 되고, 이때 일어나는 백금의 페르미 레벨 변화에 의해서 백금과 일산화탄소 흡착물 사이의 결합이 약해지게 된다[14-16].
2) 이작용기성(bifunctional) 매커니즘 : 루테늄이 낮은 과전압에서 물을 해리시켜 수산화이온(OH-)을 형성하므로 이 때 생성된 수산화이온이 백금 촉매에 피독되어 있는 일산화탄소와 반응해서 이산화탄소(CO2)로 빠르게 산화된다[17,23].
본 연구에서 합성된 촉매들 중 Pt5Ru5/C가 가장 낮은 개시전위(vs. Ag/AgCl)와 가장 큰 CO EAS 값을 나타냈으며 이로써 Pt5Ru5/C가 일산화탄소의 전기화학적 산화반응에 있어 가장 효과적인 촉매임을 확인하였다.
20 wt% Pt/C과 서로 다른 백금 : 루테늄 원자비로 합성된 20 wt% PtRu/C 시리즈 촉매의 일산화탄소의 전기화학적 산화반응에 대해 연구하였다. 루테늄 원소를 백금 촉매에 첨가함으로써 일산화탄소의 전기화학적 산화반응이 상당히 향상되었으며, 특히 일산화탄소 산화반응에 대해 가장 낮은 개시전위(vs. Ag/AgCl)와 가장 큰 EAS 값을 보이는 Pt5Ru5/C 촉매가 일산화탄소를 제거하는데 가장 높은 활성을 보이는 촉매임을 확인하였다. 또한, Pt5Ru5/C는 Pt/C 촉매에 비해서 낮은 일산화탄소 흡착(
1) 구조·전자적 특성 변화 : 격자상수와 백금 d-밴드의 페르미 레벨 변화가 백금과 일산화탄소 흡착물 사이의 결합을 약하게 만든다.
2) 이작용기성(bifunctional) 매커니즘 : 백금에 일산화탄소가 흡착되면 루테늄의 물에 대한 부분산화로 생성된 수산화이온(OH-)의 도움을 받아 백금에 흡착된 일산화탄소가 수산화이온과 반응해서 이산화탄소(CO2)로 빠르게 산화되어 백금표면의 일산화탄소가 제거된다.
이로써 Pt/C과 PtRu/C 시리즈 촉매들 중, Pt5Ru5/C 촉매가 일산화탄소의 전기화학적 산화반응에 있어 가장 효과적인 촉매로 작용함을 확인하였다.