지구온난화에 대한 해결방향으로 배가스 중 이산화탄소를 분리 및 저장하는 연구가 활발하게 진행되고 있다. 이산화탄소 흡수액은 주로 MEA와 같은 아민계 화합물이 사용되는데 이때 배가스에 함께 포함된 이산화황 (SO2)은 CO2 흡수액의 성능을 저하시키는 원인이 되거나 공기중으로 배출될 경우 산성비의 원인이 된다. 지금까지의 SO2 흡수제로는 Ca계 고체 흡수제가 주로 사용되었는데 최근 액체 흡수액으로 이온성액체가 주목받고 있다. 이온성액체는 이온으로 이루어진 특징으로 인하여 넒은 액체 범위 및 극성가스에 대하여 높은 용해성을 갖고 있다. 본 총설에서는 최근 발표된 SO2 흡수제로 이온성액체에 대하여 그 구조 변화에 따른 SO2 흡수량 변화 그리고 흡수 메커니즘에 대하여 살펴보았다.
석탄 및 석유 등의 화석연료에는 상당량의 황화합물이 포함되어 있고 이 황화합물들은 연료를 태워 에너지를 만드는 과정에서 이황화탄소(SO2) 형태로 배출된다. 실제로 발전소 등에서 배출되는 배가스(Flue gas)에는 약 50~3,000 ppm의 SO2가 포함 되어 있다. 대기로 배출되는 SO2는 햇빛과 산소의 존재 하에 SO3로 매우 쉽게 산화되고 이 SO3가 공기중의 수분과 만나면 H2SO4 즉 황산으로 변한다. 대기중에서 형성된 황산은 산성비를 만들어 지상의 생물과 토양, 건축물에 막대한 피해를 입힌다. 따라서 화석연료를 태우는 대부분의 발전소 혹은 산업시설에서는 이러한 대기오염의 주원인 물질의 방출을 막기 위해 탈황 (desulfurization) 처리된 배가스를 대기중으로 방출한다. 이 때 가장 많이 사용되는 방법이 석회(lime, CaO)나 석회암(limestone, CaCO3) 혹은 진한 NaOH 수용액 등으로 배가스를 처리하는 것 이다[1-3]. 석회나 석회암과 같은 칼슘화합물들은 SO2와의 반응으로 칼슘 설파이트(CaSO3)를 형성하고 이는 산화되어 최종적으로 석고(gypsum)라 불리우는 CaSO4로 변환된다. 원료인 칼슘화합물들의 저렴한 가격 및 SO2와의 반응성, 그리고 생성물인 석고를 다시 건축자재 등으로 사용할 수 있다는 점에서 이 방법은 가장 일반적인 SO2 제거 방법이 되었지만 또 다른 한편으로는 과량의 물을 사용함으로써 생성되는 폐수의 처리 문제, 생성물인 석고의 가격이 너무 낮아 생기는 경제성 문제, 염기 용액을 사용함으로써 발생되는 부식문제 등을 내포하고 있다. SO2의 분리가 필요한 또 다른 공정은 HTGR (High Temperature Gas-cooled Reactor)를 사용하여 황산을 물과 SO2 그리고 O2로 분리시키는 SI (Sulfur-Iodine) cycle 그리고 Hybridsulfur process이다[4,5]. 이들 공정들은 물을 분해하여 최종적으로 수소를 제조하는 반응을 이용하는데, 반응 사이클 중 SO2와 O2의 분리가 매우 중요한 단계이다.
한편 SO2 가스 자체는 앞에서 언급한 바와 같이 심각한 대기오염을 유발하는 물질이지만 순수한 SO2는 산업적으로 다양한 활용 분야를 가지고 있다. 즉 황산의 원료로 사용되거나 반응에서 술폰닐 그룹을 도입하는 시약, 그리고 하수처리장에서 사용되는 염소의 환원제로 사용될 뿐만 아니라 말린 과일이나 와인 등에 소량 첨가하여 부패를 막는 역할을 하기도 한다. 그러나 CaSO4의 경우 SO2로 다시 재생하는 방법이 불가능하다. 따라서 SO2를 선택적으로 흡수할 수 있을 뿐만 아니라 다시 쉬운 방법으로 재생할 수 있는 흡수제에 대한 연구 개발이 중요하다.
SO2를 재생할 수 있는 흡수제의 가장 중요한 조건으로는 다음과 같은 사항을 들 수 있다.
① 가역적인 SO2 흡수 탈착
② SO2에 대한 높은 흡수성 및 타 가스에 대한 선택성
③ 낮은 재생온도
실제로 이러한 조건을 충족시키기 위한 흡수시스템으로 고체 흡착제를 사용한 Pressure Swing Absorption (PSA)이나 Temperature Swing Absorption (TSA)을 사용하는 방법, 그리고 극성
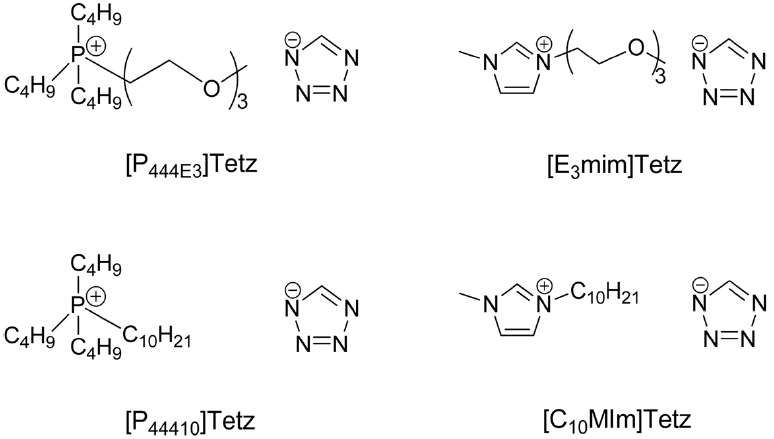
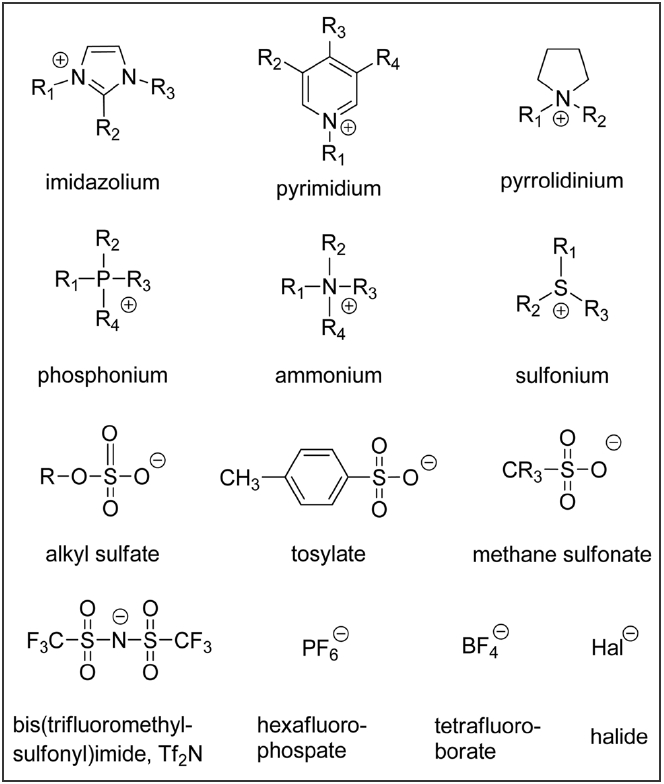
유기용매를 사용하는 방법[6,7] 등이 연구되고 있지만 최근 많은 연구가 진행되고 있는 분야는 이온성액체를 이용하는 것이다. 이온성액체는 유기양이온과 음이온으로 이루어진 물질로 100 ℃ 이하에서 액체로 존재하는 물질이다(Figure 1, 2).
이온성액체의 특징 중 하나가 높은 열적 안정성, 낮은 휘발성 뿐만 아니라 극성 가스에 대한 용해도가 높기 때문에 CO2 흡수액 및 BF3나 PH3와 같이 독성이 큰 물질의 저장매체로 사용하는 방법에 대한 많은 연구가 진행되었다(Figure 3)[8-12].
SO2는 황을 중심으로 양쪽에 산소가 연결되어 있고 O-S-O의 각이 119°로 구부러진 구조로 존재하여 결과적으로 분자내에 영구적인 쌍극자모멘트(dipole moment)가 존재한다(Figure 4). 따라서 극성도가 큰 이온성액체에 대한 용해도가 매우 클것으로 예상할 수 있다. 또한 이온성액체의 낮은 휘발성 및 높은 열적 안정성 등의 특징은 SO2를 탈착하는 과정에서 용매의
휘발이 없어 일반적으로 유기용매를 사용했을 때 발생하는 휘발에 의한 대기오염 및 흡수액 보충 문제 그리고 반복적인 흡수 탈기에 의해 흡수액이 분해하는 문제를 최소화 할 수 있다.
이온성 액체에 대해서는 이미 많은 수의 논문과 저서가 이미 알려져 있으므로 본 총설에서는 최근 활발하게 발표되고 있는 SO2 흡수 및 분리용 매체로서 이온성액체의 개발동향에 대하여 살펴보겠다.
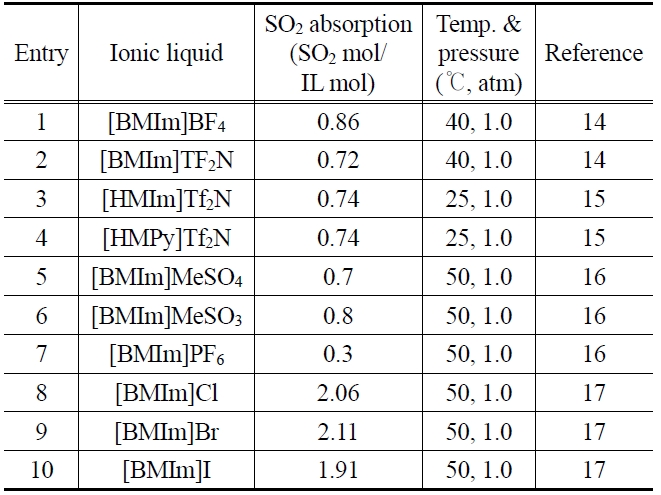
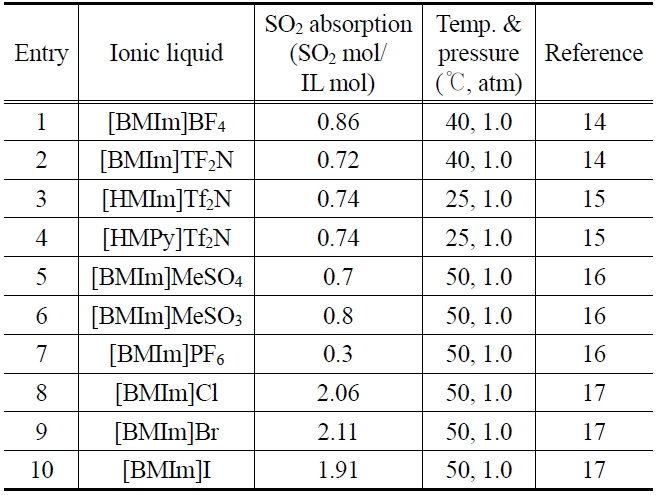
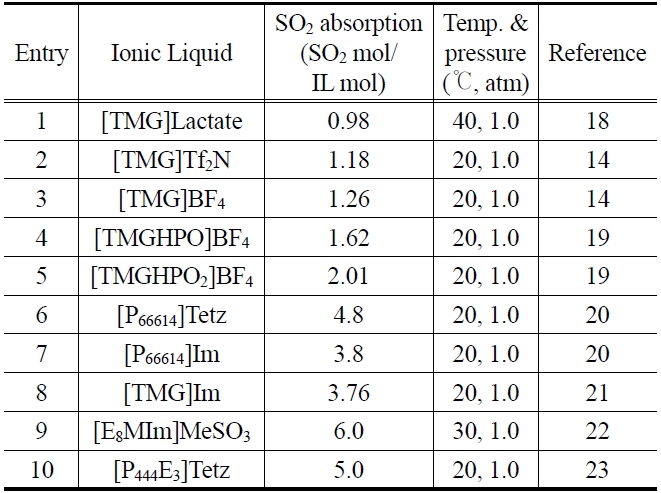
Figure 1에 표시된 양이온과 음이온으로 이루어진 이온성액체들은 시기적으로 가장 먼저 알려졌고 결과적으로 가장 폭넓게 연구되고 활용된 이온성 액체에 속한다. 분자가 양이온과 음이온으로 나누어져 있을 뿐 아무런 작용기를 가지고 있지 않을 뿐만 아니라 음이온의 경우도 할라이드를 제외하고는 염기성이나 수소결합능력, 혹은 배위능력이 전혀 없거나 매우 약한 구조에 속한다. 또한 Figure 2에서 볼 수 있듯이 매우 넓은 적용온도 범위를 갖고 있고 열적으로도 상당히 안정하다. 이러한 구조의 이온성액체에 대한 SO2 용해도를 측정해 보면 25 ℃ 1 bar에서 BF4와 Tf2N, MeSO3, 그리고 MeSO4 음이온에 대하여 25~50 ℃ 온도 범위에서 이온성액체 1 몰당 0.7~0.8 몰의 SO2를 녹이고 PF6 음이온의 경우 다른 음이온에 비하여 감소된 용해도를 보여준다(Table 1). 물론 Table 1의 Entry 1~7의 결과가 각각 다른 온도에서 여러 연구자에 의해 발표된 내용이라 이온성액체 간의 SO2 흡수량에 대한 직접적인 우위의 비교는 어렵다. 그러나 SO2와 직접적인 상호작용을 할 수 있는 작용기가 없는 이온성 액체의 구조에서 양이온에 치환된 알킬그룹의 길이에 대한 영향이나 양이온의 종류 그리고 음
[Table 1.] SO2 solubilties in various ionic liquids
SO2 solubilties in various ionic liquids
이온의 종류에 따른 흡수량의 차이는 현저하게 나타나지 않는다는 사실은 알 수 있다. 또한 Table 1 중 SO2에 대한 용해도가 가장 큰 [BMIm]BF4는 40 ℃에서 24.4 g / 100 g ILs로 물에 대한 SO2의 용해도(9.4 g/100 g water, 25 ℃) 보다 2배 이상 큰 값이다. 유사한 산성 가스인 CO2와의 용해도를 비교해 보면 [HMIm]Tf2N에 대한 SO2의 Henry’s law constant는 25 ℃에서 약 1.64 bar로 동일한 용매에 대한 CO2의 Henry’s law constant(32.8 bar)와 비교해 보았을 때 SO2가 CO2 보다 20배 더 용해도가 크다는 것을 보여준다[15].
Table 1에서 보면 할라이드계 음이온을 갖는 이온성액체를 사용하여 SO2를 흡수하는 경우(Entry 8-10) 좀 더 증가된 SO2 흡수량을 보여준다. 염소, 브롬, 그리고 요오드 음이온을 갖는 이온성액체를 이용하여 SO2 흡수실험을 수행한 결과 할로겐의 종류에는 크게 상관없이 이온성액체 몰당 약 2 mol 정도의 SO2 흡수량을 보여주었다. 또한 할라이드계 음이온을 갖는 이온성액체와 SO2와의 상호작용을 이해하기 위하여 최적구조를 계산해본 결과 할라이드가 이미다졸의 C2-H와 SO2 사이에 위치 한 구조가 가장 낮은 에너지를 갖는 것으로 나타났다[17].
특정한 작용기를 갖지 않는 이온성액체를 이용하여 SO2를 흡수한 후 다시 SO2와 이온성 액체를 분리하는 과정은 가역적으로 일어난다. Figure 5에는 [BMIm]Cl 이온성액체를 이용하여 SO2의 흡수/탈기를 반복한 결과가 나타나 있다[17]. SO2의 흡수는 50 ℃에서 수행하였고 탈기의 경우 140 ℃에서 질소로 퍼지함으로써 SO2를 회수하였다. 세번의 흡수/탈기 실험 동안 이온성액체의 구조변화나 흡수량의 변화는 관찰되지 않는다. 그러나 질소를 사용하여 이온성액체와 SO2를 분리하는 경우 순수한 SO2를 얻기 위해서는 다시 질소와 SO2를 분리해야 하는 문제점을 갖고 있다. 또한 최적의 탈기 온도는 아니지만 상당히 높은 140 ℃에서 SO2가 분리된다는 단점을 갖고 있다.
이온성 액체가 갖는 가장 큰 특징 중 하나는 양이온과 음이온의 구조를 바꾸거나 작용기를 도입함으로써 특정한 목적에
맞는 구조를 설계할 수 있다는 것이다. 이를 TSILs (Task Specific Ionic Liquids)라고 명명하고 실제로 상당히 많은 용도에 대하여 그에 맞는 이온성액체가 설계되고 제시되어 있다. SO2의 흡수를 목적으로 한 TSILs도 다양한 구조가 제시되어 있고 이에 관하여 살펴보고자 한다.
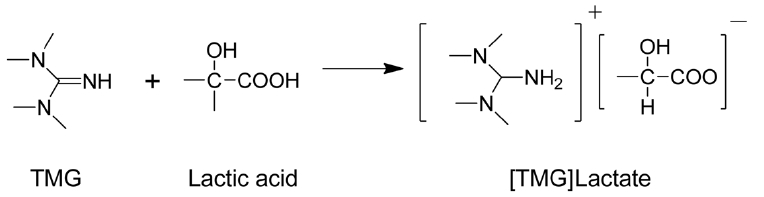
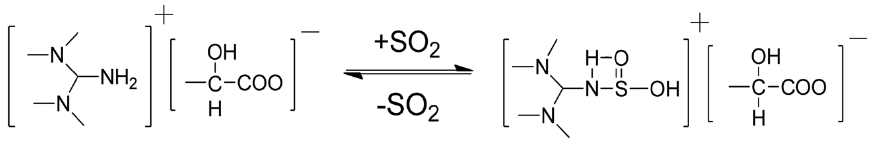
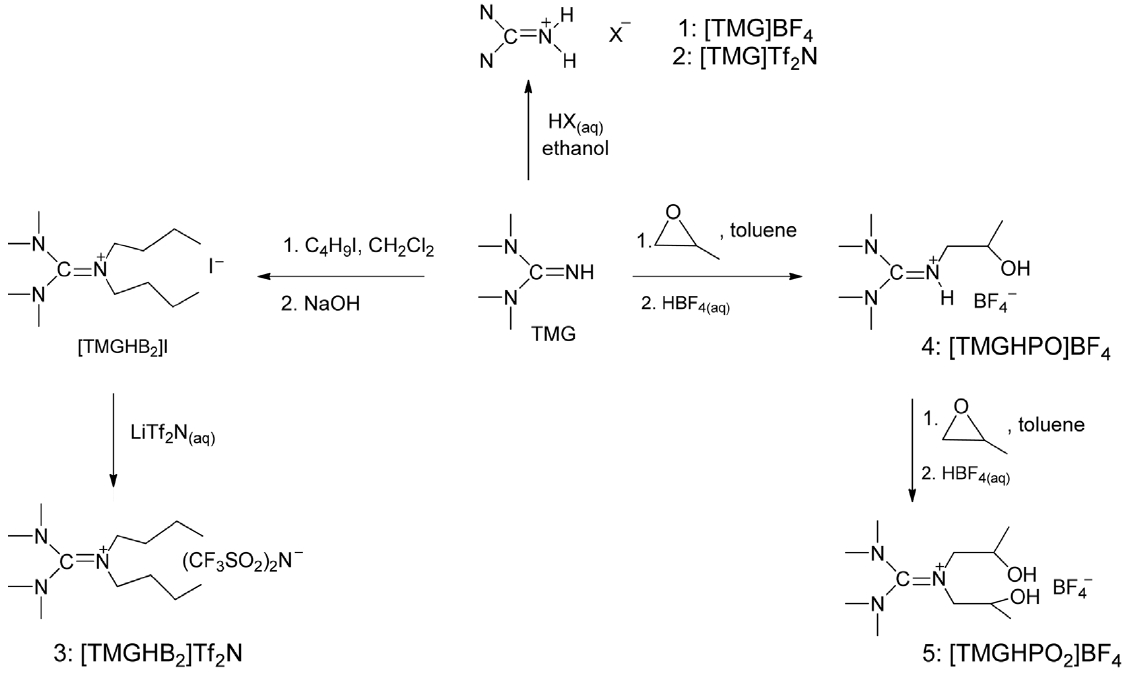
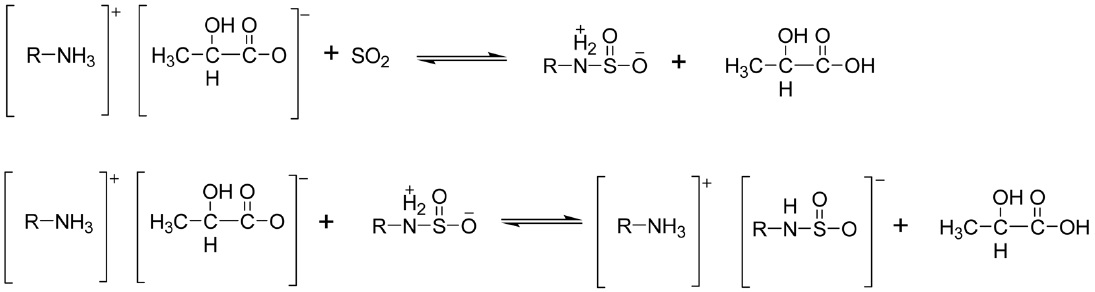
Tetramethyl Guanidine (TMG)을 lactic acid와 섞으면 Scheme 111과 같은 산염기 반응을 통하여 이온성 액체 [TGM]Lactate가 형성된다. 여기에 SO2 가스를 주입시키면 Scheme 112와 같은 반응을 통하여 이온성 액체에 SO2가 고정된 화합물이 형성된다 [18]. 따라서 SO2 흡수량은 40 ℃에서 이온성 액체 1 몰당 거의 1 몰인 0.978 몰로 한정되고 흡수속도는 약 2시간이 지나야 완결되는 양상을 보인다. 이와 같이 낮은 흡수속도는 이온성액체와 SO2간의 화학결합의 형성으로 인하여 용액 전체의 점도가 증가하기 때문이라고 설명할 수 있다.
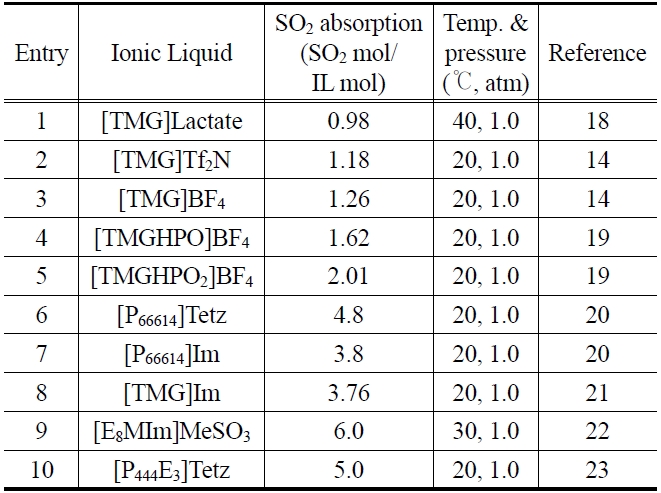
[TGM]Lactate를 이용한 SO2 흡수 연구는 작용기를 갖는 이온성액체를 SO2의 분리에 활용한 거의 최초의 예로 의의가 크다. 그러나 다른 논문에서 지적된 것처럼 [TGM]Lactate 이온성액체의 열적으로 낮은 안정성 및 흡수된 SO2가 모두 재생되지 않는다는 단점을 갖고 있다. 이러한 점을 개선하기 위하여 lactate 음이온을 비배위성 음이온인 BF4나 Tf2N으로 바꾸거나 guanidinium 양이온의 수소를 알킬그룹으로 바꾼 이온성액체를 활용하여 SO2의 흡수액으로 활용한 결과가 발표되어 있다 [14,19]. Table 2에 나타낸 것처럼 음이온을 lactate에서 Tf2N으로 바꾸어 주는 경우 SO2 흡수량은 이온성 액체 몰 당 약 1.2 몰의 SO2 흡수능을 보여준다. 그러나 lactate 음이온과는 달리 SO2의 흡수에 의한 이온성액체의 점도가 증가하지 않을 뿐만 아니라 IR이나 NMR에서 guanidinium과 SO2간의 화학적 결합이 관찰되지 않는다. 이러한 이유는 음이온의 짝산의 산도와 관계가 있다[24]. 즉 lactic acid와 같은 약산의 경우(pKa = 4) Scheme 111과 같은 구조의 이온성액체를 형성하여도 SO2와 같은 강산(H2SO3 pKa = 1.8)이 들어오는 경우 역반응이 일어나고 결과적으로 Scheme 112와 같이 guanidine과 SO2간의 결합이 형성
[Table 2.] SO2 solubilties in TSILs.
SO2 solubilties in TSILs.
된다. 그러나 Tf2N이나 BF4의 짝산의 경우 그 산도가 SO2보다 훨씬 크기 때문에 Scheme 111의 역반응이 일어나지 않고 결과적으로 Tf2N와 BF4 음이온을 갖는 아민계 이온성액체는 물리적인 방법으로만 SO2를 흡수한다. 그리고 그 결과 흡수된 SO2가 140 ℃에서 완전히 탈착되어 흡수액의 온도에 따른 가역적인 흡탈착이 가능하다.
Guanidinium에 알킬그룹을 치환하여 Scheme 113에 보여지는 여러가지 구조의 이온성액체를 합성한 후 이를 SO2 흡수에 이용한 경우도 알려져 있다[19]. 부틸기가 치환된 [TMGHB2] Tf2N과 2-하이드록시 프로필기가 치환된 [TMGHPO2]BF4 모두 20 ℃에서 이온성액체 1 몰당 2 몰의 SO2를 흡수한다고 알려져 있다. 이때 [TMGHB2]Tf2N은 흡수된 SO2가 140 ℃, 0.1 mbar의 감압조건에서 30분 내에 탈착이 완료되는데 비하여 [TMG HPO2]BF4의 경우 동일한 조건에서 10~15%의 SO2가 탈착되지 않고 잔존하는 현상을 보여주었다. 이러한 결과는 [TMGHPO2] BF4 내의 -OH 기가 SO2와 상당히 강한 화학적인 결합을 형성하는 것을 의미한다.
[TMG]Latate와 유사한 구조로 다양한 구조의 trialkylammonium lactate를 SO2 흡수제로 사용한 경우에 대해서도 알려져 있
는데[17,24,25] 모두 암모늄 양이온과 SO2 간의 화학적 결합이 형성되므로 그 흡수량은 이온성액체 1 몰당 SO2가 1 몰 정도로 알려져 있다. 그러나 최근 연구결과에 따르면 아민계 혹은 guanidinium계 이온성 액체계 흡수제는 Scheme 114와 같은 반응을 통해 0.5 몰의 SO2만을 화학적으로 흡수하는 것으로 판명되어 나머지 0.5 몰은 물리흡수에 의해 일어나는 것으로 추측하고 있다[24].
3.2. SO2-Binding organic liquids (SO2BOLs)
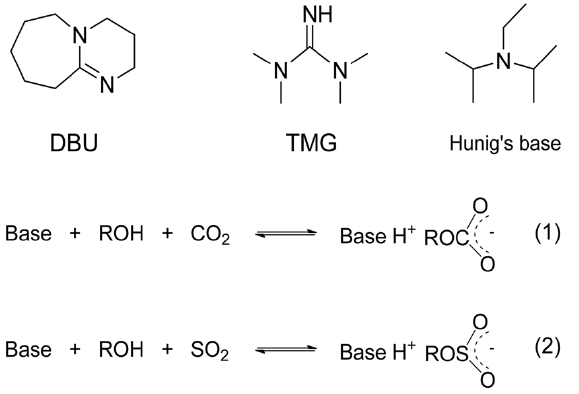
2005년 캐나다 Queens Univ.의 Jesseop 그룹은 Figure 6의 DBU (1,8-diazabicylo-[5.4.0]-undec-7-ene)와 같은 구조의 아민 화합물이 알코올의 존재하에 CO2와 반응하여 반응식 (1)과 같은 이온성액체의 구조를 띤다는 사실을 발표하였다[26]. 이러한 산성가스 흡수액의 특징은 염기와 알코올만으로 존재할 경우 유기용매에 녹는 비극성의 성질이 강하지만 CO2와 반응하여 생성된 이온화합물은 유기용매에 녹지 않는 특징을 갖는다는 것이다. 또한 생성된 이온성액체 화합물은 질소 퍼지 등으로 쉽게 역반응이 일어나고 결과적으로 가역적인 CO2 흡수액
으로 작용할 수 있어 CO2BOLs (CO2-Binding Organic Liquids) 로 명명되었다. CO2와 유사하지만 더 친핵성 성격이 큰 SO2의 경우에도 반응식 (2)와 같은 작용을 통하여 SO2를 흡수할 수 있다[27]. 그러므로 CO2BOLs과 유사하게 SO2를 잘 잡는 염기물의 경우 SO2BOLs로 불리울 수 있다. 그러나 SO2 화합물의
경우 O-S 결합이 너무 강하여 역반응이 잘 일어나지 않는다. 즉 SO2를 흡수한 용액을 140 ℃로 가열하였을 때 DBU의 경우 흡수된 SO2의 반 정도만 탈기가 되고 Hunig’s base의 경우 85 %의 SO2만 탈기된다고 보고되어 있다.
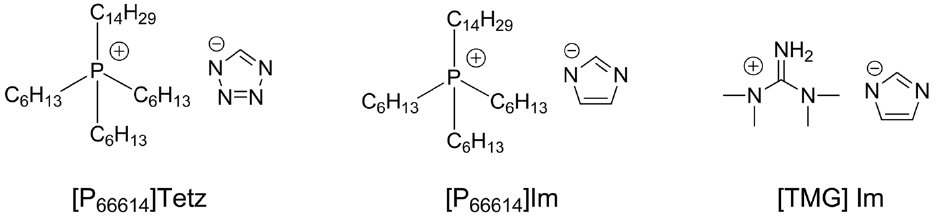
이미다졸(imdiazole)이나 테트라졸(tetrazole)은 pKa가 14.4 와 4.9로 비교적 음이온이 안정한 형태이고 따라서 Figure 7과 같은 구조의 이온성액체를 형성할 수 있다[20,21]. 이러한 이온성액체를 이용하여 SO2 흡수에 활용해 본 결과 이온성액체 1 몰당 테트라졸계의 경우 4.8 몰 그리고 이미다졸계의 경우 3.8 몰의 SO2를 흡수하는것으로 측정되었고, 특히 테트라졸계 흡수액은 20 ℃와 80 ℃에서 가역적인 흡탈착이 가능한 것으로 나타났다(Figure 8). 이와 같이 SO2에 대하여 기존에 알려진 물질보다 높은 SO2 흡수 성능을 보여주는 이유는 음이온 내 존재하는 여러 개의 아민이 각각 SO2와 상호작용을 할 수 있기 때문으로 설명한다. 유사하게 guanidinium 양이온에 이미다졸 음이온으로 이루어진 이온성액체([TMG]Im)의 경우에도 20 ℃에서 몰당 약 4.1 몰의 이온성액체를 흡수한다고 보고되어 있다[21].
양이온에 에테르 그룹이 치환된 이온성액체 역시 SO2 흡수에
매우 우수한 성능을 보여준다고 알려져 있다. 다양한 수의 에테르가 포함되어 있는 이온성액체를 이용하여 SO2 흡수 실험을 수행해 본 결과 Figure 9와 같이 치환된 에테르의 길이가 증가 할수록 SO2 흡수량 또한 증가하는 것으로 나타났다[22]. SO2 1 bar를 기준으로 에틸렌 옥사이드(ethylene oxide)의 개수가 1개일 때 약 이온성액체 1 몰당 약 3 몰의 SO2를 흡수하는 능력을 보여주었고 에틸렌 옥사이드 개수가 8개일 때 6 몰의 SO2를 흡수하는 성능을 보여주었다. 컴퓨터를 이용하여 에테르 그룹을 갖는 이온성액체와 SO2 간의 상호작용을 살펴본 결과 에틸렌 옥사이드의 단위 개수가 증가할수록 이온성액체와 SO2 간의 상호작용 엔탈피(interaction enthalpy)가 에틸렌옥사이드 단위당 약 4 kcal/mol로 증가하였고, 또한 에테르쪽 뿐만 아니라 음이온인 메탄술포네이트(CH3SO3-)도 약 두 분자의 SO2와 상호작용을 통하여 SO2의 흡수에 기여하는 것으로 계산되었다.
Figure 10에서는 [EnMIm]MeSO3와 [TMG]Latate의 반복적인 SO2 흡수탈기 실험결과를 도시하였다. 그림에서 볼 수 있듯이 E1과 E3의 경우 5회의 연속적인 흡수/탈기실험결과 SO2 흡수량의 변화가 없는데 비하여 [TMG]Lactate의 경우 흡수/탈기가 진
행될수록 그 흡수량이 감소하는 것을 관찰할 수 있다.
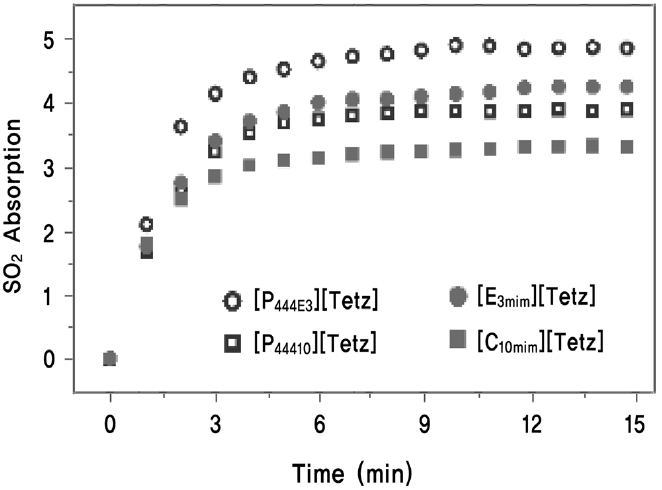
최근 에테르 그룹이 치환된 양이온과 아졸계 음이온으로 이루어진 이온성액체를 합성하고 이의 SO2 흡수량을 에테르그룹이 없는 아졸계 이온성액체의 흡수량과 비교한 연구결과가 발표되었다(Figure 11, 12)[23]. 앞선 연구결과에 의하면 양이온의 에테르 그룹과 음이온의 테트라졸 그룹이 동시에 SO2를 흡수할 수 있으므로 한가지 작용기만을 갖고 있는 이온성액체에 비하여 훨씬 더 증가한 SO2 흡수능을 기대할 수 있다. 그러나 실제로 측정된 값은 [P444E3]Tetz의 경우 SO2 1 bar, 20 ℃에서 이온성 액체 1 몰당 5 몰로 한가지 작용기만 갖고 있는 경우에 비하여 크게 증가했다고 할 수 없다(Figure 12).
지금까지 SO2 흡수제로서 개발된 다양한 이온성액체계 화합물을 살펴보았다. 작용기가 존재하지 않는 이온성 액체로부
터 시작하여 다양한 종류의 양이온 및 음이온 그리고 특정한 구조의 작용기의 개발을 통해 SO2 흡수능을 이온성액체 몰 당 최고 6몰까지 증가시킬 수 있었다. 그러나 실제로 배가스 내에 존재하는 SO2를 선택적으로 포집하는데 이와 같은 이온성액체를 실제로 사용하기에는 아직 많은 문제를 해결해야 할 필요가 있다. 예를 들면 배가스 중 매우 적은 부분만 차지하고 있는 SO2를 어떻게 선택적으로 분리할 것인지, 탈기 시 질소를 사용 하지 않으면서 최소의 에너지를 사용하여 SO2를 어떻게 회수 할지 등등 많은 과제가 남아있다. 물론 이온성액체 개발 이전에도 탈황을 위한 많은 촉매 및 공정들이 개발되어 왔고 현재에도 더 훌륭한 재료 및 시스템의 개발을 위해 다양한 각도에서 연구가 진행되고 있다. 그럼에도 우리가 이온성액체에 주목해야 하는 이유는 새로움에 대한 가능성 때문이다. 본 총설에서는 SO2 흡수를 위한 다른 다양한 접근들, 예를 들면 SO2 흡수 장치와 관련된 시스템적 접근 혹은 SO2 용해 자체의 물리화학적 해석 등을 다루지 않고 오직 흡수액 구조에 대한 SO2 흡수 변화량에만 집중하였다. 그 이유는 기존의 한계를 뛰어넘을 수 있는 원천기술은 새로운 물질의 개발에서 시작되기 때문이다. 이러한 관점에서 다른 화학물질에 비하여 비교적 최근 알려졌을 뿐만 아니라 그 자체에 무궁한 구조다양성을 갖고 있는 이온성액체가 향후 지구온난화 등의 문제에 어떠한 해결책을 줄 수 있을지 아직은 예측하기 어렵지만 그 새로움에 많은 기대를 건다.
![Available temperature range of ionic liquids[16].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f002.jpg)
![Various gas solubility in ionic liquid at 25 ℃[9].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f003.jpg)
![Structure of sulfur dioxide[13].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f004.jpg)
![SO2 absorption and desorption cycles in [BMIm]Cl; SO2 absorption in SO2 stream of 20 mL/min at 50 ℃ and SO2 desorption in N2 stream of 10 ml/min at 140 ℃[17].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f005.jpg)
![Reversible absorption/desorption process for azole-based ILs. SO2 absorption was carried out at 20 ℃, and desorption was performed at 80 ℃ under N2. [P66614]Tetz: absorption ■; desorption □; For [P66614]Im: absorption, ●; desorption, ○[20].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f008.jpg)
![Stuctures of [EnMIm]MeSO4 and their SO2 solubilities with a pressure at 30 ℃: (■) E0, (▲) E1, (▲) E2, (△) E3, (□) E8, (▽) [TMG]Latate, and (◇) TEGDME[22].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f009.jpg)
![SO2 absorption-desorption cycles of E1 (▲), E3 (○), and [TMG]Lactate (▽). In each cycle, SO2 is absorbed at 30 ℃ and at atmospheric pressure, and desorbed at 100 ℃ [22].](http://oak.go.kr/repository/journal/11707/CJGSB2_2012_v18n1_22_f010.jpg)