PCB에칭에 의해 발생한 염화철 폐식각액 중 염화철을 산화시키고 구리를 석출시키는 전기화학적 재생공정은 환경오염을 줄이면서도 부산물을 얻어내어 경제성이 크다. 그러나, 염화철 폐식각액은 철과 구리, 두 가지 금속이 함께 함유되어 있기 때문에 전해조에서 일어나는 반응이 복잡하다. 본 연구에서는 회분식 공정을 통하여 전기화학적인 염화철 산화 및 구리 석출반응의 특성을 조사하고 관련된 공정변수들의 최적 조건을 도출해내었다. 염화철의 산화는 항상 원하는 수준으로 되었으며, 탄소 음전극을 사용한 반응에서 350 mA/cm2의 전류밀도와 12 g/L의 구리 농도 조건에서, Fe2+이온의 비율이 높을수록 구리 석출 효율이 높았다. 또한, 도출해낸 최적 조건을 바탕으로 Bench 장치 연속운전을 통해서 scale-up 가능성을 확인하였다.
금속의 채취, 정련, 도금, 식각 등의 표면처리 과정에서 나오는 폐액은 용액 중에 인체에 해로운 금속이온들을 다량 함유하고 있기 때문에, 이를 처리하기 위한 연구가 지속적으로 진행되어 왔다. 일반적으로 금속 이온을 함유한 폐액의 처리는 희석, 침전 및 산화-환원 등의 화학적 방법이 널리 사용되어 왔다[1]. 그러나 화학적 재생 방법은 막대한 양의 화학적 중화제 및 산화-환원제의 사용과 함께 생성되는 슬러지의 처리라는 또 다른 문제점을 지니고 있다[2]. 따라서 폐액의 재생과 함유된 금속의 회수를 통하여 자원을 재활용하면서도 환경오염을 최소화하는 방법으로서 전기화학적 재생 방법이 각광받고 있다[3]. 여러 가지 공정에 의해 발생하는 다량의 폐액
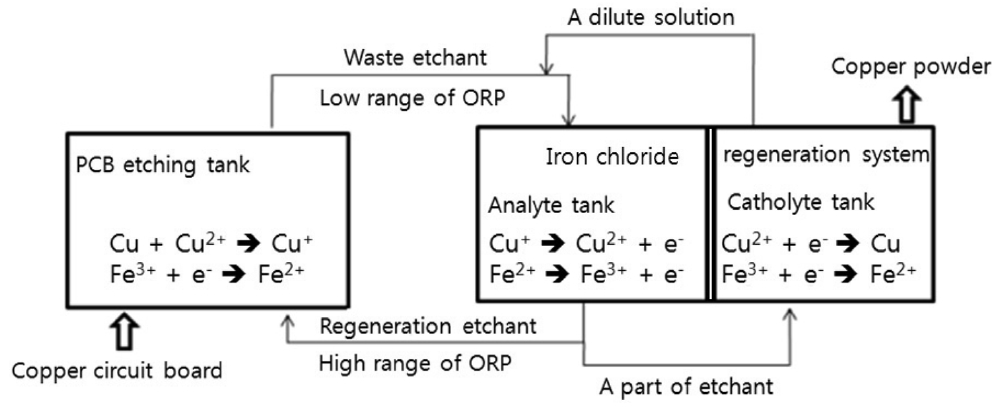
들 특히 PCB 염화동 폐식각액의 경우, 전기화학적 산화-환원 처리방법이, 첨가제 없이 식각용액을 연속적으로 재사용하면서 식각공정에서 용출된 구리이온을 환원시켜 금속형태의 구리로 회수할 수 있는 장점 때문에 널리 활용되고 있다.
염화철 폐식각액의 경우, 전기 화학적 재생은 Figure 1에서 보듯이 전기에 의해 양극에서 철 2가 이온의 산화에 의해 가진 철 3가 이온을 생성시키고, 음극에서는 구리 이온을 환원시켜 전극에 석출시키면서 염화철 폐액 중의 구리함량을 감소시킴으로써 달성된다. 염화동 폐식각액의 전기화학적 재생 공정에서는 구리 이온의 농도만 제어하면 되므로 공정운전이 수월하지만, 염화철 폐액에서는 구리 이온 및 철 이온이 공존하기 때문에 각 이온들 간의 간섭 현상까지도 제어가 필요한 어려움을 수반하고 있다. 이러한 공정에 대해 Hillis[4]와 Adaikkalam, et al.[5]가 연구하여 각각 발표한 바 있으나, 이들 결과는 고농도의 폐액을 회분식으로 재생하는 공정들로서 석출 효율이 낮으며 재생에 소요되는 시간이 길고 운전이 복잡하다는 단점을 가지고 있었다. 그리고 저 전류밀도 조건에서 반응을 진행하여 구리가 낮은 입도로 회수되어 후처리 공정에서 여과시간이 길어지는 문제점을 수반하고 있었다.
따라서 본 연구에서는 염화철 폐식각액의 전기화학적 재생 공정에서 재생 시간의 단축 및 구리 석출 효율의 증진, 그리고 고밀도 구리의 석출을 위한 최적 운전 방법을 찾아내기 위한 실험을 진행하였고, 공정 변수의 최적조건을 실험실 규모의 회분식 전해조에서 조사하였다. 특히, 구리 이온의 농도와 철 이온의 조성에 따라서 재생에 걸리는 시간 및 회수되는 구리의 양이 차이가 크기 때문에 이들을 적절히 제어하면서 구리 수율을 높여보고자 하였다. 이러한 결과를 토대로 구리를 회수하고 재생된 폐액을 PCB 공정의 식각 액으로 사용하는 연속식 전해 공정의 가능성을 조사하였다.
본 연구에서 사용된 용액은 K사에서 얻어진 염화철 폐식각액을 분석하여 비슷한 조건의 폐액을 제조하여 사용하였다. 이는 매번 동일한 조성의 폐식각액을 얻기 어렵고, 보관시 공기에 의한 폐식각액의 산화가 계속 진행되므로 필요한 때마다 동일한 농도로 제조하여 사용하였다. 염화철 폐식각액의 ICP 분석 결과 62.2 g/L의 구리이온 농도와 121.8 g/L의 철 이온 농도를 지니고 있는 것을 확인하였다. 또한, 염화철 폐식각액의 HCl 농도는 0.5 N으로 측정되었다. 따라서 양극전해질로는 35% HCl을 0.5 N로 희석하고, 1 L 부피의 희석된 HCl에 염화 제1구리(CuCl). 염화 제2구리(CuCl2), 염화 제1철(FeCl2), 염화 제2철(FeCl3) 분말을 사용하여 Cu2+ 36 g/L, Cu+ 24 g/L, Fe3+ 100 g/L, Fe2+ 20 g/L 농도를 지니는 실험 용액을 제조하여 사용하였다. 음극전해질은 양극전해질과 마찬가지로 35% HCl을 0.5 N으로 희석하고, 1 L 부피의 희석된 HCl에 염화 제1구리(CuCl), 염화 제2구리(CuCl2), 염화 제1철(FeCl2), 염화 제2철(FeCl3) 분말을 사용하여 Cu2+ 12 g/L, Fe2+ 80 g/L 농도의 기본 용액을 제조하여 사용하였고, 여러 가지 공정 변수에 따라 변화하는 경우는 해당화합물을 가감하여 제조 사용하였다.
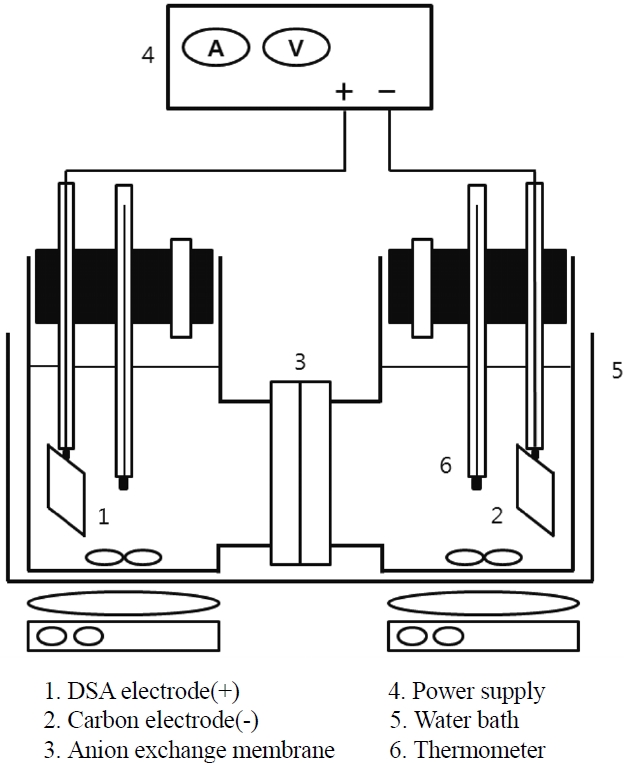
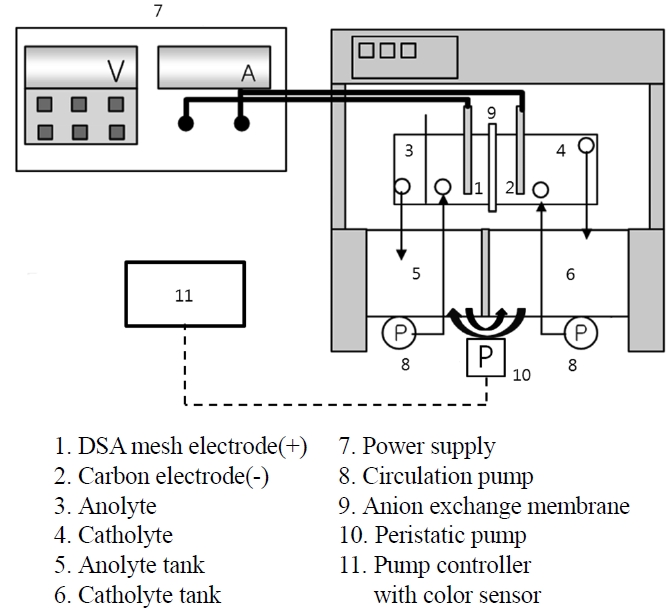
본 연구에 사용된 전기화학적 재생 장치는 Figure 2에 도시하였다. 주요 구성부는 반응 셀, 전원공급장치, 마그네틱 교반기이다. 반응조는 용량이 1 L인 H-cell이고 실험 상태를 관찰하기 위해 투명유리재질로 만들었으며, 반응기 위를 실리콘 재질의 뚜껑으로 막아두었다. 뚜껑에는 구멍을 뚫어서 전극지지대 및 온도 센서, 유리 재질의 냉각용 관을 설치하였고 음이온 교환막으로는 IONAC MC-3475 (LANXESS, Germany) 및 AFN, AMX, ACS (Aspon, Japan)를 사용하여 양극실과 음극실을 분리하였다. 반응에 필요한 전원공급은 (주)갑진에서 만든 전원공급장치로 전압(0~30 V), 전류(0~35 A)까지 조절할 수 있는 제품을 사용하였다. 또한, 실험에 사용된 양극판은 티타늄 판에 IrO2 코팅을 한 DSA 전극이었으며, 음극판은 카본 전극을 이용하였고, 사용된 전극의 면적은 20 cm2이었다. 온도는 Pt100 (Teflon tube)센서와 전송기(TZ4W, Autonics)를 사용하여 측정하였다.
전해 실험을 위하여 음이온 교환막으로 격리된 반응 셀에 각각 전극을 삽입하고 양극액과 음극액을 투입한 후 각각의 액은 마그네틱 교반기를 이용해 교반시켰다. 전원공급장치를 이용하
여 일정한 전류를 반응 셀의 전극으로 통과시켰다. 반응은 주로 회분식으로 진행하였으나, 연속식으로 반응할 경우에는 음극액 중 구리 농도를 일정하게 유지시키기 위하여 양극액과 음극액을 일정한 유속으로 순환시키기도 하였다.
음극액 중의 구리 및 철의 농도는 중요한 공정 변수이기 때문에 실험 전후 및 도중 이들의 농도를 측정하였다. 구리 및 철의 농도 분석 장치로는 휴대용 분광계(X100, C-Mac)를 사용하였는데, 구리 농도 측정에는 Bichinchoninate 방법을, 철 농도 측정에는 1,10-Phenanthroline-10 방법을 적용하였다[6].
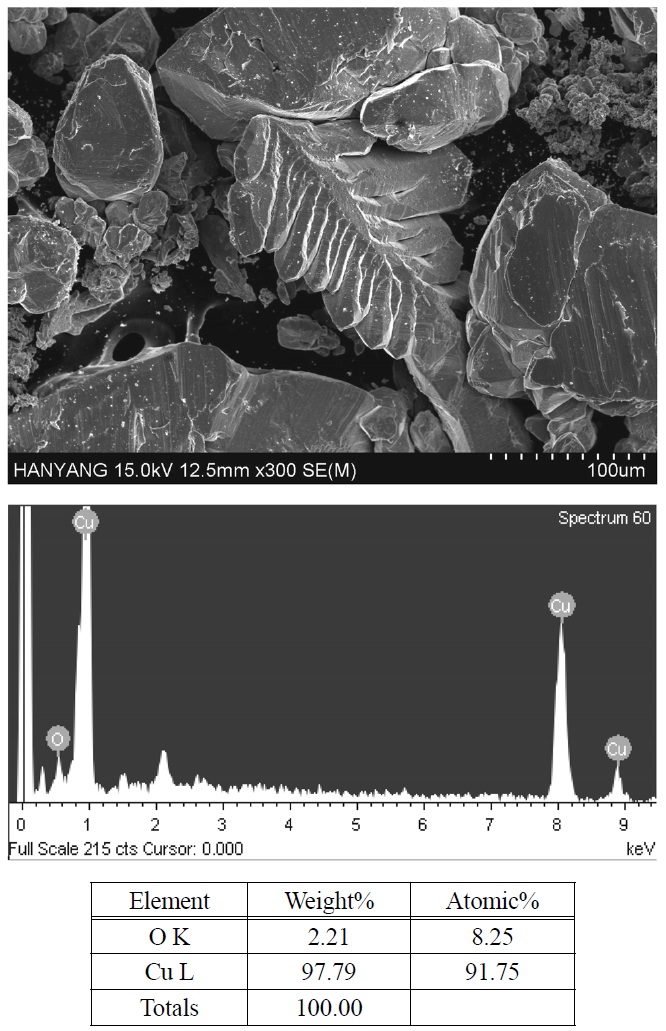
석출된 구리의 형상 및 순도 분석은 SEM EDAX (Hitachi-S4800)로 분석하였다. 반응 후에 석출되는 구리를 증류수를 사용하여 2~3회 정도 충분히 씻은 뒤 감압 여과하여 액을 제거하고 오븐에서 24시간을 건조하여 석출량을 측정한 후, 샘플을 채취하고 이를 분석하였다.
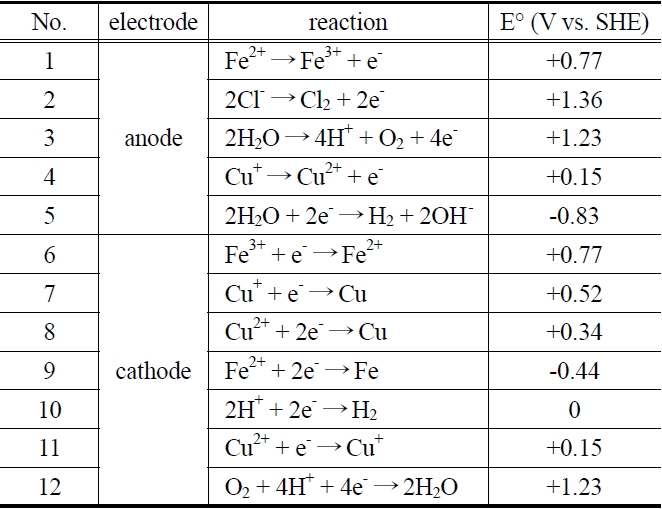
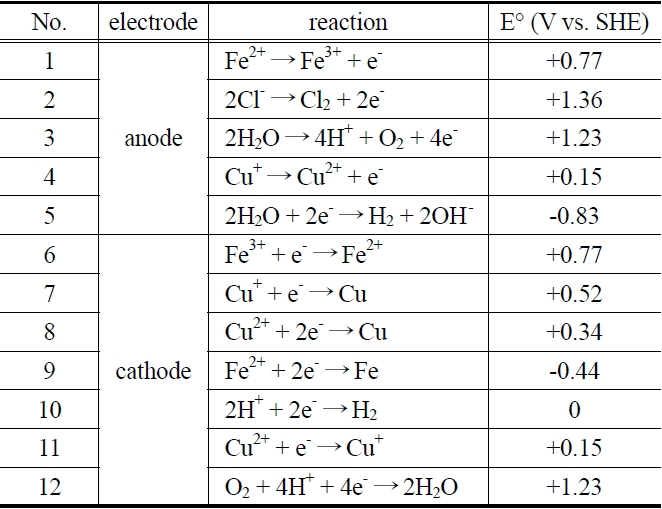
전해 반응조에서 일어나는 기본 반응식은 Table 1과 같다. 전해조의 양극에서는 반응 (1)의 철 이온의 산화반응 및 반응 (4)의 구리 이온의 산화반응이 나타나며, 용액 중의 염소이온 존재에 따른 (2), (3), (5)의 부반응도 함께 수반하게 된다. 음극에서는 철 이온의 환원전위가 구리 이온의 환원전위보다 높은 특성으로 인하여 (6)의 철 이온의 환원반응이 우선적으로 일어
[Table 1.] Possible oxidation-reduction reactions on electrodes
Possible oxidation-reduction reactions on electrodes
나게 되고, Fe2+이온으로 충분히 환원이 이루어지면 (7), (8), (11)의 구리 이온의 환원반응이 진행된다. 또한, (10)의 수소발생으로 pH가 증가하지만 용액 중에 녹아있던 산소도 환원되어 (12)와 같은 부반응이 발생하여 용액의 pH는 일정하게 유지된다. 이러한 부반응들은 양극과 음극에서의 전류효율을 감소시킴과 동시에 전극의 안정성에 커다란 영향을 주는 주된 요인으로 작용하게 된다[7].
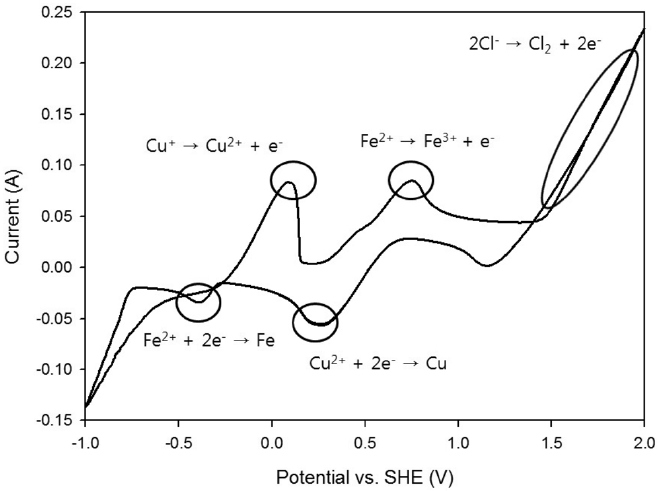
Figure 3은 CV (Cyclic Voltammetry)로 염화철 폐액과 동일한 조성액(Cu2+ 60 g/L, Fe2+ 100 g/L)에 대한 분석 결과이다. Reference electrode로 Ag/AgCl (+0.197 V Vs SHE)을 사용하였지만 분석 전에 보정을 하였기 때문에 기준 전극이 SHE (Saturated Hydrogen Electrode, 0 V)일 때와 동일한 값을 나타낸다. 분석 결과 Table 1에 있는 Eo값과 거의 일치하는 곳에서 피크들이 나타났다. +0.15 V에서 구리의 산화 피크가 나타났고, +0.34 V에서 구리가 환원되어 석출되는 피크가 나타났다. 또한, +0.77 V에서 철의 산화 피크가 나타났고, +1.5 V 이상에서는 염소가스가 발생하는 피크를 나타났다. 그 외에 -0.44 V에서 철의 환원 피크가 미약하게 관찰되었으며, 이러한 결과는 Belobaba, et al.[8] 등의 연구 결과와 유사하였다.
회분식 운전은 음이온 교환막에 의해 분리된 양극액과 음극액에서 외부의 유입 및 유출이 전혀 없는 상태로 진행하였는데, 전기가 공급되면 양극액과 음극액에 있는 각각의 전극의 layer에서 산화 및 환원 반응이 진행되어, 염화철 폐식각액의 재생 및 구리의 석출이 이루어졌다. 이 때 구리의 석출량으로부터 다음 식에 의해 전류효율을 계산하였다.
위에서 기술된 기본 반응식을 토대로, 예비실험에서 비교적 높은 전류효율을 주었던 반응조건(Catholyte Cu2+ 12 g/L, Fe2+ 80 g/L, Anolyte Cu2+ 36 g/L, Cu+ 24 g/L, Fe3+ 100 g/L, Fe2+ 20 g/L, HCl 0.5 N, Cutrrent density 350 mA/cm2, Anode electrode DSA, Cathode electrode Carbon, Space of electrode 15 cm)을 중심으로 각 변수를 적절히 변화시키면서 반응 특성을 조사하였다. 특히 음극실 내의 구리 농도는, 폐액을 그대로 음극액으로 사용했던 이전의 연구자들과 달리 저농도를 사용하여 구리석출효율을 높이도록 하였다.
이러한 조건에서 구리가 60~90%의 전류효율로 회수되었고, 구리는 분말 상태로 얻어졌다. 석출된 구리를 SEM EDAX 분석 시 Figure 4에서 보듯이 dendrite 형상의 순도 90% 이상의 고순도 구리가 석출되며, 철은 함유되지 않았음을 알 수 있었다. 또한, 산소는 건조 시 구리가 산화되어 포함된 것으로 사료된다. 반응 공정의 진행 결과 염화철(II)의 산화반응은 회수되는 구리의 양에 상관없이 거의 무관하게 잘 진행되었으므로, 본 연구에서는 회분식 운전의 최적 조건을 찾기 위해서 최대 구리 회수율을 보이는 시점을 찾는데 주력하였다.
3.2.1. 음이온 교환막의 종류에 따른 영향
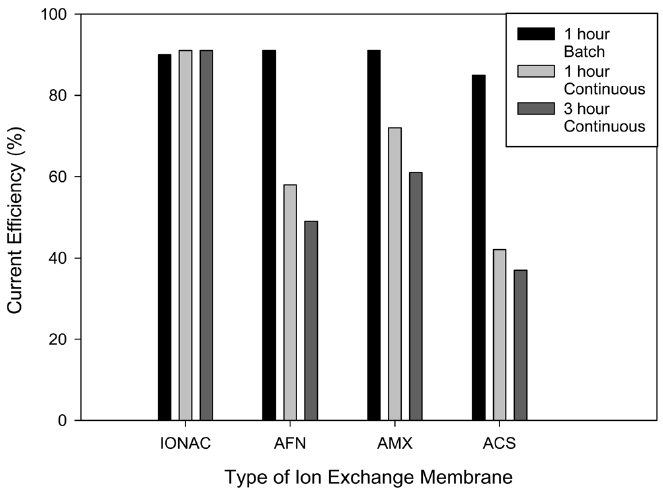
음이온 교환막은 이온은 이동하면서도 반응조의 물질들은 분리시켜주는 중요한 역할을 한다. 여기서 주목할 점은 음이온 교환막에 존재하는 기공을 통해서 이동하는 이온의 자유 이동도 및 막의 내구성이 중요한 인자로 작용한다. 이러한 이유 때문에 음이온 교환막의 선정 과정에서 IONAC MC-3475, AFN, AMX, ACS의 4종류 음이온 교환막을 회분식과 연속식 실험을 통해 구리 석출 효율을 비교하였다. AFN, AMX, ACS 막은 IONAC 막과 비교하였을 때, 육안으로 보기에 얇았고, 항상 0.5 N NaCl 용액에 보관해야 했다. 실험 결과는 Figure 5에 나타나듯이 1시간 회분식 반응에서 90% 정도 수준으로 거의 효율의 차이가 없었으나, 1시간 연속식 반응에서는 AFN, AMX, ACS 막의 효율이 IONAC 막에 비해 현저히 낮았는데, 이들 막을 통하여 교환되는 이온의 양이 적기 때문에 반응의 활성도가 떨어지는 것으로 사료되었다. 3시간 연속식 반응에서 IONAC
막에 비해 AFN, AMX, ACS 막들이 외관상 오염도 심하였고 전류 효율도 낮아서, 막의 오염에 의해 구리 석출 효율이 낮아지게 되는 것으로 사료되었다. 이에 따라 이후의 실험은 IONAC 막을 사용하여 진행하였다.
3.2.2. 음극액의 철 이온에 따른 영향
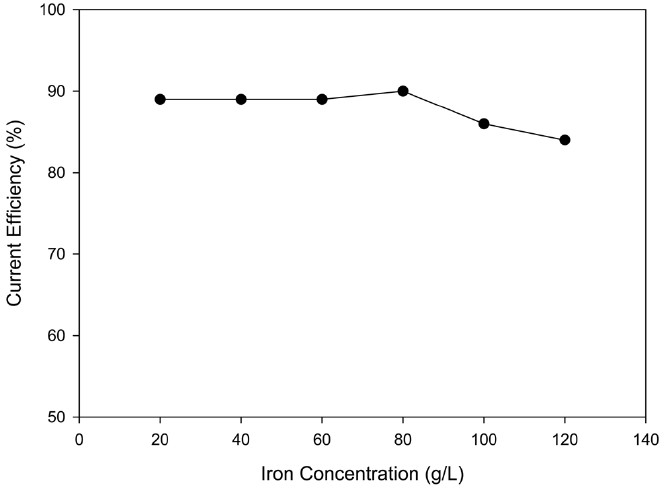
음극액에 녹아있는 철 이온의 농도에 따른 영향을 알아보기 위해 음극액의 철 농도를 Fe2+ 20~120 g/L로 변화시키면서 경향성을 살펴보았다. Figure 6에 보이듯이, Fe2+이온의 농도가 높아지면 높아질수록 육안으로 보이는 음극액의 색은 짙어지지만 구리 석출 효율에는 거의 영향력이 없음을 알 수 있었다. 하지만 80 g/L에서 최고 효율을 보였고, 그 이상이 되면 약간의 감소를 하므로 추후 실험에서는 음극액 Fe2+ 농도를 80 g/L에서 진행하였다.
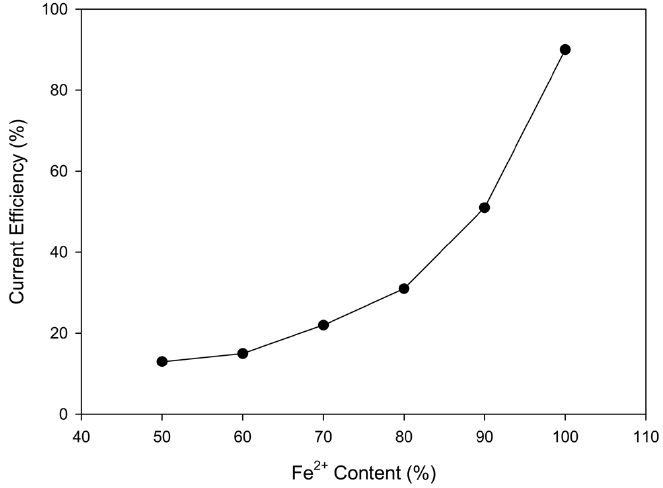
음극액에 녹아있는 철 이온의 비율에 따른 영향을 알아보기 위해 음극액에 존재하는 Fe2+와 Fe3+용액 중 Fe2+의 함량을 변화시키면서 경향성을 살펴보았다. Figure 7에 나타나듯이 Fe2+비율이 높아질수록 구리 석출 효율이 향상되었다. 특히 Fe2+가 100%일 때와 100%가 아닐 때의 효율 차이가 현저함을 알 수 있었는데, 그 이유는 표준 전위차에 의해 음극실 내에
철 이온이 모두 Fe2+로 환원이 된 다음에 구리의 석출이 시작되기 때문으로 사료된다[9].
3.2.3. 전류밀도에 따른 영향
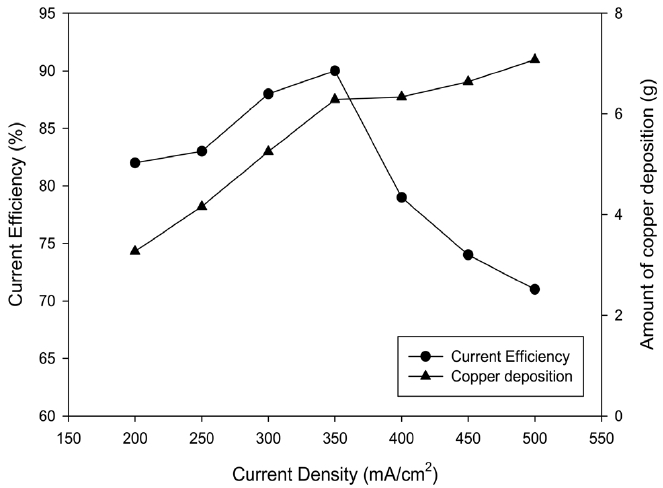
전류밀도에 따른 영향을 알아보기 위해 전류밀도를 200~500 mA/cm2로 변화시키면서 경향성을 살펴보았다. 전류밀도가 높아진다는 것은 같은 크기의 전극에 대해서 단위 면적당 공급되는 전류의 양이 증가함을 의미하기 때문에 당연히 전류밀도가 높아지면서 구리의 석출 양은 직선적으로 증가함을 알 수 있었다. 하지만 Figure 8에 나타나듯이 전류 효율은 석출 양과 같이 직선적인 증가는 나타나지 않았으며 350 mA/cm2에서 최대를 보인 후 감소하는 것을 알 수 있었다. 이는 고전류 밀도 조건이 되면서 구리이온의 물질전달 속도가 상대적으로 떨어지게 되어 구리석출속도가 저하되고 부반응인 수소생성반응이 증대되기 때문으로 사료된다.
3.2.4. 음극액의 구리 이온에 따른 영향
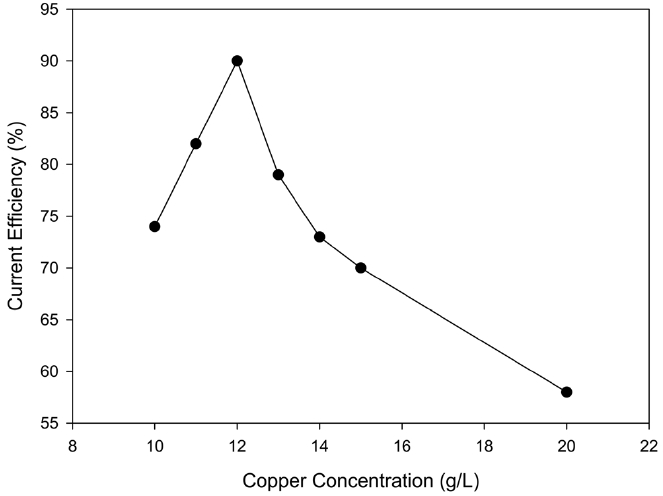
음극액에 녹아있는 구리 이온의 조성에 따른 영향을 알아보기 위해 반응 시작 시 음극액의 Cu2+ 초기농도를 10~20 g/L로 변화시키면서 경향성을 살펴보았다. 1시간 동안의 회분식 반응에서 구리이온의 농도가 구리 석출과 함께 약간 감소하나, 전류효율의 구리이온 농도에의 의존경향성을 조사하는 데는 무리가 없었다. Cu2+의 초기농도를 10~20 g/L로 설정한 이유는 염화동 재생 및 구리 회수 공정에서도 20 g/L 이상의 농도에서는 석출 효율이 현저히 떨어졌기 때문이다[10]. Figure 9에 나타나듯이 구리 초기농도가 증가하면 석출 효율이 직선적으로 증가하다가 12 g/L일 때 최대 효율을 나타내고, 그 이상이 되면 석출 효율이 감소하는 것을 알 수 있었다. 이는 염화동 공정에 대해 보고된 것처럼 농도가 진하면 구리가 재 용출되며, 구리 이온의 농도가 낮을수록 구리의 전착에 대한 수소 발생량이 상대적으로 증가하여 구리 석출에 한계 농도를 가지기 때문으로 사료되었다. 본 연구에서의 구리 석출 한계 농도는
5 g/L로 한계 농도 이하가 되면 수소 기포의 발생량이 극대화되어 더는 구리의 전착이 진행되지 않았다.
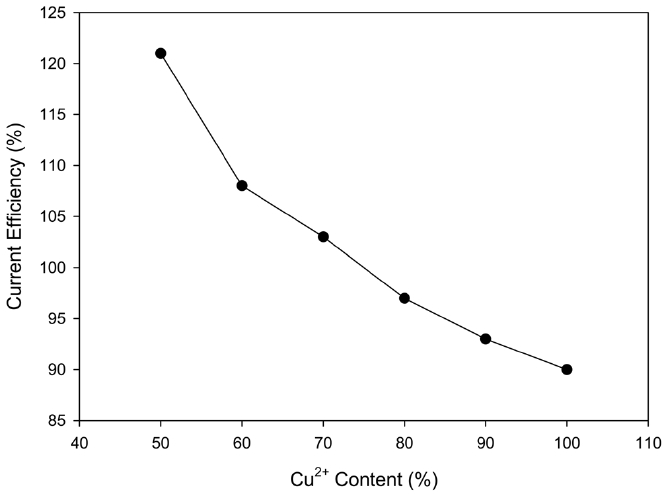
음극액에 녹아있는 구리 이온의 비율에 따른 영향을 알아보기 위해 음극액에 존재하는 Cu+와 Cu2+용액 중 Cu2+의 함량을 변화시키면서 경향성을 살펴보았다. Figure 10에 나타나듯이 Cu+이온의 비율이 높을수록 석출 효율이 높아지는 것을 알 수 있었다. 일정 농도의 HCl 용액에서 Cu의 농도와 pH 사이의 관계는 pH = log(1/[Cu2+/2)식에 의해 정의되는데, Cu+이온의 비율이 높을수록 석출 효율이 높아지는 이유로서, Sneed 등이 설명하였듯이[11], Cu2+ 농도가 증가하면 pH가 증가하게 되어서 음극전해질에서는 전기화학적 석출반응의 경쟁반응인 copper halide 착화합물의 생성 반응이 활성화되어 구리를 용출시키게 되어 Cu2+ 농도 비율이 구리의 석출효율에 큰 영향을 미치기 때문으로 사료되었다. 또한, Cu+와 Cu2+ 혼합용액에 대
한 이온평형의 결과 Cu+ 농도가 증가하면 Cl-이온의 농도가 증가하면서 수소이온의 활동도가 감소하면서 pH가 감소하게 되고, 환원성 분위기가 강해지기 때문에 석출 효율이 증가하는 것으로 보고된 바 있다[12].
3.2.5. 음극액의 HCl 농도에 따른 영향
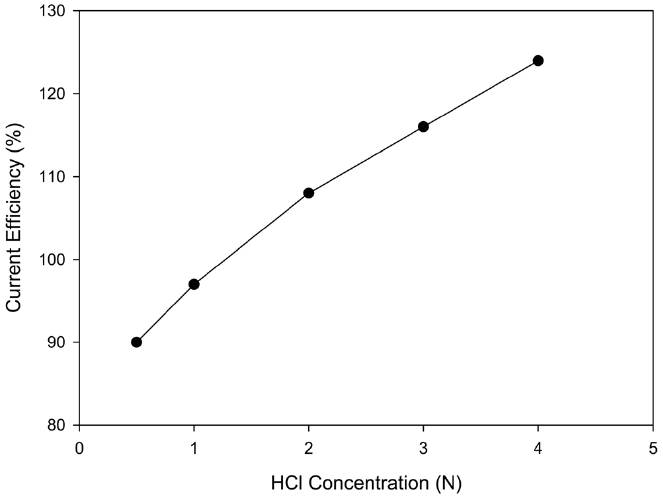
음극액의 HCl 농도에 따른 영향을 알아보기 위해 음극액의 HCl 농도를 0.5~4 N으로 변화시키면서 경향성을 살펴보았다. Figure 11에 나타나듯이 HCl 농도가 증가하면 구리의 석출 효율이 직선적으로 증가하였는데, 이는 HCl 농도가 증가하면 pH가 감소하면서 환원성 분위기가 강해지기 때문에 수소이온의 활동도가 감소하기 때문으로 사료되었다. 또한, 철 및 구리 이온과 만나서 착화합물을 생성하는 Cl-이온이 증가하지만, pH도 같이 감소하기 때문에 착화합물의 생성이 증가하기 보다는 음이온 교환막을 통해서 보다 많은 Cl-이온이 이동을 하게 되는 것으로 보였다. 따라서 구리 석출 효율에도 긍정적인 영향을 주는 것으로 사료되었다.
3.3.1. H-Cell 운전 연구
연속식 운전은 회분식 실험을 통해서 현실적으로 구현 가능한 최대 구리 석출 효율을 나타내는 최적화된 조건에서, 양/음극액을 peristatic pump(선일아이라, MP-3N)를 이용하여 순환시켜 줌으로써 음극실 내 구리 농도를 일정하게 유지하면서 장시간 운전을 실시하여 보았다.
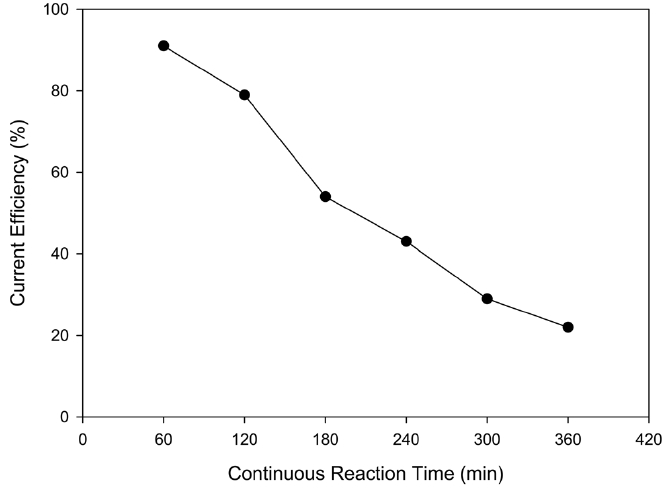
Figure 12를 보면 1시간 반응에서는 동일한 조업 조건에서 회분식과 연속식 운전 결과들이 같은 석출 효율을 나타내는데 이는 연속식 운전을 하더라도 회분식과 동일한 재생 및 구리 회수가 가능함을 보여주는 결과이다. 하지만 반응 시간이 증가하면 할수록 석출 효율이 현저히 감소하는 것을 알 수 있었다. 이는 본 연구를 위해 제조한 반응기는 구조상 석출된 구
리 입자들을 보존할 공간이 협소함은 물론 음이온 교환 막과 전극을 석출된 구리가 가로막기 때문에 반응성이 떨어짐과 동시에 용출도 빠르게 일어났기 때문이다. 또한, 장시간 운전에 따라 H-cell 내의 전체적인 구리 농도가 감소하여 효율이 떨어지는 점도 있었으리라 사료된다. 따라서 연속식 운전의 가능성을 확인하기 위하여 반응기의 구조를 변경하고 스케일 업을 하여 이후 실험을 진행하였다.
3.3.2 Bench 장치 운전 연구
Figure 13은 초기 실험에 사용되었던 H-cell을 스케일 업 하여 제작한 벤치장치를 나타내는데, H-Cell의 연속식 실험에서 문제점으로 지적되었던 반응기 구조상의 문제를 해결하여
제작하였다. 다시 말해서 반응조에서 석출된 구리가 막과 전극을 막는 현상을 방지하기 위하여 석출된 구리를 일정 시간마다 막에서 긁어내었고, 반응조의 밑 부분을 수평이 아닌 빗면으로하여 구리 입자들이 흘러 내려가도록 설계를 하여 막과 전극이 구리 입자에 의해 방해를 받을 가능성을 최소화 하였다. 여기서 음극액의 구리 농도를 유지하기 위해, 동일한 철 농도를 가지는 양극조로부터 적정용량의 폐액 흐름을 칼라 센서와 PC를 이용하여 지속적으로 자동 조절해주면서 음극조로 순환시켰다[13]. 실제 연속공정에서는 염화철 식각조로부터 고농도 구리를 함유한 염화철 폐식각액을 공급 받게 되나, 본 실험에서 1~2시간 실험하는 경우에는 거의 유사한 거동을 보였다.
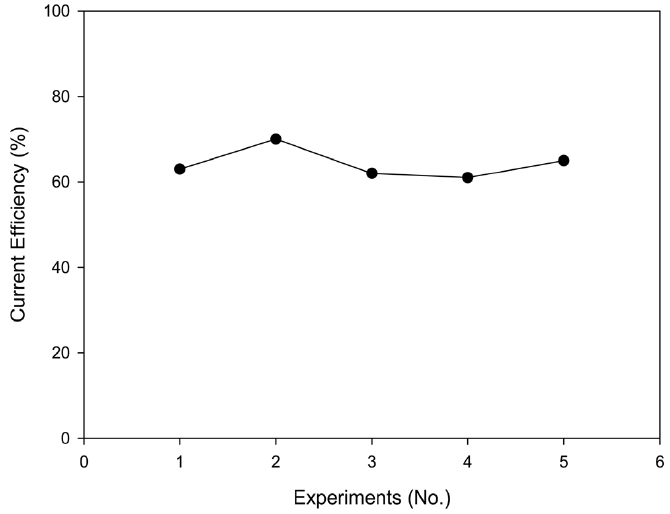
실험 조건으로는 음극액 구리 농도 Cu2+ 12 g/L, 음극액 철 농도 Fe2+ 80 g/L, 양극액 구리 농도 Cu2+ 36 g/L, Cu+ 24 g/L, 양극액 철 농도 Fe3+ 100 g/L, Fe2+ 20 g/L, 양, 음극액 HCl 농도 0.5 N, 전류밀도 350 mA/cm2, (+)전극 DSA, (-)전극 카본, 전극간격 10 cm, 반응시간 60 min에서 온도 유지를 위한 냉각조건하에 진행되었다. 회분식 반응에서는 구리 석출 효율이 평균 90%의 수준이었고 연속식 반응의 석출 효율은 회분식 반응보다 낮은 평균 70%의 수준이었다. 연속식 조건에서 운전을 진행한 결과는 Figure 14와 같은데, 효율이 60~70% 정도 수준으로 안정적 운전이 이루어졌다. 효율이 약간 낮은 이유는 장시간 운전의 결과 반응조의 밑 부분을 빗면으로 내려가도록 해도 운전 중에 석출된 구리를 회수할 수 없기 때문에 순환에 의해 석출 구리의 재용출을 완전히 방지할 수는 없고, 이로 인해 운전 시간이 길어질수록 재용출되는 구리의 양이 증가하기 때문인 것으로 추정된다. 그러나 본 연구 수행 중, 과거 연구[4,5]의 방법에 따라 고농도의 폐액을 음극조에 넣고 바로 반응시켰을 때 거의 구리가 석출되지 않았던 것에 비하면 크게 효율이 향상 된 것이며, 충분한 경제적 가능성을 가지는 것으로 사료된다. 아울러 추가적인 연구에 의해 구리농도와 철농도를 일정하게 자동으로 유지하는 방법을 적용하여 운전한 결과, 전
류효율이 98%까지 상승함을 발견한 바 있는데, 그 자세한 내용은 추후에 발표할 예정이다.
이상의 결과는 염화철의 전기적 재생 공정에서 음극조 내의 구리농도를 12 g/L 정도의 저농도로 조절해주면 고농도의 구리를 함유한 폐액을 직접 회분식으로 운전해주는 공정에 비해 크게 효율이 향상됨을 보여주었다. 아울러, 이러한 결과는 염화동 폐부식액의 재생 공정에서, 음극조 내의 구리농도를 10~20 g/L 정도의 저농도로 조절해주면 고효율로 구리를 회수할 수 있었다는 보고[2,7]와 유사하다. 본 연구의 결과를 바탕으로, 현재 (주)화백엔지니어링과 함께 염화철 전해재생공정을 연속 파일로트 장치로 제작하여 상업적 개발을 진행 중에 있다.
본 연구에서는 염화철 폐식각액을 재생하면서 구리를 회수하는 전기화학적 재생 공정에서, 음극조 내의 구리농도를 저농도로 조절하면서 효율적으로 반응시키는 방법의 가능성을 알아보고 그 반응 특성을 조사하였는데 결론은 아래와 같다.
1) 반응에 미치는 공정변수들의 영향들을 살펴보면, 음이온 교환막으로 격리된 전해조를 이용하였는데 IONAC MC-3475 막이 석출 효율과 내구성에서 가장 좋은 특성을 보였다. 구리 농도가 증가하면 석출 효율이 증가하였다가 12 g/L일 때 최대 효율을 나타냈고, 그 이상에서는 감소하였으며, 구리이온의 조성에서는 Cu+가 증가하면 석출 효율이 높았다. 철 농도는 석출 효율에 거의 영향력이 없었지만 철이온 조성에서는 Fe2+의 비율에 따라서 현저한 석출 효율의 차이를 보였다. 전류 밀도가 증가할수록 구리 석출 양은 증가하였지만 석출 효율은 감소하였으며, 350 mA/cm2일 때 가장 높은 효율을 보였다.
2) 양극조 내의 Fe2+ 산화는 항상 용이하게 수행되었으므로 음극조 내 구리 석출 효율을 높이는 조건을 최적 공정조건으로 삼았는데, Cu 12 g/L, Cu+비율 40% 이상, 350 mA/cm2, Fe2+비율 90%이었고, 철 농도는 크게 상관이 없었다.
3) Lab 규모의 기초 실험 결과를 바탕으로 bench 장치로 scale-up을 하여 최적 조건으로 실험을 진행한 결과 연속식 공정에서 약 60~70%의 석출 효율이 얻어졌고 안정적인 염화철 폐식각액의 재생 및 구리 회수가 가능한 것으로 나타났다. 이로부터 염화철의 전기화학적 재생 공정에서 음극조 내의 구리 농도를 12 g/L 정도의 저농도로 조절해주면, 고농도의 구리를 함유한 폐액을 직접 회분식으로 운전해주는 공정에 비해 크게 효율이 향상됨을 확인하였다.