페롭스카이트형 산화물을 능금산법으로 합성하여 TG/DTA, XRD, XPS, TEM 및 H2-TPR 등에 의해 특성분석을 하였고, 벤젠의 연소반응에서의 활성을 조사하였다. 대부분의 촉매들은 페롭스카이트 결정구조를 잘 가지고 있었으며 15에서 70 nm의 크기를 나타내었다. LaMnO3 촉매가 가장 높은 활성을 보여주었고 350 ℃ 에서 거의 100%의 전환율을 나타내었다. 반응 활성을 증가시키기 위해 페롭스카이트 산화물의 A-와 B-위치에 다른 금속이온의 치환을 행하였다. LaMnO3 촉매의 A-위치에 Sr을 일부분 치환시키면 벤젠의 전환율이 증가하였다. 또한, B-위치에 Co 및 Cu 이온의 치환 역시 촉매 활성을 증가시켰고, LaMn1-xBxO3 (B = Co, Fe, Cu)형 페롭스카이트에서 촉매활성은 Co > Cu > Fe 의 순서로 감소하였다.
간단한 방향족 화합물인 벤젠은 석유화학, 페인트, 도장시설, 철강제조와 같은 많은 화학공업에서 개시물질로서 광범위하게 사용되고 있으며 발암성 물질로 알려져 있다. 또한 다른 휘발성 유기화합물과 달리 허용배출 등급이 상당히 낮다. 이와 같은 휘발성 유기화합물의 제거 기술로는 직접 연소법, 흡착법, 촉매 연소법 등이 있다[1]. 이들 방법 중에서 촉매연소법은 고정원에서 발생되는 휘발성 유기화합물을 촉매를 이용하여 연소시켜 이산화탄소와 물로 전환시키는 방법으로 가연성가스의 연소에서 질소산화물의 발생을 최소화할 수 있고, 연소시 반응의 활성화 에너지를 낮추어 직접 연소법에 비해 낮은 반응 온도에서 휘발성 유기화합물을 효과적으로 제거할 수 있 다는 장점을 가지고 있다. 따라서 반응온도가 낮기 때문에 연간 운전비가 적게 들어 경제적이며 장치가 소형이므로 설비 확장이 용이하다는 장점을 가지고 있다. 일반적으로 귀금속 촉매(Pt, Pd)는 휘발성 유기화합물의 산화에 대하여 높은 활성을 보여준다고 보고되고 있다[2]. 그러나, 귀금속 촉매의 경우 고가이고, 염소나 황과 같은 촉매독의 존재 시 활성이 급격히 감소하기 때문에 귀금속 촉매와 유사한 활성을 가지면서 저렴한 촉매의 개발이 요구되고 있다. 따라서 이들 귀금속 촉매를 대신할 수 있는 촉매로서 제올라이트, 층상 화합물 및 페롭스카이트 등이 연구되고 있다[3,4].
ABO3형 구조를 가진 페롭스카이트형 산화물은 탄화수소의 산화반응[5], 염소계 휘발성 유기화합물[6] 및 입자상 물질의 연소반응 등에서 높은 활성을 보여주는 것으로 알려져 있다. 이와 같은 우수한 촉매적 특성 때문에 고상반응법, 졸-겔법, 수열합성법등 페롭스카이트형 산화물을 합성하기 위한 다양한 방법들이 개발되었다[7,8]. 재래식 합성기술은 높은 소성 온도와 장시간의 열처리로 인한 입자 크기의 조절의 어려우며 불순물의 함유등과 같은 많은 단점을 가지고 있다. 반면에 능금산법은 비교적 저온에서 짧은 시간에 산화물을 합성함으로서 비교적 큰 표면적을 나타내며, 재래식 방법에 비해 높은 촉매 활성을 보여주는 것으로 알려져 있다[9].
따라서 본 연구에서는 LaMnO3, LaCoO3 및 LaFeO3 페롭스카이트형 산화물을 능금산법 공정으로 제조하고, 이들의 물리적 특성을 조사하였고, 벤젠의 연소반응에서의 활성을 조사 하였다. 또한, LaMnO3형 페롭스카이트에서 A- 및 B-위치에 다른 금속이온으로 치환된 촉매들의 물리적 특성 및 벤젠연소 반응에서의 활성을 비교하였다.
페롭스카이트형 산화물을 합성하는데 사용되는 전구물질로서 해당 금속의 질산염을 원하는 비만큼 칭량한 후 능금산 (malic acid)과 섞어 증류수 100 cc에 용해시켰다. 이 때 얻어진 전체 용액을 충분히 교반시키면서 물을 증발시킨 다음 160 ℃ 의 건조기에서 충분히 건조시켜 다공질체로 합성하였 다. 이를 잘 분쇄한 다음 전기로에서 350 ℃에서 30분, 500 ℃에서 30분, 650 ℃에서 5시간 동안 소성시켜 페롭스카이트형 산화물을 제조하였다. 위의 모든 과정에서 불순물의 영향을 극소화하기 위해 초순수물을 사용하였으며, 다단계 승온 처리 온도 값은 열분석의 결과를 활용하였다.
제조된 촉매의 결정성의 변화를 살펴보기 위해 X-선 회절 분석기(XRD, Philips X’pert diffractometer, Cu-Kα)를 이용하였다. 온도에 따른 입자의 열분해, 결정화 및 상변화를 관찰하기 위해 시차 열분석(differential thermal analysis, DTA, Perkin- Elmer)및 열중량 분석장치(thermogravimetric analysis, TGA, Perkin-Elmer)를 각각 사용하여 분석하였으며, 시차 열분석은 질소 분위기에서 열중량 분석은 공기 분위기에서 승온 온도 10 ℃/min의 속도로 50~800 ℃ 범위의 온도에서 관찰하였다. 촉매들의 산화 및 환원상태를 알아보기 위해 500 mg의 촉매를 충전시킨 후 헬륨으로 희석된 5%의 수소를 사용하여 승온 환원실험(temperature-programmed reduction, TPR)을 행하였고, 승온환원 과정에서 소비되는 수소의 양과 생성되는 물의 양은 질량분석기(mass spectrometer, HIDEN Analytical)를 이용하여 측정하였다. 제조된 촉매의 초미세구조 관찰 및 크기, 모양, 크기분포 등을 확인하기 위해 LaB6 필라멘트에 의해 200 kV로 가속된 주사전자현미경(transmission electron microscopy, TEM, JEOL, JEM-2020)을 사용하였다. 또한, 촉매 표면의 조성을 알아보기 위해 X선 광전자 분광기(X-ray photoelectron spectroscopy, XPS, THERMO VG SCIENTIFIC Multi Lab 2000)를 사용하였다.
촉매를 이용하여 벤젠을 제거하는 실험은 고정층 연속반응기를 사용하였다. 반응기는 직경 1 cm, 길이 24 cm인 석영관을 사용하였고, 촉매층에 삽입된 K-형의 열전대가 연결된 온도 조절기로 반응온도를 100~500 ℃로 조절하였다. 가스는 헬륨 (99.999%)과 산소(99.999%)를 사용하였고 각각의 가스는 수분 트랩을 거쳐서 MFC (mass flow controller)를 거쳐서 유량을 조절하였고, 반응물인 벤젠은 헬륨에 의하여 기화되며 원하는 농도로 조절되어 반응기에 도입되었다. 반응물의 유량은 100 mL/min (공간속도; GHSV = 30,000 hr-1)로 조절하였다. 반 응물과 생성물의 분석은 수소불꽃 이온화 검출기(flame ionization detector, FID) 및 열전도도 검출기(thermal conductivity detector, TCD)가 장착된 가스 크로마토그래피(HP 5890 series II plus)를 사용하여 분석하였다. 벤젠과 이산화탄소의 분석을 위해 각각 Carbowax 및 Hysep Dip 컬럼을 사용하였다.
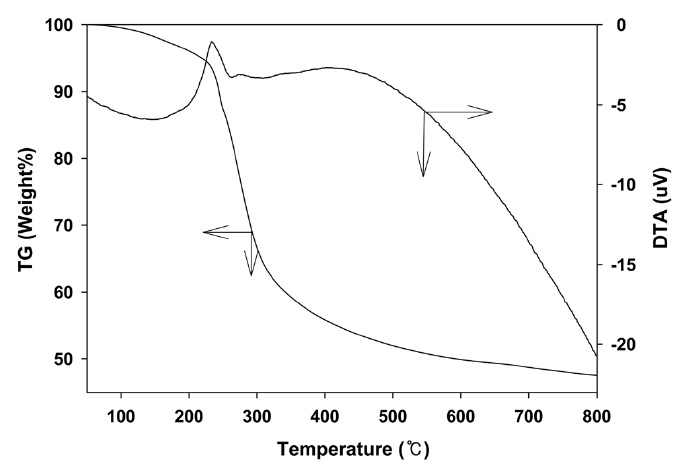
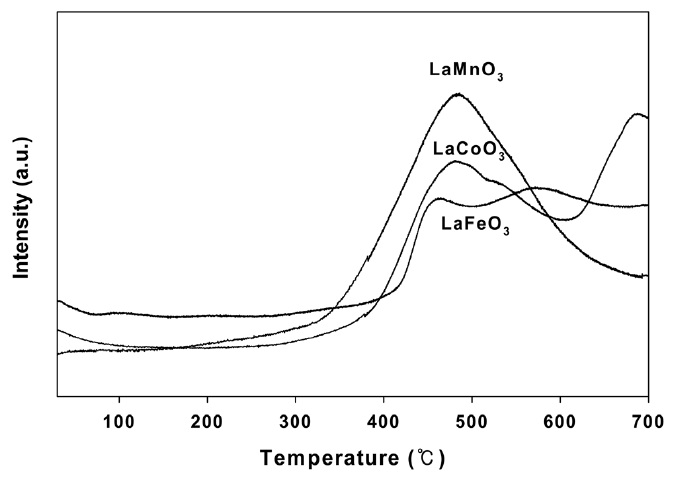
금속질산화물과 능금산의 혼합물을 160 ℃에서 건조시키면 졸-겔 상태의 페롭스카이트 전구체가 얻어진다. 만약 이 전구체를 650 ℃에서 바로 소성시키면 많은 양의 불순물이 촉매에 혼합될 가능성이 있다. 따라서 불순물의 생성을 막기위해 전구체를 단계별로 소성시킬 필요가 있다. Figure 1에 대기 중에서 LaMnO3 페롭스카이트 산화물의 전구체 물질의 열분석 결과를 나타내었다. 중량 열분석 피크에서 볼 수 있듯이
120~200 ℃ , 210~310 ℃ 및 350~650 ℃의 온도범위에서 세 번의 질량 감소가 나타났다. 처음 두 번의 질량감소는 NO3-의 분해, 잔류 능금산 및 능금산 혼합물의 분해에 기인하는 것으로 생각된다. 이 결과는 구연산을 사용한 결과와 잘 일치하고 있다[10]. 또한 마지막 질량감소가 과잉의 산소의 제거에 의한 페롭스카이트 산화물의 결정화에 가장 중요한 역할을 하 는 것으로 알려져 있다[11]. 따라서 전구체 물질의 소성에 따른 페롭스카이트 구조를 생성시키는데 충분한 시간을 제공하는 것이 매우 중요하다. 이상의 결과를 바탕으로 전구체를 350 ℃ 에서 30분, 500 ℃ 에서 30분 그리고 650 ℃ 에서 5시간 동안 공기 중에서 소성시켜 페롭스카이트 촉매를 제조하였다.
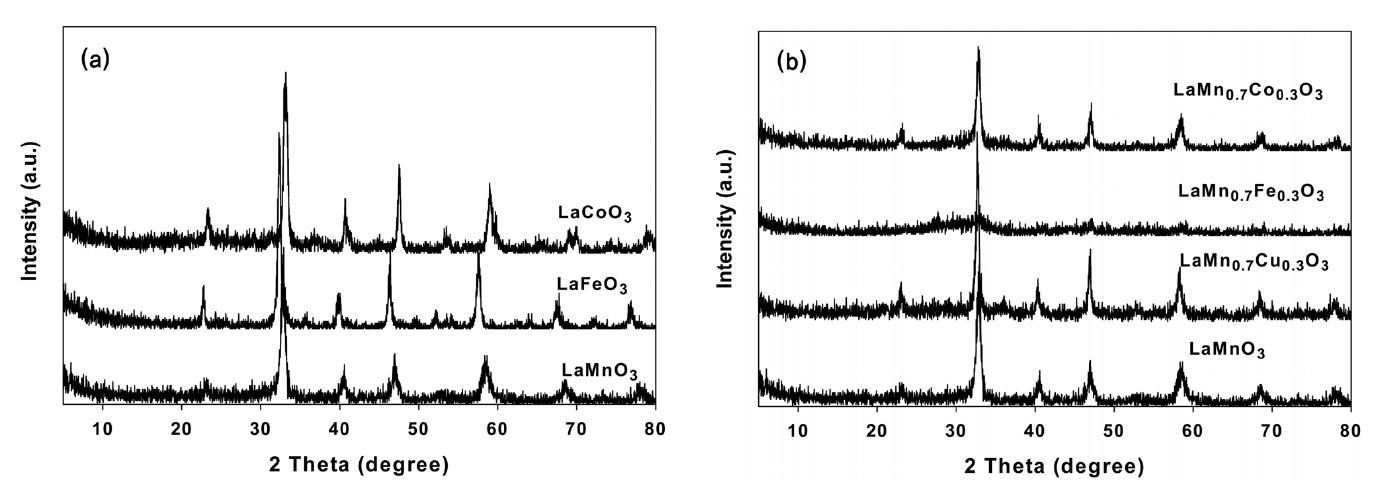
여러 가지 방법으로 제조한 LaMnO3 페롭스카이트형 산화물들의 결정성을 알아보기 위해 X-선 회절분석 측정을 행하여 그 결과를 Figure 2에 나타내었다. Figure 2(a)에서 나타나듯이 모든 페롭스카이트형 산화물들은 페롭스카이트 결정 구조를 가진 것으로 확인되는 2θ = 33̊ 부근에서 강한 회절선을 보여 주고 있다. 또한, 촉매들의 결정크기는 X-선 회절 피크에 상응하는 라인의 넓이로부터 미세 결정크기 L을 Scherrer 식을 사용하여 아래와 같이 구할 수 있다[10].
위의 식 (1)로부터 얻어진 촉매들의 결정의 크기는 15~70 nm의 크기를 보여주었으며, 그 결과는 Table 1에 나타내었다.
[Table 1.] The physical properties and results of XPS spectra of perovskite type oxides

The physical properties and results of XPS spectra of perovskite type oxides
Figure 2(b)에서는 LaMnO3형 페롭스카이트 산화물의 B-위 치에 다른 금속이온이 치환된 촉매들의 X-선 회절분석 결과를 나타내었다. Fe가 치환된 촉매를 제외하고는 대부분 페롭 스카이트 결정구조가 잘 나타났다. 또한, Scherrer 식에서 얻어진 결정의 크기는 금속 이온이 치환되면 증가하는 것으로 나타났다.
여러 종류의 페롭스카이트형 산화물들의 모양과 크기를 알아보기 위해 주사전자현미경을 사용하여 그 결과를 Figure 3
에 나타내었다. 합성된 페롭스카이트형 산화물은 금속의 종류에 관계없이 대체로 구형의 모양을 보여주고 있다. 또한, 페롭스카이트형 산화물 입자들의 크기가 LaMnO3 < LaCoO3 < LaFeO3의 순서로 커지는 것을 볼 수 있는데, 이것은 X-선 회절 분석 실험에서 얻어진 결과와 잘 일치하고 있다.
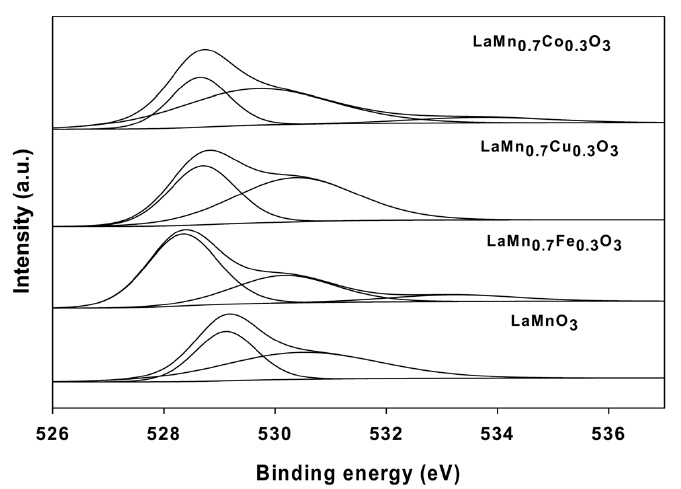
촉매 표면에 존재하는 산소의 종류를 알아보기 위해 X-선 광전자 분광법(XPS)을 사용하여 Figure 4와 Table 1에 LaMnO3형 페롭스카이트 산화물의 B-위치에 다른 금속이온이 치환된 촉매들의 O1s에 대한 결과를 나타내었다.
O1s의 스펙트라는 두 가지의 피크를 나타내고 있는데, 결합 에너지가 528.5~529.3 eV에서 나타나는 피크는 결정산소(lattice oxygen, Olat)에 기인하는 것이고, 530.2~530.8 eV에서 나타나는 피크는 산소공극에 흡착된 산소(adsorbed oxygen, Oads)에 기인하는 것으로 알려져 있다[12]. 그림에서 나타나듯이 B- 위치에 다른 전이금속이 치환됨에 따라 결정산소가 나타나는 피크가 낮은 에너지쪽으로 이동하였으며, 높은 에너지에서 나타나는 흡착산소의 피크의 크기가 달라지는 것을 볼 수 있다. 이 결과는 LaMnO3 촉매의 B-위치에 다른 전이금속의 도입은 촉매 표면층에 존재하는 산소종의 분포에 영향을 미친다는 것을 의미한다.
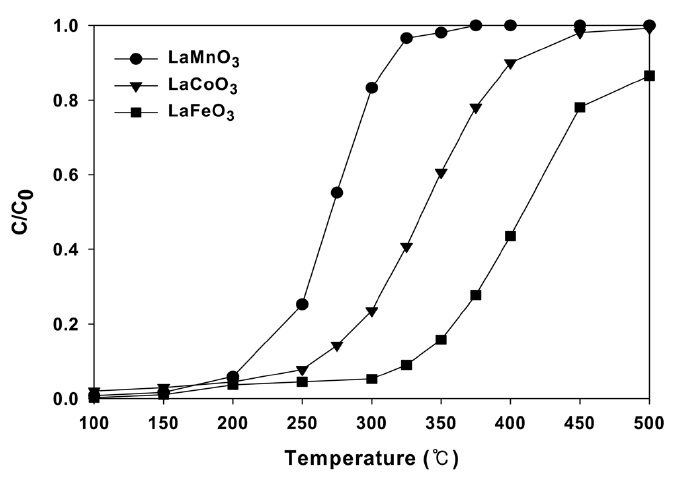
Figure 5에 여러 종류의 페롭스카이트형 산화물에서 반응 온도에 따른 벤젠의 연소반응에 대한 전환율을 나타내었다. 대부분의 연소반응에서 나타나는 반응온도에 따라 전형적인 S형 곡선을 보여주고 있다. 또한, 전환율의 급격한 상승 역시 많은 산화반응에서 나타나고 있는데, 반응 후 배출가스와 함께 과잉으로 생성되는 열 때문으로 알려져 있다[13]. 촉매를 사용하지 않은 벤젠연소에서는 2% 정도의 전환율만 보여주었고, 반응 후 얻어지는 물질은 이산화탄소가 전부였고 다른 탄소를 함유한 물질은 나타나지 않았다.
Figure 5에서 보여주듯이 LaMnO3 > LaCoO3 > LaFeO3의 순서로 연소반응의 활성이 나타났으며, LaMnO3 촉매의 경우에
는 350 ℃에서 거의 모든 반응물이 연소되는 것을 볼 수 있다. 그러나 LaFeO3 촉매의 경우에는 반응활성이 매우 낮아져 500 ℃에서도 반응물의 80% 정도만이 전환되는 것을 볼 수 있다. 일반적으로 페롭스카이트형 산화물에서 팔면체를 점유하고 있는 3
여러 페롭스카이트 촉매들의 산화 및 환원성질(redox property) 을 알아보기 위해 수소를 사용한 승온환원실험을 행하여 그 결과를 Figure 6에 나타내었다. 대부분의 촉매들에서 480 ℃ 부근에 큰 환원피크가 나타났으며, LaCoO3 촉매와 LaFeO3 촉매는 더 높은 온도에 다른 환원피크가 나타났다. 앞의 환원 피크는 흡착산소에 의한 Mn4+ 에서 Mn3+ 로의 환원에 의한 것이고, 높은 온도에서의 환원피크는 결정산소에 의한 Mn3+에서 Mn2+로의 환원에 기인한다고 보고되고 있다[14]. 따라서 벤젠의 산화반응에 직접적으로 영향을 주는 산화환원성질은 낮은 온도에서의 환원피크에 의해 결정된다고 생각된다. 또
한 피크의 크기는 촉매들이 가지는 산화환원능력에 따라 달라질 것으로 생각되며, 이들의 크기가 클수록 산화환원능력이 증가하여 벤젠의 산화반응의 활성을 증가시키는 것으로 생각된다.
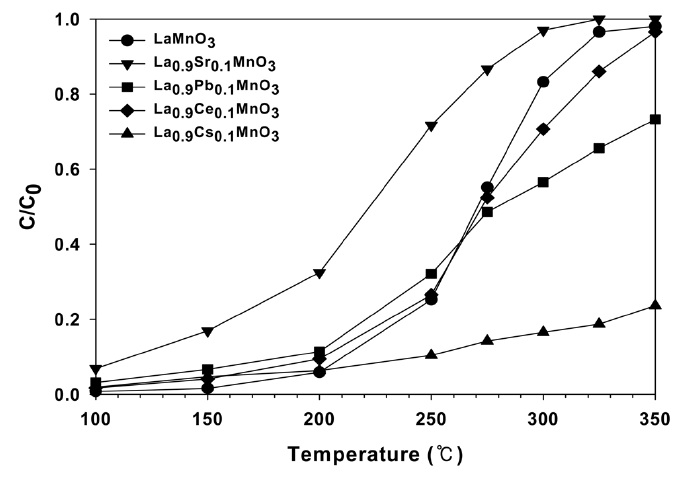
페롭스카이트형 산화물의 A-와 B-위치에 다른 금속이온을 부분적으로 치환시키면 촉매의 활성이 증가하는 것으로 알려져 있다[8,9]. Figure 7에 LaMnO3 페롭스카이트 촉매의 A-위치에 금속이온을 치환시킨 경우 벤젠의 전환율을 나타내었다. 그림에서 나타나듯이 Sr이 치환된 경우에는 촉매 활성이 증가하였고, Ce나 Pb의 치환은 활성의 큰 변화를 보여주지 않았으나 Cs의 치환은 오히려 활성이 크게 낮아지는 것을 볼 수 있다. 이것은 다른 산화반응에서도 같은 결과를 보여주고 있으며, 페롭스카이트형 산화물에서 A이온은 12면체의 간극에 끼여져 있으며, 대부분 알칼리족 또는 알칼리 토금속족과 같은 큰 이온으로 존재한다. 또한 A-위치에 다른 금속이온의 도입은 비록 B-위치의 전이금속이 촉매활성을 가지고 있더라도 페롭스카이트의 물리적 및 전기적인 성질을 변화시킬 수 있는 것으로 알려져 있다[9]. 따라서 Sr이온의 도입은 LaMnO3 페롭스카이트 촉매의 산화활성을 증가시키는 쪽으로 촉매의 성질을 변화시키는 것으로 생각된다.
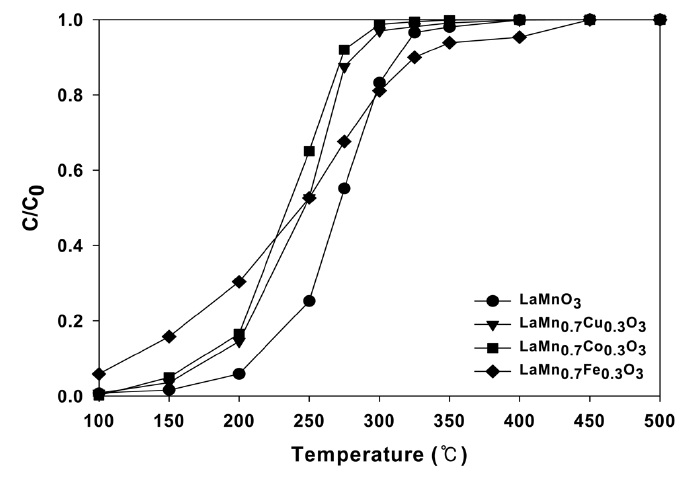
Figure 8에 LaMnO3 페롭스카이트 산화물의 B-위치에 Mn 대신 다른 금속이온으로 치환된 촉매들에 대한 벤젠의 전환 율을 나타내었다. B-위치에 다른 금속이온의 치환은 촉매의 활성을 증가시켰고 그 순서는 Co > Cu > Fe의 순서로 나타났 다. 앞에서도 언급하였던 것처럼 페롭스카이트형 산화물에서 B-위치의 전이금속이 촉매 활성을 나타내고 있으며, 이들에 다 른 전이금속이온의 도입은 촉매활성의 변화를 일으키는 것으로 생각된다. Moon et al.[11]에 의하면 LaCoO3 페롭스카이트 형에서 산화물 Fe를 일부 치환시키면 격자빈공간을 통해 산소이온이 이동하며 이들 격자빈공간이 증가할수록 산소이온의 움직임 활발해져 산화환원 능력이 증가한다고 보고하고 있다. 이와 같은 결과는 승온환원실험 결과에서 얻어지는 산화반응에 직접적인 영향을 주는 낮은 온도에서의 환원피크가
낮은 온도 쪽으로 이동하게 된다. 실제로 Figure 9에서 나타나듯이 LaMnO3 산화물에 Cu나 Co이온이 일부 치환된 촉매에서는 환원피크가 나타나는 온도가 낮은 쪽으로 이동하는 것을 볼 수 있다. 따라서 이들 이온의 치환은 페롭스카이트 산화물 의 산화환원 능력을 증가시켜 촉매의 활성을 증가시키는 것으로 생각된다.
또한, 앞의 Figure 4의 X-선 광전자 분광법의 결과에서 언급하였듯이 페롭스카이트형 산화물에는 두 종류의 산소가 존 재하며 높은 에너지밴드에서 나타나는 흡착산소종이 산화반응에 관여하는 것으로 알려져 있다. 따라서 LaMnO3 산화물의 B-위치에 Co와 Cu이온의 치환은 높은 에너지 밴드에서 나타나는 흡착산소의 양의 증가에 따른 피크의 면적이 크게 증가하는 것을 보여주고 있다. 이와 같은 결과로부터 LaMnO3 산화물의 B-위치에 Co 및 Cu이온의 치환이 벤젠의 산화반응 에 대한 활성의 증가시키는 것을 알 수 있다.
여러 종류의 페롭스카이트형 산화물을 능금산을 연소제로 하여 졸-겔법으로 합성하였으며 이들의 물리적 특성을 조사 하였고, 벤젠의 연소반응에서 반응활성을 비교하였다. 제조된 촉매들은 대부분 페롭스카이트 결정구조를 보여주고 있으며, Scherrer 식에 의해 얻어진 입자들의 크기는 15에서 70 nm였 다. 또한, 벤젠 연소반응에서 LaMnO3 촉매가 가장 높은 활성 을 나타내었고 350 ℃ 에서 거의 100%의 전환율을 보여주었다. LaMnO3 촉매의 A-위치에 Sr이온을 일부분 치환시키면 벤젠의 전환율이 증가하는 반면에 Cs이온의 치환은 오히려 활성을 감소시켰다. 또한, B-위치에 Co 및 Cu이온의 치환 역시 촉매 활성을 증가시켰고, LaMn1-xBxO3 (B = Co, Fe, Cu)형 페롭스카이트에서 촉매활성은 Co > Cu > Fe의 순서로 감소하 였다.