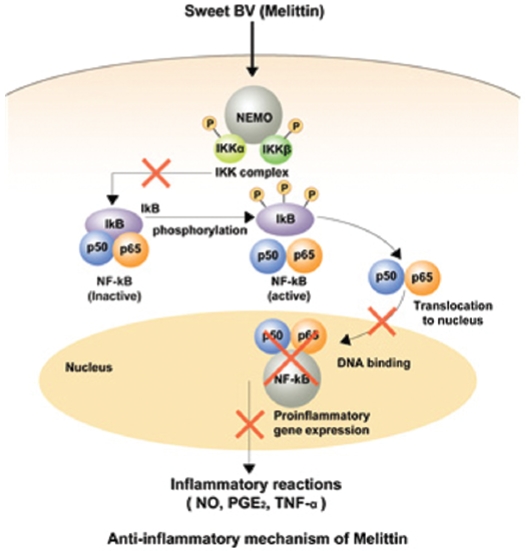
Sweet Bee Venom(이하 SBV)은 벌독(Bee Venom)의 주성분인 melittin을 분리ㆍ정제하여 근ㆍ골격계 질환 등의 치료에 사용되는 약침제제이다1).
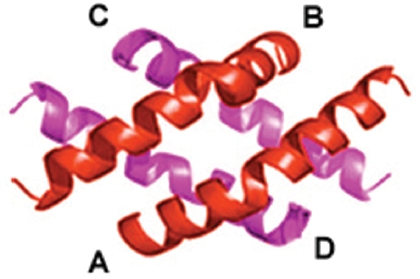
Melittin은 벌독에서 건조 중량으로 약 40-50%를 차지하고 있는 분자량 2840의 저분자 펩티드로, 26개의 아미노산으로 구성된 나선형의 구조를 가진 것으로 추정되는 물질이다 (Fig. 1). 그동안 근ㆍ골격계 질환이나 연부 조직 질환, 그리고 자가 면역계 질환의 치료에 사용되어온 봉독이 우수한 효능2-5)에 비해 강력한 항원성을 가지고 있어, 시술자가 의료 사고 등에 노출될 가능성이 비교적 다른 치료법에 비해 높다는 위험성이 있었다6-8). 따라서 봉독의 위험 요소인 allergy 반응을 억제하기 위해 벌의 독에서 주 항원으로 작용하는 분자량 10,000 이상의 효소성분(phospholipase A2, hyaluronidase 등)과 가려움이나 염증을 일으키는 histamine 등의 저분자 물질을 단백질 분리기법을 이용하여 정제단계에서 제거하고, 순수하게 melittin만 분리ㆍ정제하여 개발된 약침용 봉독이 바로 SBV이다9).
그동안 SBV에 대한 다양한 연구 결과, SBV는 봉약침에 비해 전신 과민반응이나 부종, 동통 그리고 종창과 같은 국소ㆍ즉시형 과민반응을 현저하게 감소시킨 것으로 보고되었고10-12), 또 임상적 운용에서도 봉약침에 비해 많은 장점을 가지고 있음이 보고된 바 있다13-16).
하지만 몇몇 사례의 보고17)와 같이 SBV의 시술 후 전신즉시형 과민반응(anaphylaxis)이 발생한 사례가 보고되고 있어 이에 대한 정확한 규명이 필요한 실정이다.
이미 SBV의 안전성과 관련한 연구로 김 등18)의 rat를 이용한 단회근육시술 독성시험, 윤 등19)의 비글견을 이용한 단회근육시술 독성시험, 임 등20)의 비글견의 심혈관계에 미치는 영향, 박 등21)의 비글견을 이용한 4주 반복 근육시술 독성시험 등이 보고된 바 있다.
이에 저자는 SBV의 항원성 유무를 알아보기 위해, 기존의 연구 자료가 풍부하여 항원성 시험에 흔히 사용되는 Hartley계 기니픽에 능동성 전신성 anaphylaxis(active systemic anaphylaxis-ASA)와 수동 피부 anaphylaxis( passive cutaneous anaphylaxis-PCA) 반응시험을 수행한 결과 유의한 결론을 얻어 이에 보고하는 바이다.
시험물질을 전자저울 (LA230S, CP323S, Sartorius, Germany)로 측량하여 조제병에 넣고, 부형제를 일부 넣어 vortex mixer로 용해시키고, 부형제를 가하여 규정농도로 조제하였다. 부형제는 생리식염수를 사용하였다.
2.1 실험동물 및 사육 환경
실험에 사용된 동물은 과민증상의 연구에 많이 사용되고 있는 5주령의 Hartley계 Guinea Pig을 사용하였고, 수컷의 체중은 250-300g이었다. 실험동물의 반입 시 동물의 외관 검사를 실시하였고, 전자저울(BP4100S, Sartorius, Germany)로 체중을 측정하였다. 7일간의 순화기간 중에 매일 1회 일반증상을 관찰하였다. 순화기간 종료일에 체중을 측정하고, 일반증상 및 체중변화를 확인하여 모든 동물에 이상이 없음을 확인하였다.
실험실의 온도는 21.6~23.7℃, 습도는 38.7~59.3%를 유지하였고, 실험동물용 고형사료(Teklad Certified Irradiated Global 18% Protein Rodent Diet 2918C)와 물은 충분히 공급하였다. 모든 실험은 식품의약품안전 청고시 제2005-79호(비임상시험 관리기준)의 Good Laboratory Practice (GLP) 규정22)을 준수하여 비임상시험 인증기관인 (주)바이오톡스텍에서 시행하였다.
2.2 군의 분리
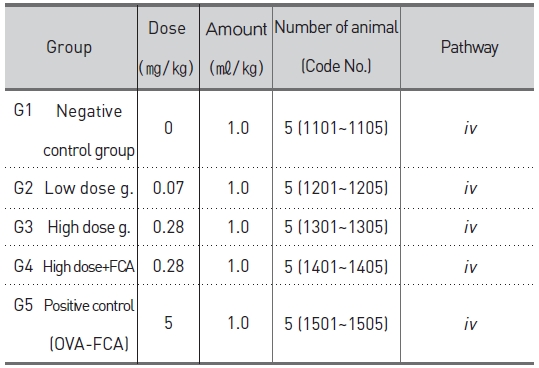
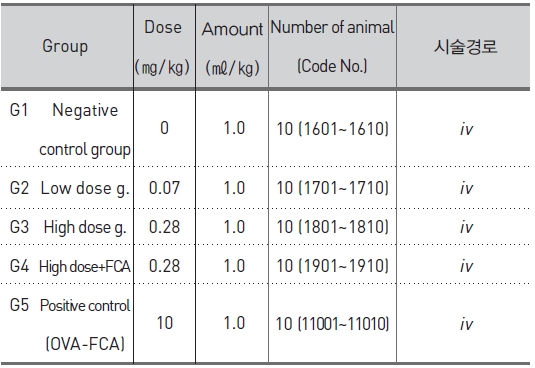
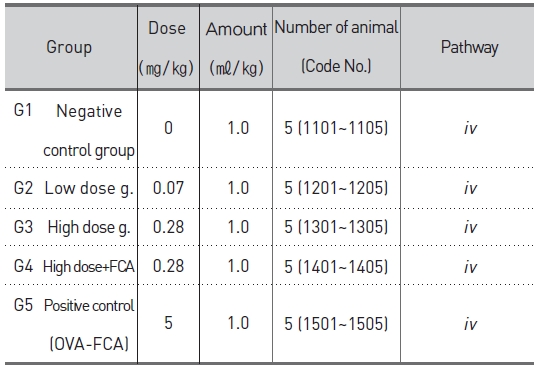
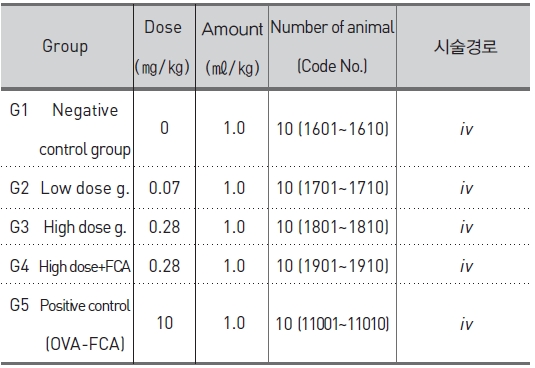
군 분리는 모든 동물에 대하여 순화종료일(군 분리일)에 실시하였다. 군 분리는 일반 증상 및 체중의 증가에 이상이 없는 동물 중 75마리를 선발하였다. 선발한 동물을 각 군 평균체중이 균등하도록 무작위로 군을 분리하였고 감작 시에는 군당 5마리로, 야기 시에는 군당 10마리로 실험을 진행하였다 (Table 1, 2).
[Table 1.] Experimental design and treating groups for active systemic anaphylaxis (ASA) test.
Experimental design and treating groups for active systemic anaphylaxis (ASA) test.
[Table 2.] Experimental design and treating groups for passive cutaneous anaphylaxis (PCA) test.
Experimental design and treating groups for passive cutaneous anaphylaxis (PCA) test.
2.3 시약
SBV를 적정비율로 생리식염수 (중화제약, 한국)에 녹여 사용하였다. Ovalbumin (OVA)과 evans blue는 Sigma (St. Louis, MO, USA)에서, Freund's complete adjuvant (FCA)는 Difco (Grand Island, NY, USA)에서 구입하여 사용하였다.
2.4 1회 시술 용량의 설정 및 시술 경로
SBV의 임상적용예정용량은 약 0.1 ~ 0.4 ㎎/human/회(성인 60kg 기준 시 최대 0.007㎎/㎏)이므로, 본 시험 에서는 임상예상용량의 10배인 0.07㎎/㎏을 저용량으로, 저용량의 4배인 0.28㎎/㎏을 고용량으로 하였고 0.28㎎ /㎏ +FCA를 혼합 시술군으로 설정하였다. 야기 시에는 모든 시험군에 고용량인 0.28㎎/㎏을 설정하였다. 양성대조군은 OVA 10㎎/㎖에 동량의 FCA를 가하여 5㎎/㎖-FCA 유화액을 만들어 사용하였다. 감작 시에는 5㎎/㎏, 야기 시에는 10㎎/㎏을 설정하였다. 시술 경로는 ‘의약품 독성시험기준’23)에서 항원성 시험의 아나필락시스 쇼크 반응시험 및 수동 피부 아나필락시스 반응시험에 따라 감작시에는 피하(sc), 야기 시에는 정맥(iv)으로 시술하였다.
2.5 시술 횟수 및 방법
2.5.1 감작시술
실험 시작 0. 3. 6, 9, 12 및 15일에 피하로 시술하였다. 혼합시술군 (고용량-FCA)과 양성대조군은 시술 0, 7 및 14일에 피하로 시술하였다.
2.5.2 능동 아낙필락시스(ASA) 및 수동 피부 아나필락시스(PCA) 야기
ASA 야기 시에는 후지정맥 내에 1회 시술하였고, PCA 야기 시에는 시술 4 시간 후에 후지 정맥 내에 1회 시술하였다.
2.5.3 감작혈청 분리
최종 감작 후 12일에 각 군의 감작된 기니픽 1 마리 당 2~3㎖ 정도의 혈액을 안와 정맥총에서 채혈하였다. 약 2 시간 정도 상온에서 방치해서 응고시킨 다음, 원심분리 (3,000rpm, 10min, 4℃; UNION 32R Plus, 한일과학)하여 혈청을 채취하고 동종 수동 피부 아나필락시스 반응시험의 항혈청으로 사용하였다.
2.5.4 아나필락시스 쇼크 반응방법
최종 감작일로부터 14일에 감작된 기니픽의 후지정맥내에 야기 항원량을 정맥으로 시술하여 야기하고, ‘3.4.1의 아나필락시스 쇼크반응 유ㆍ 무 판정 기준’에 따라 판정 하였다.
2.5.5 수동 피부 아나필락시스 반응방법
최종 감작 후 12일에 감작시켜 얻은 각 군의 개체별 항혈청을 생리식염 주사액으로 연속배수 희석하였다(×10, ×20, ×40, ×80, ×160, ×320, ×640, ×1280, ×2560, ×5120, 생리식염주사액). 희석한 항혈청은 냉장보관 하였다. 최종감작 후 13일에 제모한 각 군의 기니픽 등 부위에 희석한 해당 항혈청을 1㎖ 용량의 일회용 주사기로 0.05㎖씩 피내 시술 하였다. 각 혈청 1개당 감작되지 않은 2마리의 기니픽을 사용하였다 (한 혈청 × 5군 = 10마리). 피내 시술한 기니픽은 사육 상자에 넣어 수용하였고, 4시간 후 동량의 2% Evans blue와 혼합한 야기 항원량을 각 기니픽의 후지정맥 내에 주입하였다. 야기항원량의 시술 30분 후에 각 개체를 CO2를 이용하여 안락사 시킨 후 등 부위 피부를 조심스럽게 박리하였다. 판정은 아래의 ‘3.4.2 수동피부 아나필락시스 반응의 판정’에 따라 판정하였다.
3.1 일반증상 관찰
관찰 기간 중 매일 1회 일반증상의 변화와 사망 유무를 관찰하였다.
3.2 체중측정
체중은 시술 당일(시술 전) 및 주 1회 전자저울을 이용하여 측정하였다. 단, 실험 마지막 주에는 관찰 종료일(시술 29일)에 실시하였다.
3.3 부검
30분간 전신의 아낙필락시스 쇼크 반응시험 증상을 관찰한 후 shock이 일어난 동물에 대해서 CO2가스 마취하에 배대 동맥에서 방혈하여 안락사 시키고 부검하였다. 조직 검사는 시행하지 않았고, 기관 점막, 폐, 심장, 흉강 및 횡격막 등에 대한 육안적 관찰을 시행하였다.
3.4 아낙필락시스 shock의 유ㆍ무 판정
3.4.1 아나필락시스 쇼크반응 유ㆍ무 판정 기준
아나필락시스 쇼크반응시험 판정은 다음의 기준에 따라 판정하였다.
1. 불안 (Restlessness)
2. 기모 (Piloerection)
3. 진전 (Tremor)
4. 코를 문지르거나 핥음 (Rubbing or licking nose)
5. 재채기 (Sneezing)
6. 기침 (Coughing)
7. 과호흡 (Hyperpnea)
8. 배뇨 (Urination)
9. 배변 (Evacuation)
10. 유루 (Lacrimation)
11. 호흡곤란 (Dyspnea)
12. 찍찍거리는소리 (Rhonchus)
13. 청색증 (Cyanosis)
14. 보행불안 (Staggering gait)
15. 도약 (Jumping)
16. 헐떡거리고 몸부림침 (Gasping and writhing)
17. 경련 (Convulsion)
18. 횡와 (Side position)
19. Cheyne-Stokes 호흡 (Cheyne-Stokes respiration)
20. 사망 (Death)
3.4.2 수동 피부 아나필락시스 반응의 판정 등급
청색반점의 장경과 단경의 평균치가 5㎜ 이상이면 양성으로 하고, 양성을 나타내는 가장 마지막 혈청희석배수(최대희석배수)를 그 혈청의 최종 역가(항체가)로 정하였다.
3.5. 관찰 종료 후 동물의 처리
쇼크반응이 확인되지 않은 동물에 대해서는 관찰종료 후CO2가스 마취하에 안락사 시켰다.
본 시험에서 얻어진 판정치 및 측정치에 대해서는 평균을 구하고, 통계학적 해석은 실시하지 않았다.
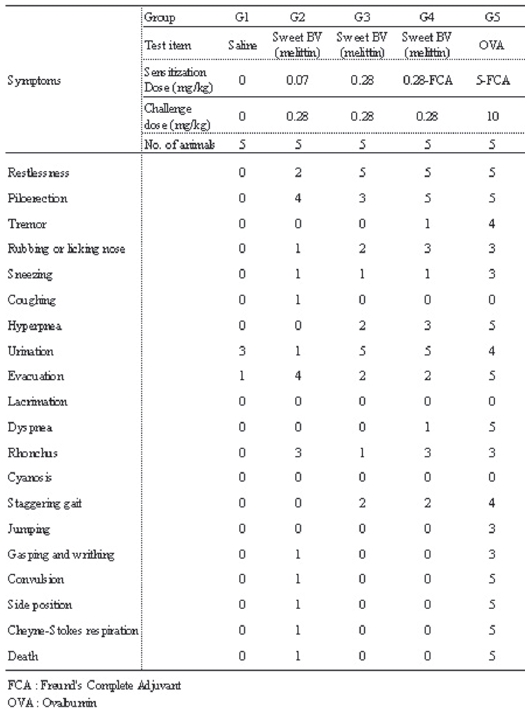
관찰기간 동안, 모든 실험군에서 사망 개체는 관찰되지 않았다. 일반증상의 관찰에서도 모든 실험군에서 이상 증상이 관찰되지 않았다 (Table 3).
[Table 3.] Clinical signs and mortality

Clinical signs and mortality
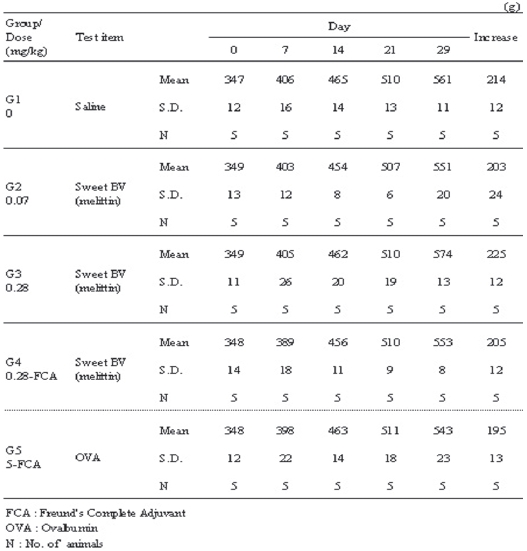
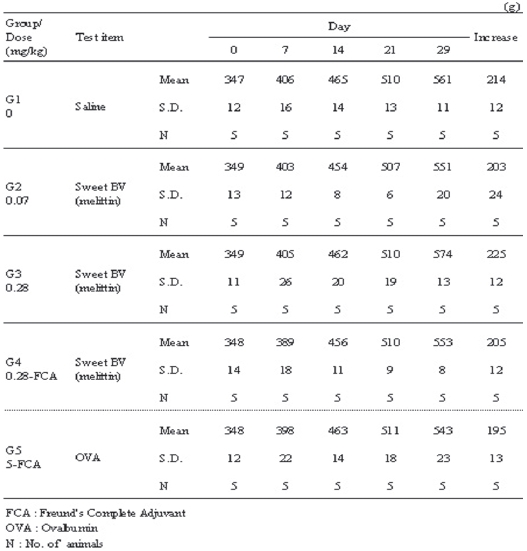
관찰기간 동안, 음성대조군은 214g, 저용량군은 203g, 고용량군은 225g, 혼합 시술군이 205g 그리고 양성대조군이 195g의 체중증가를 나타내어 SBV의 시술이 체중 변화에 영향을 미치지 않음을 알 수 있었다 (Table 4).
[Table 4.] Change of body weights
Change of body weights
기니픽을 대상으로 한 능동 전신성 아낙필락시스 shock 반응에서 음성대조군에서는 야기 항원량 시술 후 3/5례에서 배뇨 (Urination), 1/5례에서는 배변(Evacuation)의 증상이 관찰되었다.
저용량군에서는 야기 항원량 시술 후 2/5례에서 불안 (Restlessness), 4/5례에서 기모(Piloerection), 1/5례에서 코를 문지르거나 핥음(Rubbing and licking nose), 1/5례에서 재채기(Sneezing), 1/5례에서 기침 (Coughing) 1/5례에서 배뇨, 4/5례에서 배변, 3/5례에서 찍찍거리는 소리(Rhonchus), 1/5례에서 헐떡거리고 몸부림침(Gasping and writhing), 1/5례에서 경련 (Convulsion), 1/5례에서 횡와(Side position), 1/5례에서 Cheyne-Stokes 호흡(Cheyne-Stokes respiration) 이 관찰되다가 1/5례가 사망(Death)하였다.
고용량군에서는 야기 항원량 시술 후 5/5례에서 불안, 3/5례에서 기모, 2/5례에서 코를 문지르거나 핥음, 1/5례에서 재채기, 2/5례에서 과호흡(Hyperpnea), 5/5례에서 배뇨, 2/5례에서 배변, 1/5례에서 찍찍거리는 소리, 2/5례 서 보행 불안(Strggering gait)이 관찰되었다.
혼합 시술군에서는 야기항원 시술 후 5/5례에서 불안, 5/5례에서 기모, 1/5례에서 진전(Tremor), 3/5례에서 코 를 문지르거나 핥음, 1/5례에서 재채기, 3/5례에서 과호흡, 5/5례에서 배뇨, 2/5례에서 배변, 1/5례에서 호흡곤란 (Dyspnea), 3/5례에서 찍찍거리는 소리, 2/5례서 보행불안이 관찰되었다.
양성대조군에서는 야기 항원량 시술 후 5/5례에서 불안, 5/5례에서 기모, 4/5례에서 진전, 3/5례에서 코를 문지르거나 핥음, 3/5례에서 재채기, 5/5례에서 과호흡, 4/5례에서 배뇨, 5/5례에서 배변, 5/5례에서 호흡곤란, 3/5례에서 찍찍거리는 소리, 4/5례에서 보행불안, 3/5례에서 도약 (Jumping), 3/5례에서 헐떡거리고 몸부림침, 5/5례에서 경련, 5/5례에서 횡와, 5/5례에서 Cheyne-Stokes 호흡이 관찰되다가 5/5례 모두 사망하였다 (Table 5).
[Table 5.] Active systemic anaphylaxis (ASA) test.
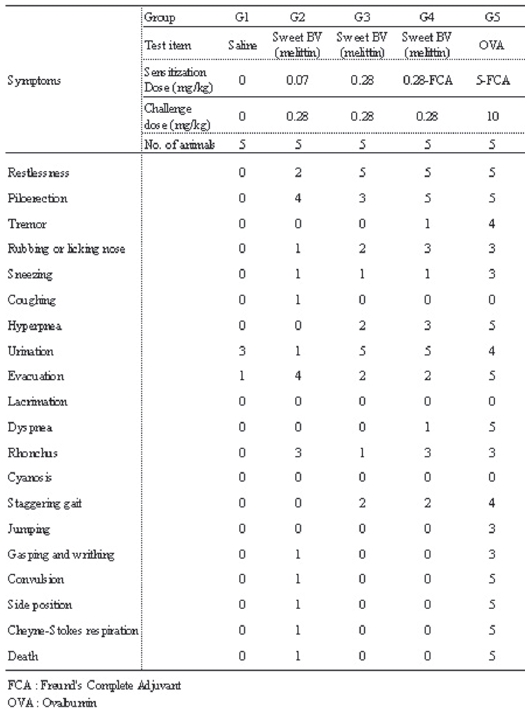
Active systemic anaphylaxis (ASA) test.
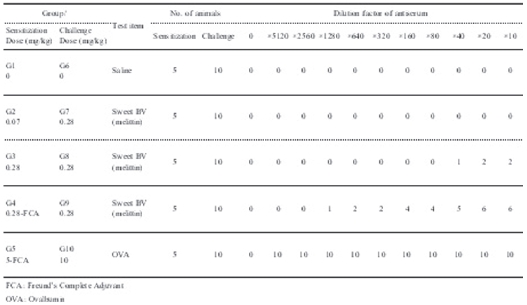
음성대조군 및 저용량군에서는 5례(감작된 혈청에 대한 5례로 1례는 기니픽 2 마리를 의미함) 모두 음성반응이 관찰되었다.
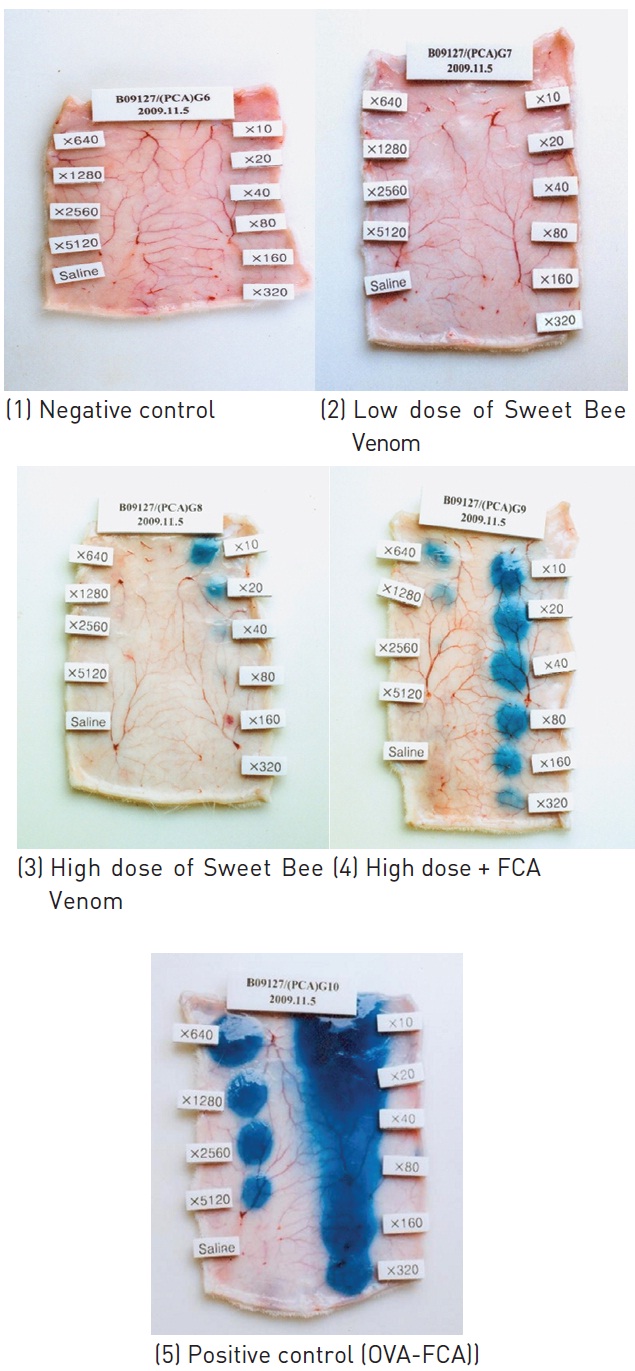
고용량군에서는 1/5례에서 최대 희석배수 20배까지 양성반응이 관찰되었고, 혼합 시술군에서는 1/5례에서 최대 희석배수 20배까지, 1/5례에서 최대희석배수 160배까지, 1/5례에서는 최대희석배수 640배까지 양성반응이 관찰되었다. 양성대조군에서는 5마리 모두에서 최대희석배수 5120배까지 양성반응이 관찰되었다 (Fig. 2, Table 6).
[Table 6.] Passive cutaneous anaphylaxis (PCA) test.
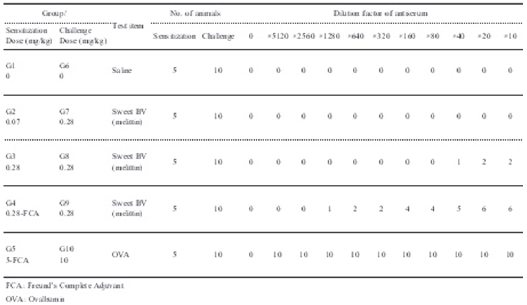
Passive cutaneous anaphylaxis (PCA) test.
아나필락시스 쇼크 반응시험의 야기 항원량 시술 후, 시험물질의 저용량군, 고용량군 및 고용량-FCA군에서 shock 반응이 확인되었으며, 저용량군에서는 1례가 사망 하였다. 양성대조군에서는 shock 반응이 확인되다가 5례 모두 사망하였다.
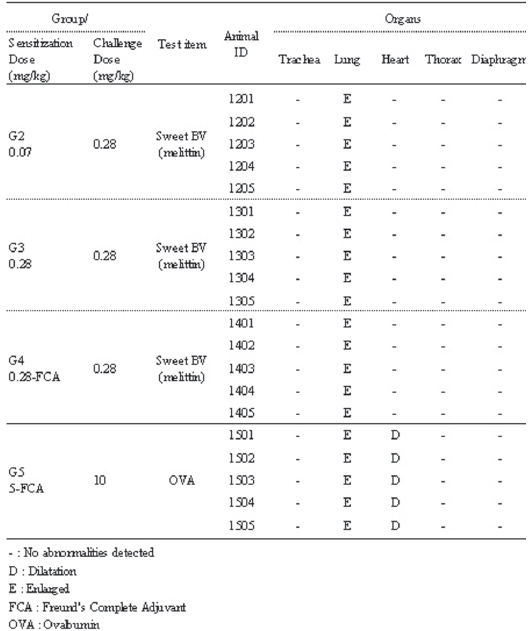
Shock 반응이 확인된 동물에 대해 부검을 실시한 결과, 저용량군, 고용량군 및 고용량-FCA군에서는 폐의 팽대 (Enlarged) 소견이, 양성대조군에서는 폐의 팽대 및 심장 확장(Dilatation) 소견이 모든 동물에서 공통적으로 관찰 되었다 (Table 7).
[Table 7.] Necropsy finding of active systemic anaphylaxis (ASA) test.
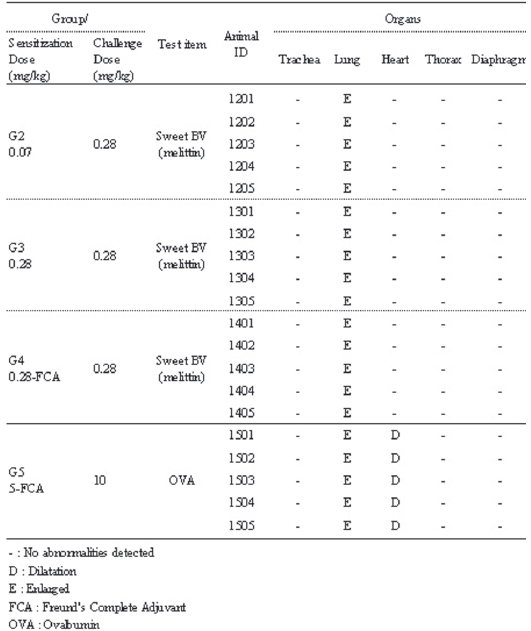
Necropsy finding of active systemic anaphylaxis (ASA) test.
아낙필락시스 shock 반응은 감작이 성립된 개체에 항원을 투여하여 항원-항체 반응을 전신성 반응으로 관찰하는 것인데, 비만세포에 결합된 항원이 crosslink 되면 비만세포로부터 히스타민 등의 매개인자들이 나오면서 일어나는 반응이다. 아낙필락시스 shock 반응을 동물 실험할 때에는 기존의 연구자료 등으로 인해 일반적으로 기니픽을 사용하 고 있다24).
毒(poison, toxin, toxicant)이란 “여러 가지 경로를 통해서 소량이 체내로 들어오면, 생체조직에 기능적 혹은 형태적으로 장애를 주거나 혹은 치사작용을 일으키는 물질”로 정의된다25). 한 의학에서도 약재에 대하여 有毒, 無毒등의 표현으로 독성을 분류하여 임상에 사용하고 있고, 본초학의 고서인 神農本草經에서도 독성의 强弱에 따라 上藥, 中藥, 下藥의 세 가지로 나누어 上藥은 거의 無毒하면서 장기간 복용하여 輕身益氣, 不老延年등의 효능이 있는 약으로, 中藥은 약간의 독성을 지니면서 질병의 예방과 치료에 사용되는 약으로, 下藥은 독성이 강하여 장기간의 복용이 곤란하면서 질병을 치료하는 효과가 강한 약재로 구분하고 있다.
어떤 물질에 대한 독성을 평가하기 위해서는 그 물질이 일으킬 수 있는 급성 또는 만성적인 유해 작용과 이들 유해 작용 각각의 용량-반응관계를 확인해야 하는데 이러한 정보를 얻는데 가장 중요한 것이 바로 동물을 이용한 시험성적이다. 즉, 독성실험은 의약품 등의 시험물질 안전성 평가를 하기 위하여 중요한 기초자료이며, 필수적이라 할 수 있다26). 독성연구의 주요목적은 신약의 안정성을 평가하여 임상적용약의 안전을 확보하기 위해 시행하는 것으로, 독성실험은 크게 급성 독성실험(단회시술 독성시험), 아급성 독성실험(1개월 반복시술 독성시험), 그리고 만성독성실험(3개월 이상 반복시술 독성시험)으로 나눈다25).
식품의약품 안전청에서도 독성시험기준23)을 엄격하게 제안하고 있고, 이러한 시험은 모두 Good Laboratory Practice (GLP) 규정에 의해 평가되어야 인정을 받을수 있다22). 또한 의약품의 품목 허가 신고ㆍ심사 규정에서도 의약품의 안전성ㆍ유효성 심사를 위하여 제출해야 하는 자료로 첫째, 기원 및 발견의 경위(배합목적 및 용도에 관한 자료 포함), 둘째, 물리화학적 성질, 규격에 관한 자료, 셋째, 안정성에 관한 자료, 넷째, 독성에 관한 자료(보존제 및 타르색소의 경우에는 신약의 첨부자료에 준하며 그 외에는 단회시술독성, 반복시술독성, 기타 필요한 독성시험자료)를 제출해야 한다고 규정하고 있다23). 이중 항원성 시험은 면역독성 시험의 일종으로 제 1형 과민반응의 일종인 능동 전신성 아낙필락시스 shock 반응과 세포친화성의 IgE type 항체의 형성 유무를 확인하기 위한 수동 피부 아낙필락시스 shock 반응이 있다.
Melittin은 26개의 아미노산으로 구성된 peptide로 벌의 독에서 건조 중량 40-50%를 차지하는 분자량 2846의 수용성 물질이다27). Melittin은 벌의 독에서 가장 중요한 allergen인 phospholipase A2를 활성화시키고 세포막에 구멍을 뚫어 파괴시키는 작용이 있는 것으로 알려져 있는데 이러한 작용은 melittin의 구조와 관련이 있는 것으로 알려져 있다28). 각각의 사슬은 두 개의 나선구조로 되어 있고, 모두 휘어진 막대기 모양을 하고 있다. 이러한 구조는 세포의 용해 작용이 용이하고, 따라서 melittin이 암세포의 사멸이나 소염효과를 나타내는 것과 밀접한 관련이 있는 것으로 추정된다.
이미 이전의 보고28-31)에서 melittin은 nuclear factor-
김 등18)은 SBV의 LD50은 30 ㎎/㎏ 이상으로 벌독에 비해 약 1/50-100의 독성을 가지고 있다고 보고한 바 있으나, 임상에서SBV의 시술 과정에서 아나필락시스 사례가 보고된 바17) 있고, SBV의 항원성에 대한 연구 보고가 이루어진바 없어 이에 대한 연구가 필요한 실정이었다. 따라서 본 연구에서는 SBV (melittin)의 이상면역반응을 검색하기 위해 기니픽을 대상으로 능동 전신성 아낙필락시스 shock 반응과 수동 피부 아낙필락시스 shock 반응 실험을 진행하였다.
전신성 아낙필락시스는 시험물질에 의한 사망이나 일반증상의 관찰 및 체중의 변화, 그리고 부검소견 등을 확인하여 용량에 따른 항원성을 평가하고 있다24).
전신성 아나필락시스 쇼크반응 결과, 저용량군, 고용량군 및 혼합 시술군과 양성대조군에서는 야기 항원량의 시술 후 전형적인 아나필락시스 shock 반응이 관찰되었고, 저용량군에서 1례, 양성대조군에서는 5례 모두 사망하였다. 부검 소견에서도 공통적으로 폐에서의 이상 소견이 관찰되어 SBV에 의한 이상면역반응으로 판단되었다.
양성대조군은 야기 후 shock 증상이 관찰되다가 모두 사망하였으며, 부검소견에서도 폐 및 심장에서 소견이 관찰되어 사망개체의 사인은 쇼크사로 판단되었다.
수동 피부 아낙필락시스는 동물의 피내에 항혈청을 투여하여 국소 피내의 호염기구와 비만세포를 수동적으로 감작 시키고, 일정 시간 후에 항원과 색소를 정맥 주사하여 항원- 항체반응의 결과를 유도해내는 것으로서, 세포로부터 화학적 매개인자의 유리에 의한 국소 모세혈관의 투과성 항진으로 나타나는 누출색소의 정도를 측정하는 것이다32).
동종 수동 피부 아나필락시스 반응시험 결과, 음성대조군 및 시험물질의 저용량군에서는 모든 동물에서 음성반응이 관찰되었다. 반면, 시험물질의 고용량군은 최대희석배수 20배까지, 혼합 시술군은 최대 희석배수 640배까지 양성반응이 관찰되었다. 양성대조군에서는 최대 희석배수 5,120배까지 양성반응이 관찰되었다.
이상의 결과를 종합해 보면 본시험 조건에서 SBV는 아나필락시스 shock 반응시험 및 동종 수동 피부 아나필락시스 반응시험에서 모두 양성반응이 관찰되어 항원성이 있는 물질로 판단되었다.
본 연구는 단백질 분리 기법인 gel filtration을 통하여 벌의 독에서 추출한 Sweet BV(melittin)의 항원성을 평가하고자 식품의약품안전청고시의 규정을 준수하여 기니픽을 대상으로 능동 전신성 아낙필락시스 shock 반응과 수동 피부 아낙필락시스 shock 반응 실험을 진행한 결과 다음과 같은 결론을 얻었다.
1. 능동 전신성 아낙필락시스shock 반응에서는 모든 실험군에서 음성대조군에 비해 아낙필락시스 반응이 관찰되었다.
2. 수동 피부 아낙필락시스 반응 시험에서는 저용량군에서는 음성반응이, 고용량군에서는 양성 반응이 관찰되었다.
3. 관찰 기간 동안 모든 동물에서 일반 증상 및 체중의 차이를 나타내지 않았다.
4. 부검 소견에서 저용량군의 사망한 개체의 폐에 이상소견이 발견되었는데 이는 SBV의 이상면역반응으로 추정되었다.
이상의 연구 결과를 바탕으로 Sweet BV는 능동 전신성 아낙필락시스 shock 반응과 수동 피부 아낙필락시스 shock 반응 실험에서 모두 항원성이 있는 것으로 관찰되었고, 향후 이에 대한보다 다양한 연구가 진행되어야 할 것으로 사료된다.